用于生成生理性X染色体失活的组合物和方法
文献发布时间:2023-06-19 12:21:13
背景技术
在某些兽亚纲哺乳动物(包含啮齿类动物)的雌性中,两个X染色体之一经失活以实现基因剂量补偿。在发育过程中,X染色体失活(X-chromosome inactivation,XCI)会以被印记或随机的方式发生。对于被印记的XCI,父系X染色体(Xp)在着床前发育过程中被选择性地失活。尽管被印记的XCI保留在胚外细胞谱系中,但其在晚期囊胚的前-上胚层细胞谱系中失去。在着床阶段,上胚层细胞经受随机的XCI,导致Xp或母系X染色体(Xm)沉默。先前研究已展示,Xist(一种X-连锁长链非编码RNA)在被印记和随机的XCI中均有重要作用。所述Xist RNA通过顺式地包覆和失活X染色体而参与XCI。
为了在着床前发育过程中选择性地使Xp沉默化,Xm中的Xist被印记,所述印记的机制被众人寻觅已久但仍不可得。使用核移植手段的先前研究已建议,Xist的基因组印记是在卵子生成过程中建立的。然而,对DNA甲基转移酶母系敲除胚胎的分析表明,卵母细胞DNA的甲基化作用对于Xist印记是可有可无的。最近的一项研究展示,孤雌生殖(parthenogenetic,PG)胚胎中H3K9me3脱甲基酶(Kdm4b)的过度表达部分地阻遏Xist的表达,暗示着H3K9me3参与了被印记的Xist沉默作用。然而,PG胚胎经受单个母系等位基因的非生理性Xist去阻遏这个事实提出了一个问题,即在H3K9me3-耗尽的PG胚胎中所观察到的去阻遏效应是否是生理性相关的。最近,发现母系H3K27me3可作为不依赖DNA甲基化的常染色体基因印记的印记标记。
这些观察结果与治疗克隆和生殖克隆相关,其中来自体细胞的供体细胞核被移植到去核卵母细胞中。这个过程被称为体细胞核移植(Somatic Cell Nuclear Transfer,SCNT),其可以通过将体细胞与去核卵母细胞融合,将细胞核注射进入去核卵母细胞,或通过任何其他方法来完成。目前,只有约1%的SCNT可成功生成可存活的胚胎。SCNT的低成功率与印记中的缺陷相关。因此,用于增加SCNT的成功率和更正印记中的缺陷的新颖的组合物和方法是必要的。
发明内容
如下所述,本发明的特征为用于在细胞中再现生理性X-染色体失活(XCI)的组合物和方法,所述细胞包含由SCNT所生成的任何胚胎的细胞。
在一方面,本发明的特征为一种用于在由体细胞核移植(SCNT)所生成的胚胎中生成生理性X染色体失活的方法,所述方法包括向经由SCNT所生成的胚胎中注射H3K27me3-特异性脱甲基酶多肽或编码所述脱甲基酶的多核苷酸。在一个实施方式中,向所述胚胎注射编码H3K27me3-特异性脱甲基酶的mRNA。在另一个实施方式中,所述多核苷酸编码Kdm6a、Kdm6b或Kdm6c多肽。在另一个实施方式中,向所述胚胎注射约1000至2000ng/μL之间的所述mRNA。在另一个实施方式中,向所述胚胎注射1800ng/μL的mRNA。在另一个实施方式中,所述X染色体存在于源自体细胞的供体细胞核中。在另一个实施方式中,所述供体细胞核被移植到卵母细胞或胚胎干细胞中。在另一个实施方式中,所述多核苷酸编码H3K27me3-特异性脱甲基酶的酶活性片段。在另一个实施方式中,所述多核苷酸存在于哺乳动物表达载体中。在另一实施方式中,所述哺乳动物表达载体包括指导H3K27me3-特异性脱甲基酶的组成性或可诱导的表达的启动子。在另一个实施方式中,所述注射的多肽是Kdm6a、Kdm6b、或Kdm6c。在另一个实施方式中,所述方法降低X-连锁基因的表达。在另一个实施方式中,所述方法不会显著改变逃脱X-染色体印记的基因的表达。在另一个实施方式中,所述方法不会显著改变常染色体基因的表达。在另一个实施方式中,X-连锁基因的母系等位基因的表达偏倚大于约35-60%。在另一个实施方式中,X-连锁基因的母系等位基因的表达偏差大于约50%。在其他实施方案中,所述胚胎是早期囊胚阶段的胚胎或衍生自成年体细胞。在另一个实施方式中,体细胞得自人类个体。在另一个实施方式中,所述方法进一步包括从所述胚胎中培养细胞以获得适合移植到人类个体的组织。
在另一方面,本发明的特征为根据先前权利要求的方法所产生的囊胚。
在另一方面,本发明的特征为根据先前方面的方法所生产的细胞或组织。
在另一方面,本发明的特征为通过将先前方面的囊胚植入宿主的子宫内而产生的克隆生物。
从详细描述和权利要求看来,本发明的其他特征和优势将显而易见。
定义
除非另做界定,否则本文所使用的所有技术和科学术语具有本领域技术人员一般理解的意义。下述参考文献向本领域技术人员提供本发明中所用的许多术语的通常定义:Singleton等人,Dictionary of Microbiology and Molecular Biology(第二版,1994);The Cambridge Dictionary of Science and Technology(Walker编辑,1988);《TheGlossary of Genetics,第五版,R.Rieger等人.(编),Springer Verlag(1991);以及Hale和Marham,The Harper Collins Dictionary of Biology(1991)。本文中,除非另做说明,否则下述术语具有下方所述的意义。
“H3K27me3-特异性脱甲基酶”意为使三甲基化的H3'Lys-27特异性脱甲基化的蛋白质。示例性的脱甲基酶包含Kdm6a、Kdm6b、和Kdm6c。
“KDM6A多肽”(赖氨酸-特异性脱甲基酶6A,也称为组蛋白脱甲基酶UTX)意为与NCBI参考序列:O15550.2,或其片段所提供的序列具有至少约85%氨基酸同一性的蛋白质,并且所述蛋白质具有脱甲基酶活性。以下提供了示例性的KDM6A氨基酸序列:
“KDM6A多核苷酸”意为编码KDM6A多肽的核酸分子。在NM_001291415.1处提供了示例性的KDM6A多核苷酸序列。
“KDM6B多肽”(赖氨酸-特异性脱甲基酶6,也称为含JmjC结构域蛋白质3)意为与NCBI参考序列:O15054.4,或其片段所提供的序列具有至少约85%的氨基酸同一性的蛋白质,并且所述蛋白质具有脱甲基酶活性。以下提供了示例性的KDM6B氨基酸序列:
“KDM6B多核苷酸”意为编码KDM6B多肽的核酸分子。在NM_001080424.2处提供示例性的KDM6B多核苷酸序列,并复制如下:
“KDM6C多肽”(组蛋白脱甲基酶UTY,也称为Y染色体上普遍存在-转录的TPR蛋白)意为与NCBI参考序列:O14607.2,或其片段所提供的序列具有至少约85%的氨基酸同一性的蛋白质,并且所述蛋白质具有脱甲基酶活性。以下提供了示例性的KDM6C氨基酸序列:
“KDM6C多核苷酸”意为编码KDM6C多肽的核酸分子。在NNM_001258249.1处提供了示例性的KDM6C多核苷酸序列,其序列复制如下:
“组蛋白H3第27位赖氨酸的三甲基化(H3K27me3)”意为组蛋白H3蛋白质亚单元上的赖氨酸27的三甲基化作用。H3K27me3修饰通常与基因阻遏相关联。
“剂”意为肽、核酸分子或小化合物。
“等位基因”意为在染色体的同一位置上发现的一个基因的两种或多种备选形式中的一种。
“变动”意为通过标准的领域已知方法诸如本文所述方法而检测到的基因或多肽的表达水平或活性的变化(增加或减少)。如本文所用,一变动包含表达水平的10%的变化,优选25%的变化,更优选40%的变化,以及最优选50%或更大的表达水平的变化。
“改善”意为降低、抑制、衰减、减少、停滞或稳定疾病的发展或进程。
如本文所用的术语“胚胞”是指胚胎发育的早期阶段,其由包卷起充满液体的空腔的中空细胞球组成,所述空腔称作囊胚腔。术语胚胞有时与囊胚互换使用。
贯穿全文使用的术语“卵裂球”是指从着床前的胚胎中获得的至少一个卵裂球(例如,1、2、3、4等)。术语“两个或更多个卵裂球的簇”与“卵裂球所衍生的生长物”可互换使用,是指在卵裂球的体外培养过程中所生成的细胞。例如,从SCNT胚胎中获得卵裂球并对其进行初始培养后,其通常至少分裂一次以产生两个或更多个卵裂球的簇(也称为卵裂球所衍生的生长物)。所述簇可以进一步与胚胎细胞或胎儿细胞一起培养。最终,卵裂球所衍生的生长物将继续分裂。源自于这些结构物,ES细胞,全能干(totipotent stem,TS)细胞,和部分分化的细胞类型将在培养方法的过程中发育出来。
如本文所用,术语“克隆(cloned)(或克隆的(cloning))”是指用于制备一新的个体单元以使其具有与另一个体单元相同的基因集合的基因操纵技法。在本发明中,如本文所用,术语“克隆(cloned)”是指一细胞、胚胎细胞、胎儿细胞和/或动物细胞所具有的核DNA序列与另一细胞、胚胎细胞、胎儿细胞和/或动物细胞所具有的核DNA序列实质上相似或相同。本文描述术语“实质上相似”和“相同”。克隆的SCNT胚胎可能发生自一个核移植,或者,克隆的SCNT胚胎可能发生自包含至少一个重新-克隆步骤的克隆过程。
在此公开披露中,术语“包括(comprises)”,“包括(comprising)”,“含有(containing)”,“具有(having)”等可以具有美国专利法中赋予它们的含义,并且可以表示“包含(includes)”,“包含(including)”等;“基本上由...组成(consisting essentiallyof)”或“基本上由...组成(consists essentially)”同样地具有美国专利法中所赋予的含义,并且所述术语是开放式的,即允许存在多于本文所列举的,只要其并不会改变本文所列举的的基本或新颖的特征,但不包括现有技术的实施方式。
“检测”是指鉴别待检测的分析物的存在、不存在或其数量。
“疾病”意为任何损害或干扰细胞、组织或器官的正常功能或发育的病况或病症。病症的实例包含与胚胎中X染色体印记的破坏相关联的缺陷(例如发育缺陷、生存力丧失)。
“DNA”意为脱氧核糖核酸。在各种实施方式中,术语DNA是指基因组DNA、重组DNA或cDNA。在特定的实施方式中,DNA包括“靶标区域”。本文所关注的DNA文库包含基因组DNA文库,和从RNA构建的cDNA文库,例如RNA表达文库。在各种实施方式中,DNA文库包括一个或多个另外的DNA序列和/或标签。
“有效量”意为使细胞恢复到生理正常状态所需的剂的量。在一个实施方式中,剂的有效量是更正印记缺陷并给予细胞生理正常的印记表型所需的剂的量。在一个实施方式中,Kdm6b mRNA的注射足以更正与异常和/或不良X染色体失活相关联的印记缺陷。用于实施本发明以治疗疾病的一种(或几种)活性化合物的有效量取决于给药方式、年龄、体重、和受试者的总体健康状况。最终,主治医师或兽医将决定适当的量和剂量方案。此量被称为“有效”量。
“胚胎”意为
“片段”意为多肽或核酸分子的一部分。所述部分优选地含有参考核酸分子或多肽的全长的至少10%、20%、30%、40%、50%、60%、70%、80%或90%。片段可以含有10、20、30、40、50、60、70、80、90、或100、200、300、400、500、600、700、800、900或1000个核苷酸或氨基酸。
术语“分离的”、“纯化的”或“生物学纯的”是指材料和天然状态下通常与其相伴的组分的分离的不同程度。“分离”表示与原始来源或周围环境的一种分离程度。“纯化”表示高于分离的一种分离程度。“纯化的”或“生物学纯的”蛋白质充分地不含其他材料,使得任何杂质不会实质地影响蛋白质的生物学特性或造成其他不利后果。也就是说,本发明的核酸或肽,如果以重组DNA技法生产而基本地不含细胞材料、病毒材料或培养介质;或,如果以化学合成而基本地不含化学前体或其他化学品,则本发明的核酸或肽即视为纯化的。纯度和同质性通常用分析化学技法确定,例如聚丙烯酰胺凝胶电泳或高效液相色谱。术语“纯化的”可表示核酸或蛋白质在电泳凝胶中基本上产生一条带。对于可以被修饰的蛋白质,例如磷酸化或糖基化,不同的修饰可能产生不同的分离的蛋白质,其可以被单独纯化。
“分离的核酸”意为核酸(例如DNA),其不含在衍生本发明的核酸分子的生物所天然存在的基因组中位于所述核酸两侧翼的基因。因此,所述术语包含例如,并入载体内的重组DNA;并入自主复制的质粒内或病毒内的重组DNA;或并入原核生物或真核生物的基因组DNA内的重组DNA;或作为独立于其他序列的单独的分子(例如,通过PCR或限制性核酸内切酶消化所产生的cDNA或基因组片段或cDNA片段)存在。另外,所述术语包含从DNA分子转录而来的RNA分子,以及编码附加的多肽序列的作为杂合基因的一部分的重组DNA。
“分离的多肽”意为本发明的多肽,其已经与其天然相伴的组分分离。通常,以重量计,当多肽至少60%不含与其天然伴随的蛋白质和天然存在的有机分子时,所述多肽即视为分离的。优选地,以重量计,制备为至少75%,更优选至少90%,最优选至少99%,本发明的多肽。可以获得分离的本发明的多肽,例如,通过从天然来源提取,通过表达编码这种多肽的重组核酸,或通过蛋白质的化学合成。纯度可以通过任何适当的方法测量,例如柱色谱、聚丙烯酰胺凝胶电泳,或通过HPLC分析。
本文所提供的范围应理解为所述范围内的所有数值的简写。例如,1至50的范围应理解为包含由1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50所组成的组中的任何数字、数字组合或子范围。
“降低(reduces)”意为至少10%、25%、50%、75%或100%的负向改变。
“参考”意为标准或对照条件。
“参考序列”是用于序列比对的基准的界定的序列。参考序列可以是指定序列的子集或整体;例如,全长cDNA或基因序列的一节段、或完整的cDNA或基因序列。对多肽来说,参考多肽序列的长度一般为至少约16个氨基酸,优选至少约20个氨基酸,更优选至少约25个氨基酸,甚至再更优选约35个氨基酸、约50个氨基酸、或约100个氨基酸。对核酸来说,参考核酸序列的长度一般为至少约50个核苷酸,优选至少约60个核苷酸,更优选至少约75个核苷酸,甚至再更优选约100个核苷酸或约300个核苷酸或任何约等于它们或在它们之间的整数。
可用于本发明的方法的核酸分子包含任何编码本发明的多肽或所述多肽片段的核酸分子。这种核酸分子不需要与内源性核酸序列100%相同,但将通常展现出实质的同一性。与内源性序列具有“实质的同一性”的多核苷酸通常能够与双链核酸分子的至少一条链杂交。可用于本发明的方法的核酸分子包含任何编码本发明的多肽或所述多肽片段的核酸分子。这种核酸分子不需要与内源性核酸序列100%相同,但将通常展现出实质的同一性。与内源性序列具有“实质的同一性”的多核苷酸通常能够与双链核酸分子的至少一条链杂交。“杂交”意为在各种严格条件下,互补的多核苷酸序列(例如本文所述的基因),或其部分,之间配对并且形成双链分子(参见,例如,Wahl,G.M.和S.L.Berger(1987)MethodsEnzymol.152:399;Kimmel,A.R.(1987)Methods Enzymol.152:507)。
例如,严格的盐浓度将一般小于约750mM的氯化钠(NaCl)和75mM的柠檬酸钠,优选小于约500mM的氯化钠和50mM的柠檬酸钠,更优选小于约250mM的氯化钠和25mM的柠檬酸钠。低严格度杂交可在无有机溶剂(例如甲酰胺)的情况下获得,而高严格度杂交可在至少约35%的甲酰胺,而更优选至少约50%的甲酰胺的存在下获得。严格的温度条件将一般包含至少约30℃,更优选至少约37℃,最优选至少约42℃的温度。变化其他参数,例如杂交时间、洗涤剂浓度,例如十二烷基硫酸钠(SDS)、以及载具DNA的包含或排除,是本领域技术人员熟知的。根据需要,通过合并这些不同的条件来实现各种严格程度。在一优选的实施方式中,杂交将发生在30℃下、750mM的氯化钠,75mM的柠檬酸钠和1%的SDS中。在一更优选的实施方式中,杂交将发生在37℃下、500mM的氯化钠,50mM的柠檬酸钠,1%的SDS,35%的甲酰胺和100μg/ml的变性的鲑鱼精子DNA(ssDNA)中。在一最优选的实施方式中,杂交将发生在42℃下、250mM的氯化钠,25mM的柠檬酸钠,1%的SDS,50%的甲酰胺和200μg/ml的ssDNA中。对于本领域技术人员来说,在这些条件上的有用的变化是显而易见的。
对于大多数应用,杂交后的清洗步骤在严格度方面也将变化。清洗的严格条件可以通过盐浓度和通过温度来定义。如上,清洗的严格度可以通过降低盐浓度或通过升高温度而提高。例如,用于清洗步骤的严格盐浓度将优选是小于约30mM的氯化钠和3mM的柠檬酸钠,最优选是小于约15mM的氯化钠和1.5mM的柠檬酸钠。用于清洗步骤的严格温度条件将一般包含至少约25℃的温度,更优选至少约42℃,甚至更优选至少约68℃。在一优选的实施方式中,清洗步骤将发生在25℃下、30mM的氯化钠,3mM的柠檬酸钠和0.1%的SDS中。在一更优选的实施方式中,清洗步骤将发生在42℃下、15mM的氯化钠,1.5mM的柠檬酸钠和0.1%的SDS中。在一更优选的实施方式中,清洗步骤将发生在68℃下、15mM的氯化钠,1.5mM的柠檬酸钠和0.1%的SDS中。对于本领域技术人员来说,在这些条件上的其他变化是显而易见的。杂交技法是本领域技术人员熟知的,并且在如下文献中描述,例如,Benton和Davis(Science 196:180,1977);Grunstein和Hogness(Proc.Natl.Acad.Sci.,美国72:3961,1975);Ausubel等人(《Current Protocols in Molecular Biology,Wiley Interscience,纽约,2001);Berger和Kimmel(Guide to Molecular Cloning Techniques,1987,AcademicPress,纽约);以及Sambrook等人,Molecular Cloning:A Laboratory Manual,ColdSpring Harbor Laboratory Press,纽约)。
“体细胞核移植”或“SCNT”意为供体细胞核从体细胞进入去核卵母细胞的移植。所述过程可用于生殖的或治疗的克隆,并且可通过将体细胞与去核卵母细胞融合、将细胞核注射到去核卵母细胞,或通过任何其他方法来完成。
体细胞的细胞核提供了遗传信息,而卵母细胞提供了胚胎发育所必需的养分和其他产生能量的物质。一旦融合已经发生,细胞就是分化全能的,并最终发育为囊胚,于此时分离出内细胞团。
如本文所用,术语“核移植”是指一基因操纵技法,其允许通过将去核卵母细胞与细胞核遗传物质或体细胞的细胞核人工地合并从而获得相同的特征和性质。在一些实施方式中,核移植程序是将来自供体体细胞的细胞核或核遗传物质移植进入去核的卵细胞或卵母细胞(已从其中去除核/原核的卵细胞或卵母细胞)。供体细胞核可以来自于体细胞。
术语“核遗传物质”是指在细胞核中所发现的结构和/或分子,其包括编码关于个体有关信息的多核苷酸(例如DNA)。核遗传物质包含染色体和染色质。所述术语还指通过细胞分裂,诸如亲代细胞进入子细胞的分裂,所产生的核遗传物质(例如,染色体)。核遗传物质不包含线粒体DNA。
术语“SCNT胚胎”是指已经与体细胞的细胞核或核遗传物质融合的去核卵母细胞的细胞或其分化全能的后代。SCNT胚胎可以发育成为一个囊胚,并在着床后发育成为活体子代。在成为囊胚之前,SCNT胚胎可以是1-细胞胚胎、2-细胞胚胎、4-细胞胚胎,或任何阶段的胚胎。
术语“供体人类细胞”或“供体人类体细胞”是指体细胞或人类细胞的细胞核,其被移植进入作为核接受者或受体的受体卵母细胞。
术语“体细胞”是指不是生殖细胞或生殖细胞前体的植物或动物细胞。在一些实施方式中,分化的细胞不是生殖细胞。体细胞与分化多能的或分化全能的细胞不相关。在一些实施方式中,体细胞是“非-胚胎的体细胞”,其意为不存在于胚胎中的或不能从胚胎中获得的以及不是由此种细胞在体外的增殖所得到的体细胞。在一些实施方式中,体细胞是“成体的体细胞”,其意为存在于除胚胎或胎儿以外的生物中的或能从前述生物中获得的细胞,或由此种细胞在体外的增殖所得到的细胞。
本文所用的术语“卵母细胞”是指已达到第二次减数分裂中期的成熟卵母细胞。卵母细胞也用于描述参与生殖的雌性配子或生殖细胞,通常也称为卵细胞。成熟的卵细胞具有单组母系染色体(人类灵长动物中为23,X),并停留在第二次减数分裂中期。
“杂合卵母细胞”是指具有来自第一个人类卵母细胞(称为“受体”)的细胞质但不具有所述受体卵母细胞的核遗传物质的去核卵母细胞;它具有来自另一个人类细胞(称为“供体”)的核遗传物质。在一些实施方式中,杂合卵母细胞还可以包括线粒体DNA(mtDNA),所述线粒体DNA不是来自受体卵母细胞,而是来自供体细胞(可以是与核遗传物质相同的供体细胞,也可以来自不同的供体,例如来自一供体卵母细胞)。
如本文所用,术语“去核卵母细胞”是指其细胞核已被去除的人类卵母细胞。如本文所用,术语“去核过程”是指去除细胞的核物质而仅留下细胞质的过程。当应用于卵细胞时,去核过程是指去除不被细胞核膜所包围的母系染色体。术语“去核卵母细胞”是指去除了核物质或细胞核的卵母细胞。
如本文所用,“受体人类卵母细胞”是指在去除其原始细胞核后从一人类核供体细胞接收了细胞核的人类卵母细胞。
如本文所用,术语“融合”是指核供体细胞和受体卵母细胞脂质膜的结合。例如,脂质膜可以是细胞的细胞膜(原生质膜)或细胞核膜。当将核供体细胞和受体卵母细胞彼此相邻放置或将核供体细胞放置在受体卵母细胞的卵黄周隙内,在核供体细胞和受体卵母细胞之间施加电刺激时,融合可能会发生。
如本文所用,术语“活体子代”意为可以“在子宫外”存活的动物。优选地,它是可以存活一秒钟、一分钟、一天、一周、一个月、六个月或一年以上的动物。动物可能不需要子宫内的生存环境。
术语“出生前(prenatal)”是指在出生前已经存在或发生。类似地,术语“出生后(postnatal)”则为在出生后已经存在或发生。
如本文所用,术语“转基因生物”是指来自另一生物的遗传物质已通过实验被移植到其体内的生物,从而所述宿主在其染色体组成中获得了被移植的基因的遗传特质。
关于本文所揭示的SCNT胚胎,如本文所用的术语“植入”是指用本文所述的SCNT胚胎使代孕雌性动物受孕。此技法是本领域技术人员众所周知的。参见,例如,Seidel和Elsden,1997,Embryo Transfer in Dairy Cattle,W.D.Hoard&Sons,Co.,HoardsDairyman。可以容许胚胎在子宫内发育,或者,可以在分娩前将胎儿从子宫环境中取出。
“个体”意为哺乳动物,包含但不限于人类或非人类的哺乳动物,诸如农业上重要的哺乳动物(例如牛、马、绵羊、猪),宠物(例如犬,猫),或稀有或濒临灭绝的哺乳动物(例如熊猫)。
“实质上相同”意为与参考氨基酸序列(例如本文所述的任何一段氨基酸序列)或核酸序列(例如本文所述的任何一段核酸序列)展现出至少50%同一性的多肽或核酸分子。优选地,此种序列与用于比较的序列在氨基酸或核酸水平上是至少60%相同的,更优选是80%或85%,更优选90%、95%或甚至99%相同的。
序列同一性通常使用序列分析软件来测量(例如,遗传学计算机组的序列分析软件包(Sequence Analysis Software Package of the Genetics Computer Group),威斯康星大学生技中心,1710大学大道,麦迪逊,威州53705,BLAST,BESTFIT,GAP,或PILEUP/PRETTYBOX程序)。此种软件通过将同源性程度指定为各种替换、缺失和/或其他修饰而匹配相同或相似的序列。保守性替换通常包含以下组内的替换:甘氨酸,丙氨酸;缬氨酸,异亮氨酸,亮氨酸;天冬氨酸,谷氨酸,天冬酰胺,谷氨酰胺;丝氨酸,苏氨酸;赖氨酸,精氨酸;和苯丙氨酸,酪氨酸。在确定同一性程度的示例性方法中,可以使用BLAST程序,其中e
“体细胞核移植”或“SCNT”意为供体细胞核从体细胞进入去核卵母细胞的移植。所述过程可用于生殖克隆或治疗克隆,并且可通过将体细胞与去核卵母细胞融合、将细胞核注射进入去核卵母细胞,或通过任何其他方法来完成。
体细胞的细胞核提供了遗传信息,而卵母细胞提供了胚胎发育所必需的养分和其他产生能量的物质。一旦融合已经发生,细胞就是分化全能的,并最终发展为囊胚,于此时内细胞团分离出来。
如本文所用,术语“核移植”是指基因操纵技法,其允许通过将去核卵母细胞与细胞核遗传物质或体细胞的细胞核人工地合并从而获得相同的特征和性质。在一些实施方式中,核移植程序是将来自供体体细胞的细胞核或核遗传物质移植进入去核的卵细胞或卵母细胞(已从其中去除核/原核的卵细胞或卵母细胞)。供体细胞核可以来自于体细胞。
术语“核遗传物质”是指在细胞核中所发现的结构和/或分子,其包括编码关于个体有关信息的多核苷酸(例如DNA)。核遗传物质包含染色体和染色质。所述术语还指通过细胞分裂,诸如亲代细胞进入子细胞的分裂,所产生的核遗传物质(例如,染色体)。核遗传物质不包含线粒体DNA。
术语“SCNT胚胎”是指已经与体细胞的细胞核或核遗传物质融合的去核卵母细胞的细胞或其分化全能的后代。SCNT胚胎可以发育成为一个囊胚,并在着床后发育成为活体子代。在成为囊胚之前,SCNT胚胎可以是1-细胞胚胎,2-细胞胚胎,4-细胞胚胎,或任何阶段的胚胎。
术语“供体人类细胞”或“供体人类体细胞”是指体细胞或人类细胞的细胞核,其被移植到作为核接受者或受体的受体卵母细胞中。
术语“体细胞”是指不是生殖细胞或生殖细胞前体的动物细胞。在一些实施方式中,分化的细胞不是生殖细胞。体细胞与分化多能的或分化全能的细胞不相关。在一些实施方式中,体细胞是“非-胚胎的体细胞”,其意为不存在于胚胎中的或不能从胚胎中获得的以及不是由此种细胞在体外的增殖所得到的体细胞。在一些实施方式中,体细胞是“成体的体细胞”,其意为存在于除胚胎或胎儿以外的生物中的或能从前述生物中获得的细胞,或由此种细胞在体外的增殖所得到的细胞。
本文所用的术语“卵母细胞”是指已达到第二次减数分裂中期的成熟卵母细胞。卵母细胞也用于描述参与生殖的雌性配子或生殖细胞,通常也称为卵细胞。成熟的卵细胞具有单组母系染色体(人类灵长动物中为23,X),并停留在第二次减数分裂中期。
“杂合卵母细胞”是指具有来自第一个人类卵母细胞(称为“受体”)的细胞质但不具有所述受体卵母细胞的核遗传物质的去核卵母细胞;其具有来自另一个人类细胞(称为“供体”)的核遗传物质。在一些实施方式中,杂合卵母细胞还可以包括线粒体DNA(mtDNA),所述线粒体DNA不是来自受体卵母细胞,而是来自供体细胞(可以是与核遗传物质相同的供体细胞,也可以来自不同的供体,例如来自一供体卵母细胞)。
如本文所用,术语“去核卵母细胞”是指其细胞核已被去除的人类卵母细胞。
如本文所用,术语“去核过程”是指去除细胞的核物质而仅留下细胞质的过程。当应用于卵细胞时,去核过程是指去除不被细胞核膜所包围的母系染色体。
如本文所用,“受体人类卵母细胞”是指在去除其原始细胞核后从一人类核供体细胞接收了细胞核的人类卵母细胞。
如本文所用,术语“融合”是指核供体细胞和受体卵母细胞的脂质膜的结合。例如,脂质膜可以是细胞的细胞膜(原生质膜)或细胞核膜。当将核供体细胞和受体卵母细胞彼此相邻放置或将核供体细胞放置在受体卵母细胞的卵黄周隙之内,在核供体细胞和受体卵母细胞之间施加电刺激时,可能会发生融合。
如本文所用,术语“活体子代”意为可以“在子宫外”存活的动物。优选地,它是可以存活一或更多小时、一天、一周、一个月、六个月或一年以上的动物。动物可能不需要子宫内的生存环境。
术语“出生前(prenatal)”是指在出生前已经存在或发生。类似地,术语“出生后(postnatal)”则为在出生后已经存在或发生。
如本文所用,术语“囊胚”是指有胎盘的哺乳动物中具有约30至150个细胞的着床前胚胎(在小鼠中受精后约3天,在人类中受精后约5天)。囊胚阶段在桑椹胚阶段之后,且可以通过其独特的形态加以区分。囊胚由一个球组成,而所述球由一层细胞(滋养外胚层)、一个充满液体的空腔(囊胚腔或囊胚空腔)和内部的一簇细胞(内细胞团,或ICM)组成。如果囊胚被植入子宫,由未分化细胞所组成的ICM会导致最终的发育成为胎儿。如果在培养物中生长,这些相同的ICM细胞则会导致形成胚胎干细胞系。在着床的时刻,小鼠的囊胚是由大约70个滋养层细胞和30个ICM细胞组成。
如本文所用,术语“转基因生物”是指来自另一生物的遗传物质已通过实验被移植到其体内的生物,从而所述宿主在其染色体组成中获得了被移植的基因的遗传特质。
关于本文所揭示的SCNT胚胎,术语“植入”如本文所用是指用本文所述的SCNT胚胎使代孕雌性动物受孕。此技法是本领域技术人员众所周知的。参见,例如,Seidel和Elsden,1997,Embryo Transfer in Dairy Cattle,W.D.Hoard&Sons,Co.,Hoards Dairyman。可以容许胚胎在子宫内发育,或者,可以在分娩前将胎儿从子宫环境中取出。
“个体”意为哺乳动物,包含但不限于人类或非人类的哺乳动物,诸如农业上重要的哺乳动物(例如牛、马、绵羊、猪),宠物(例如犬,猫),或稀有或濒临灭绝的哺乳动物(例如熊猫)。
如本文所用,术语“治疗(treat)”、“治疗的(treating)”,“疗程(treatment)”等是指减少或改善一种病症和/或伴随其的症状。应知悉,尽管不排除,对病症或病况的治疗不需要所述病症、病况或伴随其的症状被完全消除。在一个实施方式中,术语“治疗的”是指对SCNT胚胎中的印记缺陷的治疗过程。
除非特别说明或从上下文中显而易见,否则如本文所用,术语“或(or)”应被理解为包含在内。除非特别说明或从上下文中显而易见,否则如本文所用,“一(a)”、“一(an)”和“所述(the)”应被理解为单数或复数。
除非特别说明或从上下文中显而易见,否则如本文所用,术语“或(or)”应被理解为包含在内。除非特别说明或从上下文中显而易见,否则如本文所用,“一(a)”,“一(an)”和“所述(the)”应被理解为单数或复数(即,至少一个)。举例来说,“一个元件”意为一个元件或多于一个的元件。
除非特别说明或从上下文中显而易见,否则如本文所用,术语“约”应被理解为在本领域的正常容许偏差范围内,例如在平均值的2个标准差内。约可以被理解为在所载明的数值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%的范围内。除非上下文中另有说明,否则本文提供的所有数字数值全部由术语约所修饰。
本文中,在变量的任何定义中所列举的化学基团列表包含将所述变量定义为所表列出的基团的任何单个基团或组合。本文中,对某变量或某方面的实施方式的列举包含所述实施方式作为任何单个实施方式或与任何其他实施方式或其部分的组合。
本文提供的任何组合物或方法可与本文提供的任何其他组合物和方法中的一种或多种合并。
附图说明
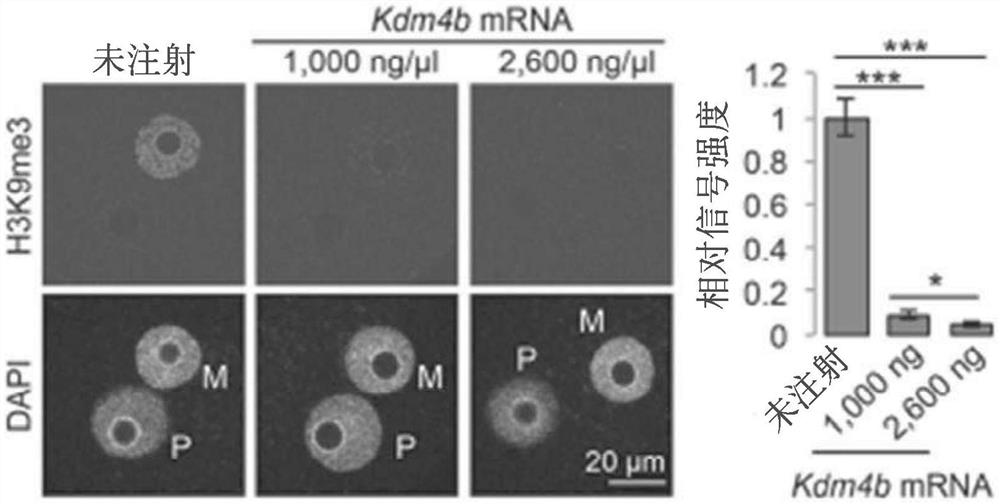
图1A至1D显示,H3K9me3的异位去除没有诱导母系Xist的表达。图1A描绘了用抗-H3K9me3抗体染色的受精卵的代表性图像。(M)母系原核;(P)父系原核。柱状图显示了母系原核的相对H3K9me3信号强度。未被注射的受精卵的平均信号强度被设为1.0。被检查的胚胎总数为:8个(未注射),9个(1000ng/μL Kdm4b)和9个(2600ng/μL Kdm4b)。误差杠表示标准误差(SE)。(***)P<0.001;(*)P<0.05,双尾Student’s t-检验。图1B描绘了在被注射了Kdm4b的四-细胞胚胎中的Xist RNA FISH(深紫红色)的代表性图像。通过针对Rnf12基因座(灰色)的同步DNA FISH来评估每个胚胎的性别。箭头指出卵裂球,其在底部面板中放大显示。图1C描绘了显示雄性胚胎中卵裂球与Xist RNA云朵和光点被指出的数量的比率的图。每个柱代表一个单独的胚胎。被检查的雄性胚胎数量为:6个(未注射),5个(1000ng/μLKdm4b)和12个(2600ng/μL Kdm4b)。图1D描绘了显示雌性胚胎中卵裂球与Xist RNA云朵和光点被指出的数量的比率的图。每个柱代表一个单独的胚胎。被检查的雌性胚胎数量为:6个(未注射),6个(1000ng/μL Kdm4b)和8个(2600ng/μL Kdm4b)。
图2A至2C显示,在卵母细胞和着床前胚胎中的Xist被母系H3K27me3所包覆。图2A描绘了位于Xist基因座的H3K27me3ChIP-seq(Zheng等人.2016.Mol Cell 63:1066–1079),DNase I-seq(Inoue等人.2017.Nature 547:419–424),和DNA甲基化作用的水平(Kobayashi等人.2012.PLoS Genet 8:e1002440)的基因组浏览器视图。(Oo)MII卵母细胞;(Sp)精子;(7d)从7日龄雌性中收集的正在生长的卵母细胞;(14d)从14日龄雌性中收集的正在生长的卵母细胞;(GV)完全成长的GV阶段的卵母细胞。图2B描绘了位于Xist基因座的在单-细胞,两-细胞,和囊胚胚胎以及E6.5上胚层中的H3K27me3等位基因的基因组浏览器视图。高亮的方块指出了经计算确定出的区域,在所述区域中的H3K27me3富集的母系等位基因偏倚在囊胚胚胎中保留。(Mat)母系等位基因;(Pat)父系等位基因。H3K27me3ChIP-seq的数据集在Zheng等(2016;Mol Cell 63:1066–1079)中进行了描述。图2C描绘了囊胚胚胎中的Xist基因座的高分辨率视图。母系等位基因-偏倚的H3K27me3区间被阴影化。
图3A至3E显示,H3K27me3的丧失诱导了母系Xist的表达。图3A描绘了用抗-H3K27me3抗体染色的受精卵的代表性图像。(M)母系原核;(P)父系原核。柱状图显示了母系原核的相对H3K27me3信号强度。被注射Kdm6b
图4A至4E显示,H3K27me3的丧失诱导了母系X-染色体失活(XCI)。图4A是描述由Kdm6
图5A和5B显示,异位Kdm6b
图6A至6F显示了在胚胎干细胞(ESCs)和被注射Kdm6b桑椹胚胚胎中的H3K27me3ULI-NChIP的确认有效。这些结果与图3A至3E所示的结果相关。图6A是散点图,其显示了在ENCODE(Encyclopedia of DNA Elements,即DNA元件百科全书)项目内的小鼠ESCs中与在我们所使用的500或2,000个ESCs中检测到的H3K27me3峰值之间的相关性。图6B描绘了一散点图,其显示了一已刊载数据集的(Liu等人.2016.Nature 537:558–562)与被注射Kdm6b
图7是描绘被注射Kdm6b胚胎中Rnf12的RT-qPCR分析的图。将数据归一化到18S,然后将Kdm6b
图8A至8D显示在被注射Kdm6bWT囊胚胚胎中的母系X染色体失活。这些结果与图4A至4E所示的结果相关。图8A是散点图,其显示了RNA-seq样本的生物学重复之间的相关性。图8B是盒须图,其显示在被注射Kdm6b囊胚中各个染色体的母系等位基因表达比[Mat/(Mat+Pat)]。盒子正中的线代表中位数。盒子的上下边缘和上下胡须分别表示第25个/第75个和第2.5个/第97.5个百分位数。Kdm6bMUT:浅灰色,左侧柱;Kdm6b
具体实施方式
本发明的特征为用于在细胞中再现生理性X染色体失活的组合物和方法,所述细胞包含由体细胞核移植(SCNT)所生成的任何胚胎的细胞。
Kdm6b是H3K27me3-特异性脱甲基酶。本发明至少部分地基于以下发现:Kdm6b-介导的母系X-染色体失活再现了生理性染色体失活。
X-染色体失活
在发育过程中,X染色体失活(XCI)会以被印记或随机的方式发生。对于被印记的XCI,父系X染色体(Xp)在着床前发育过程中被选择性地失活。随机的XCI发生在上胚层中,导致Xp或母系X染色体(Xm)沉默。Xist是一种X-连锁长链非编码RNA,其在被印记的XCI和随机的XCI中均有作用。在卵子生成过程中,Xm中的Xist被印记。Xist RNA通过顺式地包覆和失活X染色体而参与XCI。
H3K27me3-特异性脱甲基酶
在一个方面,本发明提供了一种提高人类SCNT效率的方法,所述方法包括:使供体人类体细胞、受体人类卵母细胞、杂合卵母细胞(例如,包括供体遗传物质的人类去核卵母细胞,且所述供体遗传物质为融合或活化之前的)的细胞核或细胞质或人类SCNT胚胎(即,在供体细胞核与去核卵母细胞的融合之后)与能够再现生理性X-染色体失活的H3K27me3-特异性脱甲基酶(Kdm6a,Kdm6b,Kdm6c等)接触。如本文所讨论的,发明人业已发现H3K27me3-特异性脱甲基酶可用于常态化母系X染色体失活(相对于父系X染色体失活而言),从而提高人类SCNT的效率。
H3K27me3-特异性脱甲基酶活化剂
在一个方面,本发明提供了一种提高人类SCNT效率的方法,所述方法包括:使供体人类体细胞、受体人类卵母细胞、杂合卵母细胞(例如,包括供体遗传物质的人类去核卵母细胞,且所述供体遗传物质为融合或活化之前的)的细胞核或细胞质或人类SCNT胚胎(即,在供体细胞核与去核卵母细胞的融合之后)与激活H3K27me3-特异性脱甲基酶(Kdm6a,Kdm6b,Kdm6c等)的一种剂接触。
在一些实施方式中,可用于本文所揭示的方法、组合物和试剂盒的H3K27me3-特异性脱甲基酶激活剂是一种剂,其增加编码H3K27me3-特异性脱甲基酶的基因的表达,或增加人类H3K27me3-特异性脱甲基酶的活性,例如,人类Kdm6a、Kdm6b、Kdm6c等。
在一些实施方式中,可用于本文所揭示的方法、组合物和试剂盒的H3K27me3-特异性脱甲基酶激活剂是一种核酸剂,其编码Kdm6a,Kdm6b,或Kdm6c的多肽。
在某些实施方式中,所述剂包括编码人类H3K27me3-特异性脱甲基酶激活剂的核酸序列,其包含但不限于Kdm6a、Kdm6b或Kdm6c,或其具有至少80%序列同一性的生物活性片段或同源物或变体(或至少约85%、或至少约90%、或至少约95%、或至少约98%或至少约99%序列同一性),此外,与对应的编码人类Kdm6a、Kdm6b或Kdm6c的野生型序列相比,所述序列将人类SCNT的效率提高至相似或更高的程度。
在一些实施方式中,可用于本文所揭示的方法的H3K27me3-特异性脱甲基酶激活剂选自任何人类Kdm6a、Kdm6b或Kdm6c多肽,或此人类Kdm6a、Kdm6b或Kdm6c多肽的变体或生物活性片段。本发明涵盖了可用于本文所揭示的方法和组合物的本领域技术人员可以识别出的人类Kdm6a、Kdm6b或Kdm6c多肽的适当的人类同源物,以及编码此人类同源物的核酸。在一些实施方式中,H3K27me3-特异性脱甲基酶激活剂是编码H3K27me3-特异性脱甲基酶多肽的核酸剂,其是表达自载体,例如病毒载体。
在备选的实施方式中,用于本文的所涵盖的H3K27me3-特异性脱甲基酶激活剂是编码Kdm6a、Kdm6b或Kdm6c,或其功能性片段的合成的修饰过的RNA(modRNA)。合成的修饰过的RNA(modRNA)描述于美国第US2012/03228640号专利申请;和第US2009/0286852号专利申请和第US2013/0111615号专利申请以及美国专利第8,278,036号专利;第8,691,966号专利;第8,748,089号专利;第8,835,108号专利,其全部内容在此通过引用并入本文。在一些实施方式中,所述合成的修饰过的RNA分子不在载体中表达,并且所述合成的修饰过的RNA分子可以是裸露的合成的修饰过的RNA分子。在一些实施方式中,组合物可以包括存在于脂质复合物中的至少一种合成的修饰过的RNA分子。
在一些实施方式中,所述合成的修饰过的RNA分子包括至少两个修饰过的核苷,例如,选自由5-甲基胞苷(5mC)、N6-甲基腺苷(m6A)、3,2'-O-二甲基尿苷(m4U)、2-硫代尿苷(s2U)、2’氟尿苷、假尿苷、2'-O-甲基尿苷(Um)、2’脱氧尿苷(2'dU)、4-硫代尿苷(s4U)、5-甲基尿苷(m5U)、2'-O-甲基腺苷(m6A)、N6,2'-O-二甲基腺苷(m6Am)、N6,N6,2'-O-三甲基腺苷(m62Am)、2'-O-甲基胞苷(Cm)、7-甲基鸟苷(m7G)、2'-O-甲基鸟苷(Gm)、N2,7-二甲基鸟苷(m2,7G)、N2、N2、7-三甲基鸟苷(m2,2,7G)和肌苷(I)所组成的组的至少两个修饰过的核苷。在一些实施方式中,所述合成、修饰的RNA分子进一步包括5’端帽,诸如5’端帽类似物,例如5'二鸟苷端帽。在一些实施方式中,可用于本文所揭示的方法和组合物的合成的修饰过的RNA分子不包括5’三磷酸。在一些实施方式中,可用于本文所揭示的方法和组合物的合成的修饰过的RNA分子进一步包括多聚腺苷酸尾、Kozak序列、3’非转译区,5’非转译区,或其任意组合。在一些实施方式中,所述合成、修饰的RNA分子可以任选地用碱性磷酸酶处理。
在引入本文所述的多核苷酸时,基本上可以采用任何用于引入核酸构建体进入细胞的方法。引入核酸的物理方法包含注射含有构建体的溶液,被由构建体覆盖的粒子轰击,将细胞、组织样本或生物浸入核酸溶液中,或在构建体存在时对细胞膜进行电穿孔。包装成病毒颗粒的病毒构建体既可用于完成表达构建体进入细胞的有效引入也可用于被编码蛋白的转译。可以使用本领域已知的用于将核酸引入细胞的其他方法,诸如脂质-介导的载具转运、化学介导的转运,诸如磷酸钙等。
为了在细胞内表达,可以使用DNA载体,例如包括指导编码H3K27me3-特异性脱甲基酶多肽的多核苷酸的表达的启动子的质粒载体。在一些实施方式中,编码蛋白的表达受诱导型启动子或条件式表达系统控制。在本发明的上下文中有用的启动子的示例是四环素-诱导型启动子(包含TRE-tight)、IPTG-诱导型启动子,四环素反式激活剂系统和反向四环素反式激活剂(rtTA)系统。也可以使用组成型启动子,细胞-或组织-特异性启动子也可以。许多启动子将是普遍存在的,因此它们可以在所有细胞和组织类型中表达。某个实施方式使用四环素-响应性启动子,其是体外和体内研究中最有效的条件式基因表达系统之一。
体细胞核移植
体细胞核移植(SCNT)是一种可用于例如家畜(例如奶牛、马、绵羊、山羊、猪)的生殖克隆或用于其中可生产以供细胞替换疗法的所需组织的治疗克隆的技法。不幸的是,克隆动物苦于由不适当的X-染色体失活引起的某些缺陷。本发明处理这些缺陷,是通过将生理性X染色体失活复原到体外受精所生成的胚胎,即用SCNT所生成的胚胎。
体细胞核移植涉及获得核供体细胞,然后将所述核供体细胞融合进入去核的受体细胞(最优选为去核卵母细胞)以形成核移植胚胎,激活所述胚胎,并最后培养所述胚胎或将这个胚胎移植进入母系宿主中。在核移植过程中,将来自一个细胞的完整无缺的核DNA引入到去核细胞中。核移植方法是本领域技术人员众所周知的。参见,美国第4,994,384号专利,其授予Prather等人,名称为“Multiplying Bovine Embryos”,1991年2月19日公告;美国第5,057,420号专利,其授予Massey,名称为“Bovine Nuclear Transplantation”1991年10月15日公告;美国第5,994,619号专利,1999年11月30日公告,其授予Stice等人,名称为“使Production of Chimeric Bovine or Porcine Animals Using Cultured Inner CellMass Cells”;英国第GB 2,318,578号专利、第GB 2,331,751号专利,2000年1月19日公告,其分别授予Campbell等人和Wilmut等人,名称为“Quiescent Cell Populations ForNuclear Transfer”;美国第6,011,197号专利,其授予Strelchenko等人,名称为“Methodof Cloning Bovines Using Reprogrammed Non-Embryonic Bovine Cells”,2000年1月4日公告;以及在美国第09/753,323号专利申请,名称为“Method of Cloning PorcineAnimals(代理人案卷号030653.0026.CIP1,2000年12月28日提交)”,其包含所有附图、表格和图式的全部内容在此通过引用并入本文。可以通过使用未被透明带所包围的卵母细胞来完成核移植。
在核移植程序中,将核供体细胞或其细胞核引入受体细胞中。受体细胞优选是卵母细胞,并且优选是去核的。然而,本发明部分地涉及核移植,其中卵母细胞的细胞核不是物理性地从所述卵母细胞取出的。有可能建立一个核移植胚胎,其供体细胞的核DNA在细胞分裂过程中复制了。参见,例如,Wagoner等人,1996,“Functional enucleation of bovineoocytes:effects of centrifugation and ultraviolet light”,Theriogenology 46:279-284。另外,可以通过合并一个核供体和一个以上的去核卵母细胞来完成核移植。同样,可以通过合并一个核供体,一或多个去核卵母细胞,以及一或多个去核卵母细胞的细胞质来完成核移植。所得的核供体细胞和受体细胞的组合可称为“杂合细胞”。
如本文所用,术语“核供体”是指具有可被易位进入卵母细胞的核DNA的任何细胞或其细胞核。核供体可以是已经从细胞中分离出来的细胞核。对于本领域技术人员,有多种技法可用于从细胞中分离细胞核,然后利用所述细胞核作为核供体。参见,例如,美国第4,664,097号专利、第6,011,197号专利和第6,107,543号专利,其包含所有附图、表格和图式的全部内容在此通过引用并入本文。任何类型的细胞都可以充当核供体。核供体细胞的例子包含但不限于:从体外或体内两配子的结合所产生的胚胎中分离的培养的和未培养的细胞;由培养的胚胎细胞(例如,前-囊胚细胞和内细胞团细胞)所产生的胚胎干细胞(ES细胞);从胚胎分离的内部细胞团细胞所产生的培养的和未培养的细胞;培养的和未培养的前-囊胚细胞;培养的和未培养的胎儿细胞;培养的和未培养的成体细胞;培养的和未培养的初始生殖细胞;培养的和未培养的生殖细胞(例如,胚胎生殖细胞);从动物分离的培养的和未培养的体细胞;培养的和未培养卵丘细胞;培养的和未培养的羊膜细胞;培养的和未培养的胎儿成纤维细胞;培养的和未培养的生殖脊细胞;培养的和未培养的分化的细胞;同步群体中的培养的和未培养的细胞;非同步群体中的培养的和未培养的细胞;
经血清-饥饿处理的培养的和未培养的细胞;培养的和未培养的永久细胞;以及培养的和未培养的分化全能细胞。参见,例如,Piedrahita等人,1998,Biol.Reprod.58:1321-1329;Shim等人,1997,Biol.Reprod.57:1089-1095;Tsung等人,1995,Shih Yen Sheng WuHsueh Pao 28:173-189;以及Wheeler,1994,Reprod.Fertil.Dev.6:563-568,其包含所有附图、表格和图式的全部内容在此通过引用并入本文。另外,核供体可以是先前被冷冻的或被深低温保存的。
通过核移植过程制得的杂合细胞可用于例如生殖克隆或再生克隆。
SCNT实验显示,成体的分化的体细胞的细胞核可以被重新编程为分化全能状态。因此,可以在合适的体外培养基中培养使用本文所揭示的方法所产生的SCNT胚胎,以生成分化全能或胚胎干细胞或类干细胞和细胞群落。适用于胚胎培养和成熟的培养基是本领域众所周知的。可用于牛胚胎培养和维持的已知培养基的示例包含:Ham's F-10+10%胎牛血清(FCS),组织培养基-199(TCM-199)+10%胎牛血清,Tyrodes-白蛋白-乳酸-丙酮酸(TALP),Dulbecco's磷酸盐缓冲生理盐水(PBS),Eagle's和Whitten's培养基。用于卵母细胞的收集和成熟的最常见培养基之一是TCM-199,以及1至20%的血清补充剂,其包含胎牛血清、新生血清、动情乳牛血清、羔羊血清或阉牛血清。优选的维持培养基包含具有Earle’s平衡盐、10%的胎牛血清、0.2Ma的丙酮酸和50ug/ml的硫酸庆大霉素的TCM-199。以上任何一种都可能涉及与多种细胞类型的共-培养,例如颗粒细胞、输卵管细胞、BRL细胞和子宫细胞以及STO细胞。
特别地,在着床前和着床期间,子宫内膜的上皮细胞分泌白血病抑制因子(LIF)。因此,在一些实施方式中,包括了向培养基中添加LIF的步骤以增强SCNT-衍生的胚胎的体外发育。LIF在胚胎细胞或类干细胞培养中的用途已在美国第5,712,156号专利中描述,其在此通过引用并入本文。
另一种维持培养基在授予Rosenkrans,Jr.等人的美国第5,096,822号专利中描述,其在此通过引用并入本文。这种称为CR1的胚胎培养基含有扶持胚胎所必需的营养物质。CR1含有的半钙L-乳酸的数量范围为1.0mM至10mM,优选为1.0mM至5.0mM。半钙L-乳酸是掺上了半钙盐的L-乳酸。同样地,用于在培养物中维持人类胚胎干细胞的合适培养基在Thomson等人,Science,282:1145-1147(1998)和Proc.Natl.Acad.Sci.,美国,92:7844-7848(1995)中被讨论到。
在一些实施方式中,饲养细胞将包括小鼠胚胎成纤维细胞。在下面的实施例中描述了制备合适的成纤维细胞饲养层的方法,其在本领域技术人员的技术范围内。
从囊胚-阶段SCNT胚胎(或其等同物)衍生出ES细胞(例如NT-ESCs或hNT-ESCs)的方法是本领域众所周知的。此类技法可用于从SCNT胚胎衍生出ES细胞(例如hNT-ESCs),其中用于生成hNT-ESCs的SCNT胚胎在从体细胞供体细胞所献出的核遗传物质中具有降低的H3K9me3水平,其相比未用KDM4脱甲基酶家族成员和/或组蛋白甲基转移酶SUV39h1/SUV39h2的抑制剂处理过的SCNT而言。hNT-ESCs可以在发育的较早阶段从克隆SCNT胚胎中衍生出来。
在某些实施方式中,可以使用玻璃移液管将卵裂球解离以获得分化全能细胞,所述卵裂球是生成自使用本文揭示的方法、组合物和试剂盒所生成的SCNT胚胎。在一些实施方式中,解离可能发生在0.25%胰蛋白酶的存在下(Collas和Robl,43BIOL.REPROD.877-84,1992;Stice和Robl,39BIOL.REPROD.657-664,1988;Kanka等,43MOL.REPROD.DEV.135-44,1996)。
在某些实施方式中,来自SCNT胚胎的生成物囊胚或类囊胚簇可用于获得胚胎干细胞系,例如核移植ESC(ntESC)细胞系。可以根据例如Thomson等人,Science,282:1145-1147(1998)和Thomson等,Proc.Natl.Acad.Sci.,美国,92:7544-7848(1995)(它们的全部内容在此通过引用并入本文)所报告的培养方法获得此类细胞系。
分化多能的胚胎干细胞也可以由自SCNT胚胎中所取出的单个卵裂球生成,而不会干扰胚胎的正常发育直至出生。参见2004年11月4日提交的美国第60/624,827号专利申请;2005年3月14日提交的第60/662,48号专利申请9;2005年6月3日提交的第60/687,158号专利申请;2005年10月3日提交的第60/723,066号专利申请;2005年10月14日提交的第60/726,775号专利申请;2005年11月4日提交的第11/267,555号专利申请;2005年11月4日提交的PCT第PCT/US05/39776号专利申请,其全部公开披露内容通过引用并入本文;亦参见Chung等人.,Nature,Oct.16,2005(电子版提前出版)和Chung等人,Nature V.439,pp.216-219(2006),其每个的全部公开披露内容通过引用并入本文。在此种情况下,为了生成分化多能干细胞并不会破坏SCNT胚胎。
在本发明的一方面,所述方法包括在研究和在治疗中利用衍生自SCNT胚胎的细胞。此种多能干细胞(PSCs)或全能干细胞(TSC)可以分化成为身体内的任何细胞,包含但不限于,皮肤、软骨、骨、骨骼肌、心肌、肾脏、肝脏、血液和血液形成、血管前体和血管内皮、胰岛β、神经元、神经胶质、视网膜、内耳滤泡、肠、肺等细胞。
在本发明的另一个实施方式中,从SCNT胚胎获得的SCNT胚胎,或囊胚,或分化多能或分化全能细胞(例如NT-ESCs),可暴露于一种或多种分化的诱导剂,以产出其他可用于治疗的细胞,诸如视网膜色素上皮,造血细胞前体和成血管细胞祖细胞,以及外胚层,中胚层和内胚层的许多其他有用的细胞类型。此类诱导剂包含但不限于:细胞因子,诸如白介素-αA、干扰素-αA/D、干扰素-β、干扰素-γ、干扰素-γ-诱导蛋白-10、白介素-1-17、角质细胞生长因子、瘦素、白血病抑制因子、巨噬细胞集落刺激因子、和巨噬细胞炎症蛋白-1α,1-β,2,3α,3β、和单核细胞趋化蛋白1-3、6kine、激活素A、双调蛋白、血管生成素、B-内皮细胞生长因子、β纤维素、脑源性神经营养因子、C10、心肌营养素-1、睫状神经营养因子、细胞因子诱导的中性粒细胞趋化因子-1、酸性粒细胞趋化因子、表皮生长因子、上皮中性粒细胞激活肽-78、红细胞生成素、雌激素受体-α、雌激素受体-β、成纤维细胞生长因子(酸性和碱性)、肝素、FLT-3/FLK-2配体、神经胶质细胞系源神经营养因子、Gly-His-Lys、粒细胞集落刺激因子、粒细胞巨噬细胞集落刺激因子、GRO-α/MGSA、GRO-β、GRO-γ、HCC-1、肝素-结合表皮生长因子、肝细胞生长因子、heregulin-α、胰岛素、胰岛素生长因子结合蛋白-1、胰岛素样生长因子结合蛋白-1、胰岛素样生长因子、胰岛素样生长因子II、神经生长因子、神经营养因子-3,4、抑癌蛋白M、胎盘生长因子、多效生长因子、趋化细胞因子、干细胞因子、基底层细胞衍生因子1B、促血小板生成素、转化生长因子-(α,β1,2,3,4,5)、肿瘤坏死因子(α和β)、血管内皮生长因子、和骨塑形蛋白、改变激素和激素拮抗剂表达的酶、诸如17B-雌二醇、促肾上腺皮质激素、肾上腺髓质素、α-黑色素细胞刺激激素、绒毛膜促性腺激素、皮质类固醇-结合球蛋白、皮质酮、地塞米松、雌三醇、促卵泡激素、胃泌素1、胰高血糖素、促性腺素、L-3,3',5'-三碘甲状腺原氨酸、黄体化激素、L-甲状腺素、褪黑激素、MZ-4、催产素、甲状旁腺激素、PEC-60、垂体生长激素、孕酮、催乳素、促胰液素、性激素结合球蛋白、促甲状腺激素、促甲状腺素释素、甲状腺素-结合球蛋白、和血管加压素、细胞外基质组分、诸如纤连蛋白、纤连蛋白的蛋白水解片段、层粘连蛋白、腱生蛋白、血小板、和蛋白聚糖、诸如蛋白聚糖聚合体、硫酸类肝素蛋白聚糖、硫酸软骨素蛋白聚糖、和粘结蛋白聚糖。其他诱导物包含细胞或衍生自确定组织的细胞的组分,所述组织用于向来自本发明的重新编程细胞的分化中细胞提供诱导信号。此种诱导细胞可以衍生自人类,非人类哺乳动物,或禽类,诸如无特定病原体的(SPF)胚胎或成体细胞。
卵裂球的培养。在一个实施方式中,SCNT胚胎可用于生成卵裂球,并利用与目前在着床前遗传学诊断(PGD)中所使用技法相关的体外技法,从通过本文所揭示的方法而生成的SCNT胚胎中分离单个卵裂球,而不破坏SCNT胚胎或在其他方面显著地改变它们的活性。如本文所展示的,可以如本文所揭示的从取自SCNT胚胎中的单个卵裂球中生成多能胚胎干细胞(hES)和细胞系,而不干扰胚胎的正常发育直至出生。
Wilmut等在克隆绵羊“多莉”中的发现(Wilmut等人,Nature 385,810,1997),偕同Thomson等人在衍生出hESCs中的发现(Thomson等人,Science 282,1145,1998),业已引起了人们对于再生细胞移植的相当大的热情,其基于患者特异性hESCs的建立,所述患者特异性hESCs衍生于SCNT胚胎,或衍生于从患者自身细胞核所生成的SCNT-生物工程化的细胞团。这种策略,旨在通过自体移植而规避免疫排斥,对SCNT而言也许是最强的临床依据。同样地,复杂疾病-特异性的SCNT-hESCs的衍生获得可以加速疾病机理的发现。对于细胞移植,用个体小鼠自身的SCNT-衍生的mESC对小鼠SCID和PD模型进行的创新治疗令人鼓舞(Rideout等人,Cell 109,17(2002);Barberi,Nat.Biotechnol.21,1200(2003))。最终,创立具有广泛组织相容性的SCNT-衍生的干细胞库的能力将降低对持续供应新卵母细胞的需求。
在本发明的某些实施方式中,可以可选地分化获取自SCNT胚胎的分化多能或分化全能细胞(例如,hNT-ESCs),并将其引入它们通常驻留的组织中以展现出治疗效用。例如,可以将获取自SCNT胚胎的分化多能或分化全能细胞引入所述组织中。在某些其他实施方式中,可以将获取自SCNT胚胎的分化多能或分化全能细胞系统地引入或引入到与期望的治疗效用所在位点相距一定距离处。在此种实施方式中,获取自SCNT胚胎的分化多能或分化全能细胞可以在一定距离处起作用或者可以回归到期望的位点。
在本发明的某些实施方式中,获取自SCNT胚胎的克隆细胞、分化多能或分化全能细胞可用于诱导其他多能干细胞的分化。单细胞所衍生的细胞群的生成可用于诱导其他多能干细胞的分化,所述细胞群在维持基因表达的胚胎模式的同时,也能够在体外繁殖。细胞-细胞诱导是在早期胚胎中指导分化的一般方法。在正常胚胎发育过程中,许多潜在的医学上有用的细胞类型会受到诱导信号的影响,包含脊髓神经元,心脏细胞,胰岛β细胞,和永久造血细胞。在维持基因表达的胚胎模式的同时也能够在体外繁殖的单细胞所衍生的细胞群可在多种培养条件下(体外,卵内,或体内)培养以诱导其他多能干细胞的分化而成为所期望的细胞或组织类型。
获取自SCNT胚胎的分化多能或分化全能细胞(例如,ntESCs)可用于获得任何所期望的分化细胞类型。此种分化细胞的治疗用法是空前的。如本文所讨论的,可以根据本文揭示的方法,用H3K27me3-特异性脱甲基酶处理供体细胞,或受体卵母细胞,杂合卵母细胞或SCNT胚胎。
或者,供体细胞可以是患有病症的受试者的成体体细胞,并且所生成的SCNT胚胎可以用于生产疾病的动物模型,或疾病-特异性分化多能或分化全能细胞,其可以在分化条件下培养以产生疾病的细胞模型。本发明的卓越优点是,通过提高SCNT的效率,它提供了基本上无限的同基因型或同系ES细胞的供应,特别是非诱导多能干细胞(例如,非iPSCs)的多能ES细胞。此类NT-ESCs比iPSCs有优势且适合用于移植,因为它们不是仅部分地分化多能,并且没有重编程因子的病毒转基因或强迫表达来指导它们的重编程。
在一些实施方式中,从SCNTs生成的NT-ESCs是从SCNT胚胎获得的患者-特异性分化多能细胞,其中供体细胞是从要用多能干细胞或其分化后代治疗的受试者中获得的。因此,它将排除与当前移植方法相关的显著问题,即,由于宿主对抗移植物或移植物对抗宿主排斥而可能发生的对被移植组织的排斥。通常,通过施用抗排斥药物诸如环孢素来预防或降低排斥。然而,此类药物有显著的不良副作用,例如,免疫抑制,致癌特性,并且非常昂贵。本发明应该消除,或至少大大降低,对抗排斥药的需求,例如环孢素,硫唑嘌呤,FK-506,糖皮质激素,和雷帕霉素,及其衍生物。
试剂盒
本发明提供了包括H3K27me3-特异性脱甲基酶激活剂(例如,编码Kdm6a、Kdm6b或Kdm6c的多核苷酸、Kdm6a、Kdm6b或Kdm6c多肽或其酶活性片段)的试剂盒。
在一些实施方式中,所述试剂盒包括无菌容器,其含有治疗性或预防性的细胞组合物;此类容器可以是盒子、安瓿、瓶子、小药瓶、管子、袋子、小袋、泡罩包装或本领域已知的其他适合的容器形式。此类容器可以由塑料、玻璃、层压纸、金属箔或其他适合容纳药剂的材料制成。
如果需要,本发明的剂将与以供施用所述剂以提高SCNT效率的说明书一起提供。所述说明书通常将包含有关使用组合物增强生理性X染色体失活的信息。在其他实施方式中,说明书包含至少以下一项:治疗剂的描述;用于治疗或预防神经系统疾病或其症状的剂量时程和给药;防护措施;警告;适应症;禁忌;药剂过量信息;不良反应;动物药理学;临床研究;和/或参考文献。说明书可以直接印在容器上(如果有),也可以作为贴在容器上的标签,也可以作为单独的单页,小册子,卡片或文件夹,其放在容器内或随容器提供。
除非另有说明,本发明的实践使用分子生物学(包含重组技法)、微生物学、细胞生物学、生物化学和免疫学的常规技法,其完全在本领域技术人员的知识范围内。这些技法在文献中有充分的解释,诸如“Molecular Cloning:A Laboratory Manual”,第二版(Sambrook,1989);“Oligonucleotide Synthesis”(Gait,1984);“Animal Cell Culture”(Freshney,1987);“Methods in Enzymology”“Handbook of Experimental Immunology”(Weir,1996);“Gene Transfer Vectors for Mammalian Cells”(Miller和Calos,1987);“Current Protocols in Molecular Biology”(Ausubel,1987);“PCR:The PolymeraseChain Reaction”(Mullis,1994);“Current Protocols in Immunology”(Coligan,1991)。这些技法适用于本发明的多核苷酸和多肽的生产,因此,可以在制备和实践本发明时考虑这些技法。用于特定实施方式的特别有用的技法将在后面部分中讨论。
提出以下实施例以向本领域技术人员提供如何制备和使用本发明的测定、筛选和治疗方法的完整公开披露和描述,并非意图限制发明人所视本发明的范围。
实施例
实施例1:对于双亲胚胎中的Xist沉默作用,H3K9me3是可有可无的
为了确定Kdm4b-介导的H3K9me3的丧失是否可以诱导双亲胚胎中的Xist去阻遏,将Kdm4b mRNA注射进入体外受精来源的胚胎。免疫染色分析证实,Kdm4b mRNA注射以浓度依赖的方式有效地耗尽了受精卵中的H3K9me3(图1A)。为了评估Xist RNA的表达,在四-细胞胚胎中执行了RNA荧光原位杂交(FISH)分析。为了区分雄性和雌性胚胎,使用针对Rnf12基因座的特异性探针同时通过DNA FISH标记X染色体。因此,雄性或雌性胚胎的每个卵裂球应该分别具有一个或两个DNA FISH信号。“未注射”对照雄性胚胎显示无Xist RNA信号,且大多数雌性胚胎显示了一个RNA云朵或光点信号(图1B至1D)。类似地,被注射Kdm4b的胚胎在雄性或雌性胚胎中均不诱导母系Xist表达(图1B至1D)。不受限于理论,这表明在生理性双亲条件下H3K9me3在母系Xist沉默作用中没有扮演主要角色。
实施例2:在卵母细胞和着床前胚胎中,母系H3K27me3包覆Xist
由于母系H3K27me3可以充当印记标记(Inoue等2017.Nature547:419–424),检查了其在Xist印记中的潜在参与度。对H3K27me3ChIP-seq(染色质免疫沉淀[ChIP]结合高通量测序)数据集(Zheng等人2016.Mol Cell 63:1066–1079)的分析揭示了Xist被广泛的H3K27me3区间所包覆,所述区间在成熟卵母细胞中跨越约450kb并且是在卵母细胞生长期间确立(图2A)。卵母细胞DNase I测序(DNase I seq)(Inoue等人2017.Nature 547:419–424)和DNA甲基化组(Kobayashi等人2012.PLoS Genet 8:e1002440)数据集的分析揭示,整个H3K27me3区间展现出低的染色质可及性和低的DNA甲基化作用(图2A)。不受限于理论,这暗示着独立于DNA甲基化作用的异染色质区间的形成。对受精后胚胎的ChIP-seq数据集的分析(Zheng等人2016.Mol Cell 63:1066–1079)揭示,母系H3K27me3区间在整个着床前发育过程中都得到维持,但在胚胎第6.5天(E6.5)上胚层中丢失(图2B)。值得注意的是,跨越从Xist至Zcchc13但不包括Tsix启动子的上游约200-kb区域,在囊胚胚胎中维持了H3K27me3富集的母系等位基因偏倚(图2C)。这些数据支持母系H3K27me3在母系Xist沉默作用中的潜在作用。
实施例3.母系H3K27me3负责母系Xist沉默作用
为了检查H3K27me3是否对母系Xist沉默作用负责,通过注射编码H3K27me3-特异性脱甲基酶Kdm6b的mRNA,耗尽了受精卵中的H3K27me3(图3A)。作为阴性对照,对受精卵的预备是通过注射催化突变体Kdm6bMUT,其在催化结构域怀有一个点突变(图3A;Inoue等人2017.Nature 547:419–424)。尽管有外源性Kdm6b的瞬时表达,但在四-细胞阶段和桑椹胚阶段,Kdm6bWT胚胎中的H3K27me3水平显著低于Kdm6bMUT胚胎中的水平(图5A至5B)。
为确认H3K27me3在被注射Kdm6bWT胚胎中的Xist基因座处丢失,执行了超低输入原生ChIP-seq(ULI-NChIP)分析(Brind’Amour等2015.Nat Commun 6:6033),其方法只使用500–2000个小鼠胚胎干细胞仍可有效运作(图6A)。H3K27me3 ULI-NChIP使用来自被注射Kdm6bWT或Kdm6bMUT的桑椹胚胚胎的约2000个卵裂球执行。通过将被注射Kdm6bMUT胚胎与公开的桑椹胚胚胎数据集进行比较来验证数据的质量(图6B至6D;Liu等人2016.Nature537:558–562)。被注射Kdm6bWT胚胎中的H3K27me3峰值的数目比被注射Kdm6bMUT胚胎中的数目小得多(图6E)。重要的是,Xist基因座在遍及Kdm6bWT胚胎的整个区间中展现出H3K27me3富集的显著降低(图6F)。再者,对单核苷酸多态性(SNP)信息的分析揭示,母系H3K27me3区间在Kdm6bWT胚胎中丢失(图3B)。
为了检查在被注射Kdm6bWT四-细胞胚胎中母系Xist是否被压抑,执行了RNA/DNAFISH分析。RNA/DNA FISH分析揭示了大多数被注射Kdm6bWT雄性显示一个Xist RNA云朵或光点,而所有被注射Kdm6bMUT雄性均未显示信号(图3C至3D)。再者,大多数被注射Kdm6bWT雌性显示两个Xist RNA云朵或/和光点,而大多数被注射Kdm6bMUT雌性显示一个云朵(图3C,3E)。这些结果展示,在Xist基因座的母系H3K27me3的丧失在四-细胞阶段诱导了母系Xist去阻遏。
实施例4.H3K27me3的丧失诱导母系X-染色体失活(XCI)
为了检查母系Xist表达是否一直持续到桑椹胚阶段(图4A),执行了RNA/DNA FISH分析。引人注目的是,大多数被注射Kdm6bWT的雄性和雌性胚胎分别显示出一个或两个RNA云朵,而大多数被注射Kdm6bMUT的雄性和雌性胚胎分别显示出零个和一个RNA云朵(图4B至4D),表示重新被激活的Xist是持久的。尽管Xist可以通过Rnf12的过度表达而上调(Tan等2016.Proc Natl Acad Sci 113:3197–3202),RT-qPCR分析没有发现Rnf12在被注射Kdm6bWT胚胎中向上调控的证据(图7),排除了Kdm6bWT-介导的Xist压抑是由于Rnf12过度表达所引起的可能性。
为了确定母系Xist表达是否导致母系XCI(图4A),对早期囊胚阶段杂合小鼠胚胎(具备生物学重复)执行了RNA测序(RNA-seq)分析(图8A)。对SNP信息的分析允许Xm-连锁基因的检查,其揭示了在被注射Kdm6bWT胚胎中Xm-连锁基因的表达水平被显著下调,但常染色体基因的表达水平并没有被显著下调(图4E)。一致地,在被注射Kdm6bWT胚胎中,X-连锁基因的母系等位基因表达偏倚[Mat/(Mat+Pat)]被显著破坏,尽管其仍然是>50%(图8B)。这些数据展示,在被注射Kdm6bWT胚胎中,与父系XCI相比,母系XCI的发生的水平是较轻的。对单个X-连锁基因的仔细检查证实,大多数基因在被注射Kdm6bWT胚胎中被下调(图8C),而已知会逃脱出被印记XCI的基因(Borensztein等人2017.Nat Struct Mol Biol 24:226–233)则没有变化(图8D)。不受限于理论,这暗示着Kdm6b-介导的母系XCI可以再现生理性XCI。
综上所述,本文所述的结果提供证据证明H3K27me3充当Xist的印记标记。在Xist基因座上母系H3K27me3的基于区间的调控是一个有吸引力的发现,并提出了重要的问题。例如,在卵子生成过程中如何定义所述H3K27me3区间的边界?跨越Xist和Zcchc13的所述区间的前半部分(约200kb)如何在囊胚胚胎中维持母系等位基因-特异性的H3K27me3富集?值得注意的是,这个约200-kb的区域似乎形成了一个拓扑关联结构域(Giorgetti等人2014.Cell 157:950–963),意味着诸如CTCF之类的蛋白质可能参与调节染色质边界。有趣的是,所述结构域与一组转基因高度重叠,在常染色体中所述组转基因的插入再现了被印记的XCI(Okamoto等人2005.Nature 438:369–373)。不受限于理论,这提出了如下的可能性:所述区域内可能存在吸引多梳家族复合体的核心元素,且所述元素在卵子生成过程中有助于印记的建立。
综上所述,本研究不仅将Xist鉴别为H3K27me3-依赖的被印记基因的新成员(Inoue等人2017),而且展示了H3K27me3-依赖的基因组印记在保护Xm免于经受XCI中的生物学重要性。
上述结果是使用以下材料和方法获得的。
小鼠卵母细胞的收集
所有动物研究均按照哈佛医学院的机构动物照护和使用委员会的指导执行。卵母细胞收集和体外受精的程序先前已有描述(Inoue等人2017.Nature 547:419–424)。本研究中用于SNP分析的杂合胚胎是通过B6D2F1/J(BDF1)卵母细胞和PWK精子(Jackson实验室,003715)的体外受精获得的。
mRNA制备和注射
先前已描述了Kdm6b mRNA的构建和制备以及显微注射进入受精的卵母细胞(Inoue等人2017.Nature 547:419–424)。Kdm4b构建体的生成是通过将其cDNA扩增子克隆进入pcDNA3.1-Flag-poly(A)83质粒。mRNA是用mMES-SAGE mMACHINE T7 Ultra试剂盒(生命科技)合成,通过氯化锂沉淀被纯化,并用无核酸酶纯水溶解。被注射的Kdm6b
用于FISH的探针
Xist RNA探针的制备是通过使用带有Cy3-dCTP(通用电气医疗,PA53021)的切口平移(Nick translation)试剂的试剂盒(雅培分子,07J00-001)。模板DNA是编码全长小鼠Xist基因的质粒(Addgene,26760)(Wutz和Jaenisch.2000.Mol Cell 5:695–705)。DNAFISH探针的制备使用了带有Green-dUTP(雅培分子,02N32-050)的相同试剂盒。模板DNA是含有Rnf12基因座(RP23-36C20)的BAC克隆(Fukuda等2015.Development 142:4049–4055)。将荧光探针使用5μg的Cot-1 DNA(生命科技),5μg的鲱鱼精子DNA(赛默飞世尔)与2.5μg的酵母tRNA(赛默飞世尔,AM7119)乙醇沉淀,然后溶解于20μL的甲酰胺(赛默飞世尔,17899)。探针储存于4℃。在使用前,将探针(每种0.75μL)与0.75μL的Cot-1 DNA/甲酰胺和2.25μL的4×SSC/20%的葡聚糖(密理博S4030)混合。将探针混合物在80℃加热30分钟,然后移转到37℃培养箱中(“预退火的探针”)。
整胚RNA/DNA FISH
将四-细胞或桑椹胚胚胎在受精后46或78小时(hpf),在2%的多聚甲醛(PFA)(溶于含有0.5%的Triton X-100的PBS)中于室温下固定20分钟。用0.1%的BSA/PBS清洗3次后,将胚胎用含有0.02%的Triton X-100的0.1N的HCl在4℃下处理15分钟。用0.1%的BSA/2×SSC清洗3次后,将胚胎在一系列的10%、20%和50%的甲酰胺/2×SSC玻璃皿(电镜科学,705430-30)中温育,并温育30分钟。样本用矿物油覆盖,在80℃加热30分钟,然后在37℃温育30分钟以上。然后将胚胎移植至4.5μL的“预退火的探针”中,在另一玻璃皿上用矿物油覆盖,并在37℃温育24小时以上。胚胎用预热好的42℃的0.1%的BSA/2×SSC清洗,在最后一滴中留置30分钟,然后以内含DAPI的VectaShield(Vector实验室)封固到载玻片上。在激光-扫描共聚焦显微镜(蔡司,LSM800)下检测荧光。
整胚免疫染色
免疫染色和定量分析的流程先前已描述(Inoue等人2017.Nature 547:419–424)。
母系等位基因-偏倚的H3K27me3区间的鉴别
BED文件,包含内细胞团(ICM)中H3K27me3 ChIP-seq的100-碱基-对(bp)子序列集中的RPKM(每百万映射读数中来自某基因每千碱基长度的读数,reads per kilobase permillion mapped reads)数值,是来自GSE76687(Zheng等人2016.Mol Cell 63:1066–1079)。BED文件标记了两个亲本等位基因的母系或父系所含有的RPKM值,并且将等位基因的读数归一化到总读数的数目。“bedtools makewindows”用于生成整个mm9基因组1-kb子序列集,且每个子序列集的RPKM值通过“bedtools映射定位(map)”来计算。使用1为信号的截止值和4为倍数变化的截止值,将所有子序列集分为“无信号”,“双等位基因的”和“母系偏倚的”三个类别。使用滑动窗口手段来鉴别出富集了“母系偏倚的”H3K27me3子序列的区间。所使用的审查标准如下:在一个20kb的窗口内,“母系偏倚的”子序列集的最小数目为3,并且“母系偏倚的”子序列集的百分比大于“双等位基因的”子序列集。重叠的窗口通过“bedtools合并(merge)”予以合并。在所述基因组中,总共鉴别出5986个区间。
ULI-NChIP
在78hpf(受精后78小时),每组约110个桑椹胚胚胎用酸性Tyrode’s溶液(Sigma-Aldrich)短暂处理以去除透明带,用0.2%的BSA/PBS清洗,然后移植至1.5-mL的管子中。使用H3K27me3抗体(Diagenode,C15410069)如先前所述(Brind’Amour等人2015.Nat Commun6:6033)执行ULI-NChIP并有如下修改。首先,我们使用Beckman SPRIselect珠粒(BeckmanCoulter)代替了Agencourt Ampure XP珠粒。其次,使用适于Illumina(New EnglandBiolabs)的NEBNext Ultra II DNA文库制备试剂盒制备测序文库。第三,使用Kapa(Hifi)高保真热启动预混液(Kapa Biosystems)执行PCR扩增。最后,没有执行尺寸的选择。对于输入样本,10%体积的染色质溶解物被取出且用于文库构建和测序。文库的定量分析和测序已在先前描述(Inoue等人2017.Nature 547:419–424)。
ULI-NChIP的数据分析
为了Kdm6bMUT和Kdm6bWT样本之间的归一化,使用了类似MAnorm(Shao等2012.Genome Biol 13:R16)的策略。首先,在Kdm6bMUT和Kdm6bWT样本之间识别出共有的峰值。下一步,基于共有峰值内每个样本的RPKM数值,将所有样本归一化到覆盖率最高的样本。将SNP-特异性读数归一化到每个文库的唯一映射的读数的总数,然后基于每个等位基因SNP-特异性读数的总和进一步归一化到覆盖率最高的等位基因。
逆转录和实时定量PCR分析
在46hpf(四-细胞),60hpf(八-细胞),和78hpf(桑椹胚)收集被注射Kdm6b的胚胎。逆转录和实时定量PCR分析的流程已在先前描述(Inoue和Zhang.2014.Nat Struct MolBiol 21:609–616),除了本研究中对逆转录使用了随机引物。用于实时定量PCR的引物序列如下:18S-F(5′-TTG ACGGAAGGGCACCACCAG-3′),18S-R(5′-GCACCACCACCCACGGA ATCG-3′),Rnf12-F(5′-TTTGTCGCAGGGCAGTCTTA-3′),和Rnf12-R(5′-GTTTGCCCATCACTATTCCAGC-3′)。
RNA-seq和数据分析
将96hpf时刻的囊胚胚胎用酸性Tyrode's溶液短暂处理,用0.2%的BSA/PBS清洗,并于-80℃保存在PCR管中。每组的40至46个胚胎被汇总而用于RNA-seq。如先前所述(Inoue等2017)制备RNA-seq文库,除了在cDNA扩增后使用了Nextera XT DNA文库制备试剂盒(因美纳)。
统计分析
统计分析是以R(http://www.r-project.org)来实施的。配以默认参数使用了“cor”函数而计算出Pearson’s R系数。对于图8B,用R的函数“wilcox.test.”执行了Mann-Whitney U-检验。
代码的可获得性
基于SNP信息,使用了客制化的流水线将测序数据的比对从杂合胚胎拆分到它们的亲本来源。所述代码提供于https://github.com/lanjiangboston/UniversalSNPsplit。
数据的可用性
本文所生成的ChIP-seq和RNA-seq数据集存放于GEO数据库(Gene ExpressionOmnibus database),其登录号为GSE103714。GV卵母细胞的WGBS数据集是下载自http://www.nodai-genome.org/mouse.html?lang=en(Kobayashi等人2012.PLoS Genet 8:e1002440)。H3K27me3 ChIP-seq数据集是下载自GSE76687(Zheng等人2016.Mol Cell 63:1066–1079)。所述卵母细胞DNase I-seq数据集是来自GSE92605(Inoue等人2017.Nature547:419–424)。BAM文件和ENCODE数据的峰值文件是下载自https://www.encodeproject.org/files/ENCFF001KDT。桑椹胚胚胎H3K27me3 ChIP-seq数据集是来自GSE73952(Liu等2016.Nature 537:558–562)。
其他实施方式
从前面的描述中将显而易见的是,可以对本文所描述的本发明进行变化和修改以将其适用于各种用途和条件。此种实施方式也在以下权利要求的范围内。
本文对变量的任何定义中的元件列表的列举包含将所述变量定义为所列元件的任何单个元件或其组合(或其子组合)。本文对实施方式的列举包含所述实施方式作为任何单个实施方式或与任何其他实施方式或其部分的组合。
本说明书中提及的所有专利,出版物和登录号在此通过引用并入本文,其范围如同明确地和个别地指出每个独立的专利,出版物和登录号被通过引用并入本文。
- 用于生成生理性X染色体失活的组合物和方法
- 用于治疗病理性血管生成和血管通透性的组合物和方法
