一种蓝藻藻胆体冷冻电镜制样的方法
文献发布时间:2023-06-19 12:24:27
技术领域
本发明涉及生物样品的冷冻电镜样品制备领域,具体涉及一种蓝藻藻胆体冷冻电镜制样的方法。
背景技术
蓝藻藻胆体是一类大型捕光天线蛋白复合体,其位于蓝藻细胞的内囊体膜外朝向基质的一侧,可以吸收光能并将能量传递至光系统反应中心。目前有很多针对藻胆体的生化实验研究其组装和能量转递机制,但是仍有很多疑问尚不清楚,所以迫切需要解析藻胆体的高分辨结构信息,结合这些生化结果来理解其的组装和能量传递机制。
蓝细菌的藻胆体在上世纪70年代就已经体外纯化出来,但是至今为止经过半个多世纪蓝藻藻胆体的近原子级高分辨率结构仍然没有得到解析。这是由于体外纯化的藻胆体只有在高磷酸盐(0.6~1.0mol/L)且常温(16~28℃)的环境下才能稳定存在,而在该环境下晶体不生长,所以不能用常用的X射线晶体衍射(X-ray)结构解析,而蓝藻藻胆体的分子量约为6000kDa左右,所以也不能利用核磁共振解析其结构,最终就剩下利用冷冻电镜技术解析其结构。
但是,目前为止利用冷冻电镜(Cryo-EM)解析蓝藻藻胆体结构有三个难点:1、蓝藻藻胆体样品只在常温环境下稳定存在,而冷冻电镜制样需要将样品速冻在-150℃左右的液态乙烷中,所以蓝藻藻胆体样品经过冷冻电镜制样常常会解聚;2、蓝藻藻胆体样品只有在高磷酸盐(0.6~1.0mol/L)环境下才能稳定存在,虽然Cryo-EM能在维持复合物稳定的高浓度磷酸盐下成像,但该环境下的样品在冷冻电镜下的衬度急剧下降,导致解析出蛋白复合体结构的分辨率不高;3、由于蓝藻藻胆体常为圆盘形,且底部与类囊体膜连接的部分有疏水结构域,所以蓝藻藻胆体的常规冷冻制样还存在优势取向,这会极大影响其三维重构模型的正确搭建。
发明内容
本发明的目的是提供一种蓝藻藻胆体冷冻电镜的制样方法,以克服藻胆体常规冷冻制样的解聚、衬度差和优势取向的三大难点,为利用冷冻电镜解析各类蓝藻藻胆体的高分率结构提供一种有效的方法。
为实现上述目的,本发明对蓝藻藻胆体通过1,5-戊二醛(GA)交联解决藻胆体低温解聚的问题,然后利用“正面上样,反面快速稀释”的方法快速降低样品中的磷酸浓度解决衬度问题,并在稀释缓冲液中加入去垢剂如NP40解决样品的优势取向问题,最终使得蓝藻藻胆体的冷冻制样能获得高完整性、好衬度、无优势取向的样品,为后续进行单颗粒样品数据采集及分析从而解析其高分辨率结构提供一种有效手段。具体的,本发明的技术方案如下:
一种蓝藻藻胆体冷冻电镜制样的方法,包括以下步骤:
(1)通过蔗糖梯度离心体外纯化蓝藻藻胆体;
(2)将体外纯化的蓝藻藻胆体溶液中的蔗糖除去,然后浓缩得到浓度为9~12mg/mL的藻胆体蛋白溶液,加入终浓度为0.005~0.015%(w/v)的1,5-戊二醛(GA)交联1~2分钟,然后加入pH 7.0Tris-HCl缓冲液终止反应;
(3)采用“正面上样,反面稀释”的方法进行冷冻电镜制样,包括:
(3-1)对冷冻制样用载网双面进行亲水化处理;
(3-2)将交联后的藻胆体蛋白样品上样到亲水化处理后的载网的正面;
(3-3)在载网反面快速加入与上样蛋白样品等体积的含非离子去垢剂的pH7.0Tris-HCl缓冲液,并吹吸2~3次;
(3-4)重复步骤(3-3),使上样蛋白样品的盐浓度快速降低至原来的1/3。
上述步骤(1)对蓝藻藻胆体进行体外纯化的方法是现有技术公知的方法。
上述步骤(2)中,采用无糖的缓冲液(通常为磷酸钠和/或磷酸钾缓冲液)对体外纯化的蓝藻藻胆体进行洗涤,除去蔗糖,然后浓缩为藻胆体蛋白浓度为9~12mg/mL的贮存液备用,冷冻电镜制样前取该藻胆体蛋白贮存液加入交联剂交联。
上述步骤(3)中,其它未特别描述的藻胆体冷冻电镜制样操作,与常规冷冻电镜制样操作相同。
优选的,上述步骤(2)中,加入的pH 7.0Tris-HCl缓冲液的终浓度为10~50μM。
优选的,上述步骤(3)在18℃、湿度100%的条件下进行上样操作。
上述步骤(3-1)中,所述载网优选采用金网,可以通过辉光放电的方法对金网双面进行亲水化处理。
上述步骤(3-3)中,所述非离子去垢剂可以选择NP40(乙基苯基聚乙二醇)、DDM(十二烷基-beta-D-麦芽糖苷)等中的一种,所述pH7.0 Tris-HCl缓冲液优选为10~50mM的pH7.0Tris-HCl缓冲液,其中非离子去垢剂的含量优选为0.01%~0.05%(w/v)。
通常步骤(3-2)中交联后藻胆体蛋白样品的上样体积为3~4μL,经过步骤(3-3)和(3-4)两次等体积缓冲液的吹吸,快速将上样蛋白样品的盐浓度(磷酸盐)降低到原来的1/3。
本发明提供的蓝藻藻胆体冷冻电镜制样的方法通过对藻胆体蛋白进行交联,以及“正面上样,反面稀释”的上样方式克服了藻胆体常规冷冻制样的解聚、衬度差和优势取向的三大难点,应用本方法可以解析出了蓝藻藻胆体近原子级的高分辨率结构信息,为今后利用冷冻电镜解析各类蓝藻藻胆体的高分率结构提供一种有效的方法。
附图说明
图1.体外纯化蓝藻藻胆体蔗糖梯度离心图,箭头指示的是完整藻胆体的条带。
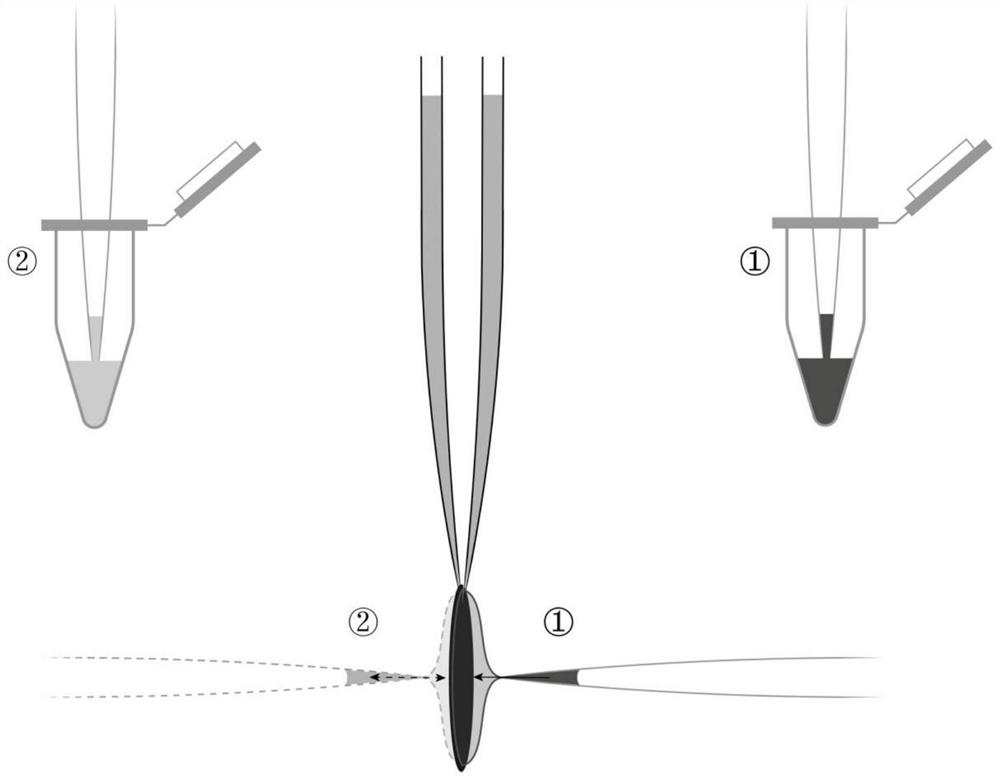
图2.本发明方法中所述的“正面上样,反面稀释”步骤的操作示意图。
图3.显示了本发明方法冷冻制样的效果以及利用所制样品收数据解析结构的分辨率,其中:a显示负染后透射电镜观察可见此藻胆体的形态为五核八杆的圆盘型;b为在300kv冷冻电镜下观察到本发明方法制备的蓝藻藻胆体样品;c为利用单颗粒分析收集数据后的三维平均重构图片;d为解析出的蓝藻藻胆体整体分辨率图,已经解析到近原子级分辨率。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。下述实施例中的%,如无特殊说明,均为质量百分含量。
蓝细菌鱼腥藻属Anabaena sp.PCC 7120(来源于中国科学院淡水藻种库(FACHB)),生长于BG11液体中,以照明日光灯光源,光强为25uE/m
其中Trace metal mix含有如下组分:
实施例1、蓝藻藻胆体的体外纯化
1、配置Buffer A(0.9M磷酸钠缓冲液pH 8.0,1升含300.41g Na
2、固体蔗糖灭菌,使用Buffer C配置1M、0.85M、0.70M、0.55M、0.40M和0.25M的蔗糖溶液;
3、取2L蓝藻鱼腥藻属Anabaena sp.PCC 7120菌液,8000rpm离心收集沉淀,液氮研磨破碎,后面的步骤尽量避光;
4、用25mL Buffer C(提前加入终浓度均为0.1mM的PMSF(苯甲基磺酰氟)、苄脒和6-氨基己酸)悬浮研磨好的蓝藻粉末,4℃3000rpm离心10min取上清;
5、加入Triton X-100至终溶度为2%(v/v),在摇床轻轻震荡30min,20000rpm离心30min,取中层蓝色液体,注意不要取到上层和下层的杂质;
6、用Buffer C配好1M、0.85M、0.70M、0.55M、0.40M和0.25M的蔗糖溶液,3:3:3:4:4:5比例,由低浓度到高浓度依次轻轻加入超速离心机离心管,加入离心管总体积10%的制备的蓝色藻胆体粗提物,35000rpm超速离心过夜;
7、用带弯钩的针头吸取0.70M蔗糖界面处的深蓝色条带即为完整藻胆体(见图1),负染后透射电镜观察可见此藻胆体的形态为五核八杆的圆盘型,如图3中a所示。
实施例2、蓝藻藻胆体的冷冻电镜样品制备
(1)蓝藻藻胆体除糖浓缩后交联
1、用Millipore 30kDa的超滤管对体外纯化的蓝藻藻胆体进行浓缩,同时用无糖的buffer C洗涤,除去蔗糖,并最终将藻胆体蛋白浓缩为10mg/mL的贮存液。
2、加入终浓度为0.01%(w/v)的1,5-戊二醛(GA)交联2分钟,然后加入终浓度为50μM pH 7.0Tris-HCl终止反应。交联处理后的藻胆体样品用于后续蛋白冷冻电镜制样。
(2)蓝藻藻胆体冷冻制样
1、用购自Quantifoll的R1.2/1.3的300目的金网,对金网双面都辉光放电作亲水化处理。
2、利用FEI Vitrobot冷冻电镜制样仪,在18℃、湿度100%的条件下,将交联后的蛋白进行冷冻电镜样品制备。除采用“正面上样,反面快速稀释”法外,其它操作均为常规蛋白样品冷冻电镜常规操作。
(3)“正面上样,反面快速稀释”(图2所示)操作步骤如下:
步骤①:取交联之后的蓝藻藻胆体样品3.5μL上样在金网的正面,并吸附60秒。
步骤②:在金网反面快速加入3.5μL的含0.05%(w/v)NP40的50mM Tris-HClpH7.0的缓冲液,并吹吸2~3次。
步骤③:再重复步骤②一次,最终将藻胆体的磷酸盐浓度快速降低为原来的1/3。
实施例3、蓝藻藻胆体的冷冻电镜样品数据收集并利用单颗粒分析解析其结构
如图3中b所示,在300kv冷冻电镜下观察本发明方法制备的蓝藻藻胆体样品,衬度和完整度都十分理想,也没有优势取向。
在筛到良好的藻胆体冷冻电镜制样样品后,利用300kv冷冻电镜收集数据。图3中c为利用单颗粒分析收集数据后的三维平均重构图片。图3中的d为解析出的蓝藻藻胆体整体分辨率图,已经解析到近原子级分辨率。
- 一种蓝藻藻胆体冷冻电镜制样的方法
- 一种蓝藻藻胆体冷冻电镜制样的方法
