多孔纳米复合材料医疗植入装置
文献发布时间:2023-06-19 18:27:32
技术领域
本发明涉及一种药物洗脱纳米工程化医疗植入/接触装置(NMID),该NMID包括活性药物(药物或生长成分)、水性孔、一个或多个亲水性结构域、一个或多个疏水性结构域和边界带电双层;该装置被配置成维持药物以高精度和长持续时间(超过一周)的释放。本公开描述了具有足够亲水性、离子渗透性和气体渗透性的多孔纳米复合材料的制备,以及利用植入在孔-聚合物界面(中间相电荷层)上的电荷的静电力来增强带相反电荷的药物在工程化装置递送时的分配和保留的方法。NMID将用于将活性药物和其它功能性成分受控地递送到体内体盘。
背景技术
设计和制造医疗植入物的技术已经发展了三代,从仅仅使用惰性材料的原始状态开始,经过了解决人体免疫抵抗的第二阶段(通常是通过包含生物相容性表面涂层诸如PEG来完成),并且现在到达了与身体系统实现良好的相互作用的复杂阶段,不仅是治愈受伤,而且有助于身体的完全再生。最新的生物医学装置将被有意地设计成通过以下方式来对宿主身体功能进行药理学干预,即递送预埋的功能性药物成分,包括但不限于基本构建块、营养物、基因、生长因子、信号肽和/或干细胞,以刺激和加速所需的细胞应答、愈合和再生反应。
新型生物医疗装置的核心技术是将复合材料纳米工程化以配制装置主体或其外部涂层,从而促进一种或多种药物以高精度剂量、几乎恒定的速率以及延长持续时间的可持续递送。接触镜片材料技术的最新进展为该核心技术的进一步发展提供了平台。硅酮-水凝胶复合技术自其在1997年实现以来已经改善了接触镜片的亲水性和透氧性并且将其转化为透气亲水性软组织样装置。
美国专利号10,617,559公开了一种装置,该装置包括:(i)至少一种药物,(ii)一个或多个储层结构域,和(iii)层配置屏障结构域(或屏障层),该层配置屏障结构域用于阻断药物从储层结构域到受试者眼睛眼表的扩散路径。
现有技术表明,药物通过多孔复合材料的渗透有三种运输模式。这些结果表明,在将镜片浸入泪液池中之后,水性孔中的溶解药物在几个小时内会发生爆发性释放。第二种释放模式,主要是吸附在结构域-孔界面处的药物的释放,会持续超过一天。陷在固体聚合物结构域内的药物出来得最慢,并且时间可持续数周,这取决于固体聚合物的弛豫时间尺度(与聚合物的玻璃化转变温度有关)。许多努力着力于将大部分(80%)的药物释放延长到超过一周,包括使用屏障涂层、溶解扩散屏障或带电表面活性剂。
需要一种安全并且提供药物持续释放的药物洗脱医疗植入/接触装置。
附图说明
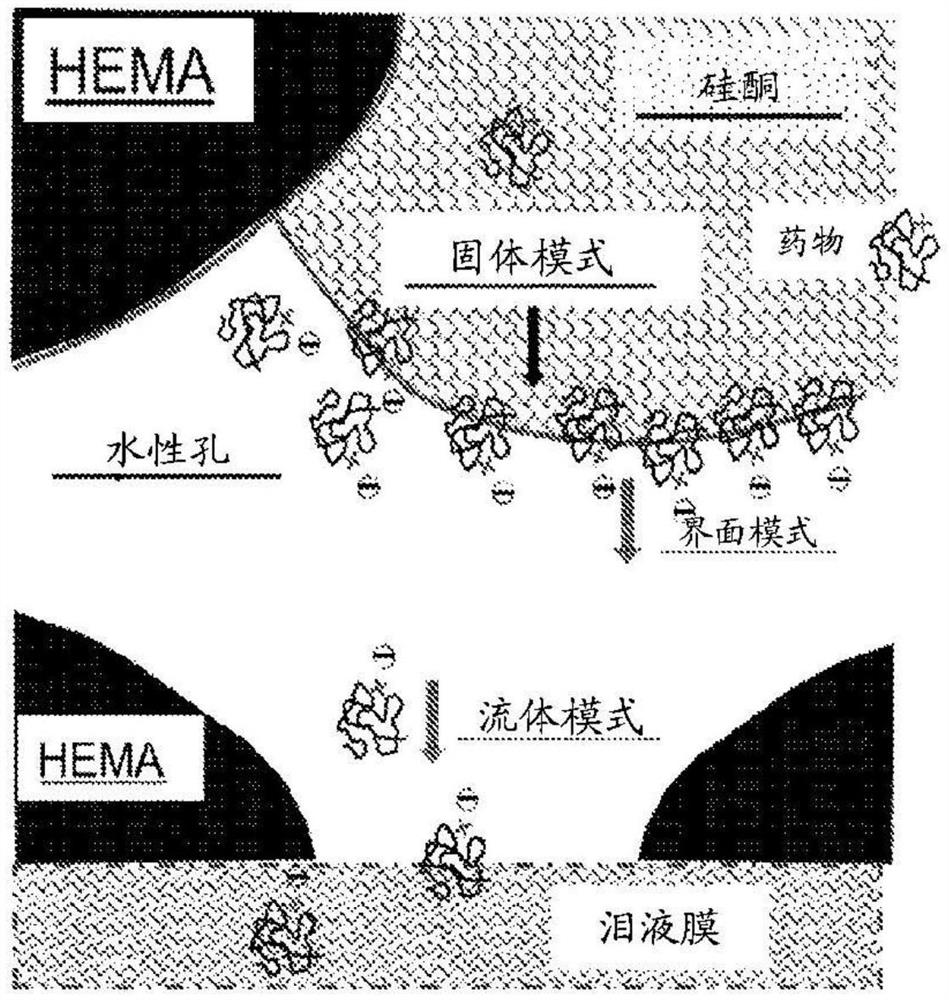
图1药物通过多孔纳米复合材料的渗透。
图2药物通过多孔纳米复合材料的三种运输模式。
图3油酸分子在孔-结构域界面的解离增强了阳离子药物的分配和保留。
图4对于以下两种不同的硅酮水凝胶商业镜片油酸负载与浸泡溶液浓度的相关性:ACUVUE
图5负载有油酸的接触镜片的THCL的累积释放%。
图6负载有油酸的接触镜片的THCL的累积释放%。
图7负载有油酸的接触镜片的BUP的累积释放%。
图8负载有油酸的接触镜片的BUP的累积释放%。
图9负载有油酸的接触镜片的KTF的累积释放%。
图10负载有油酸的接触镜片的KTF的累积释放%。
图11负载有油酸的接触镜片的THCL的累积释放%。一日ACUVUE
图12负载有油酸的接触镜片的KTF的累积释放%。一日ACUVUE
图13负载有油酸的接触镜片的DFNa的累积释放%。
图14负载有油酸的接触镜片的DFNa的累积释放%。
图15负载有油酸的接触镜片的FBNa的累积释放%。
图16负载有油酸的接触镜片的FBNa的累积释放%。
图17负载有6重量%的油酸、亚油酸或α-亚麻酸的ACUVUE
图18负载有6.5mg/mL的鞘氨醇的接触镜片的DFNa的累积释放%。
图19ACUVUE
图20酮替芬(Ketotifen)摄取(在70μg-375μg/CL KTF负载的范围内)与溶液负载浓度的线性相关性。
图21关于负载了2%油酸(油酸负载条件为15mg/ml乙醇)的接触镜片,酮替芬的负载和释放在宽范围(70μg-375μg/CL)内有一致的递送动力学曲线。
具体实施方式
如本文所用,″医疗植入/接触装置″是指与身体部分接触或植入身体环境中以干预特定身体功能或病症的装置。示例是但不限于,外科手术植入的身体部分、支架、化疗泵、组织生长支架、接触镜片、牙齿植入物、皮肤垫、伤口愈合绷带等。
如本文所用,″药物″或″药类化合物″是指具有引起受试者的生理变化的活性的分子,诸如药类药物或营养物。
″带电药物或药类化合物″意指其分子在正常生理条件下是阳离子或阴离子的。它们可属于具有pKa、pKb或等电点的化合物的类别,包括但不限于蛋白质、小肽、带有其它路易斯酸或碱基团的分子,
″疏水/亲水″比率是基于材料的溶解度和在疏水性辛醇与亲水性水之间的分配来衡量材料疏水性的量度。其通常是指辛醇/水的材料常数logP,其中P是辛醇与水之间可溶性组分的分配系数比(Sangster J,J Phys Chem Ref Data 1989;18:No.3)。高logP值意味着疏水性,并且低或负值意味着亲水性。
″结点势″是由于电子或离子在导体、半导体或电解质溶液的边界处扩散而产生的库仑势。示例是金属耦合结、P-N结、液体结或细胞水性介质结。
如本文中在本发明装置中所用,″边界带电双层″是由带负电层和带正电层组成,并且形成在亲水性/疏水性聚合物结构域和水孔的边界界面处。边界电荷双层通常由表面干层和扩散德拜层组成,就像胶体微粒或离子晶体的那些层一样。例如,边界带电双层由边界电荷改性剂的头基的电荷以及(ii)药物或带电头基的抗衡离子的电荷形成。
″边界电荷改性剂″是通过物理溶解或化学键合来植入到水-固体界面上的化合物,以在水-固体界面上产生边界带电双层并且通过水性介质中的界面离子解离或交换来形成结点势。
聚合物的″好溶剂″是其分子与单体段在能量上具有良好的相互作用的溶剂,使得其在聚合物中的溶剂化效应导致聚合物线圈膨胀并且其浸润导致聚合物溶胀。
发明人已经发现具有以下有利功能的新一代纳米工程化接触/植入生物医学装置:(a)可与体液相容并且可被体液渗透,(b)氧气和二氧化碳的高效交换,(c)细胞对疏水性结构域的强粘附(疏水性键合),(d)通过复合材料工程可延长的药物释放速率。
本发明提供了一种医疗装置,该医疗装置包括药物和纳米复合材料。在第一方面,该医疗装置包括亲水性聚合物结构域、疏水性聚合物结构域、水孔和带电双层;其中当该药物是亲水性的时,带电双层中至少80%的药物分配形成在亲水性聚合物结构域和水孔的中间相处,并且当该药物是疏水性的时,带电双层中至少80%的药物分配形成在疏水性聚合物结构域和水孔的中间相处。
在第二方面,该医疗装置包括亲水性聚合物结构域、水孔和带电双层;其中带电双层中至少80%的药物分配形成在亲水性聚合物结构域和水孔的中间相处。
在本装置中,边界带电双层中的每一层由以下形成:(i)边界电荷改性剂的头基的电荷,以及(ii)药物或带电头基的抗衡离子的电荷,其中边界电荷改性剂是具有带电头基和疏水尾的分子并且在装置的整个使用寿命期间固定在边界带电双层处。
本发明还提供了一种用于制造此类装置的方法。
本公开提供了装置复合材料的设计,该装置复合材料由水孔、亲水性聚合物结构域(单体logP<1)和疏水性聚合物(单体logP>3)结构域组成,其中水性孔和亲水性聚合物可促进由体液(例如,泪液或血液)进行的润湿,而疏水性结构域会增强气体(例如,氧气或二氧化碳)渗透以及疏水物(例如,细胞或蛋白质)的粘附。孔和结构域的尺寸被控制在纳米级,以增加孔-表面积和装置的界面相互作用。各种亲水性聚合物材料和疏水性聚合物材料可用于本发明。
本公开还概述了用于负载和递送药物活性成分的NMID的组成设计,其中使用具有高药物亲和力的一个组分结构域作为其储层,而利用其它结构域(具有低得多的药物溶解度)作为屏障,以调节药物释放到体液中的速率。水含量是可调节的以进一步调节总药物递送速率。
本公开最后提供了一种利用工程化结构域形态(例如,尺寸、几何形状和表面积)并且在聚合物-水性孔界面处包含边界电荷改性剂来显著地增强或减少带电药物的释放的方法。
本发明的多孔纳米复合材料可进一步被生物工程化以用于各种接触式或原位医疗装置,包括但不限于药物递送基质、植入装置、组织工程化支架、化疗泵、伤口敷料贴片、美容面膜等。以下各部分示出了发明人如何定制多孔纳米复合材料以制造分别实现以下特点的装置:(a)与体液的高度相容性和渗透性,(b)氧气和二氧化碳的高效交换,(c)细胞对疏水性结构域的强粘附(疏水性键合),(d)通过复合材料工程可延长的药物释放速率。
在一个实施方案中,多孔纳米复合材料由以下各项组成:水孔(10重量%-80重量%或10重量%-40重量%)、由logP在-1至1的范围内的亲水性单体制成的亲水性聚合物结构域(10重量%-50重量%)、由logP>3的疏水性单体制成的疏水性聚合物结构域(10重量%-50重量%)以及以物理方式或化学方式包含的边界带电双层(1重量%-20重量%或1重量-10重量%)。
在另一个实施方案中,多孔纳米复合材料由以下各项组成:水孔(10重量%-80重量%或10重量%-40重量%)、由logP在-1至1的范围内的亲水性单体制成的亲水性聚合物结构域(10重量%-90重量%)以及以物理方式或化学方式包含的边界带电双层(1重量%-20重量%或1重量-10重量%)。
组合物和形态特征(例如,疏水性/亲水性比率、结构域尺寸形状和取向)在每个应用中基于体液润湿、氧气交换速率、细胞粘附以及生长的所需或期望规格进行定制。
在一个实施方案中,该复合材料的亲水性结构域组分选自表1A、表1B、表1C中所列出的亲水性组分中的任何亲水性组分以提高装置的亲水性,并且疏水性结构域组分选自表1A、表1B或表1C中所列出的疏水性组分中的任何疏水性组分以将装置的透氧性(Dk>100)增强到纯水凝胶装置(Dk-20)的四倍至五倍高。纳米复合材料接触镜片可通过热固化(100℃-120℃)过程由这些丙烯酸低聚物或预聚物制成。孔隙度(例如,30体积%-40体积%)由用于均匀地混合两种不同类型的聚合物的溶剂/助溶剂体系产生,随后进行洗涤/溶剂交换过程以将水输注到孔中。水凝胶和水性孔允许体液容易渗透,而柔性的低粘性疏水性聚合物则高度透气体。
表1C示出了一些商业接触镜片的主要单体。表1C是来自″有机硅水凝胶接触镜片的动态接触角分析(Dynamic Contact Angle Analysis of SiliconeHydrogel ContactLenses)″,Michael Leonard Read、Philip Bruce Morgan、Jeremiah Michael Kelly和Carole Maldonado-Godina,生物材料应用杂志(J BiomaterAppl),2010年3月10日在线发布。表1C中使用了以下附加缩写词。mPDMS:单官能甲基丙烯酰氧基丙基封端的聚二甲基硅氧烷;EGDMA:二甲基丙烯酸乙二醇酯;TEGDMA:四乙二醇二甲基丙烯酸酯;TPVC:三-(三甲基硅氧基甲硅烷基)丙基乙烯基氨基甲酸酯;NVA:N-乙烯基氨基酸;PBVC:聚(二甲基硅氧基)二(硅丁醇)双(乙烯基氨基甲酸酯);M3U:αω-双(甲基丙烯酰氧基乙基亚氨基羧基乙基氧丙基)-聚(二甲基硅氧烷)-聚(三氟丙基甲基硅氧烷)-聚(甲氧基-聚(乙二醇)丙基甲基-硅氧烷;FMM:α-甲基丙烯酰氧基乙基亚氨基羧基乙氧基丙基-聚(二甲基甲硅氧基)-丁基二甲基硅烷;TAIC:1,3,5-三烯丙基-1,3,5-三嗪-2,4,6(1H,3H,5H)-三酮;IBM:甲基丙烯酸异冰片酯;HOB:2-甲基丙烯酸羟丁酯;NMNVA:N-甲基-N-乙烯基乙酰胺;AOE:2-烯丙氧基乙醇。
在一个实施方案中,亲水性组分可选自单体、低聚物或预聚物,该单体、低聚物或预聚物含有羟基、烷基二醇、胺、内酰胺、羧基或磺酸基基团的至少一个亲水性基团。疏水性组分可由logP>3的单体基团组成。这些不相容组分可在相容溶剂/助溶剂体系内预混合,或者将在最终固化成均匀纳米复合材料之前预反应成嵌段共聚物。
在一个实施方案中,亲水性聚合物结构域被制成为比疏水性结构域的平均尺寸小十倍,使得疏水性结构域完全浸没到亲水性结构域和液态水的连续混合物中。浸没在亲水性连续体中的这种形态疏水性结构域增强了复合材料的亲水性、接触角和毛细管浸润。
在一个实施方案中,疏水性结构域呈细长针状形状,或者为具有亲水相的互穿网络的一部分,以将透氧性Dk增强到超过100。
在另一个实施方案中,装置表面包括疏水性结构域,该疏水性结构域的尺寸为细胞的一小部分(例如,结构域尺寸介于10nm至1微米或10nm-100nm之间)并且被尺寸甚至更小(例如,比浸没的疏水性结构域的尺寸小十倍)的亲水性结构域和水孔包围,以允许经由疏水性键合增强细胞对装置表面的粘附(增强水性环境中的积聚)。
本发明通过多孔纳米复合材料以工程化精度和速率将活性功能成分运输到宿主身体环境。在本公开中,我们探索了活性成分(药物)在此类复合材料中的转移,其中使用具有高药物亲和力的一类结构域作为其储层,而利用其它结构域(具有明显更低的药物溶解度)作为屏障,以调节药物释放速率。药物通过此类双结构域复合材料内的连接纳米孔类似于色谱柱中的分子洗脱,其中药物保留时间可通过其对亲和柱组分的吸引力来精确地调节。
药物通过多孔疏水性-亲水性复合材料的运输(或从其的释放)可通过以下方式最佳地进行建模:首先研究其在每个单独组分内的渗透,然后对整个复合材料进行有效平均(即,应用运输系数的有效介质理论,参考″有效介质理论、原理和应用(Effective MediumTheory,Principles andApplications)″,第二版,Tuck C.Choy,牛津大学出版社(OxfordUniversity Press),2016年)。每个结构域中的药物渗透率通常由药物在该结构域中的溶解度(S)和扩散率(D)的乘积决定,即渗透性=SxD。在感兴趣的复合材料中,孔中的水相通常具有与其它两个聚合物结构域相比为最高的扩散常数(通常高出几个数量级),但这不一定意味着其渗透常数是最高的,这是由于药物的水溶性可能较低。由于与界面疏水性结构域的亲和力较高并且周围水性介质中的扩散速度较高,所以具有明显疏水段的许多药物可在界面区处具有最高的药物渗透率。图1示出了具有电荷头基和疏水尾的药物牢固地粘附到疏水性聚合物孔表面并且因此可能由于增强的亲和力而在界面区处具有高分区和渗透常数。药物通过三种模式从多孔纳米复合材料中排出:通过孔隙水的流体模式(最快)、通过固体边界层之后通过水孔的界面模式(中速)以及通过本体聚合物的固体模式。图2示出了尽管通过孔隙流体的扩散通常是最快的运输模式,但带电疏水性药物在界面处的明显更高的分配可使界面药物释放成为最主要的模式,尤其是当界面附着有带相反电荷的改性剂诸如油酸时。
我们的建模结果得到所公开的示例的证明,已经表明,通过多孔纳米复合材料控制药物递送的最有效的方式是通过提高药物的分配系数并且因此提高其在聚合物-孔界面区处的负载聚集。我们的创新策略是使药物的界面释放成为最主要的模式(超过总容量的80%),方式是通过在聚合物-水界面处包含边界电荷改性剂,以使药物在边界层中的分配系数与在孔隙水或固体聚合物中的分配系数相比大幅增加。本发明增强了药物从多孔纳米复合材料中的界面区的递送。
通过将固体结构域尺寸降低到纳米级,多孔复合材料的界面面积可按比例增加至超过100m2/克。本发明公开了一种具有此类高孔隙表面积的多孔纳米孔复合材料,该多孔纳米孔复合材料可进一步通过在纳米复合材料中的聚合物-水界面处通过溶剂负载或化学添加边界电荷改性剂来植入边界电荷双层来进行制备。边界电荷迁移可在改性的水性界面处生成库仑结点势,使得边界电荷与带相反电荷的药物之间的强静电吸引增强了药物的分配、聚集和保留。如实验部分中的实施例所示,此类纳米工程化装置在边界区以及所有纳米级孔中在药物分子与界面电荷之间具有长程(1/r
基于与药物的疏水段的logP的匹配,可将亲水性聚合物(logP<1)相或疏水性聚合物(logP>3)相选择作为药物储层相。药物储层聚合物的结构域尺寸优选为纳米级(10nm-100nm)以使结构域-孔界面面积和药物分区最大化。
具有可在水性介质中交换离子(包括水合氢离子H
基于我们的建模和实验结果,我们设定了在延长递送(超过一周)带电药物时为每种医疗植入/接触装置选择适当边界电荷改性剂(BCM)的一般指南,即:(1)物理植入的BCM的水溶性必须较低,以使其在装置的储存时间期间或在延长的药物递送时期内的浸出最小化;(2)BCM优选地在生理pH中是中性的,以避免在从装置中浸出后与宿主身体细胞或外部的其它功能性成分发生无意的静电相互作用;(3)BCM优选地是代谢惰性的或友好的,以使意外排放的影响或其在长时间使用后的堆积最小化。
根据上述评估,我们选择使用长链(C
对于阴离子药物,我们需要将不溶性和生物友好的阳离子BCM包含到纳米复合材料的孔表面。在一个实施方案中,我们选择鞘氨醇来延长释放DFNa。鞘氨醇的结构与油酸类似,只是具有伯胺头而不是羧酸。它是无毒的,并且是代谢副产物。
虽然所有这些化合物都是用于油-水界面的常见表面活性剂,但是它们用作边界电荷改性剂以在本发明的医疗装置中产生边界带电双层会需要如发明人所发现的特殊处理方案,这是由于它们在聚合物中的溶解度低以及在水中形成胶束的临界胶束浓度低的固有限制。
常见油-水表面活性剂(诸如脂肪酸或烷基胺)不是聚合物的天然表面活性剂。发明人已经发现,可通过物理植入或化学反应来增强它们在水-聚合物边界处的聚集密度(与水-油边界处不同),以便按比例增加其随后与带电药物的电荷相互作用。在下一部分中的一个实施方案中公开了物理植入方法。通过浸润将边界电荷改性剂物理地携带到聚合物中,并且通过宿主聚合物的溶剂溶胀按比例增加表面负载密度。
通过将药物储层结构域尺寸减小到纳米级,我们按比例大幅增加了界面面积和其中的药物聚集。通过在聚合物-孔界面处包含电荷双层,我们通过产生带相反电荷的界面大幅降低了药物化学势
本发明进一步提供了一种使用聚合物的好溶剂将水不溶性脂肪酸直接负载到聚合物结构域的方法,该好溶剂的脂肪酸溶解度也比水高。聚合物的″好溶剂″是其分子与单体段在能量上具有良好的相互作用的溶剂,使得其在聚合物中的溶剂化效应导致聚合物线圈膨胀并且其浸润导致聚合物溶胀。负载溶剂优选地是聚合物的好溶剂,使得药物负载可加速并且甚至在溶剂溶胀聚合物的情况下过饱和。此类好溶剂可将相当可观量的脂肪酸分子负载到聚合物结构域中,从而在结构域-孔界面处产生明显增加的边界改性剂聚集。这些PBCM脂肪酸分子从聚合物体相迁移到孔界面,在阴离子解离和形成带电双层的情况下,尤其是在存在除水合氢离子之外的阳离子的情况下,甚至能够更加稳定。该电荷双层用于增强阳离子药物的分配并保留它们以延长其释放。(图3)
本发明提供了一种用于制备纳米复合材料的方法,该纳米复合材料包含亲水性聚合物结构域、疏水性聚合物结构域、水孔和边界带电双层。该方法包括以下步骤:(a)将包含亲水性聚合物结构域、疏水性聚合物结构域和水孔的起始纳米复合材料浸泡在包含适当量的溶解于好溶剂中的边界电荷改性剂的溶液中,该好溶剂溶胀亲水性聚合物或疏水性聚合物,以及(b)通过溶胀过程将边界电荷改性剂携带到亲水性聚合物结构域或疏水性聚合物结构域中。该方法任选地在浸泡之后包括以下步骤:(c)从纳米复合材料的表面去除过量溶液,以及(d)干燥纳米复合材料。作为示例,疏水性聚合物是硅酮,并且好溶剂是乙醇。作为示例,起始纳米复合材料可以是商业接触镜片,包括表1C中所示的那些。
本发明还提供了一种用于制备纳米复合材料的方法,该纳米复合材料包含亲水性聚合物结构域、水孔和边界带电双层。该方法包括以下步骤:(a)将包含亲水性聚合物结构域和水孔的起始纳米复合材料浸泡在包含适当量的溶解于好溶剂中的边界电荷改性剂的溶液中,该好溶剂溶胀亲水性聚合物,以及(b)通过溶胀过程将边界电荷改性剂携带到亲水性聚合物结构域中。该方法任选地在浸泡之后包括以下步骤:(c)从纳米复合材料的表面去除过量溶液,以及(d)干燥纳米复合材料。作为示例,亲水性聚合物是HEMA,并且好溶剂是甲醇或水和乙醇的混合物。作为示例,起始纳米复合材料可以是商业接触镜片,包括表1C中所示的那些。
以上两种方法的浸泡步骤在适当的温度下进行适当的时间段。例如,浸泡为4小时至2天,或8小时-24小时,或16小时-24小时,在10℃-40℃或20℃-30℃或室温下进行。
以下示例进一步说明本发明。这些示例仅旨在说明本发明,并且不应被解释为限制性的。
以下实验中使用的所有接触镜片(包括与J&J临床试验数据的比较)均源自VisionDirect BV公司(英国约克商业公园Y0266RB(York BusinessPark,YO26 6RB,UnitedKingdom))。
对以下两种商业硅酮水凝胶接触镜片进行了测试:ACUVUE
通过称重脂肪酸负载期前后的干镜片来确定OA的负载量,如图4所示。油酸负载与负载溶液的浓度成线性关系。此外,在浓度介于15mg/mL和27mg/mL之间时,
通过将镜片浸泡在药物-PBS溶液中来负载药物。纯镜片的浸泡持续时间为在室温下持续24小时。在负载期之后,取出镜片并通过用滤纸吸干去除表面上的过量药物溶液。
图5和图6示出了
对于
图7和图8示出了
图9和图10示出了油酸对KTF的释放动力学的影响,KTF是组胺Hl受体的相对选择性非竞争性拮抗剂。
一日ACUVUE
我们发现最大的油酸负载为2.9重量%。例如,当油酸浸泡浓度从100mg/mL增加至500mg/mL时,一日ACUVUE
对于一日ACUVUE
双氯芬酸钠是在生理pH下带负电荷的非甾体抗炎药物(NSAID)之一。图13和图14示出了油酸对
氟比洛芬钠(FBNa)是白内障手术术后的非甾体抗炎药物。图15和图16示出了油酸对FBNa释放的影响。在图15中,具有13.5%和28.6%OA的
从针对DFNa和FBNa获得的结果可以得出结论,即阴离子油酸在硅酮水凝胶接触镜片中的存在由于排斥离子相互作用而加快了阴离子药物的药物释放。此外,证明了油酸对加速DFNa和FBNa的释放动力学的影响对于
油酸是具有一个双键的长链不饱和脂肪酸。亚油酸和α-亚麻酸是碳数与油酸相同的不饱和脂肪酸,但是分别具有两个和三个双键。这三种脂肪酸在室温下是油性液体。然而,由于双键数量不同,我们假设它们在疏水性结构域的水性界面处的堆积密度会影响药物释放动力学。
我们在ACUVUE
将ACUVUE
通过将镜片浸泡在5mL的0.2mg/mL药物-PBS溶液中来负载双氯芬酸钠。纯镜片的浸泡持续时间为在室温下持续24小时。在负载期之后,取出镜片并通过用滤纸吸干去除表面上的过量药物溶液。为了确定每个镜片中负载的药物量,在浸泡期前后使用UV-可见光分光光度计(Varian Can′50Bio,美国加州核桃溪市(Walnut Creek,CA,USA))测量每种浸泡溶液的药物浓度。在药物负载步骤之后,使用体外释放实验来测试镜片。
图18示出了鞘氨醇对DFNa释放的影响。在图18中,具有6.5mg/mL鞘氨醇负载溶液的
ACUVUE
通过将镜片浸泡在5mL的0.3mg/mL KTF PBS溶液中来负载富马酸酮替芬(KTF)。在负载期(23℃下24小时)之后,取出镜片并通过用滤纸吸干去除表面上的过量药物溶液。为了确定每个镜片中负载的KTF量,在浸泡期前后使用UV-可见光分光光度计(Varian Cary50Bio,美国加州核桃溪市(Walnut Creek,CA,USA))测量每种浸泡溶液的KTF浓度。在药物负载步骤之后,使用体外释放实验来测试镜片。药物释放实验是通过将药物负载镜片浸泡在3mL的Dulbecco PBS中来进行,pH为7.4并且温度为23℃。在释放实验期间,以预定时间间隔去除1mL的释放样品,并且将1mL的新鲜PBS再填充到释放介质中。使用UV-分光光度计(Varian Cary 50Bio)在300nm的波长下测量释放的药物量。针对每种不同情况,一式三份执行药物释放实验。因此,确定了对照镜片的KTF摄取为176pg,而负载硬脂酸的镜片的摄取略有增加,为214pg。相比之下,具有肉豆蔻酸的接触镜片表现出明显提高的KTF摄取,为516μg。
图19示出了硬脂酸和肉豆蔻酸对ACUVUE
在该示例中,医疗装置是商业硅酮水凝胶ACUVUE
在该示例中,医疗装置是HEMA一日ACUVUE
在该示例中,医疗装置是HEMA一日ACUVUE
该示例证明了油酸边界电荷控制技术的高精度。我们首先证实了,能够在溶液负载过程中通过药物浓度来精确地确定油酸负载镜片中的总KTF负载。
镜片品牌是ACUVUE TruEye,并且通过与实施例1中描述的相同的乙醇浸泡过程利用15mg/mL油酸乙醇来负载油酸2-4%(根据干燥镜片重量变化进行计算,可能随着干燥条件而波动)。KTF根据实施例2中的过程进行负载。图20示出了KTF负载范围70-375μg/CL与溶液负载浓度的线性相关性。
此外,我们验证了,在油酸负载的量固定的情况下(油酸负载条件为在乙醇中的15mg/ml),在每个接触镜片的70-375μg/CL KTF的宽负载范围内,动力学释放曲线相同(图21)。
我们在实施例10中的数据还表明,在将油酸负载调整到6%的情况下容易将相同KTF释放曲线延长到超过600小时(图17),并且在将油酸负载增加到9.1%的情况下进一步延长到1500小时(实施例5,图10)。通过研究油酸和KTF药物%的最佳负载组合,预计我们能够制造一种恰好在一周内以较低平均剂量精确地递送80%的KTF有效负载的硅酮-水凝胶镜片。
根据图20和图21中示出的关于在宽范围内累积释放速率百分比与CL中油酸负载量的相关性的一致性趋势,预计我们能够在商业接触镜片中规定药物和油酸负载重量的精确配方,以在期望持续时间(例如,5天)内递送超过80%的KTF埋入量(例如,80pg),从而实现高精度药物递送控制。
Johnson&Johnson的ACUVUE Theravision是用于递送日用一次性水凝胶镜片中的药物酮替芬(KTF)的首个获批产品(日本)。J&J etafilcon A-KTF释放型接触镜片的体外实验结果表明几乎90%的药物是在不到2小时内被释放(参见美国专利号9,962,376,第1列第58行,图1)。通过将实施例6、10和16的结果与如上所述9,962,376专利中公开的J&J临床试验数据相比,本发明的油酸负载接触镜片能够:(a)将KTF的每日递送剂量更精确地控制在1-375微克的宽范围内,(b)将该精确剂量递送持续时间从几小时延长至几周(600小时),明显长于9,962,376专利中所示的J&J临床数据的爆发性释放,(c)使HEMA日用一次性水凝胶镜片(参见实施例6)(其是J&J临床试验中的唯——类镜片)以及功能更多的长期佩戴硅酮-水凝胶镜片(参见实施例10和16)均实现相同的精确受控KTF递送。
本发明以及其制造和使用方式和方法现在以完整、清晰、简洁和确切的术语进行描述,以便使其所属领域的任何技术人员能够制造和使用本发明。应理解,前述内容描述了本发明的优选实施方案,并且可在不脱离如权利要求中所阐述的本发明的范围的情况下对其进行修改。为了特别指出并清楚地要求被视为发明性的主题,本说明书以以下权利要求书结束。
- 由选定尺寸的纳米颗粒制成的分级氧化的钽多孔膜的设计和组装及其牙科和生物医疗植入物应用
- 由选定尺寸的纳米颗粒制成的分级氧化的钽多孔膜的设计和组装及其牙科和生物医疗植入物应用
