一种DNA片段纯化分选试剂盒及其使用方法
文献发布时间:2023-06-19 18:27:32
技术领域
本发明涉及分子生物学技术领域,更具体地说,本发明涉及一种DNA片段纯化分选试剂盒及其加工工艺。
背景技术
DNA测序作为一种重要的实验技术,在生物学研究中有着广泛的应用。早在DNA双螺旋结构(Watsonand Crick,1953)被发现后不久就有人报道过DNA测序技术,但是当时的操作流程复杂,没能形成规模。随后在1977年Sanger发明了具有里程碑意义的末端终止测序法,同年A.M.Maxam和W.Gilbert发明了化学降解法。Sanger法因为既简便又快速,并经过后续的不断改良,成为了迄今为止DNA测序的主流。然而随着科学的发展,传统的Sanger测序已经不能完全满足研究的需要,对模式生物进行基因组重测序以及对一些非模式生物的基因组测序,都需要费用更低、通量更高、速度更快的测序技术,第二代测序技术(Next-generation sequencing)应运而生。第二代测序技术的核心思想是边合成边测序(Sequencing by Synthesis),即通过捕捉新合成的末端的标记来确定DNA的序列,现有的技术平台主要包括Roche/454FLX、Illumina/Solexa Genome Analyzer和AppliedBiosystems SOLID system。在整个DNA测序过程中,分离提取的DNA的纯度起到至关重要的作用。
磁珠法纯化DNA主要是利用利息交换吸附材料以吸附核酸,从而将核酸和蛋白质等其细胞中其他物质分离。核酸在细胞中总是与各种蛋白质结合在一起的,核酸的分离主要是指将核酸与蛋白质、多糖、脂肪等生物大分子物质分开。在分离核酸时应遵循保证核酸分子一级结构的完整性以及排除其他分子污染的原则。
而现有的DNA片段纯化分选中广泛使用AMPure XP Beads建库方法,使用贝克曼XP磁珠和Kapa磁珠进行检测,但是现有的检测方法复杂,磁珠活性低,降低了检测效率。
发明内容
本发明的目的在于提供一种DNA片段纯化分选试剂盒及其使用方法,以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:一种DNA片段纯化分选试剂盒,所述试剂盒包括有磁珠液即磁珠缓冲液和吸附珠,所述磁珠缓冲液包括有PEG 8000、Tris-HCl和NaCl。
在一个优选的实施方式中,所述PEG 8000的浓度为21-24%,所述Tris-HCl的浓度为0.04-0.06M,且所述Tris-HCl的pH为7.5-8.5,所述NaCl的浓度为1.5-2.5M。
在一个优选的实施方式中,所述吸附珠的制备方法为:(1)、称取羧基磁珠置于分散液中,分散均匀后在离心振荡作用下添加2-(N-吗啉)乙磺酸一水合物溶液和碳二亚胺进行活化处理;
(2)、活化处理完成后加入氨水及氢氧化钠溶液,搅拌均匀后加入环氧氯丙烷和DMSO的混合溶液,反应结束后清洗得到富集有环氧基的羧基磁珠;
(3)、将对氨基苯磺酸溶解至碳酸钠水溶液中,之后加入EDC、NHS和富集有环氧基的羧基磁珠进行反应,反应完成后加入硼酸盐偶联缓冲液,然后清洗干燥得到吸附珠。
在一个优选的实施方式中,所述吸附珠的制备方法中2-(N-吗啉)乙磺酸一水合物溶液和碳二亚胺物质的量浓度均为18mmol/L,所述活化处理时的温度为23-27℃,活化处理时间为32-38min,所述羧基磁珠的粒径为200nm。
在一个优选的实施方式中,所述吸附珠的制备方法中氢氧化钠的浓度为1M,氨水的添加量为羧基磁珠重量的(0.15-0.25),所述环氧氯丙烷和DMSO的混合溶液的添加量为活化处理后溶液体积的(0.3-0.5),所述环氧氯丙烷和DMSO的混合溶液中环氧氯丙烷与DMSO的体积比为1:(2-3)。
在一个优选的实施方式中,所述吸附珠的制备方法中碳酸钠水溶液物质的量浓度为0.2-0.3M,且所述氨基苯磺酸和碳酸钠水溶液的质量体积比为1:200,所述EDC和NHS的添加量为富集有环氧基的羧基磁珠质量的(0.1-0.3)和(0.05-0.25)。
一种DNA片段纯化分选试剂盒的纯化方法,具体步骤如下:
步骤一:将磁珠液从冰箱取出,室温平衡至少30min;
步骤二:旋涡振荡使磁珠液充分混匀,取磁珠液加入DNA样品中,使用移液器轻轻吸打混匀,室温孵育5min;
步骤三:将步骤二中的样品置于磁力架上,待溶液澄清后移除上清液;
步骤四:将样品始终置于磁力架上,加入200μL新配制的80%乙醇漂洗吸附珠,室温孵育30sec,移除上清液;
步骤五:重复步骤四,利用80%的乙醇漂洗两次;
步骤六:保持样品始终置于磁力架上,室温下开盖干燥吸附珠3-5min;
步骤七:将样品从磁力架上取出,加入无核酸酶水,涡旋振荡,室温静置5min;
步骤八:将样品置于磁力架上静置3min待溶液澄清后,吸取上清液到新的容器管中,得到纯化后的DNA处理样品。
在一个优选的实施方式中,DNA样品纯化时,所述步骤二中磁珠液的添加量根据DNA样品的纯化范围选择,DNA样品的纯化范围≥100bp时,磁珠液的用量为DNA样品体积的2.2倍,DNA样品的纯化范围≥200bp时,磁珠液的用量为DNA样品体积的1.2倍,DNA样品的纯化范围≥300bp时,磁珠液的用量为DNA样品体积的0.8倍,DNA样品的纯化范围≥400bp时,磁珠液的用量为DNA样品体积的0.6倍。
一种DNA片段纯化分选试剂盒的分选方法,步骤一:将磁珠液从冰箱取出,室温平衡至少30min;
步骤二:颠倒或旋涡振荡使磁珠液充分混匀,吸取磁珠液加入DNA样品中,充分混匀,室温孵育5min;
步骤三:将样品置于磁力架上静置,待溶液澄清后,吸取上清液到新的容器管中;
步骤四:向步骤三得到的上清液中加入磁珠液,充分混匀,室温孵育5min;
步骤五:将样品置于磁力架上静置,待溶液澄清后,移除上清液;
步骤六:保持样品始终置于磁力架上,加入200μL新配制的80%乙醇漂洗吸附珠,室温孵育30sec,移除上清液;
步骤七:重复步骤六,利用80%的乙醇漂洗两次;
步骤八:保持样品始终置于磁力架上,室温下开盖干燥吸附珠3-5min;
步骤九:将样品从磁力架上取出,加入无核酸酶水,涡旋振荡或使用移液器吹打充分混匀,室温静置5min;
步骤十:将样品置于磁力架上静置,待溶液澄清后,吸取上清液到新的容器管中实现DNA片段的分选。
本发明的技术效果和优点:
1、本发明提供的一种DNA片段纯化分选试剂盒,利用DNA在纳米羧基磁性粒子表面可逆化吸附行为,采用高性能磁珠和磁珠缓冲液,对DNA进行分离纯化,并且可有效去除反应体系中的dNTP、盐离子及有机杂质等,操作简便,提取质量高,而且兼容各品牌的DNA建库试剂盒和文献报道的建库流程,适合于高通量测序文库构建中DNA纯化与片段大小分选,和目前广泛使用的AMPure XP Beads使用方式完全相同,文库的产量、大小分布与其高度一致,可无缝替代AMPure XP Beads,有效降低建库成本,操作简单,纯化分选的片段满足后续基因组测序要求;
2、本发明采用羧基磁珠作为吸附珠,并对羧基磁珠活性处理,然后在活性处理后的羧基磁珠上富集有环氧基,并利用1-乙基-(3-二甲基氨基丙基)(EDC)和磺酸基琥珀酰亚胺(NHS)对羧基磁珠进行表面修饰,使得羧基磁珠表面形成有较多的羧基,从而使得吸附珠的活性较好,对DNA片段的纯化分选效果更好。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
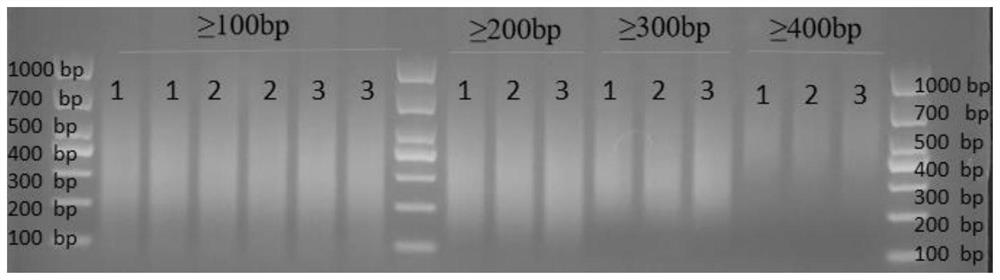
图1是本发明实施例1试剂盒对DNA纯化的琼脂糖电泳图谱。
图2是本发明实施例1试剂盒对DNA分选的琼脂糖电泳图谱。
图3是本发明实施例2试剂盒对DNA纯化的琼脂糖电泳图谱。
图4是本发明实施例2试剂盒对DNA分选的琼脂糖电泳图谱
具体实施方式
实施例1:
下面将结合本发明中的实施例及附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
参阅说明书附图1和图2,本发明提供如下技术方案:一种DNA片段纯化分选试剂盒,所述试剂盒包括有磁珠液即磁珠缓冲液和吸附珠,所述磁珠缓冲液包括有PEG 8000、Tris-HCl和NaCl。
在一个优选的实施方式中,包括PEG 8000的浓度为22.5%,所述Tris-HCl的浓度为0.05M,且所述Tris-HCl的pH为8,所述NaCl的浓度为2M。
在一个优选的实施方式中,所述吸附珠的制备方法为:(1)、称取羧基磁珠置于分散液中,分散均匀后在离心振荡作用下添加2-(N-吗啉)乙磺酸一水合物溶液和碳二亚胺进行活化处理;
(2)、活化处理完成后加入氨水及氢氧化钠溶液,搅拌均匀后加入环氧氯丙烷和DMSO的混合溶液,反应结束后清洗得到富集有环氧基的羧基磁珠;
(3)、将对氨基苯磺酸溶解至碳酸钠水溶液中,之后加入EDC、NHS和富集有环氧基的羧基磁珠进行反应,反应完成后加入硼酸盐偶联缓冲液,然后清洗干燥得到吸附珠。
在一个优选的实施方式中,所述吸附珠的制备方法中2-(N-吗啉)乙磺酸一水合物溶液和碳二亚胺物质的量浓度均为18mmol/L,所述活化处理时的温度为25℃,活化处理时间为35min,所述羧基磁珠的粒径为200nm。
在一个优选的实施方式中,所述吸附珠的制备方法中氢氧化钠的浓度为1M,氨水的添加量为羧基磁珠重量的0.2,所述环氧氯丙烷和DMSO的混合溶液的添加量为活化处理后溶液体积的0.4,所述环氧氯丙烷和DMSO的混合溶液中环氧氯丙烷与DMSO的体积比为1:2.5。
在一个优选的实施方式中,所述吸附珠的制备方法中碳酸钠水溶液物质的量浓度为0.25M,且所述氨基苯磺酸和碳酸钠水溶液的质量体积比为1:200,所述EDC和NHS的添加量为富集有环氧基的羧基磁珠质量的0.2和15。
一种DNA片段纯化分选试剂盒的纯化方法,具体步骤如下:
步骤一:将磁珠液从冰箱取出,室温平衡至少30min;
步骤二:旋涡振荡使磁珠液充分混匀,取磁珠液加入DNA样品中,使用移液器轻轻吸打混匀,室温孵育5min;
步骤三:将步骤二中的样品置于磁力架上,待溶液澄清后移除上清液;
步骤四:将样品始终置于磁力架上,加入200μL新配制的80%乙醇漂洗吸附珠,室温孵育30sec,移除上清液;
步骤五:重复步骤四,利用80%的乙醇漂洗两次;
步骤六:保持样品始终置于磁力架上,室温下开盖干燥吸附珠3-5min;
步骤七:将样品从磁力架上取出,加入无核酸酶水,涡旋振荡,室温静置5min;
步骤八:将样品置于磁力架上静置3min待溶液澄清后,吸取上清液到新的容器管中,得到纯化后的DNA处理样品。
步骤二中磁珠液的添加量根据表1中磁珠缓冲液用量的推荐进行添加,并对DNA纯化的得率检测,检测结果如表1所示:
表1
从表1可以看出,本发明试剂盒可以有效对DNA进行分离纯化,≥100bp的DNA片段纯化得率应该大于等于85%;通过琼脂糖电泳检测,如图1所示,纯化的片段符合目的要求的片段。
DNA片段的分选,具体步骤如下:
步骤一:将磁珠液从冰箱取出,室温平衡至少30min;
步骤二:颠倒或旋涡振荡使磁珠液充分混匀,吸取磁珠液加入DNA样品中,充分混匀,室温孵育5min;
步骤三:将样品置于磁力架上静置,待溶液澄清后,吸取上清液到新的容器管中;
步骤四:向步骤三得到的上清液中加入磁珠液,充分混匀,室温孵育5min;
步骤五:将样品置于磁力架上静置,待溶液澄清后,移除上清液;
步骤六:保持样品始终置于磁力架上,加入200μL新配制的80%乙醇漂洗吸附珠,室温孵育30sec,移除上清液;
步骤七:重复步骤六,利用80%的乙醇漂洗两次;
步骤八:保持样品始终置于磁力架上,室温下开盖干燥吸附珠3-5min;
步骤九:将样品从磁力架上取出,加入无核酸酶水,涡旋振荡或使用移液器吹打充分混匀,室温静置5min;
步骤十:将样品置于磁力架上静置,待溶液澄清后,吸取上清液到新的容器管中实现DNA片段的分选。
步骤二和步骤四中磁珠液两次添加量可以按照建库试剂盒分选条件说明确定或参考表2确定。
表2
通过琼脂糖电泳检测,纯化的片段,如图1所示,如图2所示,分选的片段符合目的要求的片段。
所以本发明提供的一种DNA片段纯化分选试剂盒,利用DNA在纳米羧基磁性粒子表面可逆化吸附行为,采用高性能磁珠和磁珠缓冲液,对DNA进行分离纯化,并且可有效去除反应体系中的dNTP、盐离子及有机杂质等,操作简便,提取质量高,而且兼容各品牌的DNA建库试剂盒和文献报道的建库流程,适合于高通量测序文库构建中DNA纯化与片段大小分选,和目前广泛使用的AMPure XP Beads使用方式完全相同,文库的产量、大小分布与其高度一致,可无缝替代AMPure XP Beads,有效降低建库成本,操作简单,纯化分选的片段满足后续基因组测序要求;本发明采用羧基磁珠作为吸附珠,并对羧基磁珠活性处理,然后在活性处理后的羧基磁珠上富集有环氧基,并利用1-乙基-(3-二甲基氨基丙基)(EDC)和磺酸基琥珀酰亚胺(NHS)对羧基磁珠进行表面修饰,使得羧基磁珠表面形成有较多的羧基,从而使得吸附珠的活性较好,对DNA片段的纯化分选效果更好。
实施例2:
参阅说明书附图3和图4,与实施例1不同的是,使用的吸附珠将富集有环氧基的羧基磁珠改性磁珠替换为未改性前的羧基磁珠。则DNA纯化的得率检测如表3:
表3
通过琼脂糖电泳检测,纯化的片段,如图3所示,分选的片段,如图4所示,由表3和表1可以得出,对羧基磁珠表面修饰后,羧基磁珠对DNA片段的纯化分选效果更好。
最后:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
