一种基于钒的仿生纳米材料及其制备方法与应用
文献发布时间:2023-06-19 18:37:28
技术领域
本发明属于药物制剂技术领域,具体涉及一种基于钒的仿生纳米材料及其制备方法与应用。
背景技术
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
铁死亡是一种新发现的区别于凋亡的调节性细胞死亡模式,由铁依赖性的脂质过氧化物(LPO)的异常积累引起的。LPO的累积是一个动态过程,受到LPO的产生和消除两方面的影响。在肿瘤细胞内,亚铁离子(Fe
大多数肿瘤的代谢主要依赖于糖酵解,这一现象被称为Warburg效应。乳酸作为糖酵解的终产物,与肿瘤微环境(TME)的弱酸性直接相关。与低活性糖酵解的肿瘤细胞相比,高活性的肿瘤细胞在TME中有大量的乳酸(LA)积累,导致免疫抑制TME。已有报道表明,肿瘤来源的乳酸会使M1型肿瘤相关巨噬细胞(TAM)向M2型极化,同时也会抑制CD8
发明内容
为了解决现有技术的不足,本发明的目的是提供一种基于钒的仿生纳米材料及其制备方法与应用。本发明的材料将糖酵解抑制、铁死亡诱导和免疫抑制调节相结合,具有优良的抗肿瘤效果。
为了实现上述目的,本发明的技术方案为:
一方面,一种基于钒的仿生纳米材料,所述仿生纳米材料由糖酵解抑制剂、铁死亡诱导剂、免疫抑制调控剂以及细胞膜组成;
所述糖酵解抑制剂为己酸激酶HKII抑制剂、乳酸脱氢酶LDH抑制剂中的一种;
所述铁死亡诱导剂为基于钒的纳米材料;
所述免疫抑制调控剂为IDO抑制剂,阻断PD1/PDL1通路的抗体、多肽、小分子抑制剂,阻断CD47/SIRPα的抗体、多肽、小分子抑制剂中的一种。
另一方面,一种基于钒的仿生纳米材料的制备方法,包括以下步骤:
S1:偏钒酸铵溶于水里,加热搅拌,将其加入到单宁酸水溶液和LND的混合溶液中,剧烈搅拌,将反应液转移至透析袋中透析,得到包含糖酵解抑制剂的铁死亡诱导剂VL。
S2:向细胞膜碎片中加入过量的Traut’s试剂得到巯基化的细胞膜,将PPA-Mal加入到巯基化细胞膜溶液中,氮气保护下搅拌,透析以获得修饰有免疫抑制调控剂的细胞膜PM;
S3:用脂质挤出器通过400nm聚碳酸酯多孔膜物理挤出细胞膜囊泡PM;将VL和PM细胞膜囊泡的混合物通过200nm聚碳酸酯多孔膜挤出获得基于钒的仿生纳米材料PMVL。
第三方面,上述基于钒的仿生纳米材料或上述基于钒的仿生纳米材料的制备方法得到的基于钒的仿生纳米材料在制备抗肿瘤药物中的应用,所述药物至少包含以下一种或多种用途:
1)抑制糖酵解,减少肿瘤来源的乳酸水平;
2)诱导铁死亡,诱导调节性细胞死亡;
3)逆转免疫抑制肿瘤微环境,增强免疫响应;
4)提高抗肿瘤疗效。
本发明的有益效果为:
1、本发明的基于钒的仿生纳米材料,将糖酵解抑制、铁死亡诱导和免疫抑制调节相结合,该材料在到达肿瘤部位后,可以有效地抑制糖酵解、诱导铁死亡并逆转免疫抑制肿瘤微环境,从而清除原发性肿瘤,抑制肺转移,其显示优良的抗肿瘤效果,具有良好的实际应用价值。
2、本发明首次揭示了金属钒可以诱导铁死亡,首次证实糖酵解抑制剂LND可以通过抑制PPP通路,促进铁死亡,将糖酵解抑制、铁死亡诱导和免疫抑制调节相结合,显示优良的抗肿瘤效果,为肿瘤治疗提供了可行的治疗模式,具有良好的实际应用价值。
本发明基于钒的仿生纳米材料中的基于钒的纳米材料可以通过消耗GSH,失活GPX4,从而诱导铁死亡;糖酵解抑制剂LND可以通过抑制PPP通路,减少NADP
3、本发明通过将单宁酸和偏钒酸铵配位包载药物氯尼达明,然后用PPA修饰的肿瘤细胞膜包裹形成仿生纳米制剂PMVL。本发明将糖酵解抑制、铁死亡诱导活和免疫抑制调控相结合,为治疗肿瘤提供了可行的治疗模式,具有良好的抗肿瘤效果以及实际应用价值。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
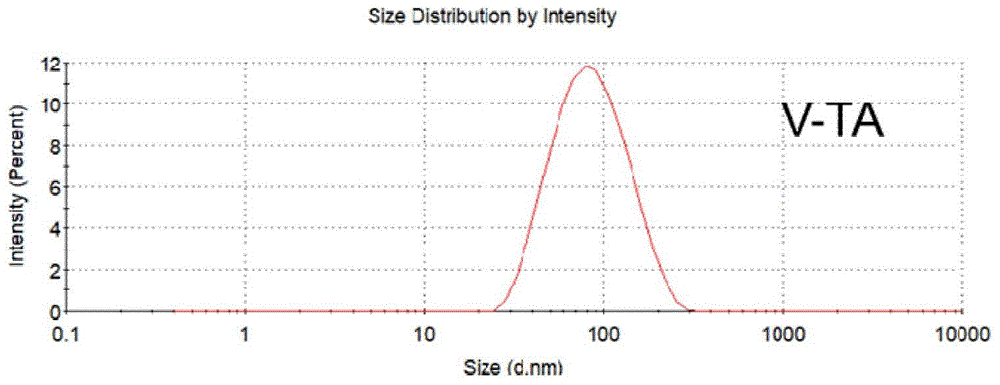
图1为本发明对比例1的V-TA的粒径分布图;
图2为本发明实施例3的PMVL的粒径分布图;
图3为本发明对比例1的V-TA的电位图;
图4为本发明实施例3的PMVL的电位图;
图5为本发明对比例1的V-TA的XPS全谱图;
图6为本发明对比例1的V-TA的V2p的精细谱图;
图7为本发明实施例1、2、3的VL、PM以及PMVL的SDS-PAGE和WB图;
图8为本发明实施例5中PMVL在不同时间下的GSH残留量柱状图;
图9为本发明实施例6中在不同PMVL浓度下B16F10细胞存活率柱状图;
图10为本发明实施例7中不同时间处理后B16F10细胞对游离Ce6、VC以及PMVC的摄取情况图;
图11为本发明实施例8中不同材料培养后B16F10细胞内GSH水平柱状图;
图12为本发明实施例9中注射不同材料后小鼠体内肿瘤体积以及肿瘤抑制率图。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
鉴于目前并无基于钒的纳米制剂以及糖酵解抑制剂以诱导铁死亡,本发明提出了一种基于钒的仿生纳米材料及其制备方法与应用。
本发明的一种典型实施方式,提供了一种基于钒的仿生纳米材料,所述仿生纳米材料由糖酵解抑制剂、铁死亡诱导剂、免疫抑制调控剂以及细胞膜组成;
所述糖酵解抑制剂为己酸激酶HKII抑制剂、乳酸脱氢酶LDH抑制剂中的一种;
所述铁死亡诱导剂为基于钒的纳米材料;
所述免疫抑制调控剂为IDO抑制剂,阻断PD1/PDL1通路的抗体、多肽、小分子抑制剂,阻断CD47/SIRPα的抗体、多肽、小分子抑制剂中的一种。
该实施方式的一些实施例中,仿生纳米材料结构为:修饰有免疫抑制调控剂的细胞膜包裹包含糖酵解抑制剂的铁死亡诱导剂。
其中,修饰有免疫抑制调控剂的细胞膜与包含糖酵解抑制剂的铁死亡诱导剂的体积比为1:1-4。
该实施方式的一些实施例中,细胞膜为肿瘤细胞膜、巨噬细胞膜、DC细胞膜、T细胞膜、血小板细胞膜中的一种。其中,肿瘤细胞膜为4T1细胞膜、B16F10细胞膜、C6细胞膜、BXPC3细胞膜中的一种。
优选的,细胞膜为肿瘤细胞膜。
进一步优选的,所述细胞膜为B16F10细胞膜。
该实施方式的一些实施例中,己酸激酶HKII抑制剂包括氯尼达明LND、2-脱氧-D-葡萄糖2-DG或3-溴丙酮酸3-BP。
其中,糖酵解抑制剂为己酸激酶HKII抑制剂。
优选的,糖酵解抑制剂为氯尼达明LND。
该实施方式的一些实施例中,免疫抑制调控剂为阻断PD1/PDL1通路的抗体、多肽、小分子抑制剂。
其中,免疫抑制调控剂为抗PDL1多肽PPA。
该实施方式的一些实施例中,基于钒的纳米材料的制备方法为:以单宁酸和偏钒酸铵配位包载糖酵解抑制剂,形成铁死亡诱导剂VL。
其中,偏钒酸铵和单宁酸的质量比为1:1-15。
铁死亡诱导剂VL中糖酵解抑制剂的载药量为10-21%,质量百分数,优选为17.2%。
本发明的另一种典型实施方式,提供了一种基于钒的仿生纳米材料的制备方法,包括以下步骤:
S1:偏钒酸铵溶于水里,加热搅拌,将其滴加到单宁酸水溶液和LND的混合溶液中,剧烈搅拌,将反应液转移至透析袋中透析,得到包含糖酵解抑制剂的铁死亡诱导剂VL;
S2:向细胞膜碎片中加入过量的Traut’s试剂得到巯基化的细胞膜,将PPA-Mal加入到巯基化细胞膜溶液中,氮气保护下搅拌,透析以获得修饰有免疫抑制调控剂的细胞膜PM;
S3:用脂质挤出器通过400nm聚碳酸酯多孔膜物理挤出细胞膜囊泡PM;将VL和PM细胞膜囊泡的混合物通过200nm聚碳酸酯多孔膜挤出获得基于钒的仿生纳米材料PMVL。
该实施方式的一些实施例中,步骤S1中,所述加热搅拌温度为60-120℃,时间为10-30min。
该实施方式的一些实施例中,步骤S1中,偏钒酸铵和单宁酸的质量比为1:1-15。
该实施方式的一些实施例中,步骤S1中,LND的质量为5-15mg。
该实施方式的一些实施例中,步骤S1中,剧烈搅拌的转速为500-1500rpm。
该实施方式的一些实施例中,步骤S1中,透析袋的截留分子量为8000-14000Da。
该实施方式的一些实施例中,步骤S2中,细胞膜碎片的制备方法为:收集B16F10细胞,离心得到细胞沉淀,4℃下,将B16F10细胞在低渗细胞裂解缓冲液中裂解,将细胞悬液差速离心以获得细胞膜碎片。
其中,差速离心的转速为10000-40000g,时间为0.5-3h。
该实施方式的一些实施例中,步骤S2中,透析中透析袋的截留分子量为8000-14000Da。
该实施方式的一些实施例中,步骤S3中PM、VL的体积比为1:1-4。
本发明设计了一种基于钒的新型仿生纳米材料PMVL,通过将单宁酸和偏钒酸铵配位并包载药物氯尼达明(LND),形成VL。PPA(Mal-PLGLAG-NYSKPTDRQYHF-NH2)通过MMP-2敏感肽序列(-PLGLAG)被修饰到B16F10肿瘤细胞膜上形成PM,最后PM包裹VL形成PMVL。钒离子V
本发明的第三种典型实施方式,提供了上述述基于钒的仿生纳米材料或上述基于钒的仿生纳米材料的制备方法得到的基于钒的仿生纳米材料在制备抗肿瘤药物中的应用,所述药物至少包含以下一种或多种用途:
1)抑制糖酵解,减少肿瘤来源的乳酸水平;
2)诱导铁死亡,诱导调节性细胞死亡;
3)逆转免疫抑制肿瘤微环境,增强免疫响应;
4)提高抗肿瘤疗效。
其中,肿瘤包括良性肿瘤和/或恶性肿瘤。
优选的,所述恶性肿瘤包括实体瘤和血液瘤;其中,实体瘤为黑色素瘤。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例1:包含糖酵解抑制剂LND的铁死亡诱导剂VL的制备
将10mg偏钒酸铵溶解在水中,80℃加热20min,将其加入到4mL单宁酸水溶液(水溶液中单宁酸浓度为10mg/mL)和2mL LND(DMSO中LND浓度为5mg/mL)的混合溶液中,剧烈搅拌(转速为800rpm)24h。最后将所得反应液用透析袋(MWCO=10000Da)对蒸馏水透析48h,所得溶液为VL溶液,其中LND的载药量为17.2%。
对比例1
与实施例1的区别在于,不添加LND,合成不载药的纳米平台V-TA。
实施例2:修饰有免疫抑制调控剂PPA的细胞膜PM的制备
收集B16F10细胞,离心得到细胞沉淀,4℃下,将B16F10细胞在低渗裂解缓冲液(20mM Tris HCl,10mM MgCl2,10mM KCl,pH 7.4,含有1%蛋白酶抑制剂和磷酸酶抑制剂)中超声裂解,将细胞悬液700g离心10min以去除重的细胞器,上清液20000g离心1.5h收集细胞膜碎片;向细胞膜碎片中加入过量的Traut’s试剂,反应1h得到巯基化的细胞膜,然后将过量的PPA-Mal加入到巯基化细胞膜溶液中,并在氮气保护下搅拌12h,用蒸馏水透析(MWCO=10000Da)以获得修饰有免疫抑制调控剂PPA的细胞膜PM。
实施例3:基于钒的仿生纳米材料PMVL的制备
将实施例2得到的修饰有免疫抑制调控剂PPA的细胞膜PM,用脂质挤出器通过400nm聚碳酸酯多孔膜物理挤出细胞膜囊泡PM;将PM细胞膜囊泡和实施例1获得的VL混合(体积比为1:3)后通过200nm聚碳酸酯多孔膜挤出获得基于钒的仿生纳米材料PMVL。
实施例4:基于钒的仿生纳米材料PMVL性能验证
取对比例1中的V-TA、实施例3中的PMVL测定粒径、电位,如图1、2、3、4所示,相较于V-TA,PMVL的粒径增大,电负性增强。
取对比例1中获得的V-TA进行XPS分析,如图5、6所示,V-TA的总谱中含有C1s、O1s、V2p的峰,以及V2p的精细谱中含有四个峰,表明V-TA成功合成。
另外取实施例1中的VL、实施例2中的PM、实施例3中的PMVL进行SDS-Page和WB表征,如图7所示,PMVL保留了PM的特征蛋白GP100和钙黏蛋白,并与PM的蛋白图谱一致,进一步证明了PM的成功包裹及功能性蛋白的保留。
实施例5:水溶液中评估PMVL消耗GSH的情况
在水溶液中评估GSH的消耗情况,具体操作如下所示:
将10mM GSH溶液和PMVL(100μg/mL,1mL)混合后孵育不同时间(0-12h)。孵育结束后,残留的GSH含量用还原型谷胱甘肽检测试剂盒测定。
结果如图8所示,随着PMVL孵育时间的延长,GSH的残留量下降,表明PMVL可以消耗GSH,并且GSH的消耗具有时间依赖性。
实施例6:PMVL抗肿瘤效果验证
选择小鼠黑色素瘤细胞B16F10为细胞系。B16F10细胞在含有10%胎牛血清(FBS)、青霉素(100U/mL)和链霉素(100U/mL)的RPMI-1640培养基中孵育。所有细胞均在37℃、5%CO
将B16F10细胞以8000个细胞/孔的密度接种到96孔板中,培养24h使其贴壁。然后用不同浓度的PMVL(0.1μg/mL、0.5μg/mL、1μg/mL、2μg/mL、4μg/mL、6μg/mL、8μg/mL、10μg/mL)加入到各孔中,将B16F10细胞继续在37℃下孵育24h。孵育结束后,向每孔中加入10%CCK8,继续孵育2h,用酶标仪测定450nm处的吸光度,计算细胞存活率。
在不同PMVL浓度下的,B16F10细胞存活率结果如图9所示,随着浓度的增加,细胞存活率逐渐降低,当PMVL浓度高达10μg/mL时,细胞存活率小于20%,表明PMVL具有良好的抗肿瘤效果。
实施例7:细胞摄取的评估
由于PMVL具有微不足道的荧光特性,将Ce6作为荧光染料包载到纳米材料中,使其具有荧光特性。
VC与实施例1中VL的区别在于:将LVD替换为Ce6。
PMVC与实施例3中PMVL的区别在于,将LVD替换为Ce6。
通过高速转盘共聚焦显微镜(高速CLSM)检测细胞摄取行为,具体实验操作如下。
将B16F10细胞接种到共聚焦小皿中(1.5×10
结果如图10所示,Ce6、VC以及PMVC的荧光强度都随着孵育时间延长而增强,表明Ce6、VC以及PMVC的摄取都具有时间依赖性;此外,在每个时间点上,PMVC的荧光均比游离Ce6和VC强,表明PMVC能显著增强B16F10的药物摄取能力,有利于更好的发挥治疗效果。
实施例8:PMVL诱导铁死亡性能验证
用谷胱甘肽检测试剂盒测定胞内GSH的水平。
MV与实施例3中PMVL的区别在于,在制备过程中未添加LND以及PPA。
MVL与实施例3中PMVL的区别在于,在制备过程中未添加PPA。
将B16F10细胞接种到培养皿中,孵育过夜。分别在培养皿中加入新鲜培养基(对照组)、游离LND、MV、MVL、PMVL、PMVL+DFO以及PMVL+Fer-1,孵育24h,其中DFO、Fer-1均为铁死亡抑制剂。孵育结束后,收集细胞,将其在液氮中反复冻融2-3次,8000g离心10min后,收集上清,按照谷胱甘肽检测试剂盒说明书测定胞内GSH的含量。所有的处理组均与对照组均一化。
实验结果如图11所示,与对照组和LND组相比,MV可以减少胞内GSH,表明基于钒的纳米材料可以消耗GSH;另外,与MV组相比,MVL和PMVL的胞内GSH水平更低,表明LND也可以降低GSH;与PMVL组相比,PMVL用铁死亡抑制剂DFO或Fer-1处理后,胞内GSH水平却增加,表明PMVL通过消耗胞内GSH水平,诱导铁死亡。
实施例9:动物实验验证PMVL抗肿瘤效果
雌性C57BL/6小鼠购自北京维通利华动物科技有限公司。所有动物实验均严格按照山东大学实验动物中心批准的方案进行。为了构建B16F10异种移植瘤小鼠模型,将1×10
当B16F10荷瘤小鼠肿瘤体积到达100mm
从图12可以看出,与NS组相比,游离LND由于在肿瘤部位的蓄积不足而几乎不能抑制肿瘤的生长。与MV组(肿瘤抑制率为61.1%)相比,用糖酵解抑制剂LND和抗PDL1肽干预后,MVL组的肿瘤抑制率为80.46%,PMVL组为87.0%。上述结果证实,PMVL的良好的抗肿瘤效果可能归因于铁死亡的诱导,糖酵解的抑制以及免疫抑制微环境的调控。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
