G7E05基因在提高植物抗大豆孢囊线虫病和/或抑制植物过敏性坏死反应中的应用
文献发布时间:2023-06-19 18:58:26
技术领域
本发明属于分子生物学技术领域,具体涉及一种G7E05基因在提高植物抗大豆孢囊线虫病和/或抑制植物过敏性坏死反应中的应用。
背景技术
大豆孢囊线虫(Heterodera glycines,soybean cyst nematode,SCN)是危害大豆生产最严重的有害生物之一,每年造成全世界大豆生产数十亿美元的损失。大豆苗期感病后子叶和真叶变黄,植株矮小,侧根数量减少,结荚少,甚至全株枯死,严重影响大豆的产量和品质。目前,采用抗性寄主是防治大豆孢囊线虫病高效而安全的策略,但是持续种植大豆抗性品种显著降低了大豆对SCN的抗性,且药剂防治困难。大豆孢囊线虫病已成为严重制约大豆生产的重要因要因素之一。因此,寻找高效的、可持续的大豆孢囊线虫防治方法是目前防治植物寄生线虫研究领域所长期面临的艰巨任务。
发明内容
针对现有技术中存在的问题,本发明的目的在于提供一种G7E05基因在提高植物抗大豆孢囊线虫病和/或抑制植物过敏性坏死反应中的应用。
为了达到上述目的,本发明采用如下技术方案:
G7E05基因在提高植物抗大豆孢囊线虫病中的应用,所述G7E05基因的核酸序列如SEQ ID NO:1所示,其编码的蛋白的氨基酸序列如SEQ ID NO:2所示。
在上述方案的基础上,通过RNA干扰技术,使大豆孢囊线虫体内的G7E05基因表达沉默,缓解G7E05蛋白对寄主植物ROS响应的抑制,从而提高植物对大豆孢囊线虫的抗性。
在上述方案的基础上,所述RNA干扰技术是通过转基因技术获得表达G7E05基因dsRNA的转基因植物;G7E05基因的dsRNA通过摄食进入大豆孢囊线虫体内,使其体内的G7E05基因表达沉默。
一种提高植物抗大豆孢囊线虫病的方法,通过转基因技术获得表达G7E05基因dsRNA的转基因植物;G7E05基因的dsRNA通过摄食进入大豆孢囊线虫体内,使其体内的G7E05基因表达沉默,缓解G7E05蛋白对寄主植物ROS响应的抑制,从而提高植物对大豆孢囊线虫的抗性;所述G7E05基因的核酸序列如SEQ ID NO:1所示,其编码的蛋白的氨基酸序列如SEQ ID NO:2所示。
G7E05基因在抑制植物过敏性坏死反应中的应用,所述G7E05基因的核酸序列如SEQ IDNO:1所示,其编码的蛋白的氨基酸序列如SEQ ID NO:2所示。
一种抑制植物过敏性坏死反应的方法,将G7E05基因的编码区序列构建到植物表达载体中,转化植物细胞,使其在植物中表达,以抑制植物过敏性坏死反应;所述G7E05基因的核酸序列如SEQ ID NO:1所示。
一种重组载体、重组菌、表达盒、转基因细胞系,含有G7E05基因的编码区序列,所述G7E05基因的核酸序列如SEQ ID NO:1所示。
在上述方案的基础上,所述重组载体、重组菌、表达盒、转基因细胞系用于提高植物抗大豆孢囊线虫病和/或抑制植物过敏性坏死反应。
与现有技术相比,本发明的有益效果在于:
本发明提供了一种能够提高大豆植株抗大豆孢囊线虫病的基因G7E05及其编码蛋白,明确了该基因编码的蛋白为效应蛋白,在大豆孢囊线虫寄生大豆中发挥重要作用,能够抑制植物免疫反应。通过转基因技术实现对线虫基因G7E05的沉默,从而提高大豆对大豆孢囊线虫的抗性。对培育抗大豆孢囊线虫的大豆品种奠定了良好的理论和实践基础。
G7E05蛋白在大豆孢囊线虫与寄主植物互作过程中,被分泌到寄主组织中,并定位于植物细胞膜上,能够抑制植物的免疫反应。G7E05效应蛋白的作用机理是:G7E05被线虫分泌到大豆根系组织中,通过抑制ROS在植物细胞内的积累,促进大豆孢囊线虫的侵染和寄生。因此,可以利用大豆孢囊线虫G7E05基因为靶标,培育抗大豆孢囊线虫的转基因植物。
附图说明
图1为扩增G7E05基因全长序列的电泳结果,其中,M:DL2000 Marker,1:G7E05基因扩增片段;
图2为G7E05蛋白的亚细胞定位结果;其中A为绿色荧光通道效果图;B为明场通道效果图;图C为绿色荧光通道与明场通道叠加效果图;
图3为G7E05蛋白分泌性验证;
图4为G7E05蛋白抑制植物过敏性坏死反应的验证;
图5为接种大豆孢囊线虫42d后的G7E05基因拷贝数,其中,WT为野生型大豆,L3和L12为RNAi株系大豆;
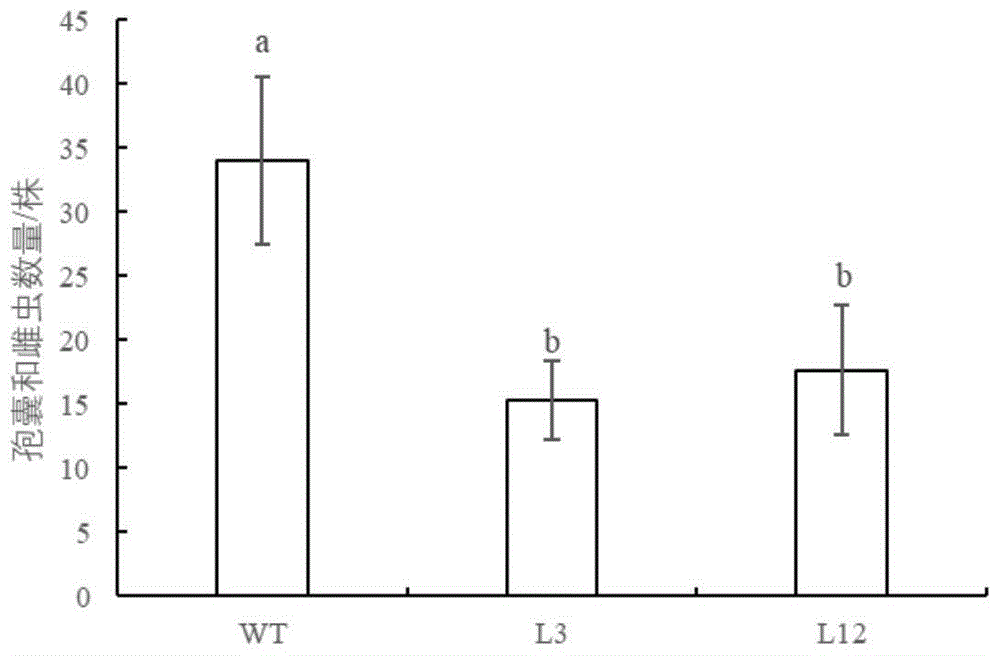
图6为接种大豆孢囊线虫42d后的孢囊和雌虫数量,其中,WT为野生型大豆,L3和L12为RNAi株系大豆;
图7为相对荧光值(与ROS产量成正比)。
具体实施方式
在本发明中所使用的术语,除非有另外说明,一般具有本领域普通技术人员通常理解的含义。
下面结合具体实施例,并参照数据进一步详细的描述本发明。以下实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
大肠杆菌DH5α感受态细胞:购自北京全式金生物技术有限公司;pSAT6载体、pSUC2载体、pGR107载体、pFGC5941载体、酵母菌株YTK12、农杆菌菌株GV3101和EHA105:青岛农业大学植物线虫研究室保存;本氏烟、拟南芥、大豆:青岛农业大学植物线虫研究室扩繁;大豆孢囊线虫:青岛农业大学植物线虫研究室保存并扩繁;
本发明中大豆孢囊线虫G7E05基因的核酸序列如SEQ ID NO:1所示,其编码的蛋白的氨基酸序列如SEQ ID NO:2所示。应当理解的是,经过一个或一个以上核苷酸残基的取代和/或缺失和/或添加或者经过一个或一个以上氨基酸残基的取代和/或缺失和/或添加并且与本发明中大豆孢囊线虫G7E05基因有90%以上同源性的衍生物,也在本发明的范畴之内。
本发明所涉及的酶切、连接、回收、转化、PCR扩增等技术均为常规实验操作,操作流程可详见《分子克隆指南(第三版)》。
实施例1
大豆孢囊线虫G7E05基因的克隆,步骤如下:
1、使用TRIZOL法提取大豆孢囊线虫2龄幼虫的总RNA,将提取的总RNA反转录合成cDNA。
2、根据基因G7E05序列设计基因全长引物:G7E05-F和G7E05-R,以步骤1获得的cDNA为模板进行PCR扩增,PCR扩增体系:cDNA2μL,上下游引物各2μL,Buffer 2.5μL,dNTP2μL,Taqase 0.5μL,ddH
克隆得到基因G7E05的基因全长序列(5’→3’)如SEQ ID NO:1所示。GenBank登录号ID:AAP30762.1,该基因开放阅读框长度为327bp,编码109个氨基酸(SEQ ID NO:2),分子量约为10.14kDa。通过Signal IP 4.0预测G7E05蛋白含有信号肽,位于N端1-19位氨基酸,不含跨膜结构域。
SEQ ID NO:1
ATGTACAAATTTTTATTTTTTCTCCATTTTTGTATCATAATTAAGGCAATTTCGGGGCTCCATTGTTGGAATTCGAACATGATTTTGCTGAGTGAAATGCCGGAAAAGGGCAGTGTCACTGTACGCCAATGTCCGTCCGGGCATCAATGCGTGACGGCAAATTGTTGGCTTGGAGTCGGCAATTACATTGTCCAAAAATGCGTGCCGGACCAGCCAGGGGCCAGAAACTATTGCAAAGACTTCAACAACATTTGCCAAATGGGCTTTTTCGGCATGCCAATTCATTGCTCATCTTGTAAGGGTGATCTGTGCAACGAAGCGCGTAAT
SEQ ID NO:2
MYKFLFFLHFCIIIKAISGLHCWNSNMILLSEMPEKGSVTVRQCPSGHQCVTANCWLG VGNYIVQKCVPDQPGARNYCKDFNNICQMGFFGMPIHCSSCKGDLCNEARN
所述引物G7E05-F和G7E05-R的序列(5’→3’)如下:
G7E05-F:5’-ATGTACAAATTTTTATTTTTTCTCCATTT-3’(SEQ ID NO:3);
G7E05-R:5’-ATTACGCGCTTCGTTGCACA-3’(SEQ ID NO:4)。
实施例2
大豆孢囊线虫G7E05蛋白的亚细胞定位
1.pSAT6-G7E05重组载体的构建
通过PCR法,将G7E05基因5’和3’两端分别引入BglⅠ和KpnⅠ酶切位点序列,纯化回收该片段。使用限制性内切酶BglⅠ和KpnⅠ对该片段和pSAT6载体分别进行双酶切,37℃孵育,切胶回收酶切基因片段和载体片段。使用NEW ENGLND BioLabs T4连接酶进行连接。将连接片段转化大肠杆菌DH5α感受态,选取测序正确的单克隆保存菌种,即成功构建pSAT6-G7E05重组载体。
2.原生质体的提取
选取生长状态良好的3-4周拟南芥叶片5-7片,将叶片切成细条,放入甘露醇溶液,将叶片残留的甘露醇溶液吸干,立即放入酶解液,避光23℃40-60rpm培养3h进行酶解。用与酶解液等体积的W5溶液冲洗除去未消化的叶组织。选取100-200目过滤网对上述溶液进行过滤,再将滤液吸至离心管中,4℃,100g离心1min,弃上清,选取个头饱满无损伤的原生质体,进行转化。
3.PEG法转化原生质体
向离心管中沿管壁缓慢加入预冷等体积的W5溶液冲洗上述步骤2制备的原生质体,轻轻混匀后,4℃,100g离心1min,弃上清;加入1/2体积的预冷W5溶液,使沉淀悬浮,冰上放置30min;4℃,100g离心1min,弃上清,加预冷的1/2体积的MMg溶液冲洗原生质体,4℃100g离心1min,弃上清,加预冷的MMg溶液200uL悬浮原生质体。取10uL上述步骤1构建成功的pSAT6-G7E05重组载体于1.5mL离心管中,加100uL原生质体提取液,吹打混匀后,加入110uL PEG/Ga
实施例3
大豆孢囊线虫G7E05蛋白的分泌活性
1.酵母分泌载体pSUC2-G7E05的构建
通过PCR法,将G7E05基因5’和3’两端分别引入XhoI和EcoRI酶切位点序列,双酶切后,纯化回收该片段。使用XhoI和EcoRI对pSUC2载体进行双酶切,切胶回收载体片段。使用NEW ENGLND BioLabs T4连接酶进行目的片段和载体的连接。将连接片段转化大肠杆菌DH5α感受态,选取测序正确的单克隆保存菌种,即成功构建pSUC2-G7E05重组载体。
2.酵母感受态细胞的转化
将pSUC2-G7E05重组载体、阴性对照空载体pSUC2、阳性对照载体pSUC2-Avr1b分别转化到suc2缺乏的酵母菌株YTK12中。将50uL感受态细胞与0.2-1.0μg DNA(体积小于5uL)混合;加入500uL EZ 3溶液并充分混合。30℃下孵育45min。在CMD-W培养基上培养2-4天筛选阳性转化子,挑取单斑,PCR鉴定阳性转化子。
3.对二糖利用能力的鉴定
选择YPDA液体培养基培养阳性克隆转化子,28℃,180rpm转速,至OD
实施例4
大豆孢囊线虫G7E05蛋白在抑制植物过敏性坏死反应中的应用
1.过敏性坏死反应重组载体的构建
通过PCR法,将G7E05基因5’和3’两端分别引入SalI和SmaI酶切位点序列,双酶切后,纯化回收该片段。使用SalI和SmaI对pGR107载体进行双酶切,切胶回收载体片段。使用NEW ENGLND BioLabs T4连接酶进行目的片段和载体的连接。将连接片段转化大肠杆菌DH5α感受态,选取测序正确的单克隆保存菌种,即成功构建pGR107-G7E05重组载体。
2.冻融法转化农杆菌
将上述阳性单克隆菌落活化,提取pGR107-G7E05重组质粒,采用冻融法转化农杆菌GV3101,PCR鉴定条带大小正确的转化子,-80℃冰箱保存菌液。
3.注射烟草
活化农杆菌菌株GV3101-pGR107-G7E05,28℃,180rpm条件下进行培养直至OD
转化pGR107-BAX的农杆菌作为阳性对照(BAX),pGR107-GFP与pGR107-BAX的农杆菌菌悬液同时注射作为阳性对照(BAX+GFP),转化pGR107-Avrlb的农杆菌,与转化pGR107-BAX的农杆菌菌悬液同时注射作为阴性对照(BAX+Avrlb)。结果如图4所示,注射阳性对照BAX和BAX+GFP之后,均出现明显坏死;注射阴性对照(BAX+Avrlb),叶片无明显症状;在注射BAX+G7E05之后,叶片坏死程度显著降低,说明效应基因G7E05能够抑制由BAX引起的细胞过敏性坏死。
实施例5
G7E05基因在提高植物抗大豆孢囊线虫病中的应用
1.植物RNAi载体pFGC5941-G7E05的构建
(1)基因G7E05反向序列的插入
以实施例1中构建的pMD18T-G7E05重组载体为模板,PCR扩增得到含Xbal和BamH I酶切位点的基因G7E05反向序列,回收纯化后,分别使用限制性内切酶Xbal和BamH I进行酶切,再经过回收纯化后,连接至经限制性内切酶Xbal和BamH I酶切的植物RNAi载体pFGC5941中,获得含反向序列的重组表达载体pFGC5941-G7E05-R;
(2)正向序列的插入
以实施例1中构建的pMD18T-G7E05重组载体为模板,扩增得到含Nco I和Swa I酶切位点的基因G7E05正向序列。分别使用限制性内切酶Nco I和Swa I对上述步骤(1)中构建的重组表达载体pFGC5941-G7E05-R和正向序列进行双酶切并连接,纯化回收后,获得基因G7E05的植物RNAi表达载体pFGC5941-G7E05。
2.植物RNAi表达载体pFGC5941-G7E05转化农杆菌
将5μL重组质粒加入至200μL农杆菌EHA105感受态细胞中,轻轻混匀;冰浴30min,液氮速冻10min,37℃热激5min,再冰浴2min;加入500μL YEP液体培养基中,28℃,150rpm,6h后,将菌液涂布于含抗生素的YEP固体培养基(50mg/L Str,25mg/L Rif和50mg/L Kan)中,28℃倒置培养36-48h。挑取单菌落进行液体培养,PCR鉴定阳性转化子并测序,即得含pFGC5941-G7E05的农杆菌。
3.农杆菌介导的大豆子叶节法转化大豆
(1)大豆无菌苗的萌发
大豆品种为Williams82。挑选饱满无病斑的种子,氯气灭菌6h后,将种子播种于萌发培养基GM上,25℃,16h光照/8h黑暗,湿度65%培养。
(2)外植体和农杆菌共培养
待种子萌发5d后,保留下胚轴2-3mm,将两片子叶纵向切开,靠近子叶节处制造伤口,置于含pFGC5941-G7E05的农杆菌菌液中浸染30min,无菌滤纸迅速吸干残留菌液,子叶背面向上平放在共培养培养基CCM上,伤口处垫一层滤纸,25℃,于黑暗处共培养3d。
(3)不定芽的诱导
先用无菌水清洗外植体3次,再用芽诱导培养基SIM(含头孢噻肟钠50mg/L)冲洗外植体3次,无菌滤纸吸干多余培养液;将外植体置于芽诱导培养基SIM上,25℃,16h光照培养。14d后诱导出不定芽。
(3)不定芽的伸长
用无菌刀片切去子叶,将不定芽转到芽伸长培养基SEM中培养,诱导芽的伸长。每14d继代一次。
(4)根的诱导
待不定芽长生长至3cm左右时,用无菌解剖刀从茎基部切下,插入到生根培养基RM中进行诱导生根,25℃,16h光照/8h黑暗培养。
(5)再生苗的驯化
待根系生长健壮后,洗净根上的琼脂,将植株移栽入蛭石中,同时用保鲜膜覆盖整株再生苗。3d后摘去保鲜膜,定期浇营养液。
上述培养基成分如下:
GM:MS+3%sucrose(蔗糖)+1mg/L 6-BA(6-苄氨基嘌呤)+20mM MES(4-吗啉乙磺酸)+0.8%agar(琼脂),pH5.6;
CCM:GM+0.1mg/L GA
SIM:GM+0.1mg/L GA
SEM:GM+0.1mg/L GA
RM:1/2MS+2%sucrose(蔗糖)+0.8%agar(琼脂)+50mg/L cef(头孢噻肟钠),pH5.6;
4、转基因株系的鉴定和线虫致病性分析
根据植物DNA提取试剂盒(Plant DNAKit,OMEGA)说明书对野生型和转基因大豆叶片进行基因组DNA提取。以DNA为模板,分别采用基因全长引物G7E05-F和G7E05-R、抗除草剂Bar基因特异引物Bar-F和Bar-R进行PCR检测,两者检测均为阳性的转基因大豆植株即为G7E05的RNAi转基因大豆植株。PCR反应体系:dNTP 2μL,Buffer 2.5μL,上下游引物2μL,模板2μL,ExTaq 0.5μL,ddH
Bar-F:5’-ATATCCGAGCGCCTCGTGCAT-3’(SEQ ID NO:5);
Bar-R:5’-GGTCTGCACCATCGTCAACCACT-3’(SEQ ID NO:6)。
培育野生型和转基因株系,待幼苗长出三出复叶时,移栽至培养钵中,分别接种大豆孢囊线虫的2龄幼虫至野生型和转基因植株的根系周围,每株接种500条。42d后,采用qRT-PCR检测G7E05基因的绝对表达量,同时统计土内孢囊数和根的雌虫数量。结果如图5所示,G7E05基因在转基因株系的拷贝数显著低于其在野生型植株的拷贝数。转基因株系的孢囊数和雌虫数量明显低于野生型,分别降低了53%和47%(图6)。上述结果表明了干扰G7E05基因的表达,显著降低了大豆孢囊线虫对大豆植株的致病性。
4、G7E05基因作用机制解析
采用同源重组方法构建含有super1300-HA-G7E05载体,测序正确的质粒转化农杆菌GV3101;将100μL农杆菌菌液注射4周苗龄的烟草叶片。48小时后,收集叶盘,并放入96孔板(每孔含200μL双蒸水)。叶面向上,盖上保鲜膜后静置16h;吸干净孔里面的水分后,向每个孔中加入100μL ROS反应液,100μL反应液配制按如下进行:34μg鲁米诺,20μg辣根过氧化物酶和100nM flg22。将微孔板置于酶标仪中进行检测,测定荧光反应的强度。
结果如图7所示。对照组在4min时荧光强度增加率显著提高,而实验组则在6min后荧光强度增加率开始逐渐升高;对照组在16min时,荧光强度达到最大值,为13918;而实验组荧光强度最大值仅为1062.7,约为对照组的0.076倍。由于荧光强度与植物ROS含量成正比,所以,在植物中过量表达G7E05蛋白可以抑制寄主植株ROS的爆发,从而有利于线虫的侵入。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
