具有改进活性的用于氨合成的催化剂
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及一种用于氨合成的含铁催化剂,该催化剂的特征在于其含有促进剂钾、钙和铝,其中钾的比例作为K
背景技术
由元素氢和氮合成氨是一种重要的大规模工业应用,通过它可以获得重要的含氮下游产物,特别是肥料。哈伯-博世(Haber-Bosch)方法本身已成为这里主要使用的方法。
氨也是用于其它领域(例如储能(“电转氨”))的重要构造单元。
用于氨合成的催化剂主要基于含铁催化剂。所述铁在此通常是磁铁矿或方铁矿(Wüstit)的形式,并且此外,所述催化剂还用其它元素促进。例如,US 5,846,507描述了一种氨催化剂的制备,该氨催化剂的主相是方铁矿,并且其是通过将铁和磁铁矿在电阻炉中熔融获得的。
所述催化剂的工业规模制备是是通过以下方式进行的:将存在于所述催化剂中的物质作为混合物在电弧炉或电阻炉中熔融,和然后将所得熔体冷却并造粒(Ullmann’sEncyclopedia of Industrial Chemistry(《乌尔曼工业化学大全》,2006年,第4.4.1.3章,第35-36页)。
CN 1235800 C描述了一种用于氨合成的催化剂,其含有60重量%至90重量%的氧化铁(II)、7重量%至35重量%的氧化铁(III)、0.1重量%至1.8重量%的氧化钾、0.5重量%至4.8重量%的氧化铝、0.3重量%至4.7重量%的氧化钙、0.1重量%至3.0重量%的二氧化钛和最高至6重量%的其它氧化物。
CN 1193827 C描述了一种用于氨合成的催化剂,其含有65重量%至92重量%的氧化铁(II)、6重量%至22重量%的氧化铁(III)、0.2重量%至1.8重量%的氧化钾、0.8重量%至3.4重量%的氧化铝、0.7重量%至3.8重量%的氧化钙、0.1重量%至1.5重量%的至少一种金属,该金属是Ti、Ru、Mo、W、V或Al,和0.2重量%至2.5重量%的至少一种以下金属的氧化物:Ce、Cr、Mg、Ni、W、Zr、Ti和Pd。
CN 102909030 B中描述的催化剂含有92重量%至95重量%的Fe
诸如O
仍需要改进的用于氨合成的含铁催化剂,该催化剂的特征在于改进的催化性能,例如活性、长期稳定性或对于催化剂毒物(例如O
发明内容
这个目的通过以下的一种用于氨合成的含铁催化剂实现,所述催化剂的特征在于存在特定含量范围的促进剂K、Al和Ca。
因此,本发明提供一种用于氨合成的含铁催化剂,该催化剂的特征在于它含有钾、钙和铝,所述钾作为K
钾的含量作为K
钙的含量作为CaO计算为基于所述催化剂的总重量计的0.8重量%至2.2重量%,优选0.8重量%至2.0重量%,更优选1.1重量%至1.8重量%,又更优选1.2重量%至1.6重量%,最优选1.25重量%至1.55重量%。
铝的含量作为Al
在根据本发明的催化剂中存在的铁主要是氧化物的形式,通常是磁铁矿或方铁矿或其混合物的形式。在一个实施方案中,在所述催化剂中的铁化合物中的方铁矿的比例为至少50重量%,优选80重量%,更优选85重量%,更优选90重量%,非常特别优选100重量%。除了主要存在的结构(例如磁铁矿和/或方铁矿)外,还可存在其它铁化合物作为次要成分。这些次要成分的比例通常低于10重量%,优选低于5重量%,特别优选低于1重量%。
在根据本发明的催化剂中的铁化合物的比例在基于所述催化剂的总重量计的80.0重量%至100.0重量%范围内,优选在80.0重量%至99.9重量%范围内,更优选在90重量%至99.9重量%范围内,特别优选在90.0重量%至97.0重量%范围内。
除了所述促进剂K、Ca和Al外,在所述催化剂中还可存在其它促进剂。在根据本发明的催化剂中,这些促进剂的比例,作为氧化物计算,通常为基于所述催化剂的总重量计的0.1重量%至20.0重量%,优选0.1重量%至10.0重量%,特别优选1.0重量%至5.0重量%,最优选1.5重量%至2.5重量%。
本发明还提供制备根据本发明的催化剂的方法。
所述方法的特征在于包括以下步骤:
a)将单质铁、含铁化合物、促进剂钾、铝、钙的化合物和任选的其它促进剂的化合物混合,以获得混合物,
b)将在步骤a)中获得的混合物熔融,
c)将得自步骤b)的熔体冷却以获得所述催化剂的固体,
d)将在步骤c)中获得的固体粉碎,
其中在步骤a)中初始加料所述促进剂钾、钙和铝的化合物以使得由步骤d)导致的催化剂含有钾、钙和铝并且所述钾的比例作为K
然后可使在步骤d)后获得的固体经历筛分步骤以获得具有所需尺寸分布的催化剂颗粒。
在所述方法的一个实施方案中,将以下物质的粉状起始化合物彼此混合在一起:单质铁、所述至少一种含铁化合物、所述促进剂钾、钙和铝的化合物以及任选的其它促进剂的化合物,并将它们在电弧炉中在高于1500℃的温度下熔融。将炽热的熔体倒出并冷却,直到它完全凝固。利用颚式破碎机和/或其它合适的方法将该固体催化剂粉碎。然后可以将该粉碎的催化剂筛分以获得具有所需尺寸分布的催化剂颗粒。
合适的含铁化合物原则上包括所具有的铁的氧化态为II和/或III的所有铁化合物。优选的化合物是Fe
在一个优选的实施方案中,使用单质Fe和化合物FeO、Fe
方铁矿是一种分子式为Fe
特别优选的是,所述催化剂是包含方铁矿的化合物,其在反应器中通过还原(通常用氢)被转化成Fe(0)。
在一个实施方案中,在所述混合物中的Fe(0)和化合物Fe
除了所述铁化合物外,所述起始混合物还含有所述促进剂钾、钙和铝的化合物。初始加料这些物质以使得由所述熔体形成的固体含有的钾、钙和铝满足:所述钾的比例作为K
所使用的促进剂钾、钙和铝的化合物通常是相应的氧化物、氢氧化物、碳酸盐、碳酸氢盐或硝酸盐。优选使用相应的氧化物、碳酸盐或硝酸盐。
除了所述促进剂钾、钙和铝的化合物之外,所述起始混合物还可含有其它的合适的促进剂的化合物。这些通常是元素V、Co、Mg、稀土或它们的组合的化合物。优选的化合物是元素V或Mg或它们的组合的化合物。
可通过根据本发明的方法获得的催化剂可随后经历还原步骤以将所述金属化合物转化成相应的金属。这可在室温下或在升高的温度下,例如在150至800℃范围内的温度下进行以将可还原的金属化合物转化成相应的金属。
在一个实施方案中,通过将所述催化剂在150至800℃范围内,优选在150至600℃范围内的温度下暴露于含氢气体料流来进行所述还原。
根据本发明的催化剂可用于氨合成,其中氨是由氢和氮形成的。应用领域在此一方面包括工业规模的氨合成,例如通过所述哈伯-博世方法。然而,所述催化剂也可用于其它应用领域,例如氨形式的氢的储能。
氨合成中使用的反应流体含有氮和氢。还可能存在其它在反应条件下惰性的气体,例如Ar。在工业规模的用于氨合成的方法中,反应流体还可能含有诸如H
本发明还提供利用根据本发明的催化剂进行氨合成的方法。在一个实施方案中,反应流体包含最高至100ppmv的H
氨合成的方法的特征通常在于还原所述催化剂的预先步骤。这是通过以下方式完成的:将所述催化剂以氧化物形式放置在反应器中,并在升高反应器温度的同时使氢气和氮气的料流导引通过所述反应器。这导致至少所述铁化合物的还原,从而通过消除氧而形成H
本发明的发明人已经发现,根据本发明的催化剂与现有技术中已知的催化剂相比,对于这种在此期间升高的H
因此,在一个实施方案中,用于氨合成的方法包括还原所述催化剂的预先步骤,在该步骤中,在12-120小时的持续时间内,H
取决于方法条件,H
附图说明
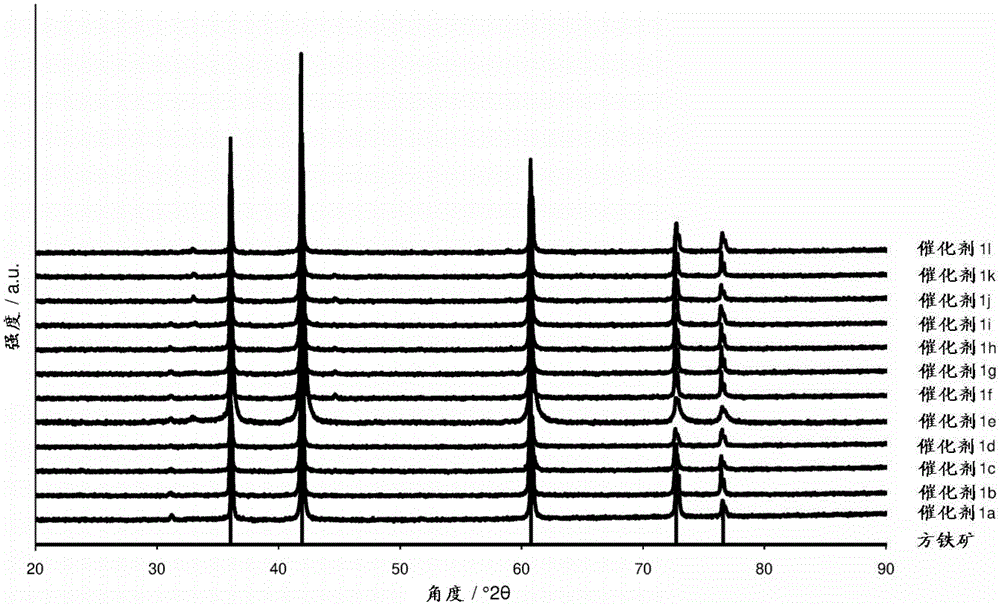
图1显示了催化剂1a至1d、1f至1l和对比催化剂1e的粉末X-射线衍射图。
图2显示了催化剂2a和2d的粉末X-射线衍射图。
图3显示了催化剂2a和对比催化剂1e在几个循环过程中的氨产率。
图4显示了催化剂2b和对比催化剂1e的氨产率随着反应温度的变化。
图5显示了由催化剂2a和对比催化剂1e产生的H
具体实施方式
实验部分
测量方法
粉末X射线衍射
通过X射线衍射法和Rietveld精修测定存在于所述催化剂中的晶体结构及其重量分数。为此,在BRUKER公司的D4 Endeavor仪器中测量所述样品,范围为5至90°2Θ(步进序列0.020°2Θ,每步1.5秒测量时间)。使用的辐射为CuKα1辐射(波长
元素分析
根据DIN EN ISO 11885通过ICP分析(电感耦合等离子体)测定化学元素。
根据“E13/E14 Deutsche Einheitsverfahren zur Wasser Abwasser undSchlammuntersuchung(《E13/E14德国对于水、废水和淤泥的统一检验法》),第1卷,1985年”,通过AAS测量(原子吸收光谱法)测定钾。
实施例1:催化剂1a至1d,1f至1l和对比催化剂1e
通过以下方式制备催化剂1a至1d,1f至1l和对比催化剂1e:将化学计量比率为1:1的磁铁矿和铁粉的混合物与KNO
表1:在催化剂1a至1l中的促进剂K、Al和Ca的含量
用途实施例1
在用于氨合成的反应中使用本发明的催化剂1a至1d、1f至1l和对比催化剂1e。
为此目的,将7g粒子直径为450至550微米的级分形式的催化剂样品加料到反应器中,并在90巴的反应器压力下,使由氮气(22.5体积%),氢气(67.5体积%)和氩气(10体积%)组成的气体料流导引通过。将所述反应器内部的温度连续升高到520℃并保持在该温度下直到所述催化剂的还原完成。然后将压力增加到100巴,并将温度降低到400℃,并将这些条件维持22小时。22小时后,检测所形成的氨浓度,并随后将温度升高到520℃并保持14小时以使所述催化剂加速失活。此后,再重复上述过程(将温度在400℃下保持22小时,然后升温到520℃保持14小时)另外两次。氨浓度结果总结在表2中。
表2:催化剂1a至1l的相对氨空时产率
从表2中可以看出,本发明的催化剂最迟在第2次循环中就产生了与对比催化剂相比更高的氨产率,并且在催化剂1a、1b、1c、1f、1g、1h、1j、1k和1l的情况下,可观察到活性甚至随着循环持续时间的增加而增加。
实施例2:催化剂2a和2b
根据实施例1中的操作过程制备催化剂2a和2b,在此选择钾、铝和钙的化合物的量以使得所得催化剂基于相应的氧化物具有以下元素组成:
催化剂2a:0.25重量%的K
催化剂2b:0.31重量%的K
同样,方铁矿再次被确认为唯一的氧化铁结构,如图2中所示。方铁矿的反射位置也显示在所述衍射图中用于参比。
用途实施例2:
在用于氨合成的反应中使用本发明的催化剂2a和对比催化剂1e。
为此目的,将120g直径为1.5-3.0mm的颗粒形式的催化剂样品加料到反应器中,并在90巴的反应器压力下,使由氮气(22.5体积%),氢气(67.5体积%)和氩气(10体积%)组成的气体料流导引通过。将所述反应器内部的温度连续升高到520℃并保持在该温度下直到所述催化剂的还原完成。然后将压力增加到100巴,并将温度降低到400℃,并将这些条件维持19小时。19小时后,检测所形成的氨浓度,并随后将温度升高到520℃和将压力升高到150巴并保持10小时,以使所述催化剂加速失活。此后,对于催化剂2a,重复上述操作过程(将温度保持在400℃下和压力保持在100巴下19小时,然后升温至520℃和升压至150巴保持10小时)另外十一次,和对于对比催化剂1e重复另外七次。氨浓度结果显示在图3中。
用途实施例3:
在用于氨合成的方法中测试催化剂2b和对比催化剂1e,在所述方法中使用的气体混合物另外含有气态H
用途实施例4
测试催化剂2b和对比催化剂1e的还原行为。为此目的,将120g直径为1.5-3.0mm的颗粒形式的催化剂样品加料到反应器中,并在90巴的反应器压力下,使由氮气(22.5体积%)、氢气(67.5体积%)和氩气(10体积%)组成的气体料流导引通过。将所述反应器内部的温度连续升高到520℃并保持在该温度下直到所述催化剂的还原完成。在图5中示出所述还原的进程。该图显示了水浓度和氨浓度随着催化剂床内部的温度变化的图。可以明显看出,本发明的催化剂2a被还原到金属态与对比催化剂1e相比更快,这也可从更早的水浓度增加看出。由于所述还原状态的实现得更快,催化剂2a还可甚至更早地将在所述气体料流中存在的氮气和氢气部分转化成氨。由于本发明的催化剂的还原行为得到改进,所以氨合成也可以在节约大量时间的情况下在工业规模上进行。
- 用于排放处理系统中的具有SCR活性基材、氨泄漏催化剂层和SCR层的催化剂制品
- 用于排放处理系统中的具有SCR活性基材、氨泄漏催化剂层和SCR层的催化剂制品
