一种调控杨树根毛发育基因PsbHLH89及其应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明涉及一种调控杨树根毛发育基因PsbHLH89及其应用,属于植物基因工程技术领域。
背景技术
杨树属于杨柳科(Salicaceae)杨属(Populus),染色体数一般为2n=38,包含白杨组(Leuce)、黑杨组(Aigeiros)、青杨组(Tacamahaca)、大叶杨组(Leucoides)和小叶杨组(Turanga),共5个组,约30多个物种。
长期以来,杨属植物作为生物能源,被广泛应用于木材生产、环境保护和生态绿化等各个方面,不仅对迅速恢复植被、防止水土流失和修复盐碱土地等具有潜在应用价值,而且也可作为木本纤维能源植物,用于生物质能开发利用。小叶杨(Populus simonii)属青杨派,是我国北方地区的主要乡土树种,具有耐瘠薄、抗逆性强、适应性广、易繁殖、寿命长和杂交可配性好等特点,但其生长期短,成材时间长,满足不了生态防护及工业用材的需求。
通过培育根系发育良好的杨树新品种,提高木材产量是杨树产业化可持续发展亟待解决的重要问题。
因此,提供一种调控杨树根毛发育基因PsbHLH89及其应用,有助于了解和深入研究杨树根毛发育的生长机理,为后续杨树遗传改良,创制优良性状新品种,打下良好的基础,同时,对培育生长性状优良的木本植物品种和提高木材产量,具有重要意义。
发明内容
本发明的目的在于提供一种调控杨树根毛发育基因PsbHLH89,并利用其表达载体转化杨树,为优良树种的培育或筛选提供技术手段,同时,为探索杨树根毛发育的分子机理奠定基础,促进林木分子育种技术的发展。
本发明的上述目的是通过以下技术方案达到的:
基于对杨树杂交子代数量性状QTL定位结果的分析,鉴定出一个与最大根长性状相关的基因bHLH89,即调控杨树根毛发育的基因PsbHLH89,其编码区核苷酸序列和氨基酸序列分别如SEQ ID NO.7和SEQ ID NO.8所示。
优选地,所述调控杨树根毛发育基因PsbHLH89的CDS全长1362bp,编码453个氨基酸和1个终止密码子。
本发明的另一目的是提供所述调控杨树根毛发育基因PsbHLH89在调控杨树根毛发育中的应用。
本发明的上述目的是通过以下技术方案达到的:
调控杨树根毛发育基因PsbHLH89在调控杨树根毛发育中的应用,其特征在于:使杨树包含基因PsbHLH89或使杨树过表达基因PsbHLH89或使杨树抑制表达基因PsbHLH89。
优选地,所述调控杨树根毛发育基因PsbHLH89在调控杨树根毛发育中的应用,其特征在于:构建含有PsbHLH89基因的植物过表达及抑制表达载体,将其异源转化到银腺杨84K(Populus alba×Populus glandulosa),筛选,获得转基因阳性植株,通过阳性植株和野生型植株表型分析,获得调控根毛发育的转基因植株。
优选地,所述调控杨树根毛发育基因PsbHLH89在调控杨树根毛发育中的应用,其特征在于:具体包括以下步骤:
1)采集来自于北京市海淀区中国林业科学研究院温室中培养的小叶杨(P.simonii‘Tongliao1’)扦插苗,进行RNA提取,反转录成cDNA,克隆出PsbHLH89的CDS序列,再将其连接pMD19-T载体进行测序,鉴定正确后,构建过表达载体和抑制表达载体,异源转化到84K银腺杨(Populus alba×Populus glandulosa)中;
2)利用潮霉素抗性和PCR技术,对PsbHLH89基因异源转化84K银腺杨进行阳性植株筛选,得到转基因阳性植株,并对其进行RNA提取和表型统计,获得调控根毛发育的转基因植株;
3)通过对根毛表型的观测,证明PsbHLH89是根毛发育得到正调控基因,促进根毛发育;
4)利用酵母单杂交和双荧光素酶试验,验证上游基因PsGL2对PsbHLH89的调控作用,结果证明PsGL2对PsbHLH89存在调控作用,并且是抑制PsbHLH89的表达。
以上研究结果证明,PsbHLH89对杨树根毛发育具有一定的促进作用,其在林木分子育种及优良品种选育中具有重要应用价值。
与现有技术相比,本发明的主要有益技术效果在于:
本发明以银腺杨84K为材料,筛选鉴定出了PsbHLH89基因,基于其过表达及抑制表达植株的表型鉴定表明,其具有促进根毛发育的能力,说明PsbHLH89基因能够正向调节植物的根毛发育,为筛选优势根部发育基因提供了新的选择,在林木基因工程领域有重要应用价值。
下面通过具体实施方式和附图对本发明作进一步说明,但并不意味着对本发明保护范围的限制。
附图说明
图1-1为本发明实施例1中过表达PsbHLH89转基因84K银腺杨株系阳性植株检测;
图1-2为本发明实施例1中抑制表达PsbHLH89转基因84K银腺杨株系阳性植株检测;
图2-1为本发明实施例1中过表达PsbHLH89转基因84K银腺杨植株的表达量鉴定;
图2-2为本发明实施例1中抑制表达PsbHLH89转基因84K银腺杨植株的表达量鉴定;
图3-1为本发明实施例1中PsbHLH89转基因84K银腺杨植株的根毛发育表型检测;
图3-2为本发明实施例1中PsGL2调控PsbHLH89表达的酵母单杂交试验;
图3-3为本发明实施例1中PsGL2调控PsbHLH89表达的瞬时转化试验。
具体实施方式
下面结合具体实施例对本发明做进一步的说明,以下实施例中未进行详细说明的操作可参照分子克隆,相关试剂盒使用说明的操作实现。
除非特别说明,下面实施例中所涉及的试剂均为市场上可购的常规试剂,所用的方法均为本技术领域常用的方法。
实施例1:
一、小叶杨PsbHLH89基因的克隆
以小叶杨(P.simonii‘Tongliao1’)为材料,使用天根多糖多酚总RNA试剂盒(天根,北京),对小叶杨叶片进行RNA提取(小叶杨总RNA),方法如下:
(1)将0.1克的小叶杨叶片组织,用液氮进行冷冻,放入液氮预冷过的研钵中进行研磨,研磨过程中,始终保持叶片组织样品处于冷冻状态,待组织样品研磨成粉末状后,转移至1.5毫升离心管中,然后,加入500微升裂解液和10微升市场可购的β-巯基乙醇的2毫升灭菌的离心管中,然后,用涡轮振荡器将组织与试剂充分混匀;
(2)12000转,离心2分钟,收集上清液;
(3)将上清液移至过滤柱上,12000转,离心2分钟,小心吸取上清液至另一个离心管中;
(4)在离心管中加入0.4倍(200微升)无水乙醇,混匀,移入吸附柱将吸附柱转入离心管中,12000转,离心15秒,弃液体;
(5)向吸附柱中加入80微升DNA酶工作液(10微升DNA酶储存液+70微升缓冲液),室温静置15分钟;
(6)向吸附柱中加入350微升去蛋白液,12000转,离心15秒,弃液体;
(7)向吸附柱中加入500微升漂洗液,12000转,离心15秒,弃液体;
(8)重复(7);
(9)12000转,离心2分钟,移入新的离心管中,晾干,加入30微升无RNA污染超纯水,溶解沉淀,室温静置2分钟,12000转,离心1分钟,即得到植物总RNA提取液;
每个样品取1.0微克总RNA,通过使用天根反转录试剂反转录为cDNA,实验耗材均无RNA污染,反应均在冰上进行;反转录步骤如下:
1)gDNA去除反应(10微升体系)见下表1:
表1
反应条件:42℃,反应3分钟;
2)上一步反应产物作为模板进行反应(20微升体系)见下表2:
表2
/>
3)将1)加入2),反应条件:42℃,反应15分钟;95℃,反应3分钟,使用时,稀释10微升cDNA+190微升超纯水,即为小叶杨cDNA模板;
参考已发表小叶杨基因组序列,使用Primer3软件设计引物(扩增子包含起始密码子及终止密码子),进行基因全长扩增;其中,PsbHLH89 ORF正向引物PsbHLH89-F如序列表中SEQ ID NO.1所示(表3),反向引物PsbHLH89-R如SEQ ID NO.2(表4)所示,PsbHLH89过表达正向引物PsbHLH89-OE-F如序列表中SEQ ID NO.3所示(表5),PsbHLH89过表达反向引物PsbHLH89-OE-R如SEQ ID NO.4(表6)所示,PsbHLH89抑制正向引物PsbHLH89-RNAi-F如序列表中SEQ ID NO.5所示(表7),PsbHLH89抑制反向引物PsbHLH89-RNAi-R如SEQ ID NO.6(表8)所示;
表3
表4
表5
表6
表7
表8
以小叶杨cDNA为模板,用相应引物进行PCR扩增,PCR反应体系(20微升体系)见下表9:
表9
反应条件见下表10:
表10
对目的片段进行切胶回收,采用美国OMEGA生物技术公司胶回收试剂盒(美国),对PCR扩增的PsbHLH89目的片段进行切胶回收,具体操作步骤如下:
1)将目的片段条带切胶于1.5毫升灭菌离心管中,加入600微升结合液,50℃至胶融化;
2)将已融化的液体移入过滤柱,将过滤柱装入离心管中,12500转,离心2分钟,弃废液;
3)加入600微升洗脱液,12500转,离心30分钟,弃废液;
4)重复(3);
5)空离心过滤柱12500转,2分钟;
6)将过滤柱转入另一个1.5毫升的离心管中,加入30微升灭菌去离子水,室温静置5分钟,12500转,离心2分钟,可重复洗脱一次;
7)0.1%琼脂糖凝胶电泳检测后,-20℃保存;
连接到pMD19-T后,进行测序,获得基因全长cDNA序列为1383bp,命名为PsbHLH89基因,序列如序列表SEQ ID NO.7所示(表11),其所编译表达蛋白序列如SEQ ID NO.8所示(表12);
表11
表12
/>
二、PsbHLH89基因植物表达载体构建
1.过量表达及抑制表达载体的构建
使用Gateway方法进行过表达载体构建,通过PCR扩增得到的带有Gateway标签的PsbHLH89的胶回收产物,正向引物PsbHLH89-OE-F如序列表中SEQ ID NO.3所示(表5),反向引物PsbHLH89-OE-R如SEQ ID NO.4(表6)所示,抑制表达载体同样使用Gateway方法进行构建,通过PCR扩增得到的带有Gateway标签的PsbHLH89 RNAi目标片段的胶回收产物,正向引物PsbHLH89-RNAi-F如序列表中SEQ ID NO.5所示(表7),反向引物PsbHLH89-RNAi-R如SEQID NO.6(表8)所示,首先通过BP反应(赛默飞,上海,中国),将其构建pDONR222中间载体上,BP反应体系见表13,得到重组质粒pDONR222-PsbHLH89/pDNOR222-PsbHLH89-RNAi,随后,利用LR反应(赛默飞,上海,中国),将PsbHLH89构建到pMDC32载体上,得到pMDC32-PsbHLH89,将PsbHLH89 RNAi目标片段构建到pH7GWIWG2载体上,得到pH7GWIWG2-PsbHLH89;
BP反应体系(5微升体系)见下表13:
表13
反应条件:16℃,反应1小时;
连接产物转化大肠杆菌DH5α,具体转化步骤如下:
1、在冰盒上取5微升BP连接产物,加入50微升北京全式金生物技术有限公司生产的大肠杆菌感受态DH5α中,用移液器轻轻混匀,冰浴30分钟;
2、将转化菌液放置,42℃下热激90s,取出后,冰浴5分钟;
3、加入300微升LB液体培养基,37℃,180转,摇1小时;
4、室温,4000转,离心5分钟,弃上清,将剩余菌液重悬;
5、将混匀的转化菌体全部涂到含有50m g/L Kan的LB固体平板上,晾干,封口,倒置于37℃恒温箱中,培养12~14小时;
随机挑取LB固体平板上长出的单菌落若干,加入300微升含Kan(50mg/L)的LB液体培养基,37℃,180转,振荡培养4~5小时后,以菌液作模板进行PCR检测阳性克隆;
PCR反应体系(20微升体系)见下表14:
表14
反应条件见下表15:
表15
反应结束后,取5微升PCR扩增产物,使用0.1%琼脂糖凝胶电泳检测,并在凝胶成像系统紫外光下拍照,条带和扩增引物大小相同可视为阳性克隆,挑选3~5个PCR阳性克隆,委托北京擎科生物科技有限公司进行测序,确认成功构建到中间载体上;依据测序结果,将目标菌种加入等体积50%的无菌甘油,震荡摇匀,在液氮预冻后,转移至-80℃冰箱保存,或通过扩大培养,提取并保存pDNOR222-PsbHLH89/pDNOR222-PsbHLH89-RNAi质粒;
pDNOR222-PsbHLH89/pDNOR222-PsbHLH89-RNAi质粒基因片段进行酶切LR连接反应;
酶切反应体系(10微升体系)见下表16:
表16
反应条件:37℃,3小时;
pDNOR222-PsbHLH89质粒进行LR反应连接,LR反应体系(5微升体系)见下表17:
表17
反应条件:25℃,反应2.5小时;
连接产物转化大肠杆菌,挑取单克隆,进行测序,结果正确的单菌落即为pMDC32-PsbHLH89/pH7GWIWG2-PsbHLH89质粒,最终克隆得到小叶杨根毛发育相关基因PsbHLH89的过表达载体pMDC32-PsbHLH89及抑制表达载体pH7GWIWG2-PsbHLH89;
三、PsbHLH89基因的遗传转化与检测
1.PsbHLH89基因的遗传转化
通过电击法,将所构建的过表达载体(pMDC32-PsbHLH89)和抑制表达载体(pH7GWIWG2-PsbHLH89)转入农杆菌GV3101中,通过农杆菌介导的遗传转化转入84K银腺杨,转化步骤如下:用于遗传转化的84K银腺杨,愈伤在培养温度为23-25℃、光照为16/8小时(白天/黑夜)、光照强度为50μM m
2.过表达及抑制表达转基因植株检测
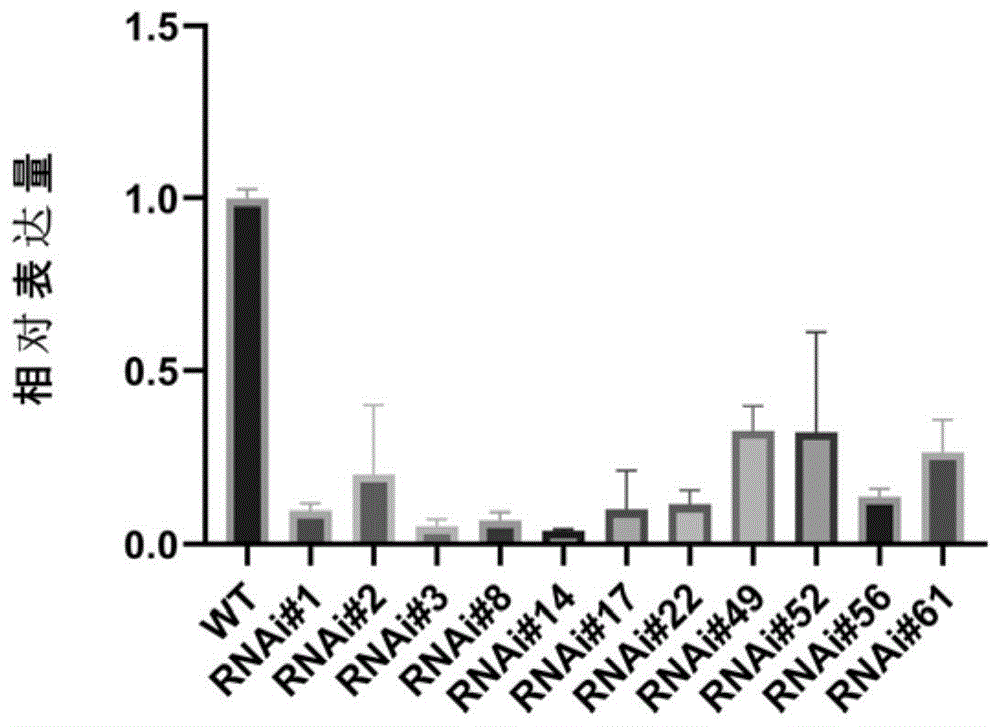
获得抗性的PsbHLH89基因过表达和抑制表达84K银腺杨和野生型植株,提取基因组DNA,利用PCR扩增表达载体上抗性基因,能够扩增得到清晰条带,即为转基因植株;如图1-1至1-2所示,为本发明实施例1中野生型84K银腺杨与过表达和抑制表达PsbHLH89的转基因银腺杨阳性植株检测图;同时,提取RNA并进行了RT-PCR,共筛选出5个过表达植株表达量高于野生型WT,11个抑制表达植株均低于WT,命名情况如图2-1至2-2所示;定量引物为PsbHLH89-RT-F(SEQ ID NO.9),见下表18;PsbHLH89-RT-R(SEQ ID NO.10),见下表19;
表18
表19
四、PsbHLH89转基因植株表型观察
将转基因株系84K银腺杨设置3个以上生物学重复,同时设置野生型84K银腺杨(WT)作为对照间种,培养地点为中国林业科学研究院组培室内,培养条件是25℃和2500lx,生长一个月后,观察根毛发育情况,结果如图3-1,与野生型相比,PsbHLH89过表达植株中根毛被促进,PsbHLH89的抑制表达植株抑制了根毛的发育,说明PsbHLH89通过促进根毛的形成;
五、PsbHLH89上游基因的验证
在小叶杨中克隆出PsGL2序列,正向引物PsGL2-AD-F如序列表中SEQ ID NO.11所示(表20)所示,反向引物PsGL2-AD-R如SEQ ID NO.12(表21)所示,同时也克隆出PsbHLH89启动子区域序列,正向引物proPsbHLH89-HIS2-F如序列表中SEQ ID NO.13所示(表22)所示,反向引物proPsbHLH89-HIS2-R如SEQ ID NO.14(表23)所示,然后将两条序列分别构建在pGADT7和pHIS2载体上;也将PsbHLH89启动子区域的“L-1Box”类似序列单独构建在pHIS2上,正向引物L-1-F如序列表中SEQ ID NO.15所示(表24)所示,反向引物L-1-R如SEQ IDNO.16(表25)所示,然后进行酵母单杂交试验,结果如图3-1所示,PsGL2可以结合PsbHLH89启动子区域,但是结合位点并不是“L-1Box”的类似序列,结果证明了PsGL2对PsbHLH89的调控作用。
表20
表21
表22
表23
表24
表25
将PsGL2构建在pGreenII-62-SK载体上,正向引物PsGL2-SK-F如序列表中SEQ IDNO.17所示(表26)所示,反向引物PsGL2-AD-R如SEQ ID NO.18(表27)所示,),然后,将PsbHLH89启动子序列构建在pGreenII-62-LUC载体上,正向引物proPsbHLH89-LUC-F如序列表中SEQ ID NO.19所示(表28)所示,反向引物proPsbHLH89-LUC-R如SEQ ID NO.20(表29)所示,瞬时转化烟草后,在活体成像仪(博鹭腾,广州)进行拍照,结果如图3-3所示,PsGL2的加入抑制荧光信号,证明PsGL2抑制PsbHLH89的表达。
表26
表27
表28
表29
本发明提供了一种重要的并且可能具有普适性的根毛发育基因资源,杨树根毛发育基因为以后相关研究提供素材,同时也为植物根毛发育研究奠定基础。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 一种水稻花器官发育调控基因PEH1及其编码的蛋白质和应用
- ZmDRR206蛋白质及其编码基因在调控植物抗病性与生长发育中的应用
- 一种调控杨树木质部发育的PagARR9基因及其应用
- 一种调控杨树根部发育及氨基酸转运基因PsAAAP21及其应用
