一种用于全细胞催化制备β-烟酰胺单核苷酸的重组菌及其构建方法和应用
文献发布时间:2023-06-19 19:27:02
技术领域
本发明具体涉及一种用于全细胞催化制备β-烟酰胺单核苷酸的重组菌及其构建方法和应用,属于基因工程技术领域。
背景技术
β-烟酰胺单核苷酸(β-Nicotinamide mononuclotide,简称NMN)天然存在于生物体内,是哺乳动物体内辅酶I烟酰胺腺嘌呤二核苷酸(Nicotinamideadeninedinucleotide,NAD
目前,NMN的生产方法有化学合成和酶法转化两种方式。化学合成以呋喃糖或烟酰胺核糖为原料经过缩合及磷酸化合成NMN,反应条件苛刻,杂质多、收率低、成本高,且涉及大量有毒有害试剂的使用,限制了其在食品领域中的应用。因此,酶法转化成为NMN的主流生产方式,其中,半酶法以烟酰胺核糖(NR)或其氯化物(NRCl)为底物,经烟酰胺核糖激酶(NRK)一步转化获得NMN,工艺稳定成熟,转化率高。例如,CN 114107160 A公开了以NRCl和三磷酸腺苷(ATP)为底物,以六偏磷酸钠为ATP再生体,在烟酰胺核糖激酶和多聚磷酸激酶的催化下生成NMN;全酶法以烟酰胺和核糖为底物,经烟酰胺磷酸核糖转移酶、核糖磷酸焦磷酸激酶和核糖激酶等酶的级联催化获得NMN。公开号为CN110195089A和CN114317515A的中国专利公开了以烟酰胺、ATP和核糖为原料,分别在烟酰胺磷酸核糖转移酶、核糖磷酸焦磷酸激酶以及核糖激酶或通过固定化的含有多磷酸激酶(PPK2)、核酮糖-5-磷酸异构酶(RKI1)、磷酸核糖焦磷酸合成酶(Prps)以及烟酰胺磷酸核糖转移酶(Nampt)的全细胞催化作用下制备NMN;在上述酶法合成NMN公开的方案中,半酶法的NR原料为化学合成,存在二氯甲烷、甲苯等致癌溶剂残留的风险;全酶法合成虽然原料成本低廉,但是转化率低、纯化工艺繁杂。因而,开发一种成本低、安全高的NMN全酶法合成方法很有必要;公开号为CN112877386A的中国专利“一种一锅法将D-核糖和烟酰胺合成NMN的方法”,其中具体公开了利用磷酸激酶和磷酸核糖异构酶级联催化将D-核糖转化为核糖-1-磷酸,再通过烟酰胺单核苷酸腺苷酸转移酶转化制备烟酰胺核糖。
发明内容
本发明的目的在于提供一种用于全细胞催化制备β-烟酰胺单核苷酸的重组菌及其构建方法,并将其应用在NMN的生产中,本发明的重组菌能够直接以D-核糖和烟酰胺、AMP为原料合成β-烟酰胺单核苷酸,够实现β-烟酰胺单核苷酸的高产量、高转化率、低成本且生产工艺简单,为后续工业化生产β-烟酰胺单核苷酸奠定基础。
本发明的技术方案如下:
本发明目的之一在于提供一种用于全细胞催化制备β-烟酰胺单核苷酸的重组菌的构建方法,将核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶以及聚磷酸激酶的编码基因通过重组载体导入受体菌,进行诱导表达,进而得到用于全细胞催化制备β-烟酰胺单核苷酸的重组菌;所述核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶以及聚磷酸激酶的表达宿主为微生物,所述受体菌包括大肠杆菌、酿酒酵母和枯草芽孢杆菌中的一种,本发明中优选大肠杆菌;
其中,所述核糖-1-激酶来源为智人、酿酒酵母或克雷伯氏菌中的一种;所述嘌呤核苷磷酸化酶来源为家鼠;所述烟酰胺核糖激酶来源为智人;所述聚磷酸激酶来源为斯氏马里杆菌、异常嗜糖气单胞菌或耐辐射球菌中的一种;所述受体菌为突变型大肠杆菌或野生型大肠杆菌;
优选的,来源为克雷伯氏菌的所述核糖-1-激酶的氨基酸序列为SEQ ID NO.1所示;来源为智人的所述核糖-1-激酶的氨基酸序列为SEQ ID NO.2;来源为酿酒酵母的所述核糖-1-激酶的氨基酸序列为SEQ ID NO.3;来源为家鼠的所述嘌呤核苷磷酸化酶的氨基酸序列为SEQ ID NO.4;来源为智人的所述烟酰胺核糖激酶的氨基酸序列为SEQ ID NO.5;来源为斯氏马里杆菌的所述聚磷酸激酶氨基酸序列为SEQ ID NO.6;来源为异常嗜糖气单胞菌的所述聚磷酸激酶氨基酸序列为SEQ ID NO.7;来源为耐辐射球菌的所述聚磷酸激酶氨基酸序列为SEQ ID NO.8。
优选的,所述野生型大肠杆菌为大肠杆菌K12。
优选的,所述突变型大肠杆菌为下述B1至B7中的任一种:
b1、将磷酸转移酶基因敲除,该改造以“△aphA”表示;
b2、将腺苷酸转移酶基因敲除,该改造以“△nadR”表示;
b3、将核糖核苷水解酶基因敲除,该改造以“△rihC”表示;
B1、所述突变型大肠杆菌为对所述野生型大肠杆菌进行上述b1-b3改造得到的野生型大肠杆菌的突变体;
B2、所述突变型大肠杆菌为对所述野生型大肠杆菌进行上述b1改造得到的野生型大肠杆菌的突变体;
B3、所述突变型大肠杆菌为对所述野生型大肠杆菌进行上述b2改造得到的野生型大肠杆菌的突变体;
B4、所述突变型大肠杆菌为对所述野生型大肠杆菌进行上述b1和b2改造得到的野生型大肠杆菌的突变体;
B5、所述突变型大肠杆菌为对所述野生型大肠杆菌进行上述b3改造得到的野生型大肠杆菌的突变体;
B6、所述突变型大肠杆菌为对所述野生型大肠杆菌进行上述b1和b3改造得到的野生型大肠杆菌的突变体;
B7、所述突变型大肠杆菌为对所述野生型大肠杆菌进行上述b2和b3改造得到的野生型大肠杆菌的突变体;
上述敲除和截短均可通过同源重组实现;
所述B1代表的突变型大肠杆菌可按照如下方法构建:将大肠杆菌K12的磷酸转移酶基因、腺苷酸转移酶基因和核糖核苷水解酶基因敲除(缺失),得到野生型大肠杆菌的突变体K12△aphA△nadR△rihC;或者将B4代表的突变型大肠杆菌中的核糖核苷水解酶C基因敲除(缺失),也可得到野生型大肠杆菌K12的突变体K12△aphA△nadR△rihC;
所述B2代表的突变型大肠杆菌可按照如下方法构建:将大肠杆菌K12的磷酸转移酶基因敲除(缺失)得到的野生型大肠杆菌K12的突变体K12△aphA;
所述B3代表的突变型大肠杆菌可按照如下方法构建:将大肠杆菌K12的腺苷酸转移酶基因敲除(缺失)得到的野生型大肠杆菌K12的突变体K12△nadR;
所述B4代表的突变型大肠杆菌可按照如下方法构建:将大肠杆菌K12的磷酸转移酶基因和腺苷酸转移酶基因敲除(缺失)得到的野生型大肠杆菌K12的突变体K12△aphA△nadR;或者是将B2代表的突变型大肠杆菌中的腺苷酸转移酶基因敲除(缺失),也可得到野生型大肠杆菌K12的突变体K12△aphA△nadR;
所述B5代表的突变型大肠杆菌可按照如下方法构建:将大肠杆菌K12的核糖核苷水解酶基因敲除(缺失)得到的野生型大肠杆菌K12的突变体K12△rihC;
所述B6代表的突变型大肠杆菌可按照如下方法构建:将大肠杆菌K12的磷酸转移酶基因和核糖核苷水解酶基因敲除(缺失)得到的野生型大肠杆菌K12的突变体K12△aphA△rihC;或是将B5代表的突变型大肠杆菌中的磷酸转移酶基因敲除(缺失),也可得到野生型大肠杆菌K12的突变体K12△aphA△rihC;或是将B2代表的突变型大肠杆菌中的核糖核苷水解酶基因基因敲除(缺失),也可得到野生型大肠杆菌K12的突变体K12△aphA△rihC;
所述B7代表的突变型大肠杆菌可按照如下方法构建:将大肠杆菌K12的腺苷酸转移酶基因和核糖核苷水解酶基因敲除(缺失)得到的野生型大肠杆菌K12的突变体K12△nadR△rihC;或是将B5代表的突变型大肠杆菌中的腺苷酸转移酶基因敲除(缺失),也可得到野生型大肠杆菌K12的突变体K12△nadR△rihC;或是将B3代表的突变型大肠杆菌中的核糖核苷水解酶基因基因敲除(缺失),也可得到野生型大肠杆菌K12的突变体K12△nadR△rihC。
优选的,所述重组载体是将SEQ ID No.1、SEQ ID No.2、SEQ ID No.3、SEQ IDNo.4、SEQ ID No.5、SEQ ID No.6、SEQ ID No.7和SEQ ID No.8所示的DNA分子替换载体pBADhisB的NcoI和EcoRI识别位点间的片段得到的重组载体;其中所述载体还可以为本领域常规的各种载体,包括:各种质粒、粘粒、噬菌体和病毒载体中的一种,本发明中优选原核表达载体pBAD-hisB。
优选的,所述核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶及聚磷酸激酶通过含有核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶或聚磷酸激酶的重组载体导入所述受体菌中,所述含有核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶或聚磷酸激酶的重组载体中,启动所述核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶及聚磷酸激酶转录的启动子是ara启动子,终止所述核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶及聚磷酸激酶转录的终止子是rrnB终止子。
本发明的目的之二在于提供一种用于全细胞催化制备β-烟酰胺单核苷酸的重组菌的构建方法构建的重组菌。
本发明的目的之三在于提供一种重组菌在制备β-烟酰胺单核苷酸中的应用。
本发明的目的之四在于提供一种β-烟酰胺单核苷酸的制备方法,将用于全细胞催化制备β-烟酰胺单核苷酸的重组菌经阿拉伯糖诱导培养得到诱导后重组菌,用所述诱导后重组菌催化D-核糖、烟酰胺和AMP进行催化反应,得到转化液,从所述转化液中收集NMN。
相较于现有技术,本发明的有益效果在于:
1、本发明构建了新型的β-烟酰胺单核苷酸高产重组菌,通过将核糖-1-激酶(MRI)基因、嘌呤核苷磷酸化酶基因、烟酰胺核糖激酶基因及聚磷酸激酶基因通过重组载体导入到突变型大肠杆菌菌株中,构建形成重组菌,重组菌能够在不影响菌体生长的前提下最大限度弱化烟酰胺单核苷酸的分支途径,有效地提高烟酰胺单核苷酸的产量和底物(核糖和烟酰胺、AMP)的转化率。
2、本发明中将重组菌用于制备β-烟酰胺单核苷酸,重组菌经过阿拉伯糖诱导培养后得到诱导重组菌,诱导表达的重组菌KN01-04以核糖、烟酰胺和AMP为底物,生物转化制备烟酰胺单核苷酸,转化24h后,烟酰胺单核苷酸的产量达到转化率均在99%以上,产量均大于66g/L,且菌株可以连续转化三次,底物残留量低,便于下游结晶精制,利用本发明提供的重组菌制备烟酰胺单核苷酸具有工艺简单、合成效率高且生产成本低的优势,具有良好的工业化应用前景。
附图标记
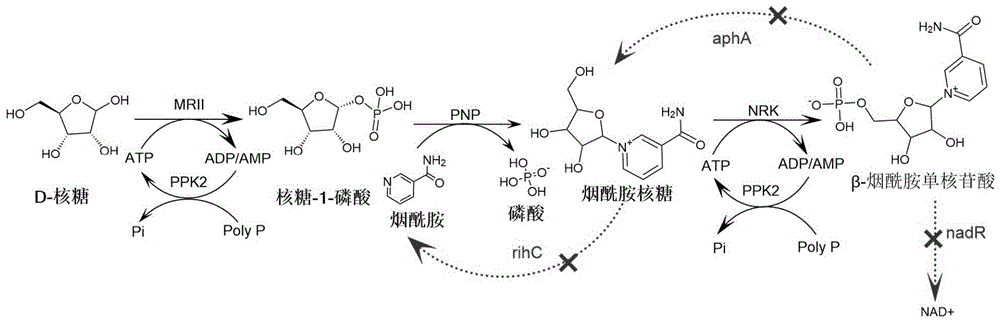
图1为本发明制备NMN的工艺路线图;
图2为本发明中NMN产量、烟酰胺和核糖的标准曲线;
图3为本发明中不同来源的核糖-1-激酶对NMN产量的影响示意图;
图4为本发明中不同来源的聚磷酸激酶对NMN产量的影响示意图;
图5为本发明中不同菌株组的NMN产量示意图;
图6为本发明中KN01重组菌的NMN产量,烟酰胺、核糖和AMP残留的时间变化示意图。
具体实施方式
下面结合附图和较佳实施例对本发明做进一步的说明,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到;
下述实施例中的实验方法,如无特殊说明,均为常规方法;
本发明中野生型大肠杆菌为大肠杆菌K12;下述实施例中的大肠杆菌K12(TomoyaBaba,Takeshi Ara,Miki Hasegawa,Yuki Takai,Yoshiko Okumura,Miki Baba,KirillADatsenko,Masaru Tomita,Barry L Wanner and Hirotada Mori1.Construction ofEscherichia coli K-12in-frame,single-gene knockout mutants:the Keiocollection.Molecular Systems Biology.(2006):1-11)公众可从福建师范大学获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用;
下述实施例中的pBADhisB载体为invitrogen公司产品,产品目录号为V430-01;
下述实施例中的T4连接酶为Thermo公司产品,产品目录号为EL0011;
下述实施例中的自诱导培养基ZYM配方如下:100mL A+2mL B+2mL C+200μL D+100μL E;其中组分A、B、C、D和E的组成如下:
A-ZY:由溶质和溶剂组成,溶剂为水,溶质为质量浓度为1%的胰蛋白胨和质量浓度为0.5%的酵母粉;
B-50×M:由溶质和溶剂组成,溶剂为水,溶质为:1.25M Na
C-50×5052:由溶质和溶剂组成,溶剂为水,溶质为质量浓度为25%的甘油、质量浓度为2.5%的葡萄糖和质量浓度为10%的L-阿拉伯糖;
D:由溶质和溶剂组成,溶剂为水,溶质为1M MgSO
E-1000×微量元素:由溶质和溶剂组成,溶剂为水,溶质为:50mM FeCl
实施例1重组菌的构建(如图1所示)
一、构建重组载体
将核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶及聚磷酸激酶的氨基酸序列,送至基因合成公司进行大肠杆菌密码子优化并人工合成编码基因,分别克隆至原核表达载体pBAD-hisB载体的NcoI和EcoRI识别位点间:
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.1.1所示的表达核糖-1-激酶序列,保持其它DNA序列不变,得到重组载体pKpMriI;
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.1.2所示的表达核糖-1-激酶的序列,保持其它DNA序列不变,得到重组载体pHsMriI;
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.1.3所示的表达核糖-1-激酶的序列,保持其它DNA序列不变,得到重组载体pScMriI;
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.2所示的表达嘌呤核苷磷酸化酶的序列,保持其它DNA序列不变,得到重组载体pMmPNP;
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.3所示的表达烟酰胺核糖激酶的序列,保持其它DNA序列不变,得到重组载体pHsNRK;
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.4.1所示的表达聚磷酸激酶的序列,保持其它DNA序列不变,得到重组载体pMsPPK2;
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.4.3所示的表达聚磷酸激酶的序列,保持其它DNA序列不变,得到重组载体pAaPPK2;
将pBAD-hisB载体的NcoI和EcoRI识别位点间的DNA序列替换为SEQ ID No.4.3所示的用表达聚磷酸激酶的序列,保持其它DNA序列不变,得到重组载体pAaPPK2;
上述重组载体pKpMriI、pHsMriI、pScMriI、pMmPNP、pHsNRK、pMsPPK2、pAaPPK2及pDrPPK2用于分别表达SEQ ID No.1-8所示的核糖-1-激酶、嘌呤核苷磷酸化酶、烟酰胺核糖激酶及聚磷酸激酶;
二、构建敲除NMN合成逆反应代谢途径基因的大肠杆菌突变体K12△aphA以载体pKD13为模板,设计敲除引物
aphA-P1H1:
5’-
aphA-P2H2:
5’-
引物aphA-P1H1和aphA-P2H2的5’端含有50bp的磷酸转移酶基因的同源臂(下划线部分),3’端为Kanr基因扩增引物,进行PCR扩增获得含FRT位点和Kanr基因的线性片段;将扩增得到的含FRT位点和Kanr基因的线性片段通过电穿孔方法导入重组大肠杆菌K12/pKD46(将pKD46载体通过氯化钙法导入大肠杆菌K12得到重组大肠杆菌K12/pKD46)的感受态细胞中,利用卡那霉素平板筛选获得阳性转化子;将能表达Flp重组酶的pCP20载体导入获得的阳性转化子,删除阳性转化子中FRT位点间的Kanr基因(Tomoya Baba,Takeshi Ara,Miki Hasegawa,Yuki Takai,Yoshiko Okumura,Miki Baba,KirillA Datsenko,MasaruTomita,Barry L Wanner and Hirotada Mori1.Construction of Escherichia coli K-12in-frame,single-gene knockout mutants:the Keio collection.Molecular SystemsBiology.(2006):1-11),得到磷酸转移酶基因缺失的大肠杆菌K12的突变体,将获得的大肠杆菌K12突变体命名为K12△aphA;
三、构建敲除NMN降解代谢途径基因的大肠杆菌突变体K12△nadR和K12△aphA△nadR
以载体pKD13为模板,设计敲除引物;
nadR-P1H1:
5’-
nadR-P2H2:
5’-
引物nadR-P1H1和nadR-P2H2的5’端含有50bpNMN腺苷酸转移酶基因的同源臂(下划线部分),3’端为Kanr基因扩增引物,进行PCR扩增获得含FRT位点和Kanr基因的线性片段;按照下述1-4的方法制备大肠杆菌K12的突变体K12△nadR和K12△aphA△nadR:
1、将扩增得到的含FRT位点和Kanr基因的线性片段通过电穿孔方法导入重组大肠杆菌K12/pKD46(将pKD46载体通过氯化钙法导入大肠杆菌K12突变株K12得到重组大肠杆菌K12/pKD46)的感受态细胞中,利用卡那霉素平板筛选获得阳性转化子;将能表达Flp重组酶的pCP20载体导入获得的阳性转化子,删除阳性转化子中FRT位点间的Kanr基因(TomoyaBaba,Takeshi Ara,Miki Hasegawa,Yuki Takai,Yoshiko Okumura,Miki Baba,KirillADatsenko,Masaru Tomita,Barry L Wanner and Hirotada Mori1.Construction ofEscherichia coli K-12in-frame,single-gene knockout mutants:the Keiocollection.Molecular Systems Biology.(2006):1-11),得到腺苷酸转移酶的编码基因缺失的大肠杆菌K12的突变株,将获得的大肠杆菌K12突体命名为K12△nadR;
2、将扩增得到的含FRT位点和Kanr基因的线性片段通过电穿孔方法导入重组大肠杆菌K12△aphA/pKD46(将pKD46载体通过氯化钙法导入大肠杆菌K12突变体K12△aphA得到磷酸转移酶基因敲除(缺失)重组大肠杆菌K12△aphA/pKD46)的感受态细胞中,利用卡那霉素平板筛选获得阳性转化子;将能表达Flp重组酶的pCP20载体导入获得的阳性转化子,删除阳性转化子中FRT位点间的Kanr基因(Tomoya Baba,Takeshi Ara,Miki Hasegawa,YukiTakai,Yoshiko Okumura,Miki Baba,KirillA Datsenko,Masaru Tomita,Barry L Wannerand Hirotada Mori1.Construction of Escherichia coli K-12in-frame,single-geneknockout mutants:the Keio collection.Molecular Systems Biology.(2006):1-11),得到磷酸转移酶和腺苷酸转移酶的编码基因缺失的大肠杆菌K12的突变株,将获得的大肠杆菌K12突变体命名为K12△aphA△nadR;
四、构建敲除烟酰胺单核苷酸降解代谢途径基因的大肠杆菌突变株K12△rihC、K12△aphA△rihC、K12△nadR△rihC和K12△aphA△nadR△rihC
以载体pKD13为模板,设计敲除引物;
rihC-P1H1:
rihC-P2H2:
5’-
引物rihC-P1H1和rihC-P2H2的5’端含有50bp核糖核苷水解酶基因的同源臂(下划线部分),并增加了终止密码子TAA(加粗部分),3’端为Kanr基因扩增引物,进行PCR扩增获得含FRT位点和Kanr基因的线性片段;按照下述1-4的方法制备大肠杆菌K12的突变体:
1、将上述含FRT位点和Kanr基因的线性片段通过电穿孔方法导入重组大肠杆菌K12/pKD46(将pKD46载体通过氯化钙法导入大肠杆菌K12得到重组大肠杆菌K12/pKD46)的感受态细胞中,利用卡那霉素平板筛选获得阳性转化子;将能表达Flp重组酶的pCP20载体导入获得的阳性转化子,删除阳性转化子中FRT位点间的Kanr基因(Tomoya Baba,TakeshiAra,Miki Hasegawa,Yuki Takai,Yoshiko Okumura,Miki Baba,KirillA Datsenko,Masaru Tomita,Barry L Wanner and Hirotada Mori1.Construction of Escherichiacoli K-12in-frame,single-gene knockout mutants:the Keio collection.MolecularSystems Biology.(2006):1-11),得到核糖核苷水解酶基因敲除(缺失)的大肠杆菌K12的突变体,将该突变体命名为K12△rihC;
2、将步骤1中的重组大肠杆菌K1/pKD46替换为K12△aphA/pKD46(将pKD46载体通过氯化钙法导入大肠杆菌K12△aphA中得到磷酸转移酶基因敲除(缺失)重组大肠杆菌K12△aphA/pKD46),其它操作均不变,得到磷酸转移酶和核糖核苷水解酶基因敲除(缺失)的大肠杆菌K12的突变体,将该突变体命名为K12△aphA△rihC;
3、将步骤1中的重组大肠杆菌K12/pKD46替换为K12△nadR/pKD46(将pKD46载体通过氯化钙法导入大肠杆菌K12的突变株K12△nadR中得到腺苷酸转移酶基因敲除(缺失)重组大肠杆菌K12△nadR/pKD46),其它操作均不变,得到腺苷转移酶和核糖核苷水解酶基因敲除(缺失)的大肠杆菌K12的突变体,将该突变体命名为K12△nadR△rihC;
4、将步骤1中的重组大肠杆菌K12/pKD46替换为K12△aphA△nadR/pKD46(将pKD46载体通过氯化钙法导入大肠杆菌K12的突变株K12△aphA△nadR中得到磷酸转移酶基因和腺苷酸转移酶基因敲除(缺失)重组大肠杆菌K12△aphA△nadR/pKD46),其它操作均不变,得到磷酸转移酶基因、腺苷酸转移酶基因、核糖核苷水解酶基因敲除(缺失)的突变体,将该突变体命名为K12△aphA△nadR△rihC;
四、构建重组菌
1、构建初始重组菌
采用氯化钙法将重组载体pKpMriI、pHsMriI、pScMriI、pMmPNP、pHsNRK、pMsPPK2、pAaPPK2及pDrPPK2导入的K12菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子即为得到产NMN的重组菌pKpMriI/K12、pHsMriI/K12、pScMriI/K12、pMmPNP/K12、pHsNRK/K12、pMsPPK2/K12、pAaPPK2/K12及pDrPPK2/K12,将该菌株编号为KN01.1,KN01.2,KN01.3,KN02.1,KN03.1、KN04.1、KN04.2及KN04.3;
2、构建重组菌KN1-01,KN2-01,KN3-01及KN4-01
采用氯化钙法将重组载体pKpMriI导入的K12△aphA△nadR△rihC菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pKpMriI/K12△aphA△nadR△rihC;将重组载体pMmPNP导入的K12△aphA△nadR△rihC菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pMmPNP/K12△aphA△nadR△rihC;将重组载体pHsNRK导入的K12△aphA△nadR△rihC菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pHsNRK/K12△aphA△nadR△rihC;将重组载体pDrPPK2导入的K12△aphA△nadR△rihC菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为
pDrPPK2/K12△aphA△nadR△rihC;
产β-烟酰胺单核苷酸的四株重组菌pKpMriI/K12△aphA△nadR△rihC、pMmPNP/K12△aphA△nadR△rihC、pHsNRK/K12△aphA△nadR△rihC及pDrPPK2/K12△aphA△nadR△rihC分别编号为KN1-01,KN2-01,KN3-01及KN4-01;
3、构建重组菌KN1-02,KN2-02,KN3-02及KN4-02
采用氯化钙法将重组载体pKpMriI、pMmPNP、pHsNRK及pDrPPK2导入的K12△nadR△rihC菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pKpMriI/K12△nadR△rihC、pMmPNP/K12△nadR△rihC、pHsNRK/K12△nadR△rihC及pDrPPK2/K12△nadR△rihC;
将产β-烟酰胺单核苷酸的重组菌pKpMriI/K12△nadR△rihC、pMmPNP/K12△nadR△rihC、pHsNRK/K12△nadR△rihC及
pDrPPK2/K12△nadR△rihC分别编号为KN1-02,KN2-02,KN3-02及KN4-02;
4、构建重组菌KN1-03,KN2-03,KN3-03及KN4-03
采用氯化钙法将重组载体pKpMriI、pMmPNP、pHsNRK及pDrPPK2导入的K12△aphA△rihC菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pKpMriI/K12△aphA△rihC、pMmPNP/K12△aphA△rihC、pHsNRK/K12△aphA△rihC及pDrPPK2/K12△aphA△rihC;
将产NMN的重组菌pKpMriI/K12△aphA△rihC、pMmPNP/K12△aphA△rihC、pHsNRK/K12△aphA△rihC及pDrPPK2/K12△aphA△rihC分别编号为KN1-03,KN2-03,KN3-03及KN4-03;
5、构建重组菌KN1-04,KN2-04,KN3-04及KN4-04
采用氯化钙法将重组载体pKpMriI、pMmPNP、pHsNRK及pDrPPK2导入的K12△aphA△nadR菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pKpMriI/K12△aphA△nadR、pMmPNP/K12△aphA△nadR、pHsNRK/K12△aphA△nadR及
pDrPPK2/K12△aphA△nadR;
将产NMN的重组菌pKpMriI/K12△aphA△nadR、pMmPNP/K12△aphA△nadR、pHsNRK/K12△aphA△nadR及
pDrPPK2/K12△aphA△nadR分别编号为KN1-04,KN2-04,KN3-04及KN4-04;
6、构建重组菌KN1-05,KN2-05,KN3-05及KN4-05
采用氯化钙法将重组载体pKpMriI、pMmPNP、pHsNRK及pDrPPK2导入的K12△nadR菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pKpMriI/K12△nadR、pMmPNP/K12△nadR、pHsNRK/K12△nadR及pDrPPK2/K12△nadR;
将产NMN的重组菌pKpMriI/K12△nadR、pMmPNP/K12△nadR、pHsNRK/K12△nadR及pDrPPK2/K12△nadR分别编号为KN1-05,KN2-05,KN3-05及KN4-05;
7、构建重组菌KN1-06,KN2-06,KN3-06及KN4-06
采用氯化钙法将重组载体pKpMriI、pMmPNP、pHsNRK及pDrPPK2导入的K12△rihC菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pKpMriI/K12△rihC、pMmPNP/K12△rihC、pHsNRK/K12△rihC及pDrPPK2/K12△rihC;将产NMN的重组菌pKpMriI/K12△rihC、pMmPNP/K12△rihC、pHsNRK/K12△rihC及pDrPPK2/K12△rihC分别编号为KN1-06,KN2-06,KN3-06及KN4-06;
8、构建重组菌KN1-07,KN2-07,KN3-07及KN4-07
采用氯化钙法将重组载体pKpMriI、pMmPNP、pHsNRK及pDrPPK2导入的K12△aphA菌株中,在含有氨卞青霉素的平板上筛选阳性克隆子,将得到的阳性克隆子命名为pKpMriI/K12△aphA、pMmPNP/K12△aphA、pHsNRK/K12△aphA及pDrPPK2/K12△aphA;
将产NMN的重组菌pKpMriI/K12△aphA、pMmPNP/K12△aphA、pHsNRK/K12△aphA及pDrPPK2/K12△aphA分别编号为KN1-07,KN2-07,KN3-07及KN4-07。
实施例2制备NMN
一、产NMN重组菌的诱导培养
分别将产NMN的重组菌KN01.1,KN01.2,KN01.3,KN02.1,KN03.1、KN04.1、KN04.2、KN04.3、KN1-01至KN1-07,KN2-01至KN2-07,KN3-01至KN3-07、KN4-01至KN4-07和大肠杆菌K12(简称K12菌株)划线到含有质量浓度为1.5%的琼脂和质量浓度为50mg/mL的氨卞青霉素的LB平板上,37℃培养12h;
挑取平板上的单菌落,接种到含有质量浓度为50mg/mL的氨卞青霉素的液体LB培养基中,37℃过夜振荡培养,转速为220rpm;将过夜培养物以1%(体积百分比)的接种量接种至自诱导培养基ZYM中,在转速为200rpm,30℃条件下振荡培养18h,分别获得诱导后的KN01.1菌株,KN01.2菌株,KN01.3菌株,KN02.1菌株,KN03.1菌株、KN04.1菌株、KN04.2菌株、KN04.3菌株、KN1-01至KN1-07菌株,KN2-01至KN1-07菌株,KN3-01至KN3-07菌株,KN4-01至KN4-07菌株和大肠杆菌K12菌株;
二、产NMN重组菌生物转化核糖/烟酰胺产NMN
分别将经过步骤一获得的诱导后的KN01.1菌株,KN01.2菌株,KN01.3菌株,KN02.1菌株,KN03.1菌株、KN04.1菌株、KN04.2菌株、KN04.3菌株、KN1-01至KN1-07菌株,KN2-01至KN2-07菌株,KN3-01至KN3-07菌株,KN4-01至KN4-07菌株和大肠杆菌K12菌株于分光光度计测量菌体OD值,按每次反应所需菌量进行分装,4℃,8000g条件下离心10min,收集菌体;再用反应体系中的ddH
实验设3次重复,每次重复实验只设3个平行样,每次重复每个时间点设7个转化体系;
NMN产量及底物(烟酰胺和核糖)残留量的分析采用高效液相色谱(HPLC)进行测定,具体测定步骤如下:
准确称取0.668g NMN(或0.244g烟酰胺NAM)标准品(购自美国Sigma公司)置于1L容量瓶中,加入500mL高纯水,搅拌使其完全溶解后再用高纯水定容至1L;摇匀后依次稀释成如下浓度:2mM、1.6mM、1.2mM、0.8mM、0.4mM的NMN标准溶液。将配制的不同浓度的NMN标准溶液,采用0.22μm的水系滤头进行过滤,收集滤液,采用HPLC进行定量测定(UltimateAQC18(5μm,4.6×250mm)色谱柱;柱温:40℃;检测波长:260nm;流动相:50mM磷酸二氢铵,纯水:甲醇(v:v)=90:10;流速:1mL/min),以260nm吸收峰的峰面积为纵坐标,NMN标准品浓度为横坐标,绘制NMN的标准曲线(图2A);以260nm吸收峰的峰面积为纵坐标,烟酰胺标准品浓度为横坐标,绘制NAM的标准曲线(图2B);
准确称取1.500g D-核糖标准品(购自美国Sigma公司)置于1L容量瓶中,加入500mL高纯水,搅拌使其完全溶解后再用高纯水定容至1L;摇匀后依次稀释成如下浓度:10mM、8mM、6mM、4mM、2mM的NMN标准溶液;将配制的不同浓度的NMN标准溶液,采用0.22μm的水系滤头进行过滤,收集滤液,采用HPLC进行定量测定(Bio-Rad Aminex HPX-87H(300x7.8mm)色谱柱;柱温:40℃;检测波长:210nm;流动相:5Mm硫酸水溶液,流速:0.5mL/min),以210nm吸收峰的峰面积为纵坐标,核糖标准品浓度为横坐标,绘制核糖的标准曲线(图2C);
2、转化液中NMN产量的测定
将KN1/2/3/4-01菌组,KN1/2/3/4-02菌组,KN1/2/3/4-03菌组,KN1/2/3/4-04菌组,KN1/2/3/4-5菌组,KN1/2/3/4-6菌组,KN1/2/3/4-07菌组,KN1/2/3/4-08菌组(或KN01.1/2.1/3.1/4.3)菌组反应体系在0h、1h、2h、3h、4h及5h不同时间点的转化液于加入5mM硫酸水用于稀释与终止反应,采用0.22μm的水系滤头进行过滤,收集滤液,采用HPLC进行定量测定;
根据转化液在260nm处吸收峰的峰面积和NMN的标准曲线换算出KN1/2/3/4-01菌组,KN1/2/3/4-02菌组,KN1/2/3/4-03菌组,KN1/2/3/4-04菌组,KN1/2/3/4-05菌组,KN1/2/3/4-06菌组,KN1/2/3/4-07菌组,KN1/2/3/4-08菌组(或KN01.1/2.1/3.1/4.3)反应反应体系在0h、1h、2h、3h、4h及5h不同时间点的转化液中的NMN的质量浓度;
转化液中NMN含量的计算公式:NMN(mM)=A×(Pst+0.1078)÷32.417,其中A代表转化液的稀释倍数;Pst代表转化液在260nm处吸收峰的峰面积(Pst单位:mAu);
烟酰胺转化率=[C÷n
核糖转化率=[C÷n
表达不同来源核糖-1-激酶的重组菌NMN产量见图3;结果显示,与家鼠来源的嘌呤核苷磷酸化酶,人类来源的烟酰胺核糖激酶,斯氏马里杆菌来源的聚磷酸激酶共同作用,来源于克雷伯氏菌的核糖-1-激酶催化核糖、烟酰胺和AMP时NMN最高产量为83.38±1.26mM,远远高于来源于酿酒酵母的核糖-1-激酶,(NMN最高产量为66.83±1.23mM)和来源于人的核糖-1-激酶(NMN最高产量为41.45±1.58mM),表明来源于克雷伯氏菌的核糖-1-激酶产NMN能力最高;
表达不同来源聚磷酸激酶的重组菌NMN产量见图4;结果表明,与来源于克雷伯氏菌的核糖-1-激酶,小家鼠来源的嘌呤核苷磷酸化酶,人类来源的烟酰胺核糖激酶共同作用下,耐辐射球菌来源的聚磷酸激酶催化核糖、烟酰胺和AMP时NMN最高产量为136.12±2.86mM,远远高于来源于斯氏马里杆菌的聚磷酸激酶(NMN最高产量为84.76±1.58mM)和来源于异常嗜糖气单胞菌的聚磷酸激酶(NMN最高产量为116.27±1.08mM),表明来源于耐辐射球菌来源的聚磷酸激酶产NMN能力最高;
不同菌株组的NMN产量见图5,KN01菌株组转化4h,NMN产量高达190.41mM,核糖/烟酰胺的转化率为为95.21%;KN02菌株组转化5h,NMN产量高达185.35mM,核糖/烟酰胺的转化率为为92.68%;KN03菌株组转化5h,NMN产量高达181.97mM,核糖/烟酰胺的转化率为为90.99%;KN04菌株组转化4h,NMN产量高达166.15mM,核糖/烟酰胺的转化率为为83.08%;KN05菌株组转化4h,NMN产量到达153.93mM,核糖/烟酰胺的转化率为为76.97%;KN06菌株组转化4h,NMN产量为171.61mM,核糖/烟酰胺的转化率为为85.81%;KN07菌株组转化4h,NMN产量为159.81mM,核糖/烟酰胺的转化率为为79.91%;KN08菌株组转化4h,NMN产量为154.12mM,核糖/烟酰胺的转化率为只有77.06%;初始转化液的pH值为6.5,反应过程中需要添加氨水调节体系pH为6-7;KN01菌株(K12△aphA△nadR△rihC菌株)NMN产量和核糖/烟酰胺的转化率为最高,且反应结束后NMN不会降解,很好的提高了NMN的产量和转化效率,及反应液中NMN的稳定性。
实施例3利用KN01重组菌组(重组菌KN1-01,KN2-01,KN3-01及KN4-01)制备NMN
挑取重组菌KN1-01,KN2-01,KN3-01及KN4-01的单菌落接种到含有质量浓度为50mg/mL氨卞青霉素的液体LB培养基中,37℃过夜振荡培养,转速200rpm;将过夜培养物以1%(体积百分比)的接种量接种至装有70L自诱导培养基ZYM的100L发酵罐中,通气比为0.6-0.8vvm,在30℃,转速为180rpm的条件下发酵培养18小时,得到发酵液。然后利用管式离心机离心发酵液,收集KN1菌体至150L转化罐中,加入60L左右纯水重悬菌株,获得重悬菌株液,使得重悬菌株液中菌体的含量以菌体湿重计为100-200OD/L,并向重悬菌株液中添加核糖/烟酰胺,使得重悬菌株液中核糖/烟酰胺的浓度为250mM,进行核糖/烟酰胺转化实验。将菌株初始使用5L转化罐进行转化,具体为:转化液初始体积为3L,转化温度为42℃,转速为300rpm,转化pH为6.5。该条件下进行核糖/烟酰胺到NMN的转化,转化时间为4h,得到NMN转化液;
转化液中NMN产量及底物(烟酰胺和核糖)残留量测定方法同实施例2。转化核糖/烟酰胺到NMN的转化结果见图6,转化时间为4h,转化液中NMN产量达到64.39g/L,转化率为96.4%。结果说明,工程菌KN01可以转化率均高于95%,底物残留量低,便于下游结晶精制,具有良好的工业化应用前景。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
- 一种用于全血T淋巴细胞的免疫磁珠的制备方法及其应用
- 一种核苷酸和该核苷酸的重组载体及其在制备抗肿瘤药物中的应用
- 一种Nucyep酶的编码基因、重组表达载体、重组工程菌及其制备方法和应用
- 产β-烟酰胺单核苷酸重组菌及其构建方法和产β-烟酰胺单核苷酸的方法和应用
- 一种以改性硅藻土为载体的固定化全细胞催化制备β-烟酰胺单核苷酸的方法
