在哺乳动物肌肉中特异性启动基因的启动子序列及其应用
文献发布时间:2023-06-19 19:27:02
技术领域
本文涉及启动子序列及其应用,尤其是能够特异性在肌肉组织驱动目的基因表达的启动子序列及其应用。
背景技术
遗传性肌肉疾病往往由于骨骼肌和心脏功能障碍导致较高的发病率和死亡率,目前尚缺乏有效的治疗方法。基因治疗是一种有效的、具有前景的治疗遗传病方法,正处于高速发展阶段,为包括肌肉疾病在内的许多遗传疾病提供了希望。病毒载体,包括慢病毒、腺相关病毒等载体是基因治疗传递基因的常用工具。但实现在肌肉细胞高效递送基因目前仍具有一定的挑战。通过开发肌肉组织特异性启动子增强病毒载体药物特定组织表达,减少递送基因的非特异性表达,达到病毒载体可控释放药物及降低病毒使用量是提高病毒载体在遗传性肌肉疾病基因治疗运用的一种有效的方法。
混合ɑ-肌球蛋白重链增强子/肌酸激酶增强子启动子(hybridα-myosin heavychain enhancer-/muscle creatine kinase enhancer-promoter,MHCK7)是由Salva M Z等人通过对小鼠肌肉肌酸激酶启动子(murine muscle creatine kinase,CK)优化所得
发明内容
在一方面,本文提供了肌肉特异性嵌合启动子,包括:1)MHCK7启动子;以及2)一个或更多个转录因子结合位点;其中所述MHCK7启动子包括SEQ ID NO:2所示序列或与其至少有90%序列一致性的功能性变体,所述转录因子选自Myod转录因子家族成员。
在一些实施方案中,所述转录因子为Myod1和/或Myog。
在一些实施方案中,所述转录因子结合位点的数量为2-9个。
在一些实施方案中,所述转录因子结合位点的数量为2个、4个或9个。
在一些实施方案中,所述转录因子结合位点包括SEQ ID NO:1所示序列,或者与SEQ ID NO:1所示序列相比包括1或2个核苷酸改变的功能性变体。
在一些实施方案中,所述转录因子结合位点位于所述MHCK7启动子的上游和/或下游和/或所述MHCK7启动子中间。
在一些实施方案中,所述的嵌合启动子包括SEQ ID NO:3、SEQ ID NO:4或SEQ IDNO:5所示序列。
在一些实施方案中,所述嵌合启动子与所述MHCK7启动子相比,在肌肉组织中有更高的启动转录活性。
在一些实施方案中,所述肌肉组织选自骨骼肌和和心肌;优选地,所述骨骼肌为肱二头肌和/或股四头肌。
另一方面,本文提供了基因表达盒,其包括上述嵌合启动子和与其可操作地连接的目的基因。
另一方面,本文提供了表达载体,其包括上述嵌合启动子或基因表达盒。
在一些实施方案中,所述表达载体为病毒表达载体。
在一些实施方案中,所述表达载体为腺相关病毒(AAV)表达载体。
另一方面,本文提供了宿主细胞,其包括上述嵌合启动子、基因表达盒或表达载体。
另一方面,本文提供了药物组合物,其包括:1)上述基因表达盒、表达载体或宿主细胞;以及2)药学上可接受的载体。
另一方面,本文提供了上述基因表达盒、表达载体、宿主细胞或药物组合物在制备治疗肌肉组织相关病症的药物中的用途。
另一方面,本文提供了治疗肌肉组织相关病症的方法,包括以有效量的上述基因表达盒、表达载体、宿主细胞或药物组合物向有需要的受试者给药。
通过在特定的位置,添加不同数目的Myod1转录因子识别结合位点序列,对MHCK7启动子进行优化。与未优化的MHCK7启动子比较,通过小鼠活体实验验证,优化后的启动子肌肉组织特异性好,在肌肉组织中的转录活性得到了很大的改善,目的蛋白在肌肉组织的表达量增加2.63-4.45倍。
附图说明
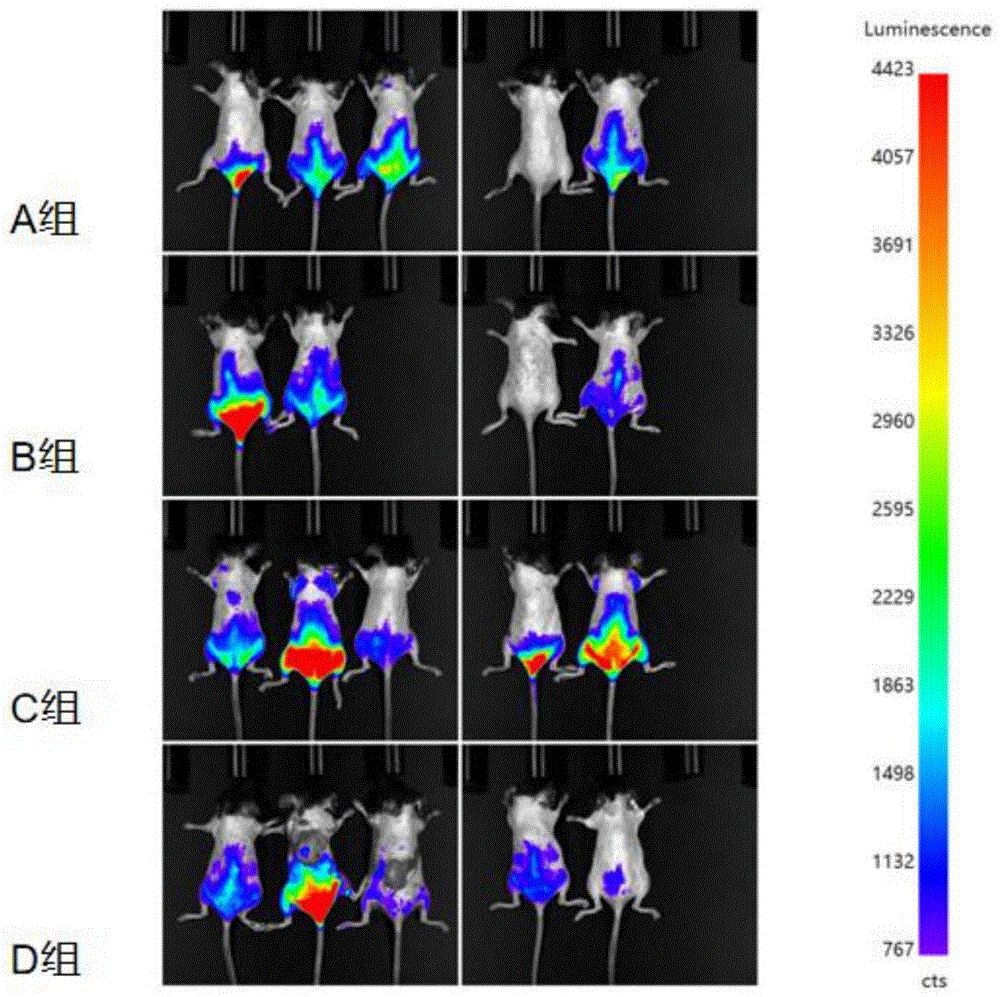
图1显示了使用不同启动子时的小鼠活体成像荧光图。A组:pAAV.MHCK7.Fluc-2a-maxGFP.WPRE.SV40pA;B组:pAAV.MHCK7-1.Fluc-2a-maxGFP.WPRE.SV40pA;C组:pAAV.MHCK7-2.Fluc-2a-maxGFP.WPRE.SV40pA;D组:pAAV.MHCK7-3.Fluc-2a-maxGFP.WPRE.SV40pA;曝光时间200ms。
图2显示了qPCR测定的不同组织中Luciferace mRNA表达水平。A.qPCR测定的使用不同启动子时不同组织Luciferase基因表达量结果。B.各组织中Luciferase基因表达量结果。A组:pAAV.MHCK7.Fluc-2a-maxGFP.WPRE.SV40pA;B组:pAAV.MHCK7-1.Fluc-2a-maxGFP.WPRE.SV40pA;C组:pAAV.MHCK7-2.Fluc-2a-maxGFP.WPRE.SV40pA;D组:pAAV.MHCK7-3.Fluc-2a-maxGFP.WPRE.SV40pA;以A组作为对照。
图3显示了通过Western blot检测Luciferase表达量的照片和灰度分析结果。A.肱二头肌;B.股四头肌。A组:pAAV.MHCK7.Fluc-2a-maxGFP.WPRE.SV40pA;C组:pAAV.MHCK7-2.Fluc-2a-maxGFP.WPRE.SV40pA;灰度分析以A组作为对照。
具体实施方式
除非另有说明,本文使用的所有技术和科学术语具有本领域普通技术人员所通常理解的含义。
术语“或”是指列举的可选择要素中的单个要素,除非上下文明确地另外指出。术语“和/或”是指所列举的可选择要素中的任意一个、任意两个、任意三个、任意更多个或其全部。
本文所用术语“包含”、“含有”、“具有”以及类似的表述表示不排除未列举的要素。这些术语也包括仅由所列举的要素组成的情形。
“启动子(promoter)”是RNA聚合酶识别、结合和启动转录的一段DNA序列,它含有RNA聚合酶特异性结合和转录起始所需的保守序列,多数位于结构基因转录起始点的上游(5’方向),启动子本身不被转录。启动子的实例包括但不限于CMV、EF1A、CAG、CBh、SFFV等启动子。
“嵌合启动子”,也可称为“组合启动子”或“复合启动子”,指其,除启动子序列外,还包括至少一个转录调控元件,并且该转录调控元件与该启动子并非天然存在于同一基因的转录调控序列中。例如,该启动子天然存在于第一基因的转录调控序列中,另一转录调控元件(如转录因子识别结合位点)天然存在于第二基因的转录调控序列中,当这两个转录调控元件因人工操作而处于同一DNA分子中并控制同一基因的转录时,可以认为它们构成了嵌合启动子。另外,还可以在嵌合启动子基础上继续增加转录调控元件,形成新嵌合启动子,这种情况下,也可以将作为基础的嵌合启动子直接称为启动子,以便与该新嵌合启动子进行区分。
提及嵌合启动子或其他转录调控元件时,“肌肉特异性的”指该嵌合启动子或其他转录调控元件偏好性地在肌肉组织(如骨骼肌或心肌)中驱动或增强可操作地连接的目的基因的表达。“肌肉特异性的”不排除该嵌合启动子或其他转录调控元件在一定程度上在另一种组织中驱动或增强可操作地连接的目的基因的表达的可能性,只是其表达相对于在肌肉中表达低得多。例如,肌肉特异性嵌合启动子可驱动目的基因在肌肉和肝组织中表达,但是,目的基因在肌肉中的表达水平为肝组织中表达水平的2倍以上,或者5倍以上,或者10倍以上,或更高。
“转录调控元件”指能够驱动(例如启动子)或增强(例如增强子)可操作地连接的目的基因在组织或细胞中的表达的核苷酸片段。“转录调控序列”指控制目的基因表达的转录调控元件的总和,它们可能连续的存在于同一DNA分子中,或者有间隔的存在于同一DNA分子中。
“可操作地连接”指调控序列与其调控对象的连接方式使得调控序列能够对其调控对象发挥作用。例如,启动子与目的基因“可操作地连接”指启动子可驱动目的基因从准确起始位点的开始转录。
“转录因子结合位点”指DNA分子上的一段核苷酸序列,转录因子可识别并与其结合。转录因子与其结合后,有助于与其他蛋白(如RNA聚合酶)一起形成转录起始复合物,启动转录过程。
“功能性变体”或“功能性片段”指在原始序列(例如天然序列)基础上包括了少许改动(例如氨基酸或核苷酸删除、添加或替换)后获得的蛋白或核酸变体,其仍然保留了原始序列的全部或至少部分功能。例如,功能性变体可保留原始序列某种活性的50%、60%、70%、80%、90%、100%或甚至具有高于原始序列的活性。
“MHCK7启动子”在本文中指一种启动子,其能够在肌肉组织中驱动目的基因的表达。MHCK7启动子本身为嵌合启动子,其序列如SEQ ID NO:2所示。
本文中,术语“核酸分子”、“核酸”和“多核苷酸”可互换使用,指核苷酸聚合物。此类核苷酸聚合物可含有天然和/或非天然核苷酸且包括(但不限于)DNA、RNA和PNA。“核酸序列”指包含于核酸分子或多核苷酸中的核苷酸线性序列。对于DNA分子来说,由于双链互补,在本文提及其中一条链的序列时,本领域技术人员应意识到已同时提及其互补链或包括其互补链的双链DNA分子。
术语“载体”指可经工程改造以含有目的多核苷酸(例如目的多肽的编码序列)的核酸分子或可在宿主细胞中复制的核酸分子(例如,核酸、质粒、或病毒等)。载体可包括以下组件中的一个或更多个:复制起点、一或更多个调控目的多核苷酸的表达的调控序列(诸如启动子和/或增强子)和/或一个或更多个可选择标记物基因(诸如抗生素抗性基因和可用于比色分析中的基因,例如β-半乳糖)。术语“表达载体”指用于在宿主细胞中表达目基因的载体。
“宿主细胞”指可为或已为载体或经分离多核苷酸的接受体的细胞。宿主细胞可为原核细胞或真核细胞。示例性真核细胞包括哺乳动物细胞,诸如灵长类动物或非灵长类动物细胞;真菌细胞,诸如酵母;植物细胞;以及昆虫细胞。非限制性示例性哺乳动物细胞包括(但不限于)NSO细胞、293以及CHO细胞,以及其衍生细胞,诸如293-6E、CHO-DG44、CHO-K1、CHO-S和CHO-DS细胞。宿主细胞包括单个宿主细胞的后代,且后代可能由于自然、偶然或故意突变而不一定与原始母细胞完全一致(在形态或基因组DNA互补方面)。宿主细胞也包括在活体内经本文提供的核酸分子或表达载体转染的细胞。
“目的基因”是指编码RNA或蛋白质产物的多核苷酸序列,所述多核苷酸序列可以根据所需目的引入到细胞或个体中,并且能够在适合条件下表达。目的基因可以编码感兴趣的产物,例如感兴趣的治疗性或诊断性产物。可使用治疗性目的基因,在将其引入细胞、组织或器官中并进行表达以产生所需的治疗结果。治疗可以通过多种方式实现,包括通过将蛋白质在不表达所述蛋白质的细胞中表达,通过将蛋白质在表达所述蛋白质的突变版本的细胞中表达,通过表达对表达它的靶细胞有毒的蛋白质(用于例如杀死不想要的细胞例如癌细胞的策略),通过表达反义RNA以诱导基因阻遏或外显子跳跃,或通过表达目的是抑制蛋白质表达的沉默RNA,例如shRNA。目的基因也可以编码用于靶向基因组的核酸酶,例如CRISPR相关核酸内切酶或转录激活因子样效应物核酸酶(TALEN)。另外,目的基因也可以是与CRISPR/Cas9系统一起使用的向导RNA或一组向导RNA。
当提及核苷酸序列时,术语“序列一致性(sequence identity)”(也称为“序列同一性”)指两核苷酸序列(例如查询序列和参照序列)之间一致性程度的量,一般以百分比表示。通常,在计算两核苷酸序列之间的一致性百分比之前,先进行序列比对(alignment)并引入缺口(gap)(如果有的话)。如果在某个比对位置,两序列中碱基相同,则认为两序列在该位置一致或匹配;两序列中或碱基不同,则认为在该位置不一致或错配。在一些算法中,用匹配位置数除以比对窗口中的位置总数以获得序列一致性。在另一些算法中,还将缺口数量和/或缺口长度考虑在内。常用的序列对比算法或软件包括DANMAN、CLUSTALW、MAFFT、BLAST、MUSCLE等。出于本发明的目的,可以采用公开的比对软件BLAST(可从https://www.ncbi.nlm.nih.gov/获得),通过使用缺省设置来获得最佳序列比对并计算出两核苷酸序列之间的序列一致性。
术语“治疗”包括治愈、缓解或预防效果。因此,治疗性和预防性治疗包括改善障碍的症状或阻止或以其他方式降低发生特定症状的风险。可以提供治疗以延迟、减缓或逆转疾病和/或其一种或多种症状的进展。术语“预防性”可以被认为是降低特定病症的严重性或发作。“预防性”还包括在以前被诊断出患有特定病症的患者中阻止所述病症的复发。“治疗性”还可以是指降低现有病症的严重性。术语“治疗”在本文中用于指称可以有益于动物、特别是哺乳动物、更特别是人类对象的任何方案。在特定实施方式中,所述哺乳动物可以肌肉组织相关病症的个体,例如人患者。
嵌合启动子
本发明人设计了在本文中称为“嵌合启动子”的转录调控元件,用于驱动或增强目的基因在肌肉组织中的表达。
该嵌合启动子包括:MHCK7启动子以及一个或更多个转录因子结合位点,其中所述MHCK7启动子包括SEQ ID NO:2所示序列或与其至少有90%序列一致性的功能性变体,所述转录因子选自Myod转录因子家族成员。
在存在两个或两个以上转录因子结合位点的情况下,这些转录因子结合位点可以直接串联连接或通过接头序列隔开。直接串联连接意味着后一转录因子结合位点的第一个核苷酸紧跟在上游转录因子结合位点的最后一个核苷酸之后。在通过接头序列连接的情况下,在上游转录因子结合位点的最后一个核苷酸与随后的下游转录因子结合位点的第一个核苷酸之间存在其他核苷酸序列。
在一些实施方案中,在存在两个或两个以上转录因子结合位点的情况下,所述转录因子结合位点都位于所述MHCK7启动子上游或下游,或者位于MHCK7启动子序列中间。在另一些实施方案中,在存在两个或两个以上转录因子结合位点的情况下,所述转录因子结合位点分别位于所述MHCK7启动子的上游和下游。在另一些实施方案中,在存在两个或两个以上转录因子结合位点的情况下,所述转录因子结合位点分别位于所述MHCK7启动子的上游和中间。在另一些实施方案中,在存在两个或两个以上转录因子结合位点的情况下,所述转录因子结合位点分别位于所述MHCK7启动子的下游和中间。在另一些实施方案中,在存在三个或三个以上转录因子结合位点的情况下,所述转录因子结合位点分别位于所述MHCK7启动子的上游、下游和中间。提及两序列在同一DNA分子中的位置关系时所用的“上游”和“下游”指一序列位于另一序列的3’方向还是5’方向。例如,A序列位于B序列的上游指A序列位于B序列的5’方向,它们之间可以直接连接或间隔有其他序列。
在一些实施方案中,所述转录因子结合位点的数量为2个以上,例如2-9个,如2、3、4、5、6、7、8、9个或更多。在一些实施方案中,所述转录因子结合位点的数量为2个、4个或9个。
在一些实施方案中,所述转录因子结合位点可以为Myod蛋白家族成员的识别结合位点。Myod蛋白家族成员可例如包括Myod1、Myf5、MyoG和Myf6转录因子。优选地,该转录因子结合位点为转录因子Myod1的识别结合位点。更具体地,该转录因子结合位点包括SEQ IDNO:1所示的核苷酸序列。
在一些优选的实施方案中,所述嵌合启动子,从5’至3’方向,依次包括所述转录因子结合位点和MHCK7启动子,其中在所述MHCK7启动子中还添加了所述转录因子结合位点。
另外,可预期,对上述转录调控序列的个别核苷酸进行改动(添加、替换或删除),也有可能仍然具有肌肉特异性表达目的基因的能力,这些改动后的功能性变体也应该包括在本发明的范围内。例如,对上述转录调控序列的个别核苷酸(例如不超过50个、20个、10个、5个、4个、3个、2个或1个核苷酸)进行改动(添加、替换或删除),并在体外或体内检测其启动目的基因表达的能力,从而获得具有肌肉特异性的本文提供的嵌合启动子的功能性变体,这些功能性变体也应该包括在本发明的范围内。例如,在一些实施方案中,功能性变体可以包括这样的核苷酸序列,其与上述转录调控序列的任一个相比,至少有80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或甚至更高的序列一致性。
上述各转录调控元件之间可直接连接或通过接头序列连接。例如,所述接头序列的长度可以在1至50个核苷酸之间,例如1至40个核苷酸,例如1至30个核苷酸,例如1至20个核苷酸,例如1至10个核苷酸。在一些实施方案中,嵌合启动子的设计可以考虑到所准备使用的载体的尺寸限制,因此,此类接头序列如果存在的话,优选短序列。代表性的短接头序列包括由少于15个核苷酸,特别是少于14、13、12、11、10、9、8、7、6、5、4、3个或少于2个核苷酸构成的核酸序列,例如1个核苷酸的接头序列。
表达盒
本文提供的嵌合启动子可以被引入到表达盒中,该表达盒被设计用于提供目的基因在感兴趣的组织(如肌肉组织)中表达。
因此,本文提供的表达盒包括上述嵌合启动子和目的基因。
在特定得实施方案中,本文提供的表达盒从5'到3'依次包含:
-本文提供的嵌合启动子;
-目的基因;以及
-多腺苷酸化信号。
从本文中公开的教导和分子生物学和基因疗法领域中的普通知识,本领域技术人员还可以考虑将其他转录调控元件并入到本文公开的嵌合启动子中,例如引入其他增强子序列(例如MCK增强子或其功能性变体)和内含子序列。可以在表达中引入的目的基因可包括任何感兴趣的基因,尤其是与肌肉病症相关的治疗性基因序列。这些治疗性基因预期可用于如下疾病的治疗:肌营养不良症(例如先天性肌营养不良症)、肌萎缩性脊髓侧索硬化、炎性肌病、肌肉代谢疾病(例如糖原代谢性肌病)、先天性肌强直以及其他神经肌肉障碍。
载体、细胞和药物组合物
本文提供的表达盒可以被引入到载体中。因此,本发明还涉及包含上述表达盒的载体。在本发明中使用的载体是适合于RNA/蛋白质表达,特别是适合于基因疗法的载体。
在一些实施方式中,所述载体是质粒载体。
在另一些实施方式中,所述载体是非病毒载体,例如含有本发明的表达盒的纳米粒子、脂质纳米粒子(LNP)或脂质体。
在另一些实施方式中,所述载体是基于转座子的系统,允许将本文提供的表达盒整合到靶细胞的基因组中。
在另一实施方式中,所述载体是适用于基因疗法的病毒载体。在这种情况下,正如本领域中公知的,可以向本文提供的表达盒添加适用于产生高效病毒载体的其他序列。在特定实施方式中,所述病毒载体可以源自于腺病毒、反转录病毒或慢病毒(例如整合缺陷型慢病毒)。在所述病毒载体源自于反转录病毒或慢病毒的情况下,所述其他序列可以是在所述表达盒两侧的反转录病毒或慢病毒LTR序列。在另一个特定实施方式中,所述病毒载体是细小病毒载体,例如AAV载体,例如适合于转导心肌的AAV载体。在这个实施方式中,所述其他序列是在所述表达盒两侧的AAV ITR序列。
在优选实施方式中,所述载体是AAV载体。人类腺相关病毒(AAV)是一种天然复制缺陷的依赖病毒,其能够整合到被感染细胞的基因组中以建立潜伏感染。AAV载体作为用于人类基因疗法的载体已有众多应用。该病毒载体的有利特性包括它与任何人类疾病不存在关联,它感染分裂和非分裂细胞两者的能力,并且可以感染源自于不同组织的广范围的细胞系。
在从人类或非人类灵长动物(NHP)分离并充分表征的AAV的血清型中,人类血清2型是被开发为基因转移载体的第一种AAV。其他目前使用的AAV血清型还包括AAV-1、AAV-3、AAV-4、AAV-5、AAV-6、AAV-7、AAV-8、AAV-9、AAV-10等。此外,其他非天然的工程化变体和嵌合AAV也可能是有用的。
AAV病毒可以使用常规的分子生物学技术进行工程化改造,使得可以优化这些粒子以用于核酸序列的细胞特异性递送,用于最小化免疫原性,用于调节稳定性和粒子寿命,用于高效降解,用于向细胞核的精确递送。
用于组装成载体的所需AAV片段包括衣壳蛋白,包括vp1、vp2、vp3和高变区,rep蛋白,包括rep 78、rep 68、rep 52和rep 40,以及编码这些蛋白质的序列。这些片段可以在各种不同的载体系统和宿主细胞中容易地利用。
本发明还涉及一种分离的细胞,例如肌肉细胞,所述细胞用本发明的核酸序列或本发明的表达盒转化。本发明的细胞可以通过注射到需要的对象的感兴趣的组织中或血流中,递送到所述对象。在特定实施方式中,本发明涉及将本发明的核酸分子或表达盒引入到待治疗对象的细胞中,并将所述已引入有核酸或表达盒的细胞给回到所述对象。
本文还提供了包含上述表达盒、载体或宿主细胞的药物组合物。此类组合物包含治疗有效量的上述表达盒、载体或细胞,以及药学上可接受的载体。
提及药物组合物,所使用的术语“药学上可接受的载体”指可以安全地进行施用的固体或液体稀释剂、填充剂、抗氧化剂、稳定剂等物质,这些物质适合于受试者给药而无过度的不良副反应,同时适合于维持位于其中的药物或活性剂的活力。依照给药途径,可以使用本领域众所周知的各种不同的载体,包括,但不限于糖类、淀粉、纤维素及其衍生物、麦芽糖、明胶、滑石、硫酸钙、植物油、合成油、多元醇、藻酸、磷酸缓冲液、乳化剂、等渗盐水、和/或无热原水等。
如果需要,药物组合物也可以含有少量润湿剂或乳化剂或pH缓冲剂。这些药物组合物可以采取溶液、悬液、乳液、片剂、丸剂、胶囊、粉剂、持续释放制剂等的形式。
本文所提供的药物组合物可以制成粉末、注射剂等临床可接受的剂型。可以使用任何适当的途径向受试者施用本发明的药物组合物,例如可通过口服、静脉内输注、肌肉内注射、皮下注射、腹膜下、直肠、舌下,或经吸入、透皮等途径给药。
在优选实施方式中,所述药物组合物按照常规程序配制成适合于静脉内或肌肉内给药。通常,用于静脉内或肌内给药的药物组合物是在无菌等渗水性缓冲液中的溶液。必要时,所述药物组合物还可以包含增溶剂和局部麻醉剂例如利多卡因,以缓解受试者注射部位处的疼痛。
本文所用的“受试者”指动物,例如哺乳动物,包括(但不限于)人类、啮齿动物、猿猴、猫科动物、犬科动物、马科动物、牛科动物、猪科动物、绵羊、山羊、哺乳类实验动物、哺乳类农畜、哺乳类运动动物和哺乳类宠物。受试者可为雄性或雌性且可为任何适龄受试者,包括婴儿、幼年、青年、成年和老年受试者。在一些实例中,受试者指需要治疗疾病或病症的个体。在一些实例中,接受治疗的受试者可为患者,其患有与该治疗有关联的病症,或有风险患上该病症。在特定实例中,受试者为人类,诸如人类患者。该术语通常可与“患者”、“检测对象”、“治疗对象”等互换使用。
在一个实施方式中,本发明的表达盒或载体可以在囊泡、特别是脂质体中递送。在又一个实施方式中,本发明的核酸序列、表达盒或载体可以在受控释放系统中递送。
治疗应用
本文提供的嵌合启动子、表达盒或载体可用于在心肌中表达目的基因。因此,在一些实施方案中,本发明涉及上述表达盒、载体、细胞或药物组合物在制备用于治疗心肌相关疾病的药物中的用途。
本文提供的表达盒和载体也可用于基因疗法。因此,在一些实施方案中,本发明涉及治疗心肌相关疾病的方法,包括以有效量的上述表达盒、载体、细胞或药物组合物向有需要的受试者给药。
在一些实施方案中,本文提供了一种在肌细胞中表达目的基因的方法,其包括将本文提供的表达盒或载体引入到所述肌细胞中,并表达所述目的基因。所述方法可以是用于在肌细胞中表达目的基因的体外、离体或体内方法。
在一些实施方案中,本本文提供了一种在心肌中表达目的基因的方法,其包括将本文提供的表达盒或表达载体引入到心肌中,并表达所述目的基因。
在特定实施方式中,可能希望将本发明的药物组合物等局部给药到需要治疗的区域,例如局部心肌组织。这可以例如利用植入物来实现,包括多孔、无孔或凝胶状材料。
向有需要的受试者给药的剂量随着几种因素而变,包括但不限于给药途径、治疗的具体疾病、对象的年龄或获得治疗效果必需的表达水平。本领域技术人员可以在本领域知识的基础上,根据这些因素和其他因素容易地确定需要的剂量。在以AAV载体给药的情况下,载体的典型剂量是至少每千克体重1×10
本发明提供了在哺乳动物肌肉中特异性启动基因的启动子序列及其应用。该启动子序列如所述序列包含SEQ ID NO:4的核苷酸序列或者与其互补的核苷酸序列。所述序列由混合α-肌球蛋白重链增强子/肌酸激酶增强子启动子序列(hybridα-myosin heavychain enhancer-/muscle creatine kinase enhancer-promoter,MHCK7)经过人工优化所得。经优化后的启动子与原启动子片段相比,其肌肉组织特异性及表达能力得到了显著的改善。所述序列涉及在哺乳动物及肌肉细胞的应用,对于肌肉疾病治疗具有重大意义。
本文提供的在哺乳动物肌肉中特异性启动基因的启动子序列及各调控元件标注如表1所示。
表1启动子及转录因子结合位点序列
/>
/>
/>
实施例1质粒构建
(1)通过无缝克隆等分子工具构建目标质粒。引物由金唯智生物合成。合成以下质粒:
(2)首先构建编号02的质粒pAAV.MHCK7-1.Fluc-2a-maxGFP.WPRE.SV40pA。以编号01,质粒pAAV.MHCK7.Fluc-2a-maxGFP.WPRE.SV40pA为模板,该质粒包含两端ITR序列,MHCK7启动子,Luciferase-p2A-maxGFP等元件。首先利用高保证酶PrimeSTAR进行扩增,并以分别携带有1个Myod1转录因子识别结合位点-5’GGCAGCTGTTGCT3’-的MHCK7-1-1-F1/MHCK7-1-1-R1为引物,序列见表2。以编号01质粒为模板,扩增MHCK7启动子-582bp--771bp序列。
反应体系如下:
扩增体系:
将上述PCR产物进行胶回收,并吸取50ng胶回收产物作为第二次扩增反应的模板,加入引物MHCK7-1-1-F2/MHCK7-1-1-R1,序列见表格2。进行第二次PCR反应,以延长末端同源臂序列,反应体系与条件与上述相同。将第二次PCR反应产物进行胶回收,回收产物命名为片段1-1。同时利用引物MHCK7-1-2-F1/MHCK7-1-2-R1,以编号01质粒为模板,扩增MHCK7-1bp--581bp片段,并进行胶回收,回收产物命名为片段1-2。以Fluc-maxGFP-F1/Fluc-maxGFP-R1为引物,以编号01质粒为模板,扩增Luciferase-p2A-maxGFP,回收产物命名为片段1-3。并利用MluI+EcoRI酶切01质粒,并回收3356bp片段,回收产物命名为片段1-4。
(3)利用Exnase Multis连接酶进行无缝克隆,将载体片段与PCR产物进行连接,连接体系如下:
/>
37℃反应30min即可。
(4)转染E.coli DH5ɑ,涂于氨苄的平板,隔天挑菌检测,阳性克隆送至广州金唯智公司进行测序,筛选出带有2个Myod1转录因子识别结合位点的MHCK7启动子质粒。并将测序结果正确的质粒命名为pAAV.MHCK7-1.Fluc-2a-maxGFP.WPRE.SV40pA。
(5)同理利用分别携带有2个Myod1转录因子识别结合位点的MHCK7-2-1-F1/MHCK7-2-1-R1为引物,以编号01质粒为模板,进行PCR反应,扩增MHCK7启动子-582bp--771bp序列。跑胶回收PCR产物,并以该PCR为模板,引物MHCK7-2-1-F2/MHCK7-2-1-R1进行第二次扩增,跑胶回收并命名为片段2-1。以MHCK7-2-2-F1/MHCK7-1-2-R1为引物,01质粒为模板,扩增扩增MHCK7启动子-1bp--581bp片段,命名为片段2-2。以Fluc-maxGFP-F1/Fluc-maxGFP-R1为引物,以编号01质粒为模板,扩增Luciferase-p2A-maxGFP,回收产物命名为片段2-3。将片段2-1、片段2-2、片段2-3及酶切载体片段1-4,进行无缝克隆连接。并筛选出带有4个Myod1转录因子识别结合位点的MHCK7启动子质粒。将测序结果正确的质粒命名为pAAV.MHCK7-2.Fluc-2a-maxGFP.WPRE.SV40pA。
(6)为了在特定的序列位置添加一定数量的Myod1转录因子识别结合位点,利用携带Myod1转录因子识别结合位点引物进行多次扩增。首先以MHCK7-3-1-F1/MHCK7-3-1-R1为引物,编号01质粒为模板,进行第一次PCR反应,扩增MHCK7启动子-582bp--771bp序列,使序列末端带Myod1转录因子识别结合位点。以第一次PCR产物为模板,以MHCK7-3-1-F2/MHCK7-3-1-R2为引物进行第二次扩增,并跑胶回收。以第二次胶回收产物为模板,MHCK7-3-1-F3/MHCK7-3-1-R2为引物,进行第三次PCR反应,胶回收PCR产物,并将片段命名为3-1。以MHCK7-3-2-F1/MHCK7-3-2-R1为引物,编号01质粒为模板,扩增MHCK7启动子-406--572bp片段,并将片段命名为3-2。以MHCK7-3-3-F1/MHCK7-1-2-R1为引物,编号01质粒为模板,扩增MHCK7启动子-1--406片段,并将片段命名为3-3。以Fluc-maxGFP-F1/Fluc-maxGFP-R1为引物,以编号01质粒为模板,扩增Luciferase-p2A-maxGFP,回收产物命名为片段3-4。将片段3-1、片段3-2、片段3-3,片段3-4及酶切载体片段1-4,进行无缝克隆连接。并筛选出带有9个Myod1转录因子识别结合位点的MHCK7启动子质粒。将测序结果正确的质粒命名为pAAV.MHCK7-3.Fluc-2a-maxGFP.WPRE.SV40pA
表2质粒制备中用到的引物序列
实施例2重组腺相关病毒的制备
为了更好的验证优化的MHCK7启动子组织特异性及表达活性,通过包装腺相关血清型9并转染小鼠测定Luciferase蛋白表达效率,以进行验证。
重组腺相关病毒包装。以5E+5cell/ml细胞的密度在15cm培养皿中接种,过夜培养16-18小时。每皿加入15μg pHelper、10μg pRep2Cap9、7μg编号01质粒pAAV.MHCK7.Fluc-2a-maxGFP.WPRE.SV40pA(02质粒、03质粒或04质粒)。和10μg转染试剂聚乙烯亚胺孵育转染,转染72小时后。收集细胞以及上清液,通过碘克沙醇密度梯度离心。采用SYBRGreenIqPCR测定病毒滴度,使用前在-80℃冰箱保存。
实施例3小鼠病毒注射活体成像及组织取样
选取20只5-6周龄BALB/c小鼠,随机分成4组,每组5只。组别设置如下:
进行尾静脉注射上述病毒(滴度为2.5×10
实施例4小鼠组织样品RNA提取及逆转录定量
按RNA提取试剂盒步骤说明操作。取0.1-0.5g组织样品,转移至含有1ml transzolup的1.5mlEP管中,加入两颗RNA free的钢珠。用震荡匀浆器进行研磨。70HZ,震荡50s,停止10s。重复7次。室温静置5min,进行离心,收集上清。按5:1的比例加入氯仿,剧烈震荡30s,室温静置3min。于4℃进行低温离心。收集上清,加入等体积的无水乙醇,轻微混匀。将所得溶液加入离心柱中,离心,弃废液。加入500ul CB9,室温离心,弃废液,重复两次。加入500ulWB9,室温离心,弃废液,重复两次。空转20s,室温去除残留乙醇。加入50ul的RNA free水进行洗脱。利用NanoDrop测量所提RNA浓度。吸取500ng进行逆转录。利用SYBRGreenI qPCR进行定量,结果如图2A、图2B,表3所示,与对照组A组比较,C组在不同的肌肉组织,包括心脏,肱二头肌,股四头肌Luciferase表达均有增加,其中在肱二头肌平均增长倍数为6.51倍,股四头肌平均增长倍数为3.72倍。同时在肝脏,肺,脑等非肌肉组织增长没有显著性差异。说明MHCK7启动子经C组优化的方式结果很好。
表3qPCR测定结果
实施例5小鼠组织样品Western blot实验
分别随机从A组、C组中取4只小鼠肱二头肌,股四头肌进行Western blot实验分析。方法如下:将组织剪切成细小碎片,加入250ul含有终浓度为1mM的PMSF的RIPA裂解液。加入两颗已灭菌的氧化锆研磨珠,平衡放入预冷的研磨仪进行研磨。程序为:温度-20℃,频率70Hz,时间每震荡50s,停顿20s,重复5-7次。研磨完,12000rpm,4℃,离心15min。小心吸取上清,并利用BCA法蛋白质浓度测定试剂盒,测定蛋白浓度。分别取20ug蛋白样品进行SDS-PAGE跑胶。结果如图3A、图3B所示,经Western blot实验分析,C组与对照组A相比较,肱二头肌Luciferase蛋白表达增加4.45倍,股四头肌Luciferase蛋白表达增加2.63倍,增强效果十分显著。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
参考文献:
[1]Maja Z Salva,Charis L Himeda,Phillip Wl Tai,et al.Design oftissue-specific regulatory cassettes for high-level rAAV-mediated expressionin skeletal and cardiac muscle[J].Mol Ther,2007,15(2):320-329.
[2]Sun B,Young S P,Li P,et al.Correction of Multiple Striated Musclesin Murine Pompe Disease Through Adeno-associated Virus–mediated Gene Therapy[J].Molecular Therapy the Journal of the American Society of Gene Therapy,2008,16(8):1366-1371.
[3]Blum R,Dynlacht B D.The role of MyoD1 and histone modifications inthe activation of muscle enhancers[J].Epigenetics Official Journal of the DnaMethylation Society,2013,8(8):778-784。
- 在哺乳动物肌肉中特异性启动基因的启动子序列及其应用
- 在哺乳动物肌肉中特异性启动基因的启动子序列及其应用
