一种松墨天牛热激蛋白MaltHSP20-5基因的dsRNA及其合成方法和应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于基因工程技术领域,具体涉及一种松墨天牛热激蛋白 MaltHSP20-5基因的dsRNA及其合成方法和应用。
背景技术
松墨天牛(Monochamus alternatus)属于鞘翅目天牛科,幼虫钻蛀危害松科(Pinaceae)树种的韧皮部及木质部,破坏树木的输导组织,影响水分和养分的运输,导致树势衰弱。更为重要的,它还是世界重大森林检疫性病害—松材线虫病的主要媒介昆虫,对森林生态系统和松林资源造成了巨大的经济及生态损失。近年来,随着全球气候变暖加剧,夏季极端高温事件频发,作为变温动物,松墨天牛在野外不避免的遭受高温环境的胁迫。
在长期的进化过程中,昆虫自身逐渐形成了一套基于行为躲避、表型可塑、遗传进化以及生理生化响应的耐热机制。热激蛋白(Heat Shock Proteins, HSPs)是昆虫热胁迫响应中的关键活性蛋白,HSPs作为一种分子伴侣,可在热胁迫下保护细胞内其它蛋白质的构象和功能稳定,阻止蛋白质的非正常聚集和降解,从而帮助机体抵御不利高温。热胁迫下,昆虫会显著提高热激蛋白的转录翻译表达,热激蛋白基因下调会导致高温胁迫下昆虫的存活率显著下降,这表明HSPs可以作为害虫防治的潜在分子靶标位点。
RNA干扰(RNA interference,RNAi)是一种生物体内天然存在的转录后基因沉默机制,当同时导入靶标基因的正义链及反义链RNA时,抑制了目的基因的表达,称为RNA干扰现象。目前RNA干扰研究中,应用较为普遍的方式是通过外源导入双链RNA(double-strandRNA,dsRNA)后,在生物体内广泛存在的Dicer酶作用下被切割成siRNA,对靶标mRNA进行识别和切割。dsRNA的合成方式有T7试剂盒法,合成容易但成本昂贵,不适宜在生产实践中能大规模应用。
发明内容
有鉴于此,本发明的目的在于提供一种松墨天牛热激蛋白MaltHSP20-5 基因的dsRNA及其合成方法和应用,基于细菌表达的方法大量合成该基因的dsRNA,通过口服喂食导入至松墨天牛体内,对该基因进行RNA干扰,降低高温胁迫下松墨天牛的存活率,可为气候变暖背景下,松墨天牛以及松材线虫病的绿色防控提供新思路。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种松墨天牛热激蛋白MaltHSP20-5基因的dsRNA,所述dsRNA的核苷酸序列如SEQ ID NO.1所示。
本发明提供了一种表达上述dsRNA的重组菌,所述重组菌的基因组中包含上述dsRNA。
本发明还提供了上述重组菌的构建方法,包括以下步骤:(1)以提取自松墨天牛的RNA反转录后得到的cDNA为模板,利用SEQ ID NO.2和SEQ ID NO.3进行扩增,得目的条带;
(2)将所述目的条带和线性化质粒连接后,转化大肠杆菌感受态细胞,挑选PCR验证阳性的单克隆,得所述重组菌。
优选的,步骤(1)所述扩增的程序,包括:98℃10s,45℃15s,72℃ 1min/Kb,35个循环。
优选的,步骤(2)所述连接,包括将所述目的条带,与经Sac I和Not I 酶切后的L4440质粒进行连接。
本发明提供了利用上述重组菌诱导表达dsRNA的方法,包括以下步骤:将所述重组菌接种于含有氨苄青霉素和四环素的LB培养基中,培养至菌液 OD
优选的,所述LB培养基中,氨苄青霉素的浓度为100μg/ml,四环素的浓度为15μg/ml。
优选的,所述诱导表达在摇床上进行,温度为37℃,时间6h,所述摇床的晃动频率为200rpm。
本发明还提供了一种防治松墨天牛的试剂,包括利用上述方法经诱导表达后得到的细菌表达液。
本发明还提供了上述试剂的制备方法,包括以下步骤:将利用上述方法经诱导表达后得到的细菌表达液离心,无菌水重悬菌体后,与促食剂混合,得所述试剂。
有益效果:本发明提供了一种松墨天牛热激蛋白MaltHSP20-5基因的 dsRNA,所述dsRNA的核苷酸序列如SEQ ID NO.1所示。本发明还利用大肠杆菌系统高效合成表达MaltHSP20-5基因的dsRNA,克服了试剂盒不能大量合成dsRNA且价格昂贵的缺点,本发明成本低廉,操作简单,可以重复使用,不受限制。并且。本发明所述MaltHSP20-5基因的dsRNA可在高温胁迫下显著提高松墨天牛的死亡率,在气候变暖背景下,该RNA制剂可单独使用,或与其它生物或非生物制剂混用,以提高对松墨天牛的防治效果。本发明利用细菌表达体系,可大量、高效、快速及低成本的制备dsRNA,通过简单的喂食即可达到RNA干扰的目的,步骤简便可行,具有很好的应用前景。
附图说明
图1为MaltHSP20-5基因的dsRNA细菌表达液RNA提取电泳图,注:图中泳道M为Marker;L1为未加IPTG诱导菌液的RNA;L2为加入1mM IPTG诱导后菌液的RNA;
图2为松墨天牛成虫口服食用染料亮蓝和MaltHSP20-5基因的dsRNA 细菌表达液示意图;
图3为喂食GFP(对照组)以及MaltHSP20-5基因的dsRNA细菌表达液后松墨天牛体内MaltHSP20-5基因的相对表达量;
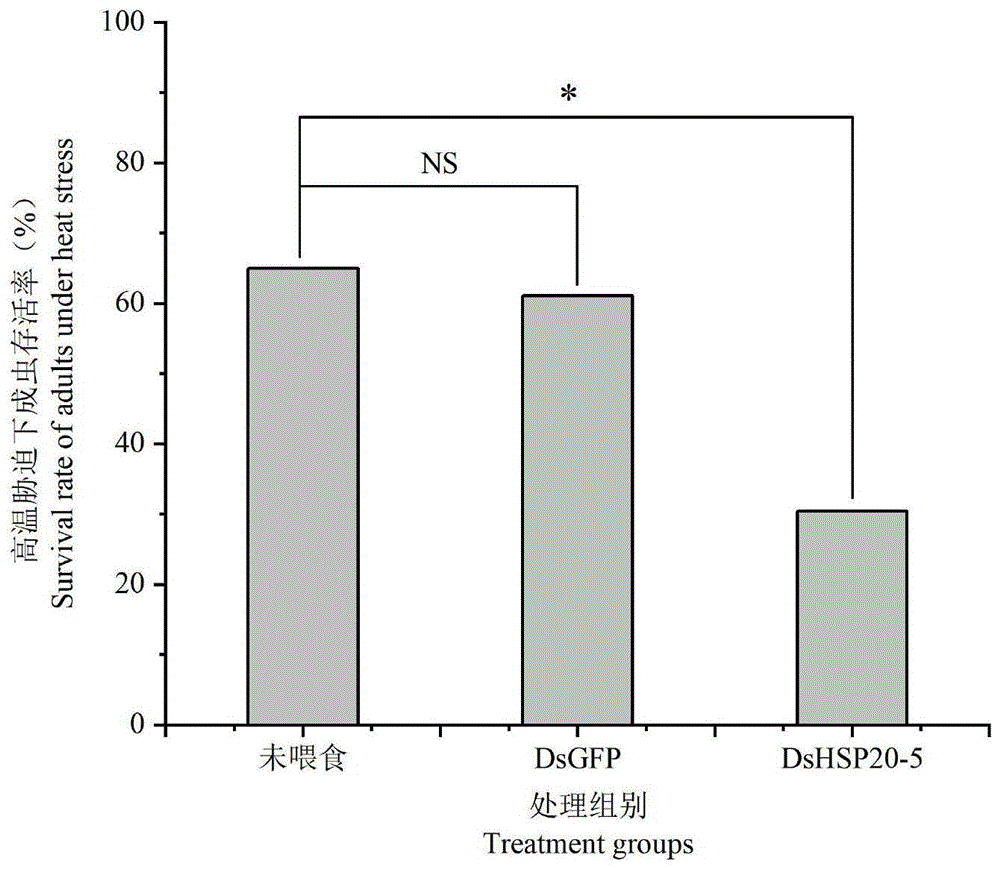
图4为未喂食DsRNA菌液组(未喂食)、喂食GFP基因dsRNA细菌表达液(DsGFP)、喂食MaltHSP20-5基因的dsRNA细菌表达液(DsHSP20-5) 三组松墨天牛成虫在高温胁迫下死亡率。
具体实施方式
本发明提供了一种松墨天牛热激蛋白MaltHSP20-5基因的dsRNA,所述dsRNA的核苷酸序列如SEQ ID NO.1所示。
本发明优选对MaltHSP20-5基因的siRNA位点进行预测分析,且在预测分析时遵循避开序列同源区,保证片段低GC含量,且在关键结构域内富含siRNA位点三大原则,将所述MaltHSP20-5基因的开放阅读框全长在在线网站(http://sidirect2.rnai.jp/)上进行siRNA位点预测,选择MaltHSP20-5 基因的开放阅读框内100~447位点共348bp合成该基因的如SEQ ID NO.1 所示的dsRNA。
本发明提供了一种表达上述dsRNA的重组菌,所述重组菌的基因组中包含上述dsRNA。
本发明所述重组菌优选以大肠杆菌为基础菌,实施例中以大肠杆菌感受态细胞HT115为例进行说明,但是不能仅将其认定为本发明的全部保护范围。
本发明还提供了上述重组菌的构建方法,包括以下步骤:(1)以提取自松墨天牛的RNA反转录后得到的cDNA为模板,利用SEQ ID NO.2和SEQ ID NO.3进行扩增,得目的条带;
(2)将所述目的条带和线性化质粒连接后,转化大肠杆菌感受态细胞,挑选PCR验证阳性的单克隆,得所述重组菌。
本发明以提取自松墨天牛的RNA反转录后得到的cDNA为模板,利用 SEQ ID NO.2和SEQ ID NO.3进行扩增,得目的条带。本发明优选提取松墨天牛的总RNA,反转录合成第一链cDNA,以SEQ ID NO.2和SEQ ID NO.3 所示的引物为引物对,进行PCR扩增,产物进行DNA回收纯化,获得DNA 模板。本发明对总RNA的提取方法并没有特殊限定,优选包括Trizol法。本发明所述扩增的体系,以50μL计,优选包括:PrimeSTAR Max Premix (2X)25μL、PrimerF1μL、Primer R1μL、cDNA模板3μL 和RNase free water20μL;扩增程序优选包括:98℃10s,45℃15s,72℃ 1min/Kb,35个循环。本发明优选对得到的PCR扩增产物进行DNA回收纯化,获得DNA模板。
得目的条带后,本发明将所述目的条带和线性化质粒连接后,转化大肠杆菌感受态细胞,挑选PCR验证阳性的单克隆,得所述重组菌。本发明所述线性化质粒优选包括经SacI和Not I酶切后的L4440质粒,实施例中优选通过同源重组的方法将所述线性化质粒与上述目的条带(或DNA模板)进行连接,得重组质粒。
本发明优选将上述重组质粒导入冻融状态的HT115大肠杆菌感受态细胞中,冰浴复苏后涂布于含有100μg/ml氨苄青霉素以及15μg/ml四环素的 LB固体平板上;37℃过夜培养后,在工作台中用无菌枪头挑取阳性克隆,进行菌液PCR验证无误后,加入等比例的50%(v/v)甘油混匀后保存于-80℃冰箱。本发明所述菌液PCR的方式优选与上述PCR扩增的引物对和程序相同,在此不再赘述。
本发明提供了利用上述重组菌诱导表达dsRNA的方法,包括以下步骤:将所述重组菌接种于含有氨苄青霉素和四环素的LB培养基中,培养至菌液 OD
本发明优选将上述重组菌接种于含双抗的LB液体培养基中进行培养,所述双抗优选包括氨苄青霉素和四环素,且在LB培养基中的浓度一次为100 μg/ml氨苄青霉素和15μg/ml四环素。本发明所述培养优选包括在温度37℃, 200rpm摇床中培养3~4h,待菌液OD
本发明实施例中优选采用-80℃保存的含甘油的甘油菌进行上述接种和培养,且接种时优选取出甘油菌1:100接种于50mL含有上述双抗的LB 液体培养基中,利用上述参数进行接种、培养和IPTG诱导后,收集细菌表达液。
本发明所述细菌表达液中,MaltHSP20-5基因的dsRNA成功在大肠杆菌中成功诱导表达,并可通过口服递送的方式投喂松墨天牛,且在喂食后1 至7天内,松墨天牛MaltHSP20-5基因的相对表达量显著降低,在喂食后5 天时,该基因的表达量下降了72.89%。并且在喂食MaltHSP20-5基因的 dsRNA细菌表达液5天后,将试虫置于42.5℃,湿度为70%的培养箱中进行高温胁迫处理,热激18h后,喂食MaltHSP20-5基因的dsRNA细菌表达液组别松墨天牛成虫的死亡率提高了35%。因此可将所述细菌表达液应用于防治松墨天牛。
本发明还提供了一种防治松墨天牛的试剂,包括利用上述方法经诱导表达后得到的细菌表达液。
本发明还提供了上述试剂的制备方法,包括以下步骤:将利用上述方法经诱导表达后得到的细菌表达液离心,无菌水重悬菌体后,与促食剂混合,得所述试剂。
本发明所述离心优选在4℃进行,并且所述离心的转速优选为5000rpm,离心是时间优选为10min,经所述离心后弃上清,将50mL细菌表达液的离心菌体,优选利用500μL无菌水重悬,并加入等体积的促食剂进行混合,所述促食剂优选包括10%(m/v)的蔗糖溶液。
下面结合实施例对本发明提供的一种松墨天牛热激蛋白MaltHSP20-5 基因的dsRNA及其合成方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。以下实施例中,未详细叙述的操作均为常规生物学实验操作,可参照分子生物学实验手册以及现有公开的期刊文献等进行。
实施例1
松墨天牛热激蛋白MaltHSP20-5基因dsRNA序列获取
(一)松墨天牛热激蛋白MaltHSP20-5基因开放阅读框全长的获取:基于转录组数据,通过功能注释搜索HSP20基因序列,并通过ORFFinder软件预测开放阅读框,得到待定核苷酸序列。设计5'和3'引物,如SEQ ID NO.6 和SEQ ID NO.7所示。
16日龄松墨天牛成虫经液氮速冻后,在遇冷研钵中研磨至粉状,Trizol 法提取松墨天牛总RNA,按照反转录试剂盒(艾科瑞,长沙)获得第一链 cDNA,以此为模板进行PCR扩增,反应体系如表1所示:
表1 PCR扩增体系
扩增程序:98℃10s,45℃15s,72℃1min/Kb,35个循环。
PCR扩增后利用DNA纯化试剂盒(艾科瑞,长沙)进行产物回收,连接至T/A bluntvector载体(Vazyme,南京),导入DH5α大肠杆菌感受态细胞,涂布于含有100μg/ml氨苄青霉素LB平板上。37℃过夜培养,挑取阳性克隆进行菌液PCR验证:以菌液为扩增模板,PCR体系及程序如上,条带正确的菌液送至杰李(上海)生物技术公司测序,获得MaltHSP20-5基因开放阅读框全长为546bp,如SEQ ID NO.8所示。
(二)MaltHSP20-5基因富含siRNA位点的预测分析:遵循避开序列同源区,保证片段低GC含量,且在关键结构域内富含siRNA位点三大原则。将获得的MaltHSP20-5基因的开放阅读框全长在在线网站 (http://sidirect2.rnai.jp/)上进行siRNA位点预测,选择了MaltHSP20-5基因的开放阅读框内100~447位点共348bp合成该基因的dsRNA,核苷酸序列如SEQ ID NO.1所示。
实施例2
松墨天牛热激蛋白MaltHSP20-5基因dsRNA细菌表达液的制备
(一)热激蛋白MaltHSP20-5基因dsRNA细菌表达载体构建:
1.MaltHSP20-5基因片段DNA模板制备
利用CEDesign(Vazyme,南京)在线软件设计MaltHSP20-5基因片段与L4440质粒SacI和NotI位点的同源引物,如SEQ ID NO.2和SEQ ID NO.3 所示,以此为扩增引物,以实施例1(一)获得的cDNA为模板,进行PCR 扩增。扩增体系及程序与实施例1相同,扩增产物进行回收纯化后获得DNA 模板。
2.L4440质粒线性化
以L4440质粒为模板,进行Sac I和Not I双酶切,反应体系如表2所示:
表2双酶切体系
金属浴37℃30min后,1%琼脂糖凝胶电泳,回收目的片段即为线性化载体。
3.MaltHSP20-5-L4440重组质粒构建
利用同源重组酶(Vazyme,南京),对MaltHSP20-5基因片段DNA模板以及线性化的L4440质粒进行重组,构建表3所示的反应体系:
表3重组质粒构建体系
将连接产物置于37℃金属反应30min后,导入冻融状态的HT115大肠杆菌感受态细胞(庄盟,北京)中,冰浴复苏后涂布于含有100μg/ml氨苄青霉素以及15μg/ml四环素的LB固体平板上。37℃过夜培养后,在工作台中用无菌枪头挑取阳性克隆,进行菌液PCR验证无误后,加入等比例50%甘油混匀后保存于-80℃冰箱。
(二)热激蛋白MaltHSP20-5基因dsRNA诱导表达:
取出甘油菌1:100接种于50mL含有100μg/ml氨苄青霉素以及15 μg/ml四环素的LB液体培养基中,置于37℃,200rpm摇床中培养3~4小时,待菌液OD
(三)热激蛋白MaltHSP20-5基因dsRNA提取:
5mL培养后的细菌表达液经4℃,12000rpm离心10min后弃上清,加入终浓度为0.5mg/mL的溶菌酶,37℃金属浴孵育10min后,加入1mL TRNzol(天根,北京)按照说明书进行RNA提取。提取同样培养条件下未加入IPTG进行诱导细菌表达液的RNA作为对照。如附图1所示,未诱导细菌表达液的RNA由28S、18S和5S三种亚基组成,而加入IPTG诱导后菌液的RNA还包括在348bp左右的条带,表明MaltHSP20-5基因dsRNA 已成功在大肠杆菌中表达。
实施例3
松墨天牛热激蛋白MaltHSP20-5基因dsRNA细菌表达液的应用
(一)热激蛋白MaltHSP20-5基因dsRNA细菌表达液的递送
采用口服喂食法向松墨天牛体内递送MaltHSP20-5基因dsRNA细菌表达液:50mL培养后的细菌表达液经4℃,5000rpm离心10min后弃上清,菌体加入500μL无菌水重悬,并加入等体积10%蔗糖溶液(作为促食剂) 和1mg/mL食用亮蓝(作为标记物)配制喂食预混液。如图2所示,通过微量进样针向每只天牛口器递送2μL的预混液,直至完全取食。喂食24小时后,于体视显微镜下利用解剖工具剖离松墨天牛成虫完整消化道,可发现食用染料亮蓝在成虫中肠段出现,表明口服喂食法可成功向松墨天牛体内递送 MaltHSP20-5基因dsRNA细菌表达液。
(二)热激蛋白MaltHSP20-5基因的RNA干扰效率
按(一)中所述方法,每日喂食松墨天牛成虫2μLMaltHSP20-5基因 dsRNA细菌表达液,分别在喂食后的第一、三、五以及七天时,取15只成虫分别转入2mL无核酶离心管中,液氮速冻。每5只成虫用研钵在液氮中研磨至粉状,取100mg固体粉末利用动物组织RNA提取试剂盒(天根,北京)提取总RNA。以相同的方法以及剂量饲喂松墨天牛成虫GFP基因dsRNA 细菌表达液,作为对照组,进行三次生物学重复。按照反转录试剂盒(艾科瑞,长沙)获取第一链cDNA,并稀释至200ng/μL。荧光定量PCR引物如 SEQ ID NO.4和SEQ ID NO.5所示,引物用于荧光定量PCR之前,先进行扩增效率的检验。以松墨天牛RPL-10基因为内参基因(李慧,何玄玉,陶蓉,等.松墨天牛小热激蛋白基因的克隆、表达谱及对温度胁迫的响应[J]. 昆虫学报,2018,61(7):749-760.),荧光定量PCR扩增的反应体系如表4所示:
表4荧光定量PCR扩增体系
扩增程序:95℃5min;95℃10s,60℃40s,40循环。
每个生物学重复还需进行3次技术重复。以喂食同等天数GFP基因 dsRNA细菌表达液为对照组,通过2
(三)喂食MaltHSP20-5基因dsRNA细菌表达液对松墨天牛耐热性的影响
如图3所示,在喂食MaltHSP20-5基因dsRNA细菌表达液的1至7天内,MaltHSP20-5基因的表达量出现了显著下调,表明通过喂食细菌表达液法,可保证MaltHSP20-5基因的长期持续下调表达。将未喂食细菌表达液组、持续5天喂食GFP基因dsRNA细菌表达液组、持续5天喂食MaltHSP20-5 基因dsRNA细菌表达液组试虫均置于42.5℃、湿度为70%的培养箱进行高温胁迫处理。高温胁迫处理时每5只性成熟成虫置于一个饲养盒(11.5cm× 11.5cm×13cm)中,放置5根10cm长的新鲜枝条,每隔6h更换枝条。每个处理组均保证30个重复。持续胁迫18h后,将试虫转移至25℃、湿度为70%的培养箱中恢复2h后,统计三组试虫的存活率。
如图4所示,42.5℃胁迫18h时,未喂食细菌表达液组存活率为65.00%,喂食GFP基因dsRNA细菌表达液组存活率为61.11%,喂食MaltHSP20-5 基因dsRNA细菌表达液组存活率为30.43%。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 一种松墨天牛热激蛋白MaltHSP20-11及其编码基因和应用
- 一种松墨天牛热激蛋白MaltHSP20-11及其编码基因和应用
