L-plastin蛋白作为药物靶点在筛选延缓骨性关节炎疼痛的药物中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物医药技术领域,具体涉及L-plastin蛋白作为药物靶点在筛选延缓骨性关节炎疼痛的药物中的应用。
背景技术
骨性关节炎(简称OA)发生发展过程中,软骨下骨髓水肿、骨囊肿形成及硬化,软骨退变及关节疼痛。软骨下骨破骨细胞过度激活与OA进程密切相关。软骨下骨的骨重建活动和破骨细胞数量受到严格控制,破骨细胞数量在OA小鼠模型早期显著增加。有人提出:破骨细胞前体迁移到软骨层,并直接与肥大的软骨细胞接触,以降解骨软骨连接和关节软骨。目前用于OA治疗的药物主要有COX-2抑制剂用于缓解症状,尚无用于治疗OA的药物,我们研究发现,OA早期软骨下骨中破骨细胞诱导血管形成改变了关节缺氧环境,并导致关节疼痛。研究表明,抑制破骨细胞异常激活可以从一开始就阻断异常的软骨下骨重建,缓解OA疼痛。LPL是肌动蛋白捆绑蛋白,在破骨细胞融合中必不可少。我们发现,阻断LPL可有效缓解OA疼痛。
发明内容
针对现有技术的不足,本发明提供了L-plastin蛋白作为药物靶点在筛选延缓骨性关节炎疼痛的药物中的应用。
本发明的目的是通过以下技术方案实现的:
第一方面,本发明提出了L-plastin蛋白作为药物靶点在筛选延缓骨性关节炎疼痛的L-plastin蛋白抑制剂药物中的应用。
第二方面,本发明提出了L-plastin蛋白抑制剂在制备延缓骨性关节炎疼痛的试剂中的应用。
第三方面,本发明提出了L-plastin蛋白作为药物靶点在制备诊断骨性关节炎疼痛的试剂中的应用。
第四方面,本发明还提出了L-plastin蛋白作为药物靶点在制备防治骨性关节炎疼痛的试剂中的应用。。
与现有技术相比,本发明具有如下的有益效果:
1、本发明首先发现了L-plastin对OA疼痛的影响,验证了L-plastin通过阻断破骨细胞成血管作用保持了软骨下骨及软骨的低氧环境稳定了HIF-1α含量与功能,从而维持了软骨的正常代谢延缓了OA软骨退变进而缓解了OA疼痛。
2、通过本发明的研究可进一步将L-plastin作为药物靶点用于OA疼痛的诊断与治疗。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显。
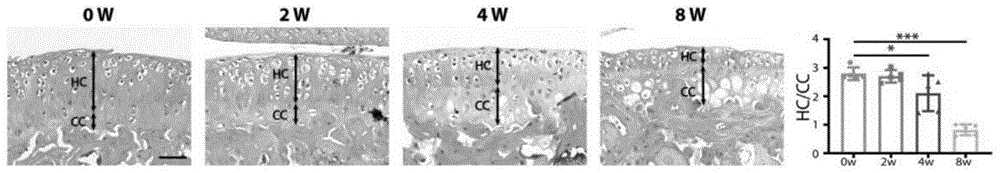
图1为实施例1的ACLT组及WT组小鼠不同时间点关节软骨及软骨下骨进行HE染色;
图2为实施例1的ACLT组及WT组小鼠不同时间点关节软骨及软骨下骨进行OARSI评分软骨磨损情况。
图3为实施例2的ACLT组及WT组小鼠不同时间点骨量分析发现;
图4为实施例3的ACLT组及WT组小鼠不同时间点抗酒石酸酸性磷酸酶(TRAP+)染色;
图5为实施例3的ACLT组及WT组小鼠不同时间点软骨及软骨下骨免疫组织化学(IHC)染色;
图6为实施例4的Lcp1敲除小鼠进行Micro CT骨量检测;
图7为实施例5的小鼠软骨及软骨下骨的破骨细胞TRAP染色;
图8为实施例6的小鼠软骨及软骨下骨HE染色;
图9为实施例7的小鼠软骨及软骨下骨Ⅱ型胶原免疫组化染色;
图10实施例7小鼠软骨及软骨下骨软骨的ACAN+免疫组化染色;
图11为实施例8小鼠软骨及软骨下骨的MMP13免疫组化染色;
图12为实施例8小鼠软骨及软骨下骨的ADAMTS5蛋白免疫组化染色;
图13为实施例8小鼠软骨及软骨下骨的COLⅩ蛋白免疫组织化学染色;
图14为实施例9ACLT后2周和4周,Lcp1-/-和WT小鼠胫骨软骨下骨中NETRIN-1蛋白的免疫荧光染色。
图15为实施例9在ACLT手术后4和8周Lcp1-/-和WT小鼠胫骨软骨下骨中CGRP+感觉神经纤维的免疫荧光染色。
图16为实施例9手术后每周对Lcp1-/-和WT的右后爪进行撤爪阈值测试,直到8周。
图17为实施例10Lcp1基因敲除抑制破骨细胞诱导的血管生成;
图18为实施例11的Lcp1基因敲除血管生成情况;
图19为实施例12小鼠软骨下骨和软骨中的低氧状态;
图20为实施例13的基于18F-氟异硝唑(18F-FMISO)的PET/CT直接测量了活体小鼠关节中的O
具体实施方式
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进。这些都属于本发明的保护范围。
实施例1
本实施例前交叉韧带离断骨性关节炎模型构建,8周雄性WT及Lcp1敲除小鼠在SPF级动物房适应环境2天后进行造模。WT及Lcp1敲除小鼠小鼠分假手术组和ACLT组。ACLT手术方法:小鼠采用腹腔注射2%戊巴比妥钠0.2ml麻醉,待小鼠翻身试验阴性,表示麻醉成功已生效。待麻醉生效后,小鼠取仰卧位,右膝关节处用电动剃毛刀备皮,碘伏消毒。右膝关节稍屈曲,使用眼科剪取右膝关节内侧入路,皮肤切口位于髌韧带平行走形,长度约1cm。切开皮肤钝性分离皮下组织,暴露至髌韧带,纵向剪开髌韧带内侧,使用显微外科镊将其向外侧牵拉暴露膝关节腔。于外科手术显微镜下用显微外科镊向下牵拉髌下脂肪垫,暴露至胫骨平台髁间嵴,定位前交叉韧带止点。直视下显微外科剪从止点离断前交叉韧带,3-0线缝合髌韧带切口及皮肤切口,皮肤再次碘伏消毒。假手术组与右膝关节内侧做1cm长切口,缝合切口皮肤再次碘伏消毒。等待小鼠麻醉复苏后放回原饲养笼。ACLT造模术后0天、2周、4周及8周进行取材,每组每个时间点至少5只小鼠。
HE染色(1)石蜡切片脱蜡脱水:二甲苯第一缸浸泡15分钟,二甲苯第二缸浸泡15分钟,无水乙醇第一缸浸泡5分钟,无水乙醇第二缸浸泡5分钟,95%乙醇浸泡5分钟,80%乙醇浸泡5分钟,75%乙醇浸泡5分钟,ddH2O清洗2遍每次5分钟。(2)苏木精染色液浸泡5分钟,自来水洗涤多于染色液(3)盐酸酒精分化液分化1至2秒,自来水洗涤多于分化液,流水反蓝15分钟(4)伊红染液染色染色5秒(5)75%乙醇浸泡2分钟,80%乙醇浸泡2分钟,90%乙醇浸泡2分钟,无水乙醇第一缸浸泡2分钟,无水乙醇第二缸浸泡2分钟。切片37度烘箱烘干5分钟,二甲苯透明5分钟;切片二甲苯挥发后,中性树脂封片;正置显微镜明场观察关节软骨区域,拍照测量关节透明软骨及钙化软骨长度,计算透明软骨与钙化软骨比例。
结果表明,在OA进展过程中,透明软骨(HC)的厚度减少,而钙化软骨(CC)的厚度逐渐增加,HC/CC的比率在8周时降至平均0.81(结果参见图1)。
在ACLT骨关节炎造模后0周、2周、4周、8周后使用OA损伤OARSI评分系统评分关节损伤程度检测软骨磨损情况,结果显示:8周时部分软骨出现磨损,软骨撕裂至全层50%-75%,国际骨关节炎研究会(OARSI)等级达到5至6级(结果参见图2)
实施例2
对造模后不同时间点骨量分析,在ACLT骨关节炎造模后0周、2周、4周、8周后使用MicroCT检测小鼠右下肢骨量。采用全自动高速X射线显微断层扫描系统(microCT;Brukerskyscan1275,德国)扫描新鲜小鼠膝关节样本。每次同时扫描三个样本,膝关节胫骨端朝下,设定扫描分辨率为9微米,每1度进行一次X线片透射。使用50千伏X射线电压和60微安电流。扫描结束后采用配套软件重建包含胫骨近1cm及股骨远端1cm的完成膝关节组织。将扫描的重建图像导入Data-Viewer软件(1.5版)后,以冠状面图像为基准,选择内侧胫骨平台为感兴趣区域并保存为收集的数据,使用CT-An软件(1.15版)进一步分析。使用CT-Vol软件(1.14版)重建了胫骨平台结构矢状面的三维图像。在扫描图像中测量了以下软骨下骨的结构参数:骨量/组织量(BV/TV,%),骨小梁分离度(Tb.Sp,μm)和软骨下骨板厚度(SBP.Th,μm)。结果表明,ACLT后2周软骨下骨的骨量减少,骨体积/总体积(BV/TV)在34.3%-55.8%之间,但在ACLT后4周和8周,BV/TV增加至56.6%-76.2%(结果参见图3)。
实施例3
骨关节炎造模后不同时间点抗酒石酸酸性磷酸酶(TRAP+)染色及LPL免疫组化染色检测,在ACLT造模后0周、2周、4周、8周后,通过抗酒石酸酸性磷酸酶(TRAP+)染色及LPL+细胞数目的计算检测软骨及软骨下骨中破骨能力,发现,ACLT后的前两周迅速增加,并在2周后减少(结果参见图4);软骨下骨中LPL+细胞的数量与TRAP+细胞的数量一致,即ACLT后的前两周迅速增加,并在2周后减少(结果参见图5)。
实施例4
本实施例在C57BL/6背景下,用CRISPR-Cas9基因编辑技术产生了Lcp1基因敲除小鼠。利用非同源重组修复引入突变的方式,造成Lcp1基因蛋白读码框移码,功能缺失。简要过程如下:通过体外转录的方式,获得Cas9mRNA和gRNA;将Cas9 mRNA和gRNA显微注射到C57BL/6J小鼠的受精卵中,获得F0代小鼠。经PCR产物测序确认,共获得1只目的基因蛋白读码框移码的F0代小鼠;F0代小鼠与C57BL/6J小鼠交配获得1个品系,共计6只阳性F1代小鼠。将获得的基因敲除杂合子小鼠(gene+/-,即后续所称的Lcp+/-)分成两部分:一部分杂合子小鼠与野生型小鼠交配,扩群繁育较多的杂合子小鼠;一部分杂合子小鼠自交,获得基因敲除纯合子小鼠(gene-/-,即后续所称的Lcp-/-本案所称的基因敲除小鼠。),进行基因敲除效果验证和后续的表型分析。
对Lcp1-/-小鼠进行Micro CT检测,具体操作如下,在ACLT造模后2周、4周使用10%的水合氯醛按照0.35ml/100g的浓度腹腔注射对各组小鼠进行麻醉。待小鼠彻底麻醉后,剥离小鼠右下肢的皮肤,剔除肌肉,分离出右侧膝关节,分离出胫骨的软骨下骨及软骨,将样本置于4%的多聚甲醛溶液4℃固定24-48小时,然后进行MicroCT检测,结果如图6所示,发现在2周和4周时Lcp1-/-小鼠软骨下骨髓中的骨体积/组织体积(BV/TV)显著增加,两组之间软骨下骨板厚度无统计学差异。
实施例5
TRAP染色用于观察软骨下骨的破骨细胞。具体操作步骤如下,取各组的软骨及软骨下骨石蜡切片,烤片:65℃恒温箱中烤片1-2小时;二甲苯脱蜡:二甲苯Ⅰ,10分钟;二甲苯Ⅱ,10分钟;水化:100%乙醇Ⅰ,10分钟;100%乙醇Ⅱ,10分钟;95%乙醇溶液,8分钟;80%乙醇溶液,8分钟;70%乙醇溶液,5分钟;50%乙醇溶液,5分钟;清洗去除乙醇:PBS冲洗3次,每次5分钟。然后进行TRAP染色。
TRAP染色结果显示:在ACLT后2周和4周,Lcp1-/-小鼠软骨下骨中的TRAP+细胞数量明显少于野生型组的(结果参见图7)。
实施例6
对Lcp1基因敲除小鼠进行HE染色,具体操作步骤如下:取不同组软骨及软骨下骨切片标本经烤片、脱蜡、梯度酒精水化后苏木紫染色10秒,流水冲洗30秒;1%盐酸酒精分化液分化10秒,流水冲洗至光学显微镜下观察到细胞核呈蓝色为止;伊红染色1分钟,流水冲洗1分钟;显微镜下观察切片细胞核呈蓝色,细胞质呈红色为止。切片自然风干,中性树脂封片。结果显示,在ACLT后4周和8周,Lcp1基因敲除小鼠的HC/CC比WT小鼠分别增加1.42和1.71倍(结果参见图8)。
实施例7
为了检测关节软骨的退变情况,对关节软骨进行了Ⅱ型胶原及ACAN+免疫组化染色。具体操作步骤如下,切片经过烤片、脱蜡、梯度酒精水化后进行抗原修复:置于0.01M枸橼酸缓存液(PH=6.0)中进行修复,修复温度为60℃,时间为18-24小时。待修复结束,自然冷却至室温后取出切片;清洗去除抗原修复液:PBS冲洗3次,每次5分钟;灭活内源性过氧化物酶:3%H2O2溶液覆盖标本,室温避光孵育10分钟;清洗去除H
结果显示:在ACLT后4周和8周,Lcp1敲除小鼠Ⅱ型胶原含量明显少于野生型组(结果参见图9)。在ACLT后4周和8周,Lcp1敲除小鼠ACAN+区域明显少于野生型组(结果参见图10)。
实施例8
对小鼠关节软骨及软骨下骨退变相关蛋白的检测,在ACLT造模后4周、8周对Lcp1敲除后小鼠及野生型小鼠检测MMP13、ADAMTS5、COLⅩ蛋白,通过免疫组化染色的方法进行检测,一抗MMP13(1:200;Proteintech,18165-
1-AP)、ADAMTS5(1:500;Thermo,PA5-27165)、COLⅩ(1:500;Abcam,ab260040)。结果显示:ACLT4周和8周后,在Lcp1敲除后,MMP13阳性的区域减少(结果参见图11)。ACLT4周和8周后,在Lcp1敲除后小鼠ADAMTS5蛋白阳性区域减少(结果参见图12)。ACLT4周和8周后,在Lcp1敲除后小鼠COLⅩ蛋白阳性区域减少(结果参见图13)。
实施例9
造模术后1、2、4、8周分别取脊柱背根神经节进行辣椒素受体1(TRPV1)免疫荧光染色,评价中枢神经系统敏化状态;造模术后每周进行Von Frey实验观察关节疼痛水平。膝关节组织通过CGRP、Netrin-1免疫荧光染色观察感觉神经侵入情况。结果显示,在ACLT术后2周,WT小鼠的NETRIN-1(神经发育所必需的蛋白质)水平增加。然而,在Lcp1敲除小鼠中没有观察到NETRIN-1在软骨下区域的表达(结果参见图14)。相应地,Lcp1-/-小鼠的CGRP+神经纤维的数量与WT小鼠相比,分别低了0.72和0.57倍(结果参见图15)。vonFrey试验显示,Lcp1基因敲除小鼠在ACLT术后3周,后肢缩回阈值比对照WT小鼠增加1.7至2.6倍(结果参见图16)。
综上所述,Lcp1基因敲除可以缓解OA的进展,其特点是软骨下骨吸收迟缓,关节软骨退化减轻,疼痛改善。
实施例10
为了验证Lcp1基因敲除抑制破骨细胞诱导的血管生成,并阻止氧从软骨下骨向软骨的扩散的假设,我们首先对软骨下骨进行了微血管成像,具体操作如下:
用戊巴比妥钠麻醉小鼠,打开胸腔,分离暴露心脏。使用静脉输液针自心尖进入,右心房剪一5mm切口,注入20ml生理盐水至灌流液呈现清亮透明液体,小鼠肝脏成黄白色。使用4%PFA溶液20ml再次心脏灌流,观察小鼠出现抽搐为宜,最后20ml生理盐水灌洗多于组织固定液。第二步经心脏注入血管内造影剂(MICROFIL,MV-120,Flow Tech)。在收取膝关节样本之前,小鼠浸泡于中性组织固定液中,在4度冰箱下保存12小时。12小鼠后按上述方法取材,膝关节在10%PFA中性组织固定液中固定3天,随后10%EDTA脱钙液中中脱钙21天。
膝关节用微电脑断层扫描(microCT;Bruker skyscan1275,德国),膝关节胫骨端朝下,分辨率为9微米,50千伏X射线电压和60微安电流。
将扫描的图像导入Data-Viewer软件(1.5版)后,选择感兴趣的体积并保存为收集的数据,使用CT-An软件(1.15版)进一步分析。使用CT-Vol软件(1.14版)重建了胫骨平台结构矢状面的三维图像。对软骨下的血管体积进行了分析。感兴趣的区域是胫骨内侧平台的中央。在扫描图像中测量了以下软骨下骨的结构参数:血管体积(VV)。
结果显示,在ACLT后4周和8周,野生型小鼠的血管体积增加,Lcp1敲除后的小鼠血管容积没有变化(结果参见图17)。
实施例11
为了进一步鉴定Lcp1基因敲除血管生成情况,评估了CD31hiEMCNhi血管的水平。具体操作如下:取各组切片在抗原修复后清洗去除抗原修复液:PBS冲洗3次,每次5分钟;灭活内源性过氧化物酶:3%H2O2溶液覆盖标本,室温避光孵育10分钟;清洗去除H2O2:PBS冲洗3次,每次5分钟;封闭:正常山羊血清专用封闭液覆盖标本,室温孵育30分钟;一抗孵育CD31(1:200;Abcam,ab182981),EMCN(1:50;Santa Cruz,sc-65495),:轻轻擦去封闭液,将稀释好的一抗溶液(用抗体稀释液)覆盖标本,于湿盒中4℃孵育过夜;次日,置于37℃孵箱复温30分钟;清洗富余的一抗:PBS冲洗3次,每次5分钟;二抗孵育:AlexaFluor488绿色荧光二抗孵育CD31,Alexa Fluor 568红色荧光蛋白孵育EMCN。于湿盒中37℃孵育1小时;清洗富余二抗:PBS冲洗3次,每次5分钟;在共聚焦显微镜下观察,结果显示在ACLT后4周和8周,WT小鼠中CD31和EMCN阳性细胞的数量显著增加,而相比来说,Lcp1缺失中的小鼠中增加较少(结果参见图18)。此结果与血管体积水平验证结果一致。
实施例12
使用低氧探针测量软骨下骨和软骨中的低氧状态。使用匹莫硝唑试剂盒检测软骨及软骨下骨氧含量。各实验组小鼠处死前1小时腹腔注射吡莫硝唑60mg/kg。一级抗体与FITC试剂盒结合,以1:100稀释度检测吡莫硝唑。
匹莫硝唑免疫染色结果显示,在ACLT后4周和8周,在Lcp1小鼠中匹莫硝唑荧光强度高于WT小鼠的荧光强度(结果参见图19)。
为了进一步证实这些结果,我们使用基于18F-氟异硝唑(18F-FMISO)的PET/CT直接测量了活体小鼠关节中的O
以上结果表明,Lcp1基因敲除可阻止H型血管的形成,并维持软骨下骨和软骨中的缺氧环境。
虽然以上描述了本发明的具体实施方式,但是本领域的技术人员应当理解,这仅是举例说明,本发明的保护范围是由所附权利要求书限定的。本领域的技术人员在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改,但这些变更和修改均落入本发明的保护范围。
序列表
<110> 上海禾麦医学科技有限公司
<120> L-plastin 蛋白作为药物靶点在筛选延缓骨性关节炎疼痛的药物中的应用
<130> JY2210003
<141> 2022-03-16
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 1
cgccaccact gcccggcaag agg 23
<210> 2
<211> 23
<212> DNA
<213> Artificial Sequence
<400> 2
caaatgaggt cactccgtac agg 23
- PA4608蛋白作为靶点在制备抗菌药物中的应用
- L-plastin蛋白作为骨性关节炎疾病修饰药物的靶点的应用
- Kindlin-2蛋白作为靶点在制备治疗骨性关节炎的药物中的应用
