一种重组人促卵泡生成素Fc融合蛋白及制备方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明涉及生物技术领域,具体涉及一种重组人促卵泡生成素Fc融合蛋白及制备方法。
背景技术
促卵泡生成素(FSH)由脑垂体分泌,成分为糖蛋白,分子量约为42kDa,由α链和β链通过非共价结合,因早期发现其对女性卵泡成熟的促进作用而得名。后来研究发现FSH在男女两性体内都是很重要的激素之一,调控发育、生长、青春期性成熟以及生殖相关的一系列生理过程。FSH在女性中的功能是促进卵泡发育和成熟,及协同促黄体生成素(LH)促使发育成熟的卵泡分泌雌激素和排卵,参与正常月经的形成;在男性中的功能是促进睾丸曲细精管的成熟和精子的生成。因此,FSH可以单独使用或与LH联合应用治疗不育不孕症。
FSH可以从脑垂体或尿液中分离提取或采用基因重组技术制备。重组FSH制品纯度高,安全性好、质量可控、与提取产品相比活性相当,备受市场青睐。临床上,FSH需连续8-10天皮下注射给药刺激女性卵泡发育,给患者带来诸多不便和痛苦。因此,开发长效重组FSH类产品是未来的一个趋势。
发明内容
本发明一个目的是提供FSH融合蛋白。
本发明提供的FSH融合蛋白,为如下B1)或B2):
B1)所述FSH融合蛋白,其A链为FSH的α链,B链为连接标签的FSH的β链;
B2)所述FSH融合蛋白,其A链为连接SP1信号肽的FSH的α链,B链为连接SP1信号肽和标签的FSH的β链;
所述SP1信号肽的氨基酸序列如SEQ ID No.5所示。
上述标签可以为Fc、HSA、CTP或XTEN中任一或者任2种组合,优选标签为Fc标签。
优选地,B1)所示的FSH融合蛋白为FSH-Fc融合蛋白,FSH为人FSH,具体的讲,将Fc标签融合于人FSH分子的β链的碳末端,形成FSH-Fc的B链,B链通过Fc结构的二硫键形成同二聚体;FSH分子的α链(即FSH-Fc的A链)通过非共价键与B链结合,形成二价FSH分子。
优选地,B2)所示的FSH融合蛋白为SP1-FSH-Fc融合蛋白,FSH为人FSH,具体的讲,将Fc标签融合于人FSH分子的β链的碳末端,且将SP1信号肽连接在人FSH分子的β链的氮末端,形成SP1-FSH-Fc的B链,B链通过Fc结构的二硫键形成同二聚体;将SP1信号肽连接在人FSH分子的α链的氮末端,形成SP1-FSH-Fc的A链,SP1-FSH-Fc的A链通过非共价键与B链结合,形成二价FSH分子。
进一步优选地,上述的FSH-Fc融合蛋白,上述Fc来自于IgG1-Fc,上述FSH为人FSH。Fc为IgG1-Fc,具体的讲,采用人IgG1-Fc的CH2和CH3区;且去除碳末端的Lys(K)氨基酸,减少分子的电荷异质性。
上述FSH融合蛋白由FSH的α链和连接Fc标签的FSH的β链非共价结合而成;
上述FSH融合蛋白由连接SP1信号肽的FSH的α链和连接SP1信号肽和Fc标签的FSH的β链非共价结合而成。
所述Fc标签在FSH的α链的C端;
所述SP1信号肽连接在FSH的α链或β链的N端。
上述FSH融合蛋白中,B1)中,所述FSH融合蛋白的A链的氨基酸序列如SEQ ID No.1所示;所述FSH融合蛋白的B链的氨基酸序列如SEQ ID No.2所示;
或,B2)中,所述FSH融合蛋白的A链的氨基酸序列如SEQ ID No.7所示;所述FSH融合蛋白的B链的氨基酸序列如SEQ ID No.8所示。
与上述融合蛋白相关的生物材料也是本发明保护的范围。
上述生物材料为上述融合蛋白的编码基因或含有所述编码基因的表达盒、重组载体、重组菌或重组细胞系。
上述融合蛋白的编码基因为如下C1-C4中任一种:
C1:B1)中,所述FSH融合蛋白的A链的编码基因的核苷酸序列如SEQ ID No.3所示,所述FSH融合蛋白的的B链的编码基因的核苷酸序列如SEQ ID No.4所示;
C2:B2)中,所述FSH融合蛋白的A链编码基因的核苷酸序列如SEQ ID No.9所示,中,所述FSH融合蛋白的的B链编码基因的核苷酸序列如SEQ ID No.10所示;
C3:在严格条件下与C1或C2中任一限定的DNA分子杂交且编码上述融合蛋白的DNA分子;
C4:与C1或C2中任一限定的DNA分子限定的DNA序列具有75%以上同一性且编码上述融合蛋白的DNA分子。
上述核酸分子或编码基因中,同一性是指核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定核苷酸序列的同一性,如NCBI主页网站的BLAST网页。例如,可在高级BLAST2.1中,通过使用blastp作为程序,将Expect值设置为10,将所有Filter设置为OFF,使用BLOSUM62作为Matrix,将Gap existence cost,Per residue gap cost和Lambdaratio分别设置为11,1和0.85(缺省值),检索一对核苷酸序列的同一性,进行计算,然后即可获得同一性的值(%)。
上述核酸分子或编码基因中,所述90%以上的同一性可为至少91%、92%、95%、96%、98%、99%或100%的同一性。
在本发明的具体实施方式中,所述重组表达质粒pCGS3-SP1-FSH-Fc为将SEQ IDNo.9所示DNA片段插入到pCGS3载体的多克隆位点(如HindIII和XhoI),且将SEQ ID No.10所示DNA片段插入到pCGS3载体的多克隆位点(如BstBI和PacI)后得到的重组表达质粒。
其中,所述表达盒是指能够在宿主细胞中表达前文第一方面中所述融合蛋白的DNA,该DNA不仅包括启动目的基因转录的启动子,还可包括终止目的基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
其中,所述宿主细胞为真核宿主细胞。
进一步地,所述真核宿主细胞可为HEK293细胞,CHO细胞,酵母细胞和昆虫细胞等,在本发明的具体实施方式中,所述宿主细胞具体为Expi293F细胞。
上述生物材料在如下A1)-A3)中任一种中的应用也是本发明保护的范围:
A1)制备FSH蛋白或其融合蛋白;
A2)提高FSH蛋白或其融合蛋白的表达量或产量;
A3)促进FSH蛋白或其融合蛋白分泌到宿主细胞外。
本发明还有一个目的是提供一种制备FSH蛋白的方法。
本发明提供的方法,包括如下步骤:使上述融合蛋白的编码基因在宿主菌或宿主细胞中进行表达,得到FSH蛋白。
上述方法包括如下步骤:
1)将上述融合蛋白中的A链和B链的编码基因导入宿主菌,得到重组菌;
2)培养所述重组菌,得到FSH蛋白。
上述融合蛋白中的A链和B链的编码基因通过重组质粒pCGS3-SP1-FSH-Fc导入宿主菌;
在本发明的具体实施方式中,所述宿主细胞具体为Expi293F细胞。
上述步骤2)中,所述培养为培养至细胞活率降至65%~75%时终止培养。
在步骤2)后,还包括步骤3):从培养后的培养产物的上清中获得FSH-Fc融合蛋白:收集培养物于3500g离心30min,收集上清进行超滤浓缩、Protein A 4FF填料亲和层析和超滤置换。
SP1信号肽或与其相关的生物材料在如下A1)-A3)中任一种中的应用也是本发明保护的范围:
A1)制备FSH蛋白或其融合蛋白;
A2)提高FSH蛋白或其融合蛋白的表达量或产量;
A3)促进FSH蛋白或其融合蛋白分泌到宿主细胞外;
所述SP1信号肽的氨基酸序列如SEQ ID No.5所示。
上述FSH蛋白由FSH的的链和FSH的β链非共价结合而成;
上述应用中,所述FSH融合蛋白,其A链为FSH的α链,其B链为连接标签的FSH的β链;上述标签可以为Fc、HSA、CTP或XTEN中任一或者任2种组合,优选标签为Fc标签。
上述连接标签的FSH的β链为在FSH的β链的C端连接标签。
上述应用中,所述与SP1信号肽相关的生物材料为所述SP1信号肽的编码基因或含有所述编码基因的表达盒、重组载体、重组菌或重组细胞系。
本发明设计一种FSH-Fc融合蛋白,用于长效FSH的候选分子,并在此基础上进行信号肽优化实验。研究发现人工改造信号肽SP1(SEQ ID No.5)引导FSH-Fc融合蛋白真核细胞分泌表达。但是信号肽SP1并非对所有蛋白都可以提高分泌表达(本实验室积累的不同蛋白表达经验表明,如SP1引导的CD19蛋白表达量极低)。因此,人工改造信号肽SP1对于引导FSH-Fc融合蛋白真核细胞分泌表达量显著优于抗体轻链信号肽SP2和荧光素酶信号肽SP3,更适用于大规模工业化生产,降低生产成本。
附图说明
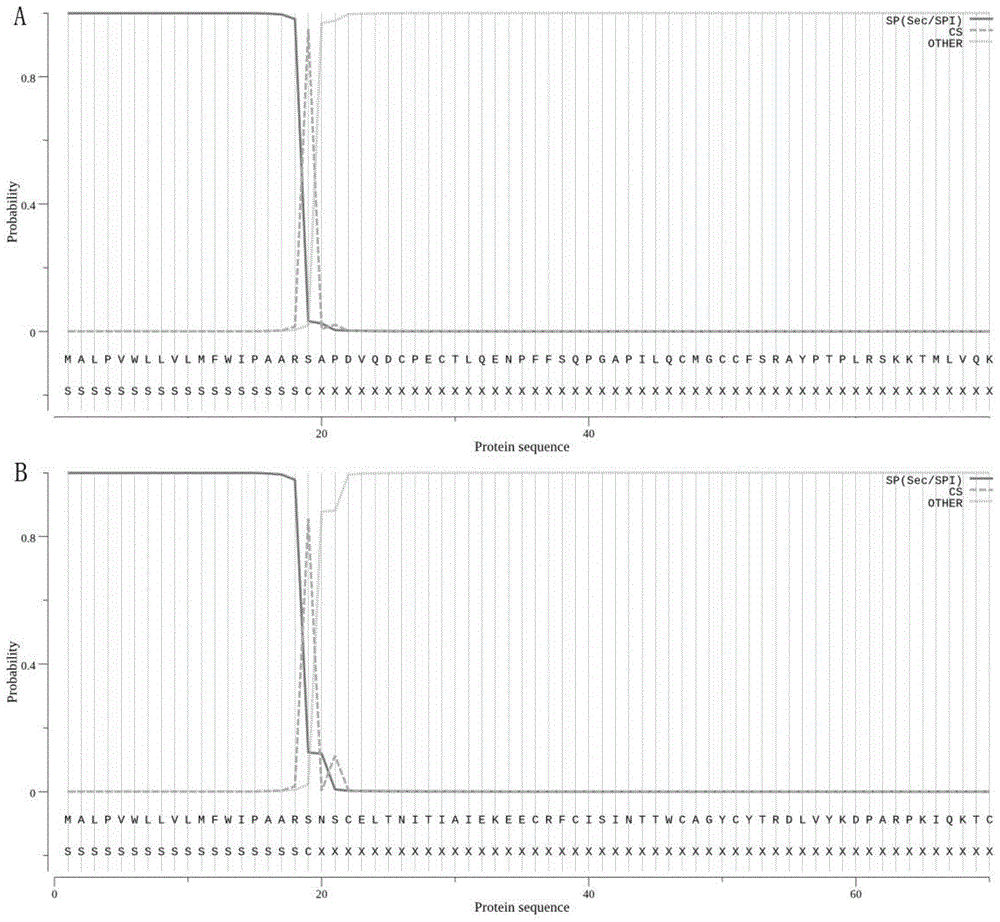
图1为人工改造信号肽SP1分泌表达预测图。SP(Sec/SPI)为预测为信号肽概率,CS为预测信号肽酶酶切位点,OTHERS代表非信号肽的概率。纵坐标为氨基酸序列为预测结构的概率,横坐标为蛋白质氨基酸序列。其中,A为FSH-Fc融合蛋白A链预测图,其中,B为FSH-Fc融合蛋白B链预测图。
图2为FSH-Fc融合蛋白重组表达质粒构建酶切鉴定图。其中A链采用HindIII和XhoI酶切,B链采用BstBI和PacI酶切,1为pCGS3-SP1-FSH-Fc(人工改造信号肽SP1表达质粒),2为pCGS3-SP2-FSH-Fc(抗体轻链信号肽SP2表达质粒),3为pCGS3-SP3-FSH-Fc(荧光素酶信号肽SP3表达质粒)。
图3为FSH-Fc融合蛋白细胞分泌上清非还原SDS-PAGE鉴定图。其中,1为pCGS3-SP1-FSH-Fc/293,2为pCGS3-SP2-FSH-Fc/293,3为pCGS3-SP3-FSH-Fc/293,4为无质粒转染的阴性对照组。
图4为FSH-Fc融合蛋白细胞分泌上清灰度分析图。其中,箭头指示峰为FSH-Fc融合蛋白峰(与阴性背景蛋白条带重合),A为pCGS3-SP1-FSH-Fc/293,B为pCGS3-SP2-FSH-Fc/293,C为pCGS3-SP3-FSH-Fc/293,D为无质粒转染的阴性对照组。
图5为FSH-Fc融合蛋白纯化SDS-PAGE纯化鉴定。其中,NR为非还原SDS-PAGE,R为还原SDS-PAGE,1为SP1-FSH-Fc,2为SP2-FSH-Fc,3为SP3-FSH-Fc。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的主要试剂及其厂家信息如下:
pCGS3表达载体:Merck公司;
HindIII:NEB公司;
XhoI:NEB公司;
BstBI:NEB公司;
PacI:NEB公司;
GXL Premix:TAKARA公司;
DNA Ligation Kit Ver.2.1:TAKARA公司;
Expi293F
Expi293
ExpiFectamine
Opti-MEM
PageRuler
Protein A 4FF填料纯化试剂盒:生工生物工程(上海)股份有限公司;
Amicon Ultra-15离心过滤装置:Millipore公司;
Amicon Ultra-0.5离心过滤装置:Millipore公司;
PBS pH7.4(1×):Gibco公司;
凝胶成像系统:Protein Simple公司;
细胞计数仪:Roche公司;
超净工作台:苏州安泰空气技术有限公司;
电热恒温水浴锅:Fisher Scientific公司;
CO
HYG-A全恒温摇瓶柜:太仓市实验设备厂;
DYY-6C型电泳仪:北京市六一仪器厂;
DYCP-31DN型水平电泳槽:北京市六一仪器厂;
微量移液器:Eppendorf公司。
实施例1、信号肽预测
采用SignalP-5.0在线软件预测人工改造信号肽SP1效率:SP1-FSH-Fc融合蛋白的A链氨基酸序列(SEQ ID No.7)和B链氨基酸序列(SEQ ID No.8)分别输入网址https://services.healthtech.dtu.dk/service.php?SignalP-5.0,选择真核生物,提交服务器预测SP1信号肽酶切位置。预测结果如图1所示,FSH-Fc的A链和B链SP1信号肽结构概率均为99.95%,信号肽酶酶切概率分别为94.97%和85.57%,酶切位点位于第19和20位氨基酸之间符合预期。
综上所述,信号肽SP1酶切效率高,有利于FSH-Fc融合蛋白分泌表达(图1)。
信号肽SP1的氨基酸序列为SEQ ID No.5,其编码基因的核苷酸序列为SEQ IDNo.6。
实施例2、重组表达质粒构建
一、SP1-FSH-Fc基因合成
委托百力格生物对SP1-FSH-Fc(SP1信号肽融合FSH-Fc)融合蛋白的A链(SEQ IDNo.7)和B链(SEQ ID No.8)密码子优化,优化的A链和B链核苷酸序列分别为SEQ ID No.9和SEQ ID No.10,交付克隆质粒分别记为pUC57-SP1-FSHA和pUC57-SP1-FSHB-Fc。
二、SP2-FSH-Fc片段扩增
采用上述一合成的pUC57-SP1-FSHA和pUC57-SP1-FSHB-Fc为模板分别扩增SP2-FSH-Fc的A链核苷酸序列(SP2-FSHA,SEQ ID No.11)和SP2-FSHB-Fc的B链核苷酸序列(SEQID No.12)。具体如下:
pUC57-SP1-FSHA为模板,引物1和引物5第一轮扩增获得片段1;片段1为模板,引物3和引物5第二轮扩增获得片段2;片段2即为SP2-FSHA目标片段(记作SP2-FSH-Fc的A链)。
pUC57-SP1-FSHB-Fc为模板,引物2和引物6第一轮扩增获得片段3;片段3为模板,引物4和引物6第二轮扩增获得片段4;片段4即为SP2-FSHB-Fc目标片段(记作SP2-FSH-Fc的B链)。
上述PCR扩增使用引物序列如下:
引物1:5’-CTGGGCCTGCTGCTGCTGTGGCTGACCGACGCCAGATGCGCCCCCGACGTGCAGGACTG-3’;
引物2:5’-TGGGCCTGCTGCTGCTGTGGCTGACCGACGCCAGATGCAACAGCTGCGAGCTGACCAAC-3’;
引物3:5’-CCCAAGCTTGCCGCCACCATGAGCGTGCCAACCCAGGTGCTGGGCCTGCTGCTGCT-3’;
引物4:5’-ACGAAGTTCGAAGCCGCCACCATGAGCGTGCCAACCCAGGTGCTGGGCCTGCTGCTGCT-3’;
引物5:5’-CCCGCTCGAGTTAGCTCTTGTGGTAGTAGCAGGTG-3’;
引物6:5’-CCTTAATTAATTAGCCGGGGCTCAGGCTCAGG-3’。
三、SP3-FSH-Fc片段扩增
采用上述二合成的pUC57-SP1-FSHA和pUC57-SP1-FSHB-Fc为模板分别扩增SP3-FSH-Fc的A链核苷酸序列(SP3-FSHA,SEQ ID No.13)和B链核苷酸序列(SP3-FSHB-Fc,SEQID No.14)。具体如下:
pUC57-SP1-FSHA为模板,引物5和引物7第一轮扩增获得片段5;片段5为模板,引物5和引物9第二轮扩增获得片段6;片段6即为SP3-FSHA目标片段(记作SP3-FSH-Fc的A链)。
pUC57-SP1-FSHB-Fc为模板,引物6和引物8第一轮扩增获得片段7;片段7为模板,引物6和引物10第二轮扩增获得片段8;片段8即为SP3-FSHB-Fc目标片段(记作SP3-FSH-Fc的B链)。
上述PCR扩增使用引物序列如下:
引物5:5’-CCCGCTCGAGTTAGCTCTTGTGGTAGTAGCAGGTG-3’;
引物6:5’-CCTTAATTAATTAGCCGGGGCTCAGGCTCAGG-3’;
引物7:5’-GTTTGCTCTGATTTGTATTGCCGTGGCTGAGGCCGCCCCCGACGTGCAGGACTG-3’;
引物8:5’-GTGTTGTTTGCTCTGATTTGTATTGCCGTGGCTGAGGCCAACAGCTGCGAGCTG-3’;
引物9:5’-CCCAAGCTTGCCGCCACCATGGGGGTGAAGGTGTTGTTTGCTCTGATTTGTATTGC-3’;
引物10:5’-ACGAAGTTCGAAGCCGCCACCATGGGGGTGAAGGTGTTGTTTGCTCTGATTTGTATTGC-3’。
四、FSH-Fc融合蛋白重组表达质粒构建
上述一、上述二和上述三基因合成或PCR扩增的融合不同连接肽的FSH-Fc的A链:SP1-FSH-Fc的A链、SP2-FSH-Fc的A链、SP3-FSH-Fc的A链以及pCGS3经HindIII和XhoI双酶切,DNA连接试剂盒(TAKARA)克隆至pCGS3表达载体,分别命名为pCGS3-SP1-FSHA,pCGS3-SP2-FSHA,pCGS3-SP3-FSHA中间载体。
上述一、上述二和上述三基因合成或PCR扩增的融合不同连接肽的FSH-Fc的B链:SP1-FSH-Fc的B链、SP2-FSH-Fc的B链、SP3-FSH-Fc的B链以及上文构建的pCGS3-SP1-FSHA,pCGS3-SP2-FSHA,pCGS3-SP3-FSHA中间载体经BstBI和PacI双酶切,DNA连接试剂盒(TAKARA)克隆至三个中间载体,分别命名为pCGS3-SP1-FSH1-Fc,pCGS3-SP2-FSH1-Fc,pCGS3-SP3-FSH1-Fc重组表达质粒。
所得三种重组表达质粒的酶切鉴定结果如图2所示,由图可见,1为pCGS3-SP1-FSH-Fc,2为pCGS3-SP2-FSH-Fc,3为pCGS3-SP3-FSH-Fc,酶切条带大小符合预期。
重组表达质粒pCGS3-SP1-FSH-Fc的结构描述:在pCGS3载体的酶切位点HindIII和XhoI之间插入SEQ ID No.9所示DNA片段,其中SEQ ID No.9的第1-6位为HindIII酶切位点,7-15为Kozak序列,16-72为天然SP1信号肽的编码基因,第73-348位为FSH-Fc的A链编码基因(仅有FSH的α链编码基因),349-351为终止密码子,352-357为XhoI酶切位点;且在pCGS3载体的酶切位点BstBI和PacI之间插入SEQ ID No.10所示DNA片段,其中SEQ ID No.10的第1-6位为BstBI酶切位点,7-15为Kozak序列,16-72为天然SP1信号肽的编码基因,第73-1083位为FSH-Fc的B链编码基因(第73-405为FSH的β链,第406-1083为Fc结构),1084-1086为终止密码子,1087-1094为PacI酶切位点。
SEQ ID No.9编码SEQ ID No.7所示SP1-FSH-Fc蛋白质的A链。SEQ ID No.7的第1-19位为SP1信号肽,第20-111位为FSH-Fc的A链;SEQ ID No.10编码SEQ ID No.8所示SP1-FSH-Fc蛋白质的B链。SEQ ID No.8的第1-19位为SP1信号肽,第20-356位为FSH-Fc的B链(第20-130为FSH的β链,第131-356为Fc结构)。
重组表达质粒pCGS3-SP2-FSH-Fc的结构描述:在pCGS3载体的酶切位点HindIII和XhoI之间插入SEQ ID No.11所示DNA片段,其中SEQ ID No.11的第1-6位为HindIII酶切位点,7-15为Kozak序列,16-75为天然SP2信号肽的编码基因,第76-351位为FSH-Fc的A链编码基因(仅有FSH的α链编码基因),352-354为终止密码子,355-360为XhoI酶切位点;在pCGS3载体的酶切位点BstBI和PacI之间插入SEQ ID No.12所示DNA片段,其中SEQ ID No.12的第1-6位为BstBI酶切位点,7-15为Kozak序列,16-75为天然SP2信号肽的编码基因,第76-1086位为FSH-Fc的B链编码基因(第76-408为FSH的β链,第409-1086为Fc结构),1087-1089为终止密码子,1090-1097为PacI酶切位点。
重组表达质粒pCGS3-SP3-FSH-Fc的结构描述:在pCGS3载体的酶切位点HindIII和XhoI之间插入SEQ ID No.13所示DNA片段,其中SEQ ID No.13的第1-6位为HindIII酶切位点,7-15为Kozak序列,16-66为天然SP3信号肽的编码基因,第67-342位为FSH-Fc的A链编码基因(仅有FSH的α链编码基因),343-345为终止密码子,346-351为XhoI酶切位点;在pCGS3载体的酶切位点BstBI和PacI之间插入SEQ ID No.14所示DNA片段,其中SEQ ID No.14的第1-6位为BstBI酶切位点,7-15为Kozak序列,16-66为天然SP3信号肽的编码基因,第67-1077位为FSH-Fc的B链编码基因(第67-399为FSH的β链,第400-1077为Fc结构),1078-1080为终止密码子,1081-1088为PacI酶切位点。
上述重组表达质粒pCGS3-SP1-FSH-Fc、pCGS3-SP2-FSH-Fc和pCGS3-SP3-FSH-Fc分别表达融合蛋白SP1-FSH-Fc、融合蛋白SP2-FSH-Fc、融合蛋白SP3-FSH-Fc,这些融合蛋白分泌到细胞外,均为融合蛋白FSH-Fc。
融合蛋白FSH-Fc的A链的氨基酸序列为SEQ ID No.1,FSH-Fc的B链的氨基酸序列为SEQ ID No.2;FSH-Fc的A链的编码基因的核苷酸序列为SEQ ID No.3,FSH-Fc的B链的编码基因的核苷酸序列为SEQ ID No.4。
实施例3、FSH-Fc融合蛋白表达
一、宿主细胞
从液氮罐中取宿主细胞Expi293F的种子库细胞,于37℃水浴迅速解冻,将解冻后的细胞悬液无菌转移至装有30ml预热的完全生长培养基的125ml药瓶中,摇床培养条件:37℃,8%CO
待细胞活率恢复90%以上,细胞密度达5×10
二、细胞转染
将实施例2构建的pCGS3-SP1-FSH-Fc,pCGS3-SP2-FSH-Fc和pCGS3-SP3-FSH-Fc分别转染宿主细胞。
1、转染前一天
转染前24h将细胞以3×10
2、转染当天
(1)细胞密度应达到5.5×10
(2)准备转染试剂和DNA复合物
1)DNA稀释
用无菌水将质粒(实施例2构建的pCGS3-SP1-FSH-Fc,pCGS3-SP2-FSH-Fc或pCGS3-SP3-FSH-Fc)稀释至1μg/μl,按照1ml细胞转染1μg质粒的量,取转染50ml细胞所需质粒的量,即50μl质粒加入3ml Opti-MEM
2)转染试剂稀释
使用前将转染试剂ExpiFectamine293
3)将稀释好的转染试剂加入质粒中轻轻上下颠倒混匀,室温反应20min。将混合好的转染试剂和DNA复合物缓慢加入细胞培养物中。37℃,8%CO
3、转染后第一天
在转染后22h,按照转染50ml细胞的量添加增强剂。即,取300μlExpiFectamine
4、培养上清收集
转染后每天监测细胞活率,当活率降至65%-75%时终止培养4天。收集培养物于3500g离心30min收集上清,名称分别记为pCGS3-SP1-FSH-Fc/293(含有信号肽SP1分泌表达的FSH-Fc融合蛋白),pCGS3-SP2-FSH-Fc/293(含有信号肽SP2分泌表达的FSH-Fc融合蛋白)和pCGS3-SP3-FSH-Fc/293(含有荧光素酶信号肽SP3分泌表达的FSH-Fc融合蛋白)。
将上述上清液进行SDS-PAGE鉴定及灰度分析。
SDS蛋白电泳图灰度分析采用Image J软件。操作步骤为Image→Type→32-Bit转化为灰度图;Process→Subtract Background→OK去除背景色;矩形工具选择泳道→Analyze→Gel→Select First Lane确定分析泳道,重复选择多条泳道同时分析;Analyze→Gel→Plot Lane生成峰面积;线性工具选择目标条带对应峰图,Wand工具计算对应峰图面积,即可获得目的蛋白表达量占总蛋白比例。
结果如图3和图4所示,可以看出,信号肽SP1分泌表达的FSH-Fc融合蛋白的表达量比轻链信号肽SP2和荧光素酶信号肽SP3分别增加6.04倍和2.58倍。
综上可知:与轻链信号肽SP2和荧光素酶信号肽SP3相比,本发明的人工信号肽SP1具有更高的FSH-Fc融合蛋白的分泌表达量产量。
实施例4、蛋白纯化
一、超滤浓缩
收样上清(即实施例3步骤4中“收集培养物于3500g离心30min”后所得上清):pCGS3-SP1-FSH-Fc/293(含有信号肽SP1分泌表达的FSH-Fc融合蛋白),pCGS3-SP2-FSH-Fc/293(含有信号肽SP2分泌表达的FSH-Fc融合蛋白)和pCGS3-SP3-FSH-Fc/293(含有荧光素酶信号肽SP3分泌表达的FSH-Fc融合蛋白),进行4℃,Amicon Ultra-15离心过滤装置(Millipore公司)6000g离心20min超滤浓缩,最终细胞上清浓缩至20至30ml。
二、亲和层析
步骤一获得的超滤浓缩上清用Protein A 4FF填料纯化试剂盒(生工)纯化。上清和Binding/Wash Buffer按照体积比1:1混匀,静置20min充分孵育。两倍柱体积的Binding/Wash Buffer平衡柱子,缓冲液依靠重力流穿预装柱。将超滤浓缩上清和Binding/WashBuffer混匀液加入柱子依靠重力流穿预装柱;如有剩余样品可再次上样,重新流通一次,收集流穿液到离心管中。两倍柱体积的Binding/wash buffer清洗柱子并收集流穿液,直到流穿液的吸光度280nm接近基线。两倍柱体积的Elution Buffer洗脱柱上的组氨酸标签蛋白,重复此步骤直到流穿液的吸光度280nm接近基线,收集洗脱液待纯化,得到镍柱纯化后的蛋白溶液。
三、超滤置换
镍柱纯化后的蛋白溶液加Amicon Ultra-15离心过滤装置(Millipore公司),分批10000g离心3min,直至溶液剩余约150μl。轻轻加入300μlPBS缓冲液(1×,pH7.4),10000g离心至剩余150μl,重复三次。PBS缓冲液(1×,pH7.4)洗脱超滤管收样,最终体积约2ml,得到纯合的蛋白,记作SP1-FSH-Fc、SP2-FSH-Fc和SP3-FSH-Fc。
留样5μl用于蛋白浓度测定和SDS-PAGE蛋白电泳检测。
结果如图5所示,SP1,SP2和SP3三种信号肽产物SDS-PAGE检测纯化样品纯度均大于90%,纯化后蛋白产品产量分别为18.3mg/L,11.74mg/L和9.06mg/L,与实施例3中灰度分析产量基本吻合吻合。
综合以上各实施例结果,本发明设计的FSH-Fc融合蛋白,并在此基础上进行信号肽优化实验。研究发现人工改造信号肽SP1(SEQ ID No.5)引导FSH-Fc融合蛋白真核细胞分泌表达。进一步的证实:人工改造信号肽SP1分泌表达量显著优于抗体轻链信号肽SP2和荧光素酶信号肽SP3,更适用于大规模工业化生产,降低生产成本。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
- 一种PLG和CRD功能片段重组融合蛋白及其制备方法和抗癌药物
- 一种重组马绒毛膜促性腺激素融合蛋白及其制备方法和其应用
- 一种重组人IL-21蛋白及其制备和应用
- 一种重组人凝血因子Ⅷ-Fc融合蛋白及制备方法
- 表达重组人肿瘤坏死因子受体-Fc融合蛋白基因的家蚕重组杆状病毒及其制备方法和应用
