制备BCL11A红系增强子纯合突变的基因工程多能干细胞的方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于基因编辑领域,具体涉及一种体外制备BCL11A红系增强子纯合突变的基因工程多能干细胞的方法、所得BCL11A红系增强子纯合突变的基因工程多能干细胞和如SEQ ID NO:5所示的sgRNA在制备BCL11A红系增强子纯合突变的基因工程多能干细胞中的应用。
背景技术
地中海贫血是由基因缺陷导致的溶血性贫血类疾病。由于基因突变导致血红蛋白功能异常,目前并没有有效的根治手段。而CRISPR基因编辑技术的发展给此类基因遗传类疾病带来了希望。目前有众多的研究表明,通过敲除患者造血细胞的BCL11A的增强子可以重新开启胎红蛋白的表达来弥补由于血红蛋白异常导致的贫血疾病,从而实现此类溶血性贫血疾病的治疗甚至治愈(Liu N,Hargreaves V V,Zhu Q,et al.Direct PromoterRepression by BCL11A Controls the Fetal to Adult Hemoglobin Switch[J].Cell,2018,173(2):430-442.;Martyn G E,Wienert B,Yang L,et al.Natural regulatorymutations elevate the fetal globin gene via disruption of BCL11A orZBTB7Abinding[J].Nature Genetics,2018,50(4):498-503.)。目前已有较多的研究利用CRISPR/Cas9技术对BCL11A增强子进行基因敲除。而基因敲除效率是基因治疗中较为关键的因素。影响基因编辑效率的因素也有很多,包括sgRNA序列,Cas蛋白种类以及转染效率等。不同的实验室具有不同的sgRNA和基因敲除效率效率(CRISPR_CAS9技术抑制B_NA结合区域sgRNAs文库构建,李頔;Wu Y,Zeng J,Roscoe B P,et al.Highly efficienttherapeutic gene editing of human hematopoietic stem cells[J].NatureMedicine,2019,25(5):776-783.;高飏,CRISPR/Cas9编辑CD34+造血干细胞BCL11A基因提升HbF表达,2017,解放军军事医学科学院;中国人民解放军军事医学科学院.)。
目前治疗该疾病的基因编辑治疗思路主要有2种。第一种是利用CRISPR/Cas9技术通过对患者携带突变的基因进行基因修复,从而实现疾病治疗。这种方案具有最佳治疗效果,但实验周期长,属于个体化的精准治疗,并且治疗费用高昂。而第二种方案是利用CRISPR/Cas9技术通过对患者BCL11A红系增强子进行基因敲除,降低BCL11A基因的表达,重新开启血红蛋白的表达,弥补血红蛋白的功能异常,从而实现患者疾病的改善甚至是治愈。该方案可以治疗不同基因突变类型,但都是由于血红蛋白功能异常导致的溶血性贫血疾病。治疗的患者类型更广泛,更具有低成本和短治疗周期,适合产业化等特点。目前已有较多对成体造血细胞进行BCL11A的基因进行敲除的研究报道,但实现成体造血细胞的高转染效率,高基因编辑效率和基因编辑后高的细胞活性依然比较困难。大多数实验室难以实现较高的BCL11A红系增强子敲除效率。
日本的山中伸弥(ShinyaYamanaka)于2006年利用病毒载体将四个转录因子的组合转入分化的体细胞中,使其重编程而得到的类似胚胎干细胞的一种细胞类型,称为诱导性多能干细胞。YoungGie Chung(郑永基)等人在2014年实现世界上首次利用35岁和75岁成年人的体细胞建立自体全能干细胞系。他们丰富了获得人体多能干细胞来源方法,多能干细胞建系的成功为多种目前无药可治的疾病带来了希望。
发明内容
针对现有技术中尚未有针对多能干细胞中BCL11A基因的58号增强子进行基因敲除的缺陷,本发明提供了具有较高的基因敲除效率的体外制备BCL11A红系增强子纯合突变的基因工程多能干细胞的方法、由所述方法制备的基因工程多能干细胞以及如SEQ ID NO:5所示的sgRNA制备BCL11A红系增强子纯合突变的基因工程多能干细胞中的应用。所述应用可以高效制备BCL11A红系增强子纯合突变的多能干细胞,进一步可对所述基因工程多能干细胞进行终末红细胞的分化,进而得到BCL11A红系增强子纯合突变的红细胞,该红细胞与成体来源的红细胞相似,目前成体来源的终末分化红细胞经过BCL11A红系增强子纯合突变后,其具有高胎红蛋白表达,并可用于治疗β地中海贫血(Liu N,Hargreaves V V,Zhu Q,etal.Direct Promoter Repression by BCL11A Controls the Fetal to AdultHemoglobin Switch[J].Cell,2018,173(2):430-442.;Martyn G E,Wienert B,Yang L,etal.Natural regulatory mutations elevate the fetal globin gene via disruptionof BCL11A or ZBTB7Abinding[J].Nature Genetics,2018,50(4):498-503.)。
本发明的构思是设计或选择一个特异靶向BCL11A红系增强子的sgRNA序列,对患者的多能干细胞进行BCL11A红系增强子进行敲除,然后对多能干细胞分离单克隆培养,挑选单克隆测序验证每个单克隆突变情况以及计算总体的基因敲除效率。筛选出纯合突变的单克隆,然后分化成造血干细胞或造血祖细胞,用于此类贫血患者的细胞移植替代治疗。
本发明人经过创造性的劳动,在多能干细胞实现约67%基因编辑效率。由于多能干细胞具有无限扩增能力,基于得到的发生基因编辑的基因工程多能干细胞,可以扩增出100%编辑的克隆系,最终可实现后代细胞100%为敲除BCL11A红系增强子的多能干细胞,与传统的成体造血细胞的BCL11A红系增强子敲除相比,这是其他成体干细胞基因编辑无法实现和突破的,具有显著的治疗优势。
本发明的一方面提供了一种体外制备BCL11A红系增强子纯合突变的基因工程多能干细胞的方法,所述方法利用CRISPR/Cas9技术对多能干细胞进行基因编辑,得到所述基因工程多能干细胞;
所述CRISPR/Cas9技术中的sgRNA序列如SEQ ID NO:5所示。
本发明所述的多能干细胞指具有分化潜力的干细胞,例如核移植的全能干细胞、胚胎干细胞系和诱导性多能干细胞(iPSC)。
在本发明一具体实施方案中,所述诱导性多能干细胞诱导自皮肤细胞,例如皮肤成纤维细胞。
本发明中,所述基因编辑的靶点为所述多能干细胞的BCL11A基因的58号增强子。
较佳地,本发明所述的58号增强子靶核苷酸序列与SEQ ID NO:5所示序列互补。
更佳地,所述靶点的序列包括如SEQ ID NO:12所示的核苷酸序列。
SEQ ID NO:12所示的核苷酸序列如下:
ACAGGACTTGGGAGTTATCTGTAGTGAGATGGCTGAAAAGCGATACAGGGCTGGCTCTATGCCCCAGGTGTGCATAAGTAAGAGCAGATAGCTGATTCCAGTGCAAAGTCCATACAGGTAATAACATAGGCCAGAAAAGAGATATGGCATCTACTCTTAGACATAACACACCAGGGTCAATACAACTTTGAAGCTAGTCTAGTGCAAGCTAACAGTTGCTTTTATCACAGGCTCCAGGAAGGGTTTGGCCTCTGATTAGGGTGGGGGCGTGGGTGGGGTAGAAGAGGACTGGCAGACCTCTCCATCGGTGGCCGTTTGCCCAGGGGGGCCTCTTTCGGAAGGCTCTCTTGGTGATGGAGAATTGGATTTTATTTCTCAATGGGAATGAAATAATTTGTATGCCATGCCGTGTGGACTCCCAAAATTGT。
较佳地,所述CRISPR/Cas9技术中,将所述sgRNA与Cas9蛋白共同导入所述多能干细胞中。更佳地,所述导入为电穿孔转染,所述电穿孔转染的条件为1000-1200V,30ms-40ms。
本发明的另一方面提供了一种BCL11A红系增强子纯合突变的基因工程多能干细胞,所述基因工程多能干细胞中第2号染色体的智人BAF染色质重塑复合亚基BCL11A(序列ID:NG_011968.1,长度:109332bp)基因组第63037位至第63226位区域通过基因编辑被破坏,其中,所述基因编辑为CRISPR/Cas9技术,所述BCL11A基因组靶核苷酸序列与SEQ IDNO:5序列互补。
本发明的另一方面提供了一种如本发明所述的基因工程多能干细胞在制备预防或治疗受试者疾病中的药物中的用途。
较佳地,所述疾病为需要大量输血进行预防或治疗的疾病,所述需要大量输血进行预防或治疗的疾病包括胎红蛋白异常相关的贫血性疾病、失血性疾病和肿瘤。
更佳地,所述需要大量输血进行预防或治疗的疾病为β-地中海贫血或镰刀形红细胞贫血。
本发明的另一方面提供了如SEQ ID NO:5所示的sgRNA在制备BCL11A红系增强子纯合突变的基因工程多能干细胞中的应用。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:
本发明提供的体外制备BCL11A红系增强子纯合突变的基因工程多能干细胞的方法使用的sgRNA序列具有较高的基因敲除效率(例如在多能干细胞中基因敲除效率可以达到67%),该序列可以特异性的对BCL11A基因的增强子序列基因敲除。所得的BCL11A红系增强子纯合突变的基因工程多能干细胞可以用于制备预防或治疗受试者疾病(例如β-地中海贫血或镰刀形红细胞贫血)的药物。
附图说明
图1A-图1F为各sgRNA在多能干细胞中的基因编辑测序图,其中:图1A为sgRNA42在多能干细胞中的基因编辑测序图,图1B为sgRNA2在多能干细胞中的基因编辑测序图,图1C为sgRNA11在多能干细胞中的基因编辑测序图,图1D为sgRNA14在多能干细胞中的基因编辑测序图,图1E为sgRNA16在多能干细胞中的基因编辑测序图,图1F为使用sgRNA31基因编辑后多能干细胞的BCL11A基因测序图。
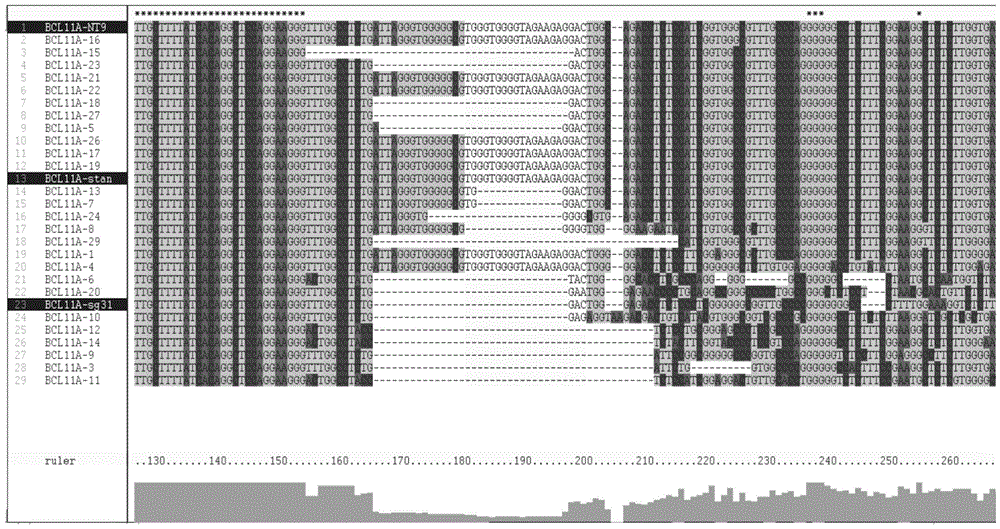
图2为基因编辑后的多能干细胞单克隆测序结果比对。
图3为各个具有基因编辑样品BCL11A-15测序峰图分析。
图4为各个具有基因编辑样品BCL11A-23测序峰图分析。
图5为各个具有基因编辑样品BCL11A-18测序峰图分析。
图6为各个具有基因编辑样品BCL11A-27测序峰图分析。
图7为各个具有基因编辑样品BCL11A-5测序峰图分析。
图8为各个具有基因编辑样品BCL11A-13测序峰图分析。
图9为各个具有基因编辑样品BCL11A-7测序峰图分析。
图10为各个具有基因编辑样品BCL11A-24测序峰图分析。
图11为各个具有基因编辑样品BCL11A-8测序峰图分析。
图12为各个具有基因编辑样品BCL11A-29测序峰图分析。
图13为各个具有基因编辑样品BCL11A-6测序峰图分析。
图14为各个具有基因编辑样品BCL11A-20测序峰图分析。
图15为各个具有基因编辑样品BCL11A-10测序峰图分析。
图16为各个具有基因编辑样品BCL11A-12测序峰图分析。
图17为各个具有基因编辑样品BCL11A-14测序峰图分析。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例中主要试剂耗材信息如表1所示。
表1实验主要试剂耗材信息
实施例1不同sgRNA在多能干细胞中的基因编辑效率的粗筛
一、实验步骤:
1.利用Precision gRNA Synthesis Kit在体外转录与纯化sgRNA
1.1.在生物公司合成制备引物,引物序列如表3所示。按照Precision gRNASynthesis Kit说明书,利用引物进行扩增sgRNA的DNA模板链。其中使用的sgRNA信息如表2所示。
表2不同的sgRNA的序列
1.2.将各sgRNA的DNA模板转录扩增得到100bp的带有各sgRNA完整序列。
1.3.利用Precision gRNA Synthesis Kit中的纯化试剂盒对扩增产物进行纯化。
2.利用电穿孔转染法将Cas9/sgRNA蛋白复合物转染到多能干细胞
2.1.将纯化后的sgRNA完整序列与Cas9蛋白进行体外孵育,参考TrueCutTM Cas9Protein V2说明书。
2.2.将孵育后的Cas9/sgRNA利用电穿孔转染技术(Neon
2.3.细胞完成电穿孔转染后,转移到细胞培养皿中,并放置细胞培养箱(37℃,5%CO
3.多能干细胞的基因组测序
3.1.从培养皿中收获基因编辑后的多能干细胞。
3.2.利用基因组提取试剂盒对细胞的基因组进行分离与纯化。
利用从生物公司合成的引物BCL+58-F和BCL+58-R(序列见表3)对基因组中的BCL11A基因位点进行扩增。引物信息如表3所示。
表3引物序列
3.3.将扩增产物利用DNA纯化试剂盒进行纯化,并将纯化后的产物送至测序公司进行基因测序。
结果如图1A-1F和表4所示:结合不同sgRNA编辑后多能干细胞的测序峰图,根据基因编辑特征性套峰的相对大小对基因编辑效率进行估测,按照低(特征性套峰与背景峰较为接近)、中(特征性套峰明显高于背景峰且明显低于主峰)、高(特征性套峰与测序主峰较为接近)三个等级对基因编辑情况进行分类。在已知的所有sgRNA组中,sgRNA31组特征性套峰与测序主峰较为接近,因此估测它具有最高的基因编辑效率。图1A-图1F为每组sgRNA的基因编辑测序峰图。
表4不同的sgRNA在多能干细胞中的基因编辑情况。
实施例2 sgRNA31在多能干细胞中的基因编辑效率的详测
1.基因编辑后的多能干细胞的单细胞克隆培养与测序
1.1.将sgRNA31基因编辑后的多能干细胞消化(消化液为Accutase,货品编号07920,品牌STEMCELL)成单个细胞悬液。
1.2.对细胞悬液进行稀释,稀释后的密度控制为1个细胞/80μL。
1.3.将稀释后的细胞悬液按照100μL/孔加入到96孔板中培养。
1.4.挑选出单个细胞生长的细胞克隆继续扩增培养,并对每个成功扩增的单细胞克隆进行提取(IPure细胞/血液/动物组织gDNA提取试剂盒,广州艾基生物技术有限公司)基因组。
1.5.对每个单细胞克隆基因组的BCL11A基因组PCR产物进行测序(由广州艾基生物公司进行测序)。
1.6.根据细胞克隆的测序的BCL11A基因结果计算得到sgRNA31的基因编辑效率。
实验结果与结论:
1.基因编辑后的混合(包含已编辑和未编辑的细胞群)多能干细胞BCL11A基因测序分析
野生型BCL11A部分序列:AGGAAGGGTTTGGCCTCTGATTAGGGTGGGGGCGTGGGTGGGGT(SEQID NO:11)。完整序列如SEQ ID NO:12所示。
SEQ ID NO:12所示的核苷酸序列如下:
ACAGGACTTGGGAGTTATCTGTAGTGAGATGGCTGAAAAGCGATACAGGGCTGGCTCTATGCCCCAGGTGTGCATAAGTAAGAGCAGATAGCTGATTCCAGTGCAAAGTCCATACAGGTAATAACATAGGCCAGAAAAGAGATATGGCATCTACTCTTAGACATAACACACCAGGGTCAATACAACTTTGAAGCTAGTCTAGTGCAAGCTAACAGTTGCTTTTATCACAGGCTCCAGGAAGGGTTTGGCCTCTGATTAGGGTGGGGGCGTGGGTGGGGTAGAAGAGGACTGGCAGACCTCTCCATCGGTGGCCGTTTGCCCAGGGGGGCCTCTTTCGGAAGGCTCTCTTGGTGATGGAGAATTGGATTTTATTTCTCAATGGGAATGAAATAATTTGTATGCCATGCCGTGTGGACTCCCAAAATTGT
从图1F中可以看出,与野生型的BCL11A基因序列相比,基因编辑后的多能干细胞的BCL11A基因出现了显著的特征性基因编辑套峰。
2.基因编辑后多能干细胞单克隆的BCL11A测序结果分析
图2中,BCL11A-NT9为未做基因编辑的正常人的多能干细胞BCL11A测序部分序列,作为对照组。BCL11A-stander为来自于NCBI官方网站公布的正常人类BCL11A基因部分序列,作为对照组。BCL11A-sg31MIX为未分离单克隆前的基因编辑后的多能干细胞的BCL11A基因部分序列。剩余组均为不同的基因编辑后的多能干细胞单克隆样品的BCL11A基因部分序列。图中阴影部分为sgRNA31靶向编辑的位置。空白的部分表示该位置不含有碱基。
从图2中可以看出,与对照组相比,绝大多数的基因编辑后的多能干细胞单克隆样品均出现了基因编辑。初步筛查具有基因编辑的疑似单克隆样品有15组,其中包括BCL11A-15、BCL11A-23、BCL11A-18、BCL11A-27、BCL11A-5、BCL11A-13、BCL11A-7、BCL11A-24、BCL11A-8、BCL11A-29、BCL11A-6、BCL11A-20、BCL11A-10、BCL11A-12和BCL11A-14。
剩余测序的单克隆样品为未发生基因编辑(6组)或属于非单克隆细胞样品(5组)。
为了从上述15组样品中获得真正的单克隆编辑样品,排除可能的单克隆细胞样品中的非单克隆细胞,结合各组的细胞峰图进行分析。
图3-17中,我们对每个细胞克隆样品的BCL11A基因测序图谱进行了分析比较,发现在上述的15个样品中,其中BCL11A-8,BCL11A-20,BCL11A-29测序峰图杂峰较多,属于非真正的单克隆样品,可能是由多个单克隆混合成的细胞样品。剩余的12个克隆均为单克隆样品,并且有8个单克隆(BCL11A-5,BCL11A-7,BCL11A-13,BCL11A-15,BCL11A-18,BCL11A-23,BCL11A-24,BCL11A-27)发生了碱基缺失且属于纯合突变。
总而言之,我们共获得了26个单克隆样品并对他们进行测序,共发现8个为非单克隆,6个单克隆样品未发生基因编辑,12个单克隆发生了基因编辑,因此该sgRNA31在多能干细胞中的基因编辑效率约为12/(26-8)=67%。
根据业内共识(例如Liu N,Hargreaves V V,Zhu Q,et al.Direct PromoterRepression by BCL11A Controls the Fetal to Adult Hemoglobin Switch[J].Cell,2018,173(2):430-442.;Martyn G E,Wienert B,Yang L,et al.Natural regulatorymutations elevate the fetal globin gene via disruption of BCL11A orZBTB7Abinding[J].Nature Genetics,2018,50(4):498-503.),所得BCL11A红系增强子纯合突变的多能干细胞分化得到的红细胞具有提高的HbF表达量。
- 一种红系特异高表达GFP的小鼠多能干细胞系及其构建方法
- 一种含有CLCN2纯合突变的白质脑病患者特异诱导多能干细胞系
- 含有NLRP7纯和突变的复发性葡萄胎患者特异性诱导多能干细胞系及构建方法
