一种癌胚抗原荧光免疫层析检测试剂盒及其制备方法
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于体外诊断免疫层析检测领域,尤其是涉及一种癌胚抗原荧光免疫层析检测试剂盒及其制备方法,具体地说是一种利用荧光免疫层析的技术原理实现定量检测人血清、血浆以及全血样本中癌胚抗原。
背景技术
癌胚抗原(CEA)是常见的恶性肿瘤相关抗原之一,是人类胚胎抗原特异性的酸性蛋白,具有调控细胞黏附作用。CEA异常表达上调是大肠癌、乳腺癌、胃癌和肺癌等许多恶性肿瘤的共同特征,因此对恶性肿瘤早期诊断、术前决策、指导治疗及复发转移判断有重要的临床应用价值。
临床检验中癌胚抗原的检测多以生化免疫比浊法酶联免疫吸附法等。由于酶联免疫吸附法检测耗时且操作复杂,已经不能满足大型医院快速定量检测的要求,该方法适合于批量检测但需要大型仪器,而免疫层析法由于检测快速且不需要大型仪器,在临床检验中占据一席之地。目前癌胚抗原免疫层析试剂也有胶体金法,检测快速但灵敏度不够、线性窄、特异性较差,无法精确的监测血液中的癌胚抗原含量的变化。
因此,亟需一种特异性高、灵敏度强的癌胚抗原试剂盒及其制备方法来解决上述问题。
发明内容
本发明为了解决现有技术灵敏度不够、线性窄、特异性较差,无法精确的监测血液中的癌胚抗原含量的变化的技术问题,提供一种特异性高、灵敏度强、标记过程简单、结果准确且稳定的癌胚抗原荧光免疫层析检测试剂盒。
本发明的第二个目的是提供癌胚抗原荧光免疫层析检测试剂盒的制备方法。
为实现上述第一个目的,本发明采用的技术方案是:
一种癌胚抗原荧光免疫层析检测试剂盒,包括试剂卡和稀释液,所述试剂卡包括PVC板以及依次设于所述PVC板上的样本垫、结合垫、NC膜和吸水纸,所述NC膜上设有检测线和质控线,所述结合垫中含有荧光微球标记的癌胚抗原抗体和荧光微球标记的羊抗鸡IgY抗体;
所述检测线上包被有癌胚抗原单克隆抗体,包被浓度为0.8-1.2mg/ml;
所述质控线上包被有鸡IgY抗体,包被浓度为0.8-1.2mg/ml。
优选的,所述标记用的荧光微球为南京微测生物科技有限公司粒径为300nm的Eu-荧光微球。
优选的,癌胚抗原标记抗体的标记量为10μg,羊抗鸡IgY标记抗体标记量为16μg。
优选的,标记抗体溶液喷量为3-5μL/cm;
包被工作液喷量为0.8-1.2μL/cm。
优选的,所述结合垫上荧光微球标记的癌胚抗原抗体中,荧光微球与癌胚抗原抗体的投料比为20:1;
所述结合垫上荧光微球标记的羊抗鸡IgY抗体中,荧光微球与羊抗鸡IgY抗体的投料比为25:2。
优选的,荧光微球标记癌胚抗原标记抗体,步骤如下:
a.取2mL离心管加入标记缓冲液MES 1mL,取混匀固含量为1%的荧光微球20μL于标记缓冲液中,再次涡旋混匀;
b.加入标记活化液100μL混匀,旋转混匀反应30min;
c.进行离心30min,离心转速为10000rpm/min,弃去上清液,加入标记缓冲液1000μL,超声;
d.加入癌胚抗原标记抗体10μg混匀,旋转混匀反应30min;
e.加入标记封闭液100μL后超声,旋转混匀反应2h;
f.离心30min,弃去上清液,加入标记保存液1mL超声;
g.将标记物移入新的10mL离心管中,吸取标记保存液4mL清洗标记所用2mL离心管,清洗后将其移入10mL离心管中,涡旋混匀。
优选的,荧光微球标记羊抗鸡IgY抗体,步骤如下:
a.取2mL离心管加入标记缓冲液MES 1mL,取混匀固含量为1%的荧光微球20μL于标记缓冲液中,再次涡旋混匀;
b.加入标记活化液100μL混匀,旋转混匀反应30min;
c.进行离心30min,离心转速为10000rpm/min,弃去上清液,加入标记缓冲液1000μL,超声;
d.加入羊抗鸡IgY抗体16μg混匀,旋转混匀反应30min;
e.加入标记封闭液100μL后超声,旋转混匀反应2h;
f.离心30min,弃去上清液,加入标记保存液1mL超声;
g.将标记物移入新的10mL离心管中,吸取标记保存液4mL清洗标记所用2mL离心管,清洗后将其移入10mL离心管中,涡旋混匀。
优选的,所述稀释液的配方为:0.01M PBS缓冲液,pH7.4。
为了实现上述第二个目的,本发明采用的技术方案是:
一种上述的癌胚抗原荧光免疫层析法测定试剂盒的制备方法,包括采用以下步骤制备试剂盒:
步骤1:在NC膜上设置检测线和质控线,将癌胚抗原单克隆抗体、鸡IgY抗体分别按0.8-1.2mg/mL浓度配制包被工作液,按0.8-1.2mg/mL包被量,用金标划线机将其划到NC膜上的检测线和质控线后干燥;
步骤2:将荧光微球标记的抗体溶液用喷金划线机按照3-5μL/cm喷量,将其喷到剪裁后的结合垫上后干燥;
步骤3:样品垫经样品垫处理液处理好后干燥;
步骤4:将上述已处理的样本垫、结合垫、NC膜和吸水纸按顺序依次贴在PVC板上,组装成试剂卡。
优选的,样品垫处理液配方由以下组分配制:抗人RBC抗体10mg、20mg阻断剂001、牛血清白蛋白10g、5mL Tween-20、0.2M pH8.0硼酸硼砂缓冲液1000mL。
本试剂盒测定的原理:采用双抗体夹心法,利用荧光免疫层析的技术原理。测试时,样本与稀释液混匀,并滴加到试剂的加样孔中,在毛细效应下进行层析,样本中的CEA抗原与荧光标记CEA抗体结合,扩散至测试区,被检测线包被的CEA单克隆抗体捕获,并形成“抗体-抗原-荧光抗体”复合物;样本中的CEA浓度与复合物荧光强度成正比,通过干式荧光免疫分析仪及设定的标准曲线,将荧光信号值转换成样本中CEA浓度。
本发明相对于现有技术,有以下优点:
1、本申请提供一种癌胚抗原荧光免疫层析法测定试剂盒,以癌胚抗原单克隆抗体和鸡IgY抗体分别作为检测线和质控线上包被用抗体,癌胚抗原抗体和羊抗鸡IgY混合作为荧光微球标记抗体,采用的荧光免疫层析法,与目前常见的检测癌胚抗原的方法如,酶联免疫法/免疫增强比浊法/胶体金法相比,不仅大大缩短了检测时间、降低检测成本,还提高了检测灵敏度,与同类方法比较,具有标记过程简单、灵敏度高、结果准确且稳定等优点。
2、本申请提供的一种癌胚抗原荧光免疫层析检测试剂盒的制备方法,通过选定合适原料、合理设计各材料用量、选取最适反应条件,制备工艺简单,制备得到产品标记过程简单、灵敏度高、结果准确且稳定,检测成本低,产品使用简便,成本低廉,适合推广。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍。
图1本申请中不同T线、C线标记抗体投料组合梯度比结果;
图2本申请中不同T线、C线包被浓度组合梯度比结果;
图3本申请中100ul在不同时间测试的T/C结果;
图4本申请实施例中试剂卡的结构示意图。
具体实施方式
下面结合具体实施方式说明本发明的具体技术方案:
实施例1:
一种癌胚抗原荧光免疫层析法测定试剂盒,包括试剂卡和稀释液,所述试剂卡包括PVC板以及依次设于所述PVC板上的样本垫、结合垫、NC膜和吸水纸,所述NC膜上设有检测线和质控线;
检测线上包被有癌胚抗原单克隆抗体,包被浓度为0.8-1.2mg/ml;
质控线上包被有鸡IgY抗体,包被浓度为0.8-1.2mg/ml;
结合垫上喷涂有荧光微球标记的抗体溶液,荧光微球标记的抗体溶液具体为含有荧光微球标记的癌胚抗原抗体和荧光微球标记的羊抗鸡IgY抗体混合。
实施例2:
一种癌胚抗原(CEA)荧光免疫层析测定试剂盒的制备方法,包括采用以下步骤制备试剂卡:
步骤1:在NC膜上设置T和C线,将癌胚抗原包被抗体、鸡IgY包被抗体分别按1.0mg/mL浓度配制包被工作液,按1.0μL/cm包被量,用金标划线机将其划到NC膜上,将NC膜放置在湿度≤30%,(37±2)℃电热鼓风干燥箱中干燥(16~24h);
步骤2:将复溶好的荧光微球标记抗体溶液用喷金划线机按照5μL/cm喷量,将其喷到剪裁后的结合垫上,在湿度≤30%,(37±2)℃环境下干燥(16~24h);
步骤3:设置浸纸压垫机轮轴高度,倒入样品垫处理液,处理好的样品垫放置于晾架上湿度≤30%,(37±2)℃环境下干燥过夜(16~24h);
步骤4:如图1将上述已处理的样本垫、结合垫、NC膜和吸水纸按顺序依次贴在PVC粘性底板上,NC膜在最底,每个组分间需重叠约2mm及以上进行组装,将制备的实验材料组装成试剂卡备用。
其中,复溶好的荧光微球标记抗体溶液包括荧光微球标记癌胚抗原标记抗体和荧光微球标记羊抗鸡IgY抗体以1:1混合。
其中,抗体浓度测定:用超纯水对质控线抗体对作适当的稀释后,用紫外分光法测定OD260和OD280的吸光值,再计算蛋白浓度。
荧光微球标记CEA标记抗体,包括步骤如下:
a.取2mL离心管加入标记缓冲液MES 1mL;取混匀固含量为1%的荧光微球20μL于标记缓冲液中,再次涡旋混匀;
b.加入标记活化液100μL混匀,旋转混匀反应30min;
c.进行离心30min,离心转速为10000rpm/min;弃去上清液,加入标记缓冲液1000μL,超声;
d.加入癌胚抗原标记抗体10μg混匀,旋转混匀反应30min;
e.加入标记封闭液100μL后超声,旋转混匀反应2h;
f.离心30min;弃去上清液,加入标记保存液1mL超声;
g.将标记物移入新的10mL离心管中,吸取标记保存液4mL清洗标记所用2mL离心管,清洗后将其移入10mL离心管中,涡旋混匀。
荧光微球标记羊抗鸡IgY抗体,步骤如下:
a.取2mL离心管加入标记缓冲液MES 1mL;取混匀固含量为1%的荧光微球20μL于标记缓冲液中,再次涡旋混匀;
b.加入标记活化液100μL混匀,旋转混匀反应30min;
c.进行离心30min,离心转速为10000rpm/min;弃去上清液,加入标记缓冲液1000μL,超声;
d.加入羊抗鸡IgY抗体16μg混匀,旋转混匀反应30min;
e.加入标记封闭液100μL后超声,旋转混匀反应2h;
f.离心30min;弃去上清液,加入标记保存液1mL超声;
g.将标记物移入新的10mL离心管中,吸取标记保存液4mL清洗标记所用2mL离心管,清洗后将其移入10mL离心管中,涡旋混匀。
进一步地,本申请的荧光微球选择南京微测生物的Eu-荧光纳米微球300nm作为标记用荧光微球,线性梯度29.14最优,且T/C精密性均<5%,荧光微球的选择如下:
对南京微测生物科技有限公司的Eu-荧光纳米微球粒径约200nm、300nm和长沙美牛生物科技有限公司羟基化荧光纳米微球200nm、300nm四种测试粒径、荧光强度和PDI系数,然后将其依次标记抗体,制备结合垫做成试剂卡,用企业参考品检测,不同厂家荧光微球制备试剂卡检测结果如表1所示。
将各种原料制备的实验材料组装成试剂卡后,用内部参考品进行评估。
表1不同厂家荧光微球制备试剂卡检测结果
从表1可以看出南京微测300nm线性梯度29.14最优,且T/C精密性均<5%,因此选用南京微测生物的Eu-荧光纳米微球300nm作为标记用荧光微球。
进一步地,标记保存液配方按1000mL配制:牛血清白蛋白20g、蔗糖20g、海藻糖50g、干酪素钠5g、Proclin 300 1mL、0.02M pH8.0 Tris缓冲液1000mL,标记缓冲液的确定如下:
按照表2配制4种不同的标记保存液进行标记保存标记物,并制备结合垫,按前面实验确定的生物材料制备成不同的试剂卡。观察标记物保存状态,并制备结合垫组装试剂卡测试企业参考品。检测结果如表3所示,根据检测结果,最终选取配方4(按1000mL配制:牛血清白蛋白20g、蔗糖20g、海藻糖50g、干酪素钠5g、Proclin 300 1mL、0.02M pH8.0 Tris缓冲液1000mL)作为本申请CEA测定试剂盒(荧光免疫层析法)的标记保存液配方。
表2 4种不同的标记保存液
表3不同配方标记保存液标记物制备试剂卡检测结果
进一步地,包被液选择含1%蔗糖pH7.4的0.01M PBS,制成试剂条后,选择包被液为澄清液体、无晶体析出和线性梯度好,包被液pH为7.4线性梯度高,包被液的选择如下:
按表4分别将包被抗体CEA、鸡IgY用4种配方的包被液稀释至包被浓度,制成试剂条后,选择包被液为澄清液体、无晶体析出和线性梯度好的缓冲液作为包被液,测试结果如表5所示。
表4四种不同的包被液
表5不同包被液制备试剂卡检测结果
由表5可以看出,包被1线性梯度35.71,T/C精密性均<6%,包被液pH值对线性梯度有较大影响,包被液pH为7.4时,线性梯度高,所以选定包被液的pH值为7.4;包被液离子强度对检测结果基本没有影响。综合考虑,选择含1%蔗糖pH7.4的0.01M PBS作为包被液的最终配方。
进一步地,样品垫处理液配方按1000mL配制:抗人RBC抗体10mg、20mg阻断剂001、牛血清白蛋白10g、5mL Tween-20、0.2M pH8.0硼酸硼砂缓冲液1000mL,此配置抗干扰能力较强,样品垫处理液配方的确定:
以0.2M硼酸硼砂缓冲液(pH8.0)为缓冲体系,按表6配制4种不同的样品垫处理液,研究抗人RBC抗体对红细胞拦截效果和阻断剂001对特异性的影响,从而确定样品垫处理液的配方,设置浸纸压垫机轮轴高度,分别倒入四种样品垫处理液,处理好的样品垫放置晾架上干燥过夜(16~24h)。
表6不同样品垫处理液测试添加干扰物的参考品的效果
将各厂家原料制备的实验材料组装成试剂卡后与未添加过抗人RBC抗体和阻断剂001的试剂卡同时实验,用添加干扰物的健康人样本不假阳、全血样本不爬膜进行评估,结果如表7所示。
表7不同样品垫处理液测试添加干扰物的参考品的效果
从上表7可以看出,10mg阻断剂001测试添加干扰物的参考品出现T/C翻倍性增长,但比未处理的样品垫试剂卡T/C明显的偏低,有一定的抗干扰能力;阻断剂001 20mg测试添加干扰物的参考品和未添加干扰物的参考品T/C无明显差异,抗干扰能力较强。
综上所述,抗人RBC抗体10mg、20mg均有效拦截红细胞,20mg阻断剂001测试添加干扰物的参考品和未添加干扰物的参考品T/C无明显差异,抗干扰能力较强,样品垫处理液2、样品垫处理液3均符合要求,综合成本因素,最终选择样品垫处理液3(按1000mL配制:抗人RBC抗体10mg、20mg阻断剂001、牛血清白蛋白10g、5mL Tween-20、0.2M pH8.0硼酸硼砂缓冲液1000mL)为样品垫处理液配方。
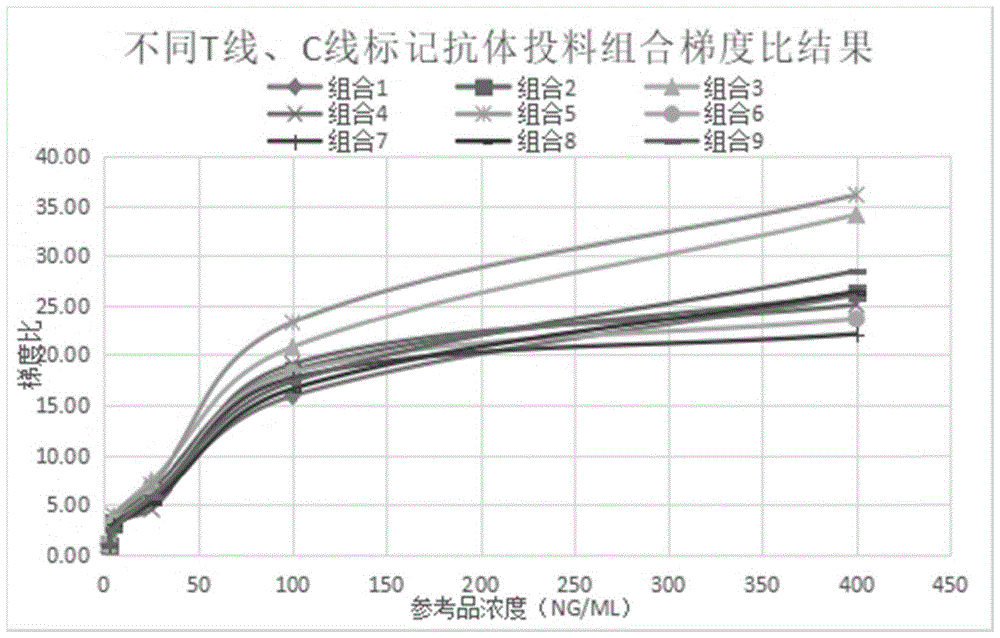
进一步地,本申请选择CEA标记抗体投料10μg,羊抗鸡IgY标记抗体浓度16μg组合投料,即荧光微球:抗体=20:1为T线投料比;荧光微球:抗体=25:2为C线投料比,此配置浓度梯度比66.1,相对最好,灵敏度较高、线性较好,且精密性均<6%,T线标记抗体投料比及C线标记抗体投料比的确定如下:
按表8将T线抗体标记量设置为5μg、10μg、20μg,C线抗体标记量设置为8μg、16μg、32μg进行正交叉实验,制备成9组不同试剂卡,分别检测CEA浓度为0.3mg/L、1mg/L、5mg/L、10mg/L、20mg/L的CEA参考品,精密性结果如表9所示。
表8T线、C线投料组合情况
表9不同T线、C线标记抗体投料比T/C精密性结果
从表9,图1可以看出组合5各内部参考品浓度梯度比36.06,相对最好,灵敏度较高、线性较好,且精密性均<6%,。选择CEA标记抗体投料10μg,羊抗鸡IgY标记抗体浓度16μg组合投料,即荧光微球:抗体=20:1为T线投料比;荧光微球:抗体=25:2为C线投料比。
进一步地,CEA包被抗体浓度1.0mg/mL,鸡IgY包被抗体浓度1.0mg/mL为最终的T线、C线包被浓度,此配置检测灵敏度较高、线性较好,且精密性均<6%,本申请包被抗体浓度的确定如下:
按表10将T线和C线包被抗体使用浓度设置为0.8mg/mL、1.0mg/mL、1.2mg/mL,如下表制备成9种不同组合,分别检测浓度为0.3mg/L、1mg/L、5mg/L、10mg/L、20mg/L的CEA参考品,测试结果如表11所示;
表10T线、C线包被浓度组合情况
表11不同T线、C线包被浓度组合T/C精密性结果
从上表11,图2可以看出组合5各内部参考品浓度梯度比38.10相对最好,灵敏度较高、线性较好,且精密性均<6%。选择CEA包被抗体浓度1.0mg/mL,鸡IgY包被抗体浓度1.0mg/mL为最终的T线、C线包被浓度。
进一步地,标记抗体溶液喷量为4μL/cm,T/C精密性均<6%,相对最优,各喷量线性梯度无明显差异,标记抗体溶液喷量的确定如下:
分别将荧光微球标记抗体溶液3μL/cm、4μL/cm、5μL/cm上样到喷金划线机中,将其喷到剪裁后的结合垫上;干燥过夜(16~24h),分别将制备的实验材料组装成试剂卡后,用企业参考品进行评估。
表12不同喷量T/C精密性结果
从表12可以看出4uL/cm T/C精密性均<6%,相对最优,各喷量线性梯度无明显差异,以成本与性能综合考虑,选择4uL/cm为标记抗体溶液喷量。
进一步地,反应所需的最佳时间为15mim,反应时间的确定如下:
按已确定的生产工艺进行试剂卡的制备,将制备好的检测卡按设定的反应时间,分别检测100uL在不同时间的T/C精密性。检测结果如表13所示,根据检测结果的线性水平筛选出反应所需的最佳时间为15mim。
表13 100uL在不同时间测试T/C精密性
由表13、图3可以看出在15min时反应完成,T/C较早稳定,精密性均<6%,因此选择15min为反应时间。
按已确定的生产工艺进行试剂卡的制备,将制备好的检测卡按设定的加样量(80μL、90μL、100μL、110μL、120μL)分别检测浓度为0.3mg/L、1mg/L、5mg/L、10mg/L、20mg/L的CEA参考品。以层析过程快,吸水纸无荧光微球,线性梯度好且样本无溢出者为优选。最终选择样本用量为100μL作为癌胚抗原(CEA)测定试剂盒(荧光免疫层析法)的最适加样量。
将实施例制备的试剂盒进行如下性能测试:
(1)线性建立
取三批试剂分别对上述编号1~11的线性浓度样本进行测定,每份样本重复测定4次,按照以下公式(1)、(2)计算每份样本4次检测结果的平均值(M)与理论值之间的相对偏差(B)和线性相关系数(r)。
B=(M-T)/T×100%....................(1)
式中:
B——相对偏差;
M——检测结果的平均值;
T——理论值。
式中:
n—测定样本数目;
X
Y
r—线性相关系数;
i——1,2,3,……n。
检测结果如表14所示:
表14线性验证
由表14可以看出线性建立和验证均满足上述设计要求,故以在[2.5,400]ng/mL范围内,线性回归的相关系数r≥0.9900,作为本产品的线性性能指标。
(2)准确度性能评估
选用在质量管理体系下稳定生产的3批癌胚抗原(CEA)测定试剂盒(荧光免疫层析法)进行准确度性能评估,对测试结果进行统计分析,满足设计试验可接受标准,即作为CEA试剂盒准确度性能指标。
测定癌胚抗原企业参考品5.17ng/mL、101.67ng/mL,按照说明书中的步骤进行检测,各重复测量3次后,每次测试结果记为(Xi),如果3次结果相对偏差都不超过±15%,即判为合格。如果大于或等于2次的结果不符合,即判为不合格。如果有1次结果不符合要求,则应重新连续测试20次,并分别按照式(1)计算相对偏差,如果大于或等于19次测试的结果相对偏差都不超过±15%,即判为合格。
Bi=(Xi-T)/T×100%...................................(1)
式中:
Bi——相对偏差;
Xi——每次测量浓度;
T——标示浓度。
测试结果如表15所示:
表15准确度测试结果
由表15看出,准确度均满足上述设计要求,故以相对偏差应不超过±15%,作为本产品的准确度性能指标。
(3)精密度性能评估
选用在质量管理体系下稳定生产的3批癌胚抗原(CEA)测定试剂盒(荧光免疫层析法)进行精密度(重复性和批间精密度)性能评估,对测试结果进行统计分析,满足设计试验可接受标准,即作为CEA试剂盒重复性和批间精密度性能指标。
重复性
取质检合格的三批本试剂盒,由同一个操作者在同一台仪器上检测浓度为5.17ng/mL和101.67ng/mL的CEA企业参考品,每个样本重复测定2次,共检测20天。评估结束时共有60对,即120个测试结果。从每批次测量中40次数据计算出批内精密度。从所有120个数据计算出批间变异系数,测试结果如表16、17、18、19所示。
表16低值样本精密度实验原始数据记录
/>
表17高值样本精密度实验原始数据记录
表18低值样本批内精密度实验原始数据计算
/>
表19高值样本批内精密度实验原始数据计算
/>
通过表16-表19试验数据可看出,三个批次CEA试剂的批内变异系数(CV)应≤15%。批间变异系数(CV)应≤20%。
参考体外诊断试剂分析性能评估系列指导原则,批间精密度公式为:
式中n=检验总数。
根据公式:
从上表16、表17中得出:
求出批间精密度:
从上表16、表17中得出
式中n=检验总数,则批间变异系数
注:
(1)表示:第一批试剂20天测的结果1的总和;
(2)表示:第一批试剂20天测的结果2的总和;
(3)表示:第二批试剂20天测的结果1的总和;
(4)表示:第二批试剂20天测的结果2的总和;
(5)表示:第三批试剂20天测的结果1的总和;
(6)表示:第三批试剂20天测的结果2的总和;
(7)表示:第一批试剂20天测的(均值-结果1)平方的总和;
(8)表示:第一批试剂20天测的(均值-结果2)平方的总和;
(9)表示:第二批试剂20天测的(均值-结果1)平方的总和;
(10)表示:第二批试剂20天测的(均值-结果2)平方的总和;
(11)表示:第三批试剂20天测的(均值-结果1)平方的总和;
(12)表示:第三批试剂20天测的(均值-结果2)平方的总和。
由以上数据分析可得批内和批间指标结果汇总如表20所示:
表20批内和批间指标结果
在重复性条件下,用本试剂盒检测2个不同水平的样本,一个低浓度水平水平5.17ng/mL及一个高浓度水平101.67ng/mL,分别重复测试10次(n=10),如表21所示,检测样本批内变异系数(CV)在5.62%~8.06%范围内。
表21重复性检测数据结果
用3个不同批次的本试剂盒分别测试5.17ng/mL、101.67ng/mL的样本,如表22所示,检测样本批间变异系数(CV)分别为8.30%、6.85%。
表22批间差检测数据结果
由上述试验结果表明,精密度均满足上述设计要求,故以批内变异系数(CV)应≤15%;批间变异系数(CV)应≤20%,作为本产品的精密度性能指标。
(4)参考区间确定
1、样本的要求与来源
①样本类型:156例血清、156全血样本。
②样本分布:年龄4-71岁之间;男女比例约各50%。
③样本入组要求:无高血糖/高血压/高血脂、无急性心肌梗死、冠心病及其他心血管疾病,无怀孕,无明显炎症感染症状等健康人员。
④样本排除标准
(1)样本收集的时间或信息不明确。
(2)样本量不足的样本。
(3)未按照产品说明书要求采集、保存的样本,或样本保存期限超出规定期限。
(4)经判定不符合检测要求的样本。
⑤样本剔除标准
(1)因仪器或人为因素(操作过程中样本受到污染,样本量不足)导致无法完成测定试验过程的样本。
(2)经统计分析,判为离群值的样本。
(3)仪器无法报值的样本。
(4)满足样本排除标准,但进入临床试验的样本。
(5)试验过程中出现的其它情况,经评估确认需要进行剔除的样本。
样本来源于广州达安临床检验中心有限公司。
2、样本采集
参照《全国临床检验操作规程(第四版)》和卫生行业标准WS/T225—2002《临床化学检验血液标本的收集与处理》血清、全血标本的采集与处理。
全血采集:用含有肝素锂、EDTA-K2或柠檬酸钠抗凝剂的抗凝管采集受检者静脉血,将采集血样摇匀备用;
血清采集:用血清管或含有促凝剂的快速血清管采集受检者静脉血,采血后应尽快分离血清,以免溶血。
3、参考区间确定的依据
参考《全国临床检验操作规程(第四版)》、专家共识、临床应用指南以及已获NMPA批准上市的同类厂家说明书,癌胚抗原(CEA)测定试剂盒(荧光免疫层析法)用于体外定量测定人体血清、血浆以及全血样本中癌胚抗原的含量,临床上用于恶性肿瘤疗效观察、预后判断及复发监测,因CEA浓度升高才具有临床意义,故选择单侧参考值范围95%的上限制定参考区间(范围)。
根据CEA项目的临床意义,将156例健康人群CEA血清样本、158例健康人群CEA全血样本按性别分组进行Z检验,验证分析不同性别之间参考区间是否具有差异性,从而确认癌胚抗原(CEA)测定试剂盒(荧光免疫层析法)是否需要分组建立参考区间。
对于三个或更多的分组,推荐使用单因素(ANOVA)方差分析进行统计,当各组测试结果单因素方差的显著性的结果均P>0.05时,则可直接判定为无显著性,相反当各组测试结果单因素方差的显著性的结果均P<0.05时,说明各组之间存在显著性差异,需分组建立参考区间,可能的分组因素如表23所示。
表23可能的分组因素
Z值计算见公式(1):
/>
式中:
和/>
S
n
Z判断限值(Z*)见公式(2)和(3):
血清:
全血:
当标准偏差S
参考区间统计分析
在剔除离群值后,用SPSS25.0统计软件建立数据库并分析数据,对数据进行正态分布检验,正态性检验采用Shapiro-Wilk检验:通过正态性检验,判定参考值是否服从正态分布,若显著性P>0.05,则服从正态分布,根据CEA项目临床意义,采用95%制定CEA参考区间。
数据符合正态分布的,双侧95%参考范围
不符合正态分布的,则制定频数表,采用百分位数进行计算,双侧95%参考范围:P
实验原始数据如表24所示:
表24CEA健康人群156例血清参考区间数据汇总表
/>
/>
从表25可知,在156例CEA健康人群血清样本检测的数据中,D<1/3R,检测数据无离群,无需剔除样本。
表25 156例CEA健康人群血清离群值分析
参考区间分组
通过Z值和Z判断限值(Z*)计算公式可知,Z=(-0.19)<Z*=2.42且标准偏差S
参考区间数据统计及分析
从Shapiro-Wilk检验(见表26)结果可知,,在α=0.05的检验水准下,P=0.000,P<0.05,拒绝原假设,可认为数据不服从正态分布,156例健康人群CEA血清样本浓度呈偏态分布,则制定频数表,采用百分位数计算95%参考值范围,选择检测值的单侧95%上限作为CEA健康人群参考区间(见表27)。
表26Shapiro-Wilk检验
表27频数分析
表28试验数据汇总表
对数据作进一步的统计分析可知(见表28),156例健康人群CEA血清样本浓度呈偏态分布,故本项目测试数据采用百分位数进行计算,CEA浓度升高才有临床意义,因此选择第95百分位数检测值作为CEA血清的参考区间。
结合本次参考区间研究结果以及在售同类产品参考值范围信息和临床诊断意义,将本公司生产的癌胚抗原(CEA)测定试剂盒(荧光免疫层析法)测定人体血清、血浆和全血样本中癌胚抗原含量的正常参考范围定为:<5ng/mL。
(5)质控品测试数据
本次参考区间确认研究共进行了6次质量控制,试验表明,癌胚抗原(CEA)质控品的测值均在质控范围内且重复测定结果的CV均在15%以内,符合质控标准,参考区间研究试验可靠,结果如表29所示。
表29质控品测试数据
本申请提供一种癌胚抗原荧光免疫层析法测定试剂盒,以癌胚抗原单克隆抗体和鸡IgY抗体分别作为检测线和质控线上包被用抗体,癌胚抗原抗体和羊抗鸡IgY混合作为荧光微球标记抗体,采用的荧光免疫层析法,与目前常见的检测癌胚抗原的方法如,酶联免疫法/免疫增强比浊法/胶体金法相比,不仅大大缩短了检测时间、降低检测成本,还提高了检测灵敏度,与同类方法比较,具有标记过程简单、灵敏度高、结果准确且稳定等优点,提供的一种癌胚抗原荧光免疫层析检测试剂盒的制备方法,通过选定合适原料、合理设计各材料用量、选取最适反应条件,制备工艺简单,制备得到产品标记过程简单、灵敏度高、结果准确且稳定,检测成本低,产品使用简便,成本低廉,适合推广。
以上所述仅为本申请的较佳实施例而已,并不用以限制本申请,凡在本申请的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本申请的保护范围之内。
- 一种丙型肝炎病毒抗原荧光免疫层析检测试剂盒及其制备方法
- 一种免疫层析用封闭剂组合物、用途、及免疫层析试剂盒的制备方法
- 一种荧光免疫层析卡的制备方法及荧光免疫层析卡
- 一种用于早期乳腺癌多联检测的荧光免疫层析检测卡、试剂盒
- 一种抗缪勒氏管激素的近红外荧光层析免疫定量检测试剂盒
- 一种核酸杂交捕获免疫荧光检测方法、免疫荧光层析试条及试剂盒
- 一种核酸杂交捕获免疫荧光检测方法、免疫荧光层析试条及试剂盒
