一株具有抗猪流行性腹泻病毒功能的屎肠球菌及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于微生物技术领域,尤其涉及一株具有抗猪流行性腹泻病毒功能的屎肠球菌及其应用。
背景技术
肠道疾病是现代化养猪场内普遍存在的问题,而腹泻类疾病在仔猪阶段比较易发,包括细菌性腹泻,病毒性腹泻,营养性腹泻以及寄生虫引起的腹泻,其中病毒性腹泻发生率高,传播快,传播范围广,并且死亡率高,治疗效果不明显,主要以预防为主,特别是在2010年至今不断爆发的猪流行性腹泻病毒(PEDV),流行性腹泻是一种急性高度传染性传染病,主要表现为腹泻,呕吐,脱水等临床症状,在部分规模化猪场死亡率居高不下,有的甚至可以达到80%以上,是引起新生仔猪肠炎和死亡的重要原因,给养殖业造成了重大的经济损失。
针对疾病来说,预防的效果要好于治疗效果,尤其是病毒性疾病,PEDV也不例外,PEDV具有严格的细胞趋性和宿主特异性。然而,由于病毒遗传变异,有效的疫苗保护受到了影响;抗病毒药物通常有严重的毒副作用,使用量和效果有限。因此,需要不断寻求可控制病毒性疾病的有效方法,益生菌因其无毒、无抗药性、无残留、抗菌、抗病毒、促生长、绿色安全的优点受到广泛关注。
尿肠球菌具有显著的益生菌特性,且大多数菌株安全可靠,因此成为1989年美国公布的种可直接词喂的益生菌菌种之一,也是我国农业部《饲料添加剂品种目录》相关文件中允许使用的益生菌菌种,许多制药公司和企业将其制成调整人或动物肠道微生态的益生菌制剂。屎肠球菌可以调节肠道菌群平衡、减少肠道致病菌感染、治疗腹泻和肠炎以及增强宿主的免疫功能,其正常代谢可以产生有机酸、过氧化氢和细菌素等能够抑制和杀灭病原菌和病毒。已有相关研究表明,屎肠球菌可以抑制猪传染性胃肠炎病毒和猪甲型流感病毒的复制,但在猪流行性腹泻病毒上未见报道。
发明内容
基于此,本发明提供了一株具有抗猪流行性腹泻病毒功能的屎肠球菌及其应用,该菌株可用于制备可用于预防PEDV的饲料、饲料添加剂和药物,为PEDV的预防和治疗提供新的方向。
本发明的第一方面,提供一株具有抗猪流行性腹泻病毒功能的屎肠球菌(Enterococcus faecium)EFA5,保藏编号为:GDMCC NO.62904保藏在广东省微生物菌种保藏中心,保藏日期2022年10月19日,保藏地址为广东省广州市广东省科学院微生物研究所。
本发明的屎肠球菌(Enterococcus faecium)EFA5的16S rRNA基因序列如SEQ IDNO.1所示。该菌株具有以下微生物学特性:菌株EFA5在培养基上的菌落呈乳白色,中央光滑凸起,边缘粗糙;菌株在镜下呈短杆状,革兰氏染色阳性,无芽孢;生长迅速,在培养基上生长18h即可进入稳定期;具有较强的产酸能力,培养基pH在20小时内从5.4趋近于4.0;具有良好的耐酸能力和耐胆盐能力;对猪小肠上皮细胞黏附能力比较强。
所述屎肠球菌EFA5由健康陆川母猪及断奶仔猪粪便分离得到。
所述屎肠球菌EFA5对猪流行性腹泻病毒具有抑制作用,通过CCK8法间接检测屎肠球菌EFA5发酵上清液对PEDV的抑制率,发现屎肠球菌EFA5发酵上清液在细胞水平对PEDV具有很强的的抑制率作用,1/4稀释度的发酵上清液对PEDV的抑制率约为0.6;通过检测屎肠球菌EFA5发酵上清液对PEDV滴度的影响,发现添加发酵上清液的实验组的TCID
本发明的第二方面,提供一种饲料或饲料添加剂,所述饲料或饲料添加剂含有屎肠球菌EFA5或其发酵产物。
本发明的第三方面,屎肠球菌EFA5在制备抗猪流行性腹泻病毒药物中的应用。
在其中一些实施例中,所述药物含有屎肠球菌EFA5和/或其发酵产物。
在其中一些实施例中,所述药物剂型为片剂、胶囊、粉剂、丸剂、颗粒剂或者溶液剂。
在其中一些实施例中,所述药物包含屎肠球菌EFA5以及药学上可以接受的辅料。
与现有技术相比,本发明具有以下优点:
本发明提供的屎肠球菌EFA5具有显著的益生特性,生长迅速,具有较强的产酸能力,可以在猪肠道内定殖,实验测定表明,本发明筛选到的屎肠球菌EFA5能够有效抑制猪流行性腹泻病毒(PEDV)的复制,具有较强的抗病毒能力。本发明公开的一株具有抗猪流行性腹泻病毒功能的屎肠球菌可作为益生菌用于制作饲料或饲料添加剂,并且在制备抗猪流行性腹泻病毒药物上具有广阔的应用场景。
附图说明
图1为屎肠球菌EFA5菌落形态图;
图2为屎肠球菌EFA5在100倍油镜下的革兰氏染色镜检图;
图3为屎肠球菌EFA5 16S rRNA遗传进化分析图;
图4为屎肠球菌EFA5生长曲线图;
图5为屎肠球菌EFA5产酸曲线图;
图6为屎肠球菌EFA5的酸和胆盐耐受测定结果图;
图7为屎肠球菌EFA5黏附IPEC-J2细胞的黏附情况图;
图8为vero细胞的正常形态图;
图9为PEDV感染vero细胞以产生细胞病变的结果图;
图10为屎肠球菌EFA5发酵上清液的细胞毒性测定结果图;
图11为屎肠球菌EFA5发酵上清对PEDV抑制率测定结果图;
图12为屎肠球菌EFA5发酵上清对PEDV滴度的影响测定结果图;
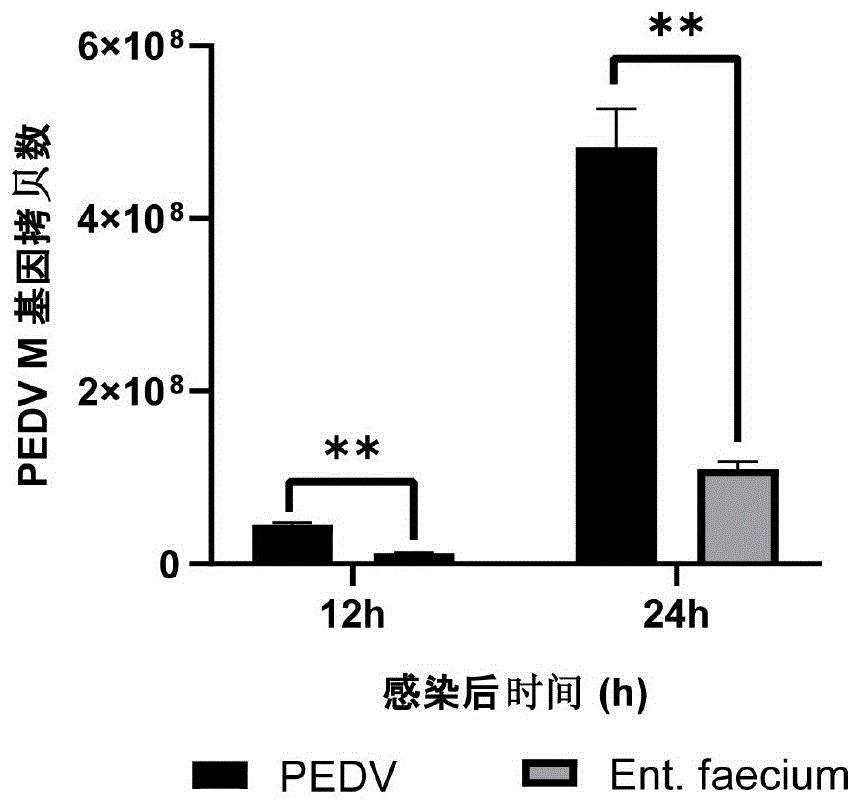
图13为屎肠球菌EFA5发酵上清对PEDV M基因拷贝数的影响测定结果图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与术语本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在限制本发明。
本发明中,“第一方面”、“第二方面”、“第三方面”、“第四方面”等仅用于描述目的,不能理解为指示或暗示相对重要性或数量,也不能理解为隐含指明所指示的技术特征的重要性或数量。而且“第一”、“第二”、“第三”、“第四”等仅起到非穷举式的列举描述目的,应当理解并不构成对数量的封闭式限定。
本文所使用的术语“和/或”、“或/和”、“及/或”的可选范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
在本发明的下述实施例中,所用的实验材料和试剂来源如下:
猪源屎肠球菌(Limosilactobacillus reuteri)EFA5保存于菌种保藏中心,保藏编号为:GDMCC NO.62904。
猪小肠上皮(IPEC-J2)细胞和非洲绿猴肾(Vero)细胞由本实验室保存。
PEDV-JS2013毒株由上海兽医研究所馈赠。
其他所述试剂或材料,如未特别说明,均来源于商业渠道。
实施例1屎肠球菌的分离和鉴定
1.1菌株分离
采集广西贵港扬翔股份公司某猪场健康陆川母猪及断奶仔猪粪便作为样本,在无菌环境下,取1g粪便样本加入99ml无菌生理盐水,充分摇匀,将粪便样品梯度稀释,稀释梯度分别为10
1.2菌株鉴定
对分离到的菌株进行革兰氏染色,选取镜下为杆状或短杆状、革兰氏染色阳性、无芽孢的菌株进一步鉴定。菌株EFA5在MRS培养基上的菌落呈乳白色,中央光滑凸起,边缘粗糙,菌落形态如图1所示;菌株在镜下呈短杆状,革兰氏染色阳性,无芽孢,菌体形态如图2所示。
采用细菌DNA提取试剂盒(Servicebio,中国)对菌株EFA5进行基因组DNA提取,之后采用Ex Taq DNA Polymerase试剂盒(TaKaRa,中国)对16S基因进行PCR扩增。采用27F(5′AGAGTTTGATCCTGGCTCAG 3′)和1492R(5′TACGGTTACCTTGTTACGACTT 3′)通用引物对菌株进行16S rRNA基因扩增。扩增条件为:预变性95℃5min;95℃30s,56℃30s,72℃1min30s共35个循环,72℃退火延伸10min。吸取5μL的PCR产物于1%(w/v)琼脂糖凝胶电泳检测后,将剩余的PCR产物作为样品送至上海生工公司进行测序。将该序列比对NCBI数据库(https://blast.ncbi.nlm.nih.gov),采用MEGA 5.1软件建立系统发育树。建立的系统发育树如图3所示,可知该菌株与NCBI中GenBank的屎肠球菌ATCC 19434(ID:NR_115764.1)、屎肠球菌NBRC 100486(ID:NR_113904.1)和屎肠球菌DSM 20477(ID:NR_114742.1)16Sr RNA的同源性最接近,确定该菌株为Enterococcus faecium,并将其命名为屎肠球菌(Enterococcusfaecium)EFA5。并将屎肠球菌(Enterococcus faecium)EFA5于2022年10月25号保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC NO.62904,,,存活状态为存活,保藏地址为广东省广州市广东省科学院微生物研究所,邮编为510075,联系电话为020-87137633。
EFA5菌株的16S rRNA基因测序结果如SEQ ID NO.1所示:
ACCGGAGCTTGCTCCACCGGAAAAAGAGGAGTGGCGAACGGGTGAGTAACACGTGGGTAACCTGCCCATCAGAAGGGGATAACACTTGGAAACAGGTGCTAATACCGTATAACAATCAAAACCGCATGGTTTTGATTTGAAAGGCGCTTTCGGGTGTCGCTGATGGATGGACCCGCGGTGCATTAGCTAGTTGGTGAGGTAACGGCTCACCAAGGCCACGATGCATAGCCGACCTGAGAGGGTGATCGGCCACATTGGGACTGAGACACGGCCCAAACTCCTACGGGAGGCAGCAGTAGGGAATCTTCGGCAATGGACGAAAGTCTGACCGAGCAACGCCGCGTGAGTGAAGAAGGTTTTCGGATCGTAAAACTCTGTTGTTAGAGAAGAACAAGGATGAGAGTAACTGTTCATCCCTTGACGGTATCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCAAGCGTTGTCCGGATTTATTGGGCGTAAAGCGAGCGCAGGCGGTTTCTTAAGTCTGATGTGAAAGCCCCCGGCTCAACCGGGGAGGGTCATTGGAAACTGGGAGACTTGAGTGCAGAAGAGGAGAGTGGAATTCCATGTGTAGCGGTGAAATGCGTAGATATATGGAGGAACACCAGTGGCGAAGGCGGCTCTCTGGTCTGTAACTGACGCTGAGGCTCGAAAGCGTGGGGAGCAAACAGGATTAGATACCCTGGTAGTCCACGCCGTAAACGATGAGTGCTAAGTGTTGGAGGGTTTCCGCCCTTCAGTGCTGCAGCTAACGCATTAAGCACTCCGCCTGGGGAGTACGACCGCAAGGTTGAAACTCAAAGGAATTGACGGGGGCCCGCACAAGCGGTGGAGCATGTGGTTTAATTTGAAGCAACGCGAAGAACCTTACCAGGTCTTGACATCCTTTGACCACTTTAGAGATAGAGCTTCCCCTTCGGGGGCAAAGTGACAGGTGGTGCATGGTTGTTGTCAGCTCGTGTCGTGAGATGTTGGGTTAAGTCCCGCAACGAGCGCAACCCTTATTGTTAGTTGCCATCATTCAGTTGGGCACTTTAGCAAGACTGCCGGTGACAAACCGGAGGAAGGTGGGGATGACGTCAAATCATCATGCCCCTTATGACCTGGGCTACACACGTGCTACAATGGGAAGTACAACGAGTTGCGAAGTCGCGAGGCTAAGCTAATCTTTTAAAGCTTCTTTCAGTTCGGATTGCAGGCTGCAACTCGCCTGCATGAAGCCGGAATCGCTAGTAATCGCGGATCAGCACGCCGCGGTGAATACGTTCCCGGGCCTTGTACACCCCGCCCGTCACACCCCGAGAGTTTGTAACCCCCGAAGTCGGTGAGGTAACCT
实施例2屎肠球菌EFA5益生特性研究
2.1屎肠球菌EFA5生长特性及产酸特性研究
将活化好的菌株经MRS液体培养基活化培养12h后,按1%的接种量接种于若干装有9mL MRS液体培养基的10mL无菌离心管中,37℃静置培养。从0h开始至24h,每隔三个小时取出一支,使用特定的仪器测定其在OD值为600nm下的光密度值,以OD数值为纵坐标,时间为横坐标,绘制其生长曲线。结果表明,菌株生长迅速,18h即可进入稳定期,生长曲线如图4所示。
用同样的接种操作对其进行产酸能力的测定,分别培养后的4h、8h、12h、16h、20h和24h取出,采用pH计测定培养液的pH值,每次取两个平行样求平均值,并用所测的pH值进行绘图。如图5所示,EFA5菌株有较强的产酸能力,培养液的初始pH为5.7,培养24小时后培养液的pH下降至4.2,说明该菌株具有良好的产能力,能够降低肠道pH值,调节肠道稳态。
2.2屎肠球菌EFA5酸耐受性及胆盐耐受性研究
用1M HCl分别调节MRS培养液的pH值至2.0,3.0,4.0,121℃高压蒸汽灭菌15min,保温至合适温度备用;在MRS液体培养基中分别加入0%、0.1%、0.3%和0.5%(w/v)的牛胆碱,充分振荡,使牛胆碱完全溶解,灭菌,保温至合适温度备用。从﹣80℃冰箱取出EFA5菌株,活化后取100μl菌液,分别接种于900μl已预先调节好pH或加入了牛胆碱的MRS肉汤,并做好标记,放入培养箱中培养12h,同时设置对照组。分别在培养后0h和12h测量菌液的OD值。如图6所示,该菌株有良好的耐酸能力和耐胆盐能力,该菌株在pH≤3的环境中菌液的OD值较低,而在pH值为4或牛胆碱浓度为0%、0.1%、0.3%和0.5%的环境中,菌液的OD值与对照组基本相同。以上结果表明:该分离株对酸性环境有一定的耐受能力,在高浓度的胆盐环境下存活率几乎不受影响,说明该菌株有良好的抗逆性,可以在胃肠道中生存。
2.3屎肠球菌EFA5黏附猪小肠上皮细胞
将屎肠球菌(Lactobacillus reuteri)EFA5接种至MRS肉汤培养基中,37℃厌氧培养12小时,4℃下4000rpm离心10min,收集菌体用无菌PBS溶液洗涤2次,最后重悬于DMEM(Gibco,美国)并调整浓度为1×107cfu/mL。将实验室保存的猪小肠上皮细胞IPEC-J2复苏后进行传代培养,取对数生长期的小肠上皮细胞IPEC-J2进行胰酶消化,用DMEM培养基调整细胞浓度至约1×105个/mL。在6孔板放入细胞爬片,将细胞接种到6孔板中,每孔接种2mL,37℃、5%(v/v)CO
实施例3屎肠球菌EFA5抗猪流行性腹泻病毒的评价
3.1细胞培养
Vero细胞用含10%FBS(Gibco,USA)的DMEM(Gibco,USA)培养,长成单层贴壁细胞时进行传代,传代时用0.25%的胰酶消化,约1min即可以消化下来。具体步骤如下:弃去贴壁细胞的旧培养液,然后用PBS溶液洗两次,去除残留的旧培养基;向瓶内加入1mL消化液(0.25%胰酶)轻轻摇动培养瓶,使消化液流遍所有细胞表面;在显微镜下观察,当细胞收回突起变圆或细胞间隙增大后,立即终止消化(倒掉消化液,加入少量的含血清的新鲜培养液,终止消化);用移液管吸取瓶内培养液,反复吹打消化好的细胞使其脱壁并分散,形成细胞悬液;将细胞悬液分装到新培养瓶中,并补加一定量的含血清的新鲜培养液,使总体积至5ml;轻轻摇晃,使细胞均匀分布,盖上瓶盖,放回细胞培养箱培养。正常Vero细胞的形态如图8所示,可见细胞分布均匀,密度紧凑,边界清晰,状态良好。
3.2PEDV病毒增殖与滴度测定
(1)病毒增殖
将消化好的Vero细胞接T25细胞培养瓶,放37℃、5%CO2恒温箱培养,至细胞长满单层时进行攻毒。将-80℃保存的PEDV病毒液(JS2013)50μl与1ml无血清接毒培养基(每mlDMEM含10ug无EDTA胰酶)混合均匀接种到长有单层Vero细胞的培养瓶中,37℃、5%CO2恒温培养箱孵育,1h后补加4ml接毒培养基,37℃、5%CO2恒温培养箱培养24-48h;每天观察细胞状态,80%以上细胞出现病变时收获病毒细胞增殖液。病毒细胞增殖液反复冻融3次,4000rpm离心10min,收集上清病毒液-80℃保存备用。PEDV感染Vero细胞产生的病变如图9所示,在病变区域细胞边界模糊,细胞发生融合、破碎,细胞碎屑漂浮于培养基。
(2)病毒滴度测定
采用Reed-Muench法计算PEDV病毒液中病毒的滴度(TCID
将消化好的Vero细胞接96孔板,放37℃、5%CO
由结果可知,病毒的TCID
3.3屎肠球菌EFA51发酵上清液的制备
将屎肠球菌EFA5活化后接种到MRS肉汤中,37℃静置培养18h,10000r/min离心5min,用NaOH调整上清pH至7.0,用0.22μm滤器过滤后保存于-20℃冰箱备用。
3.4屎肠球菌EFA51发酵上清液的细胞毒性检测
在96孔板中接种细胞悬液,培养至长出单层细胞。取屎肠球菌EFA51的发酵上清液以2倍梯度稀释,选取1、1/2、1/4、1/8、1/16、1/32不同梯度稀释液。处理组每孔加入100ul不同稀释度的发酵上清液,每个稀释度做5个重复,于37℃、5%CO
3.5CCK8法间接检测屎肠球菌EFA5发酵上清液对PEDV的抑制率
在96孔板中接种细胞悬液,培养至长出单层细胞。将屎肠球菌EFA5发酵上清液接种于96孔板细胞,每孔100μl,共培养90min,DMEM洗涤后以MOI=0.01的PEDV感染细胞,置培养箱中吸附90min,洗涤后加入细胞维持液,继续培养。同时设立病毒对照组和正常细胞对照组。病毒对照:以MOI=0.01的PEDV感染Vero细胞,置温箱中吸附90min后PBS洗涤,加入细胞维持液继续培养。病毒抑制率=(益生菌处理组OD
3.6屎肠球菌EFA5发酵上清液对PEDV滴度的影响
实验分为处理组和对照组,具体操作如下:
处理组:将消化好的Vero细胞铺在96孔板,放37℃、5%CO
对照组:将细菌代谢物换成DMEM,每孔100μl,孵育90min,其余处理相同。
每天观察并记录细胞病变(CPE)情况,直到没有新的病变产生,按Reed-Muerch法计算PEDV病毒液的TCID50。
结果如图12所示,与对照组相比,EFA5发酵上清预处理组极显著地降低了病毒滴度(约10倍)。
3.7对病毒M基因拷贝数的影响
(1)样品制备
在12孔板中接种vero细胞悬液,培养至长出单层细胞。将益生菌代谢产物接种于细胞,每孔1ml,于37℃细胞培养箱共培养90min,用PBS洗涤后以MOI=0.01的PEDV感染细胞,置培养箱中吸附1h,PBS洗涤后加入细胞维持液,继续培养。同时设立病毒对照组。每组3个重复。等病毒对照组细胞病变达到80%左右收毒,将12孔细胞培养板放入-80℃冰箱反复冻融三次,离心收集上清,即为待测样品。
(2)RT-qPCR法检测各样品中PEDV M基因拷贝数
I.抽提病毒上清液中总RNA
利用RNA fast200RNA试剂盒(Dieckmann,中国)抽提病毒液总RNA,放-80℃冰箱保存备用。
II.反转录
利用HiScript II 1st Strand cDNA Synthesis Kit(Vazyme,中国)对获得的总RNA进行反转录,反转录体系如下:
a.基因组DNA去除(16μl体系):
反应程序:42℃2min。
b.配置第一链cDNA合成反应液(20μl体系):
反应程序:50℃15min;85℃2min。
III.利用qPCR对PEDV M基因进行实时定量
利用AceQ Universal SYBR qPCR Master Mix试剂盒(Vazyme,CHINA)对反转录产物进行实时荧光定量,反应体系如下:
反应程序:95℃5min;95℃10s,60℃30s,40个循环;
检测结果如图13所示,在病毒感染12h和24h后,益生菌发酵上清液预处理组的病毒M基因拷贝数均极显著低于对照组。以感染后24h为例,对照组病毒基因拷贝数为4.8×10
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 一种eGFP标记的、抗猪传染性胃肠炎和猪流行性腹泻的重组屎肠球菌疫苗株及其应用
- 一株基因型2a的猪流行性腹泻病毒毒株及其在制备猪流行性腹泻疫苗中的应用
