ACT001在制备治疗脓毒症药物中的应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于脓毒症治疗领域,具体涉及ACT001在制备治疗脓毒症药物中的应用。
背景技术
脓毒症(sepsis)被定义为机体对感染的功能失调反应引起的危及生命的器官功能障碍,具有病理机制复杂,短期死亡率高,长期复发率和长期死亡率高,早期识别困难等特点。目前脓毒症休克的死亡率高于40%,治疗费用给社会和家庭造成了巨大的经济负担,是当今医疗机构面临的一大挑战。脓毒症的发病进程中会产生多种并发症,弥漫性血管内凝血(Disseminated intravascular coagulation,DIC)已被认定为是脓毒症的致命并发症之一。血管内形成血栓是弥漫性血管内凝血的标志,血栓造成组织供血不足,缺氧坏死和养分补给不足等。正常机体中外周血流阻力小,心肌收缩力度大,组织血液灌注充分,而在脓毒症患者体内存在微血管血栓使外周血流阻力增加,另一方面心肌受损心脏收缩力度降低,导致外周组织血液灌注不足氧气和营养缺失,进一步加重了器官衰竭,并发心脏疾病的脓毒症患者的死亡率要远高于单纯的脓毒症患者。综上所述,脓毒症诱发的凝血功能异常会加重机体的多器官功能衰竭,在脓毒症的发病进程中起着重要的作用。
目前脓毒症治疗主要集中于发病早期,如体液复苏、清除感染源、血压维持和糖皮质激素治疗、抗生素治疗等,由于脓毒症多由细菌感染导致,因此抗生素治疗是目前临床不可缺少的治疗手段。
然而不容忽视的是,多种广谱抗生素耐药菌的存在,严重危胁人类生命安全,每年夺去数十万患者的生命,且呈逐年上升趋势。因此亟需开发新型脓毒症治疗的新药,应对抗生素耐药带来的严峻挑战。此外,抗生素的长期使用会导致耐药菌的增多,影响肠道菌群平衡,因此只适合短期的紧急杀菌使用,是现有的脓毒症治疗的另一局限。
ACT001目前已用于癌症的治疗特别是脑癌的治疗,现已具有显著疗效。由于ACT001的原型药物小白菊内酯具有抗炎抗血小板的作用,且其代谢产物木香内酯在动物模型中具有抗脓毒症的疗效,预示ACT001具有抗炎,抗凝和防治脓毒症的作用,但是目前学术界对于ACT001的研究结果多为癌症及帕金森方面的报道,对于炎症和抗凝方面的研究有待进一步开发。因此本发明以脓毒症小鼠为模型,探究ACT001以及ACT001与C0127-2联用对脓毒症进程,凝血功能,炎症反应和心功能的影响。基于本研究揭示的ACT001以及联合用药对改善脓毒症小鼠生存、凝血功能、心功能等生理生化指标的一系列突破性的成果及部分相关作用机制(ACT001的抗凝、抗炎和心脏保护作用等),提出本发明技术方案。
发明内容
为了解决现有技术存在的问题,本发明提供了ACT001在制备治疗脓毒症药物中的新应用。本发明旨在开发治疗脓毒症的新型药物,探究一种天然药物成分的改造化合物(ACT001)治疗脓毒症的潜在应用,并对药物抑制脓毒症的体内凝血和保护心脏功能进行药效和机制研究。
为便于理解本发明,对ACT001进行如下说明:
小白菊、辛夷、黄兰等免疫调节中药中有一种共同物质——小白菊内酯(如式I所示),通过对提取的小白菊内酯进行化学修饰后得到一种可以口服并能被肌体快速吸收的化合物(即为ACT001,如式II所示),并通过化学改造增加了其水溶性使其在剂型上可以有更多的选择,且已经实现工业化生产,成本相对较低,ACT001在实验中简称AC。
本发明的方案是提供一种ACT001在制备治疗脓毒症药物中的应用。
进一步地,本发明提供了ACT001在制备治疗脓毒症并发引起的血栓药物中的应用。
进一步地,本发明提供了ACT001在制备治疗脓毒症并发引起的弥漫性血管内凝血药物中的应用。
进一步地,本发明提供了ACT001在制备治疗脓毒症并发引起的器官功能衰竭药物中的应用。
进一步地,本发明提供了ACT001在制备治疗脓毒症并发引起的心脏疾病药物中的应用。
进一步地,本发明提供了ACT001在制备治疗脓毒症并发引起的心肌受损药物中的应用。
进一步地,发明提供了ACT001与C0127-2联合在制备治疗脓毒症药物中的应用。
进一步地,所述的药物是以ACT001为原料,加入医学上可接受的辅料或者辅助性成分,制备而成的制剂。
进一步地,所述的药物是以ACT001和C0127-2为原料,加入医学上可接受的辅料或者辅助性成分,制备而成的制剂。
进一步地,所述的制剂包括注射制剂和口服制剂。
为便于理解技术方案,本发明的具体研究过程为:
本发明将ACT001按照一定的浓度以PBS作为溶剂配置成注射液作为治疗药物,使用高效液相色谱对药物进行了稳定性检测确定了使用期间的药物浓度不变保证了药效。在药效研究上本发明通过CLP建立了小鼠脓毒症模型,并通过一系列实验,以血必净注射液为阳性对照,评价了ACT001单独用药,ACT001与C0127-2联用的药效:a.检测小鼠七天的生存率,b.小动物超声成像系统检测小鼠心脏功能,c.FeCl
本发明的有益效果为:
1、ACT001显著提高脓毒症小鼠的生存率,降低了促炎因子的产生,发挥体内抗凝效果,减轻了脓毒症导致的心肌功能障碍,可以作为一种脓毒症的潜在治疗药物。
2、作为抗癌药物而开发的ACT001对于脓毒症也显示出治疗效果,且具有抗凝抗炎效果,通过抑制STAT3磷酸化等途径抑制炎症因子和凝血因子发挥了抗炎抗凝效果,进而防止了过度炎症和弥散性凝血对其它器官造成损伤,发挥了器官保护作用。
3、ACT001与C0127-2联合治疗脓毒症,在动物实验中显现优于二者单独用药的疗效,显著提高脓毒症小鼠的生存率,降低了炎症因子风暴,发挥体内抗凝效果,减轻了脓毒症导致的心脏功能障碍,有望成为一种脓毒症的潜在治疗方案。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
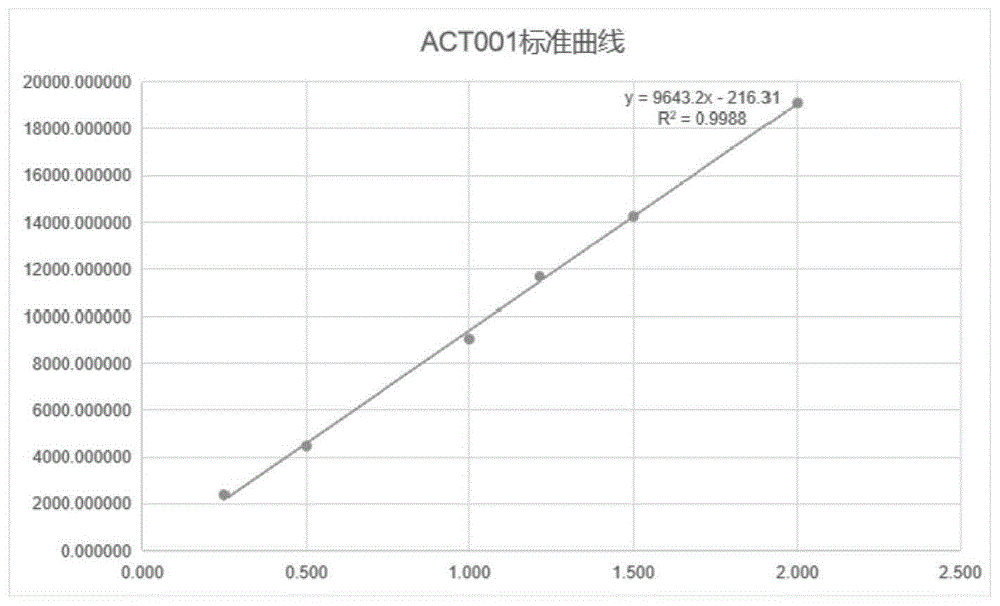
图1是ACT001标准曲线,y=9643X-216.31,R
图2是不同温度下,不同时间内ACT001的浓度变化,其中:
图2a是4℃冰箱存放条件下ACT001 96小时内的浓度变化;
图2b是常温存放下96小时内ACT001的浓度变化(n=3);与0h对比***p<0.001,与48h相比###p<0.001。
图3是ACT001不同给药浓度与存活率的关系曲线。
图4是ACT001对脓毒症小鼠生存的治疗效果,其中:
图4a是小鼠七天生存率曲线图(n≥6);
图4b是ELISA试剂盒检测各组血清中的IL-6浓度;
图4c是ELISA试剂盒检测各组血清中的TNF-α浓度。
图5是ACT001对脓毒症小鼠的心肌形态学影响,其中:
图5a是sham组心室腔位置病理染色结果;
图5b是CLP模型组心室腔位置病理染色结果;
图5c是ACT001治疗组心室腔位置病理染色结果;
图5d是XBJ治疗组心室腔位置病理染色结果;n≥3。
图6是各组小鼠超声心动图。
图7是超声心动图检测各组小鼠的心脏功能结果,其中:
图7a是各组小鼠左心室射血分数;
图7b是各组小鼠左心室短轴缩短率;
图7c是各组小鼠舒张期左心室后壁厚度;
图7d是各组小鼠收缩期左心室后壁厚度;
图7e是各组小鼠收缩期左心室内径;
图7f是各组小鼠收缩期左心室内径。
图8是CCK8检测细胞活力筛选细胞给药最适稀释倍数,与1:50相比**p<0.01,***p<0.001。
图9是中性粒细胞纯度检测的结果。
图10是PMA刺激中性粒细胞形成NETs的荧光代表性图片。
图11是PMA刺激中性粒细胞形成NETs荧光统计结果,与mod组相比***p<0.001,(n≥3)。
图12是各组小鼠散斑多普勒血流成像检测FeCl
图13是ACT001对凝血的影响与安全性的结果,与con组相比*p<0.05,**p<0.01,****p<0.0001,肝素组与其他所有组相比####p<0.0001,其中:
图13a是各组血流比值变化曲线;
图13b是各组血栓形成时间;
图13c是各组小鼠断尾后血液流出到出现纤维蛋白丝的凝血时间(n=9);
图13d是各组小鼠断尾后出血到停止出血的出血时间(n=9)。
图14是小鼠心脏组织转录组结果,其中:
图14a是差异基因聚类结果,红色代表上调,蓝色代表相对下调;
图14b是Sham组与CLP组比较差异基因分布;
图14c是ACT001组与CLP组比较差异基因分布;
图14d是XBJ组与CLP组比较差异基因分布。
图15是ACT001与CLP的生物功能分析,其中BP、CC、MF分别代表生物过程、细胞成分、分子功能。
图16是ACT001与CLP的全部KEGG分析排名前20的结果。
图17是ACT001与CLP的KEGG分析排名前20的上调通路及下调通路,通路及功能柱状图按照-log10(padj)绝对值大小从左向右排序。
图18是ACT001调节的部分基因RT-PCR验证结果,与CLP相比*p<0.05,**p<0.01,***p<0.001,与sham相比#p<0.05,n=4,其中:
图18a是各组IL6mRNA表达水平;
图18b是各组JAK3mRNA表达水平;
图18c是STAT3mRNA表达水平;
图18d是各组CSF3表达水平;
图18e是各组SOCS3mRNA表达水平。
图19是ACT001对心脏p-STAT3蛋白水平的影响,与CLP相比**p<0.01,n=3,其中:
图19a是心脏组织p-STAT3蛋白表达水平免疫印迹条带;
图19b是蛋白条带灰度值统计结果。
图20是改进例中,6个组别中小鼠七天生存率曲线图。
图21是改进例中,4个组别中小鼠七天生存率曲线图。
图22是芍药苷标准曲线,y=19168X+1189.6,R
图23是羟基红花黄色素A标准曲线,y=27479X+1547,R
图24是不同温度下,不同时间内,相关溶液的浓度变化,其中:
图24a是2C溶液中的羟基红花黄色素A在4℃条件下96h内的浓度变化;
图24b是2C溶液中的芍药苷在4℃条件下96h内的浓度变化。
图24c是ACT001溶液在4℃条件下96h内的浓度变化。
图24d是AC2C溶液中的羟基红花黄色素A在4℃条件下96h内的浓度变化。
图24e是AC2C溶液中的芍药苷在4℃条件下96h内的浓度变化。
图24f是AC2C溶液中的ACT001在4℃条件下96h内的浓度变化。
图25是不同组别对脓毒症小鼠生存的治疗效果,其中:
图25a是小鼠七天生存率曲线图(n≥6);
图25b是ELISA试剂盒检测各组血清中的IL-6浓度;
图25c是ELISA试剂盒检测各组血清中的TNF-α浓度。
图26是不同组别对脓毒症小鼠的心肌形态学影响,其中:
图26a是sham组心室腔位置病理染色结果;
图26b是CLP模型组心室腔位置病理染色结果;
图26c是XBJ治疗组心室腔位置病理染色结果;
图26d是AC2C治疗组心室腔位置病理染色结果;
图26e是ACT001治疗组心室腔位置病理染色结果;
图26f是2C治疗组心室腔位置病理染色结果;n≥3。
图27是各组小鼠超声心动图。
图28是超声心动图检测各组小鼠的心脏功能结果,其中:
图28a是各组小鼠左心室射血分数;
图28b是各组小鼠左心室短轴缩短率;
图28c是各组小鼠舒张期左心室后壁厚度;
图28d是各组小鼠收缩期左心室后壁厚度;
图28e是各组小鼠收缩期左心室内径;
图28f是各组小鼠收缩期左心室内径。
图29是各组小鼠散斑多普勒血流成像检测FeCl
图30是不同组别对凝血的影响与安全性的结果,其中:
图30a是各组血流比值变化曲线;
图30b是各组血栓形成时间;
图30c是各组小鼠断尾后血液流出到出现纤维蛋白丝的凝血时间(n=9);
图30d是各组小鼠断尾后出血到停止出血的出血时间(n=9)。
图31是小鼠心脏组织转录组结果,其中:
图31a是差异基因聚类结果,红色代表上调,蓝色代表相对下调;
图31b是2C组与CLP组比较差异基因分布;
图31c是AC2C组与CLP组比较差异基因分布;
图32是AC2C与CLP的生物功能分析,其中BP、CC、MF分别代表生物过程、细胞成分、分子功能。
图33是AC2C与CLP的全部KEGG分析排名前20的结果。
图34是AC2C与CLP的KEGG分析排名前20的上调通路,通路及功能柱状图按照-log10(padj)绝对值大小从左向右排序。
图35是AC2C与CLP的KEGG分析排名前20的下调通路,通路及功能柱状图按照-log10(padj)绝对值大小从左向右排序。
图36是不同组别调节的部分基因RT-PCR验证结果,其中:
图36a是各组IL6mRNA表达水平;
图36b是各组JAK3mRNA表达水平;
图36c是STAT3mRNA表达水平;
图36d是各组CSF3表达水平;
图36e是各组SOCS3mRNA表达水平。
图37是PMA刺激中性粒细胞形成NETs的荧光代表性图片。
图38是PMA刺激中性粒细胞形成NETs荧光统计结果。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。实施例1:ACT001的稳定性与对脓毒症治疗的药效学评价
(一)、ACT001的药物稳定性检测
按照标准溶液的配制方法确定ACT001标准曲线,如图1所示,回归方程y=9643X-216.31,R
SPSS16.0统计软件对各组数据进行单因素方差分析(one-way ANOVA),将P<0.05视为具有统计学意义,与0h相比***p<0.001,***p<0.001,与48h相比###p<0.001。
ACT001是小白菊、辛夷、黄兰等中药材中所共有的一种成分小白菊内酯的改造化合物,通过化学修饰增加了其水溶性。在动物实验中将其溶解于PBS中作为注射液通过尾静脉注射的方式对小鼠进行给药,为了监测其在水溶液中是否稳定,通过高效液相色谱(HPLC)对配制后不同时间点的溶液浓度进行了测定,以确定在动物实验过程中其浓度是否改变从而确定药效是否稳定以及药物保存条件。通过HPLC检测得到以下结论:
1、ACT001水溶液在4℃冰箱中存放并用封口膜密封的条件下在0h、48h、96h三个时间点检测结果中ACT001的浓度无显著性变化,而在常温存放条件下的同期配制的ACT001则发生了非常显著的浓度降低说明发生了降解。
2、实验中配制的药物需要配制后应立即分装并封口,保存在4℃冰箱中并于96h内使用完毕,大于这个时间的最好于-20℃冰箱中冷冻保存使用前恢复到常温,或现配现用。
(二)、ACT001对脓毒症模型小鼠的药效评价
试验小鼠:
本发明中所有试验均通过天津中医药大学试验动物伦理委员会(天津,中国)批准,并按照其指导原则实施(许可证号:TCM-LAE-20170017)。所用动物为SPF级雄性ICR小鼠,7周龄,体积重23±2g,购自北京维通利华试验动物科技有限公司(中国北京市,证书编号:京SCXK 2018-0011)。饲养条件:恒温22℃、相对湿度40±5%,小鼠可自由获取商品无菌鼠粮和纯净水,光照黑暗循环各12h。小鼠适应性喂养一周后用于实验。
药物配制:
精密称取ACT001粉末28.4mg,溶于1mLPBS中,充分溶解后得到无色透明的ACT001储存液,浓度为28.4mg/mL,每只小鼠的给药剂量为2-200mg/kg/天,将配制好的ACT001储存液用PBS稀释20倍即得到使用浓度的药物,混匀后分装为1mL每管,封口膜封口后将使用量的药物放4℃冰箱备用,多余的-20℃冰箱中保存。
分组及药物干预方法:
小鼠分组为:假手术(sham)组、CLP(盲肠结扎穿刺)组、ACT001组、XBJ(血必净)组。实验前给药一天,通过尾静脉注射给药,CLP手术后2h开始给药,给药周期为12h/次,血必净给药体积为9mL/kg/次,sham组与CLP组给与等体积的生理盐水作为代替。手术后监测各组小鼠生存死亡情况,连续监测七天。
其中需要强调的是,血必净注射液由红花、川芎、赤芍、丹参和当归五种成分组成,其化学成分复杂,芍药苷、羟基红花黄色素A、丹参素、川芎嗪、阿魏酸等21种化合物的含量较高,具有活血化瘀、溃散毒邪、疏通经络的功效。血必净在脓毒症患者抗凝治疗方面表现出明显优势,于2004年获得中国药监局批准,用于治疗脓毒症,且被列入《脓毒症中西医结合诊治专家共识》。
数据分析:
SPSS16.0统计软件对各组数据进行单因素方差分析(one-way ANOVA),将P<0.05视为具有统计学意义。与Sham组相比#p<0.05,##p<0.01,###p<0.001,与CLP组相比*p<0.05,**p<0.01,***p<0.001。
结果:
每天给药两次,每次的给药浓度为2-50mg/kg,提前给药1天后进行手术观察七天生存率,结果显示25mg/kg/天的给药浓度ACT001显著提升了脓毒症小鼠的生存率,如图3所示。后续选25mg/kg/天的给药浓度进行试验,阐明药效。我们通过体内实验对ACT001的给药方式进行了研究,结果显示注射给药和口服(灌胃)给药均适用于ACT001。为保持实验的一致性,后续实验选择注射给药方式。
如图4所示,在七天生存率实验中,与CLP组相比,ACT001与XBJ都显著提高了脓毒症小鼠的生存率,ACT001组与XBJ组之间没有显著性差异,说明在提高生存率上ACT001与血必净效果相当。ELISA结果表明CLP组与sham组相比IL-6和TNF-α水平显著上调,与CLP组相比ACT001与XBJ治疗组都下调了IL-6和TNF-α。由结果可知,ACT001能显著提高脓毒症小鼠的生存率,并降低小鼠外周血血清中IL-6、TNF-α的浓度,发挥了抑炎效果。
结论:
脓毒休克的死亡率极高,因此对脓毒症小鼠的生存率的影响直接体现出药物对脓毒症治疗的药效。本实验通过小鼠的生存率改变对ACT001的使用浓度及给药方法进行了筛选,并与XBJ进行了生存率改变的对比,同时使用ELISA试剂盒检测了两种药物对小鼠体内IL-6、TNF-α这两种炎性因子水平的影响,得到了如下结论:
1、ACT001可以显著提高脓毒症小鼠生存率。
2、与CLP组相比,ACT001与XBJ都能显著的提高小鼠的生存率,说明这两种药物都具有对脓毒症产生治疗的效果显著提高小鼠生存率,ACT001与XBJ两组的统计结果之间没有差异,说明ACT001与血必净效果相当。
3、ELISA结果显示两个药物都能够显著降低脓毒症导致的炎症水平的上升且两种药物之间没有显著性差异,说明ACT001与XBJ具有效果相当的抗炎效果。
(三)、ACT001对脓毒症小鼠心脏形态学的影响
分组:
7周龄ICR小鼠分为sham(假手术)组、CLP组、ACT001组、XBJ组共4组,每组5只,与之前一样,CLP手术前先给药2次,12h/次,按照药效实验同样的动物处理方法对小鼠进行CLP手术,手术结束后2h时开始给药,24h时将所有小鼠安乐死,按照本领域的常规操作取心脏相关组织,并进行切片、染色。
结果:
各组小鼠心脏形态学变化如图5所示,拍摄位置为心室腔位置,可以发现CLP手术小鼠心肌严重受损,出现大量的心肌分离和丢失断裂,ACT001与血必净治疗组小鼠的心肌损伤相较于CLP组来说得到了缓解,说明ACT001与XBJ都能够起到心脏保护作用,缓解小鼠的心脏损伤保护心脏结构的完整性。
结论:
通过观察各组小鼠心脏组织切片H&E染色结果可以知道,CLP手术后小鼠心肌形态严重受损,发生了严重的心肌分离和丢失断裂,这可以和超声试验中的心功能损伤相对应,sham组小鼠心肌排布紧密心功能强,CLP组小鼠心肌分离丢失收缩力变弱心功能减弱,经过ACT001与XBJ治疗的小鼠心肌损伤明显好转,说明ACT001与XBJ均具有较好的心脏保护功能。
(四)、ACT001对脓毒症小鼠的心功能的影响
分组:
ICR小鼠分为Sham(假手术)组、CLP模型组、ACT001组、XBJ组,实验前给药一天,通过尾静脉注射给药,CLP手术后2h开始给药,给药周期为12h/次,给药体积为9mL/kg/次,sham组与CLP组给与等体积的生理盐水作为代替。手术后24h时使用高分辨率超声成像系统检测小鼠的心脏功能。
超声心动仪检测小鼠心功能:
按照现有方法,在完成CLP手术后24h时使用Vevo2300型超高分辨率超声心动成像系统对小鼠主动脉和心脏左心室进行血流成像进行经胸超声心动图对小鼠心功能进行检测。为节省时间减少测量间隔,提前使用脱毛膏将小鼠胸部毛发脱去,超声前用三溴乙醇对小鼠进行麻醉,对后将小鼠固定到带有心电图检测系统的加热器上,将四肢固定到电极上,在胸口涂抹足量超声耦合剂后轻轻降下超声探头,贴近胸口,观测屏幕,出现图像后对小鼠和探头位置进行调整直至出现带有乳头肌的心室腔和流出道时锁定鼠板和探头位置,记录图像,每只小鼠记录3个心动周期取平均值,数据分析由超声系统配套软件进行处理。
结果:
小鼠接受CLP手术后24h时通过超声成像系统测定各组小鼠的心功能,用以评价ACT001及其他药物对脓毒症小鼠心脏功能的影响。如图6、图7所示,与sham组相比,小鼠经过CLP手术造成脓毒症后其心脏超声成像检测结果显示射血分数(EF%)降低,左室短轴缩短率分数(FS%)降低,左室后壁舒张期(LVPWd)降低,左室后壁收缩期(LVPWs)增加,左室内径舒张期(LVIDd)增加,左室内径收缩期(LVIDs)增加,显著降低了心功能。ACT001及其单体给药治疗后EF%,FS%,LVPWd,LVPWs,LVIDd,LVIDs结果都得到显著改善。
结论:
人体依赖于循环系统的正常生理功能维持生命。在脓毒症中,保证心脏的正常生理功能是维持患者生命的关键,因此我们在脓毒症模型中检验ACT001是否具有保护心功能的效果。通过小动物超声成像系统检测心功能,从结果分析可以看出小鼠经过CLP手术后与sham相比心输出量(EF%),短轴缩短率(FS%),舒张期左心室后壁厚度(LVPW;d)均降低;收缩期左心室后壁厚度(LVPW;s),舒张期左心室内径(LVID;d),收缩期左心室内径(LVID;s)上升,心脏功能受到了损伤,加重小鼠脓毒症死亡率。反观药物治疗组,被脓毒症下调的心功能参数都得到了显著改善,说明药物具有心脏保护作用,ACT001与XBJ对心功能各项指标的改变无显著性差别,说明ACT001对改善心脏功能具有与XBJ相似的药效。
实施例1的结论为:
1、通过HPLC检测ACT001配制成溶液后0h、48h、96h这三个时间点的浓度,发现浓度无显著性变化,说明ACT001配制成水溶液后在4℃密封条件存放条件下成分稳定,浓度随时间变化不明显,说明在动物实验给药期间药物浓度稳定不变,不存在浓度变化引起的药效改变,增加了结果可信度。
2、ACT001能对脓毒症小鼠起到显著的治疗效果,提高了脓毒症小鼠的生存率,能起到与XBJ相似的药效,在提高生存率方面ACT001与血必净相比虽无显著性差异,但其与sham组的差异要小于CLP组,从生存曲线上也可以看出ACT001的下降速率是要低于XBJ的,且都可显著降低脓毒症小鼠体内炎症因子,说明ACT001在脓毒症治疗方面可以起到和血必净相似的效果。
3、在心脏保护方面小鼠经过CLP造模后心脏功能显著下降,心脏形态学结果显示心脏组织损伤严重,经过ACT001治疗后心脏功能显著恢复,形态学损伤也明显降低了,XBJ在这方面与ACT001效果相似,说明ACT001在心功能保护方面和XBJ具有相似的效果。
实施例2:ACT001的抗凝血效果与安全性评价
(一)、ACT001对中性粒细胞外陷阱网(NETs)形成的影响
CCK8检测体外最适给药浓度:
通过CCK8检测细胞活力的方式测试最佳细胞给药浓度。培养的细胞为RAW264.7巨噬细胞,培养瓶中的细胞消化下来计数后按每孔10000个的细胞密度接种于96孔板中,共设置了6个稀释比例,分别为1:10,1:20,1:50,1:100,1:300,1:500。使用基培将药物进行稀释。细胞在给药前先将全培替换成基培孵育24h,然后吸出所有基培加入带有药物的基培孵育24h。在避光条件下将CCK8试剂用基培稀释10倍后替换掉孔中的药物培养基,包上锡纸继续在孵箱中孵育1h以上,450nm检测OD值,待OD值接近1就可以记录如果所有孔数值都很低就需要继续孵育。测得的OD值按照如下公式计算细胞活力:细胞活力*(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100
A(加药):具有细胞、CCK8溶液和药物溶液的孔的吸光度。
A(空白):具有培养基和CCK8溶液而没有细胞的孔的吸光度。
A(0加药):具有细胞、CCK8溶液而没有药物溶液的孔的吸光度。
中性粒细胞NETs生成:
(1)完全培养基的配制:配制含10%FBS的1640培养基,准备无菌的50mL离心管,将37摄氏度预热的1640基础培养基消毒后放入超净台,过火杀菌后倒45mL在50mL离心管中,在加入5mLFBS和500μL的双抗,过火盖盖后混匀备用,另取50mL离心管分装无血清的1640基培用于冲洗骨髓和配置药物。
(2)骨髓单细胞悬液获取:所用器械酒精消毒后放入超净工作台内紫外灭菌30min,健康小鼠麻醉后脱颈椎处死,浸泡于盛有75%酒精的烧杯中充分浸湿,烧杯喷酒精消毒后放入超净台,双手消毒后进入超净台取出小鼠,剪开小鼠腿部皮肤,剥离肌肉组织,剪开关节连接组织取出股骨和胫骨,浸泡于PBS中,清洗干净,剪去骨头两端,用注射器吸取1640空白培养基,从骨头一端将骨髓冲出到培养皿中,1mL移液枪尽量吹散骨髓,过200目细胞筛得到骨髓单细胞悬液。
(3)Percoll细胞分离液的配制:用0.85%的NaCl水溶液将纯的Percoll液分别配制成浓度为80%,65%,50%的分离液。
(4)中性粒细胞的分离:将配制好的Percoll分离液从高浓度到低浓度依次加入到15mL离心管中,从第二层开始都需要慢慢加以防止分层界面消失,移液枪枪头贴壁接触液面通过慢慢调量程将Percoll液慢慢滴加到管内,加好分离液后,通过加Percoll液同样的方法将得到的骨髓单细胞悬液慢慢加到最上层,随后盖上盖子缠上封口膜后4℃离心机800g离心30min,得到分层的细胞分离液用移液枪伸入第一层和第二层分离液之间的蓬松层吸出该层的细胞,PBS洗3次后加入红细胞裂解液裂解红细胞,再用PBS清洗3次后进行细胞计数,按照计数结果取约2份(一份作为空白对照)100万个细胞的细胞悬液,进行流式细胞检测细胞纯度。
(5)流式细胞检测:取出的约含100万个细胞的细胞悬液4℃350g离心5分钟,弃去上清,用100μLPBS重悬,加入1μLPE-antimouse-Ly6G抗体,4℃冰箱中避光孵育30分钟,4℃350g离心5分钟弃上清,PBS洗两遍后1000μLPBS重悬,上机检测。打开流式细胞仪及软件,选择PE所在通道,开始上机检测,先用空白细胞进行电压调节,调节到细胞基本分布在中间即可,换到标记的细胞,跑约10000个细胞即停止,看标记阳性细胞数量的比例。
(6)种板:将得到的中性粒细胞按每孔10000的密度接种到96孔板中,静置4小时待其贴壁后,分组为对照组(Control),模型组(Model),ACT001组,AC组,XBJ组,给药组每孔均加入动物给药浓度的药物的100倍稀释药物100μL(该浓度由CCK8测试得到),孵育10h后每孔加入0.5μM的PMA刺激4h,诱导中性粒细胞形成NETs,随后固定细胞进行免疫荧光实验,操作流程如下:
(a)4%多聚甲醛固定:吸出孔中的药物,加入100μL 4%多聚甲醛,室温固定30min;
(b)PBS洗板3次,每孔200μL,每次5min;
(c)0.5%Trition打孔(PBS配制),每孔100μL,室温10min;
(d)吸出Trition,PBS洗3次,每孔200μL,每次5min;
(e)5%BSA封闭,每孔100μL,室温封闭1h;
(f)加入一抗,BSA稀释,每孔50μL,4℃过夜;
(g)回收一抗,每孔200μL PBS洗3次,每次5min;
(h)加入二抗(避光),每孔50μL,再加入Hoechst,每孔50μL,避光37℃孵育1h;
(i)1h后,每孔200μL PBS洗2次,每孔加入100μL PBS上高内涵检测。
试剂配制方法:
0.5μM PMA:原浓度5mg/mL,M=616.83g/mol,n=5*10-3g/616.83g/mol=8μM/mL=8mM,8mM→8μM→0.5μM=1μL+999μL基培;
0.5%Trition:50μL Trition X-100+9950μLPBS;
5%BSA:1gBSA+20mLPBS;
一抗:Histone H3 1:300,5%BSA配制;
二抗:1:1000,PBS配制;
Hoechst:1:200,PBS配制。
结果:
CCK8细胞活力结果如图8所示,在6个不同稀释浓度中,1:10和1:20都显著的出现了细胞活力被抑制的现象,与1:50相比几个大稀释倍数组中1:100组细胞活力最高,所以采用1:100稀释度进行细胞实验。
按照本领域技术人员的常用方法诱导中性粒细胞NETs形成,经过Percoll液离心分离后在EP管中可以清晰的看到65%与50%两个浓度层之前有松散的细胞层,吸出该层处理后用流式细胞仪检测中性粒细胞含量大于86%,如图9所示,剩余的基本为细胞碎片。
不同处理组的中性粒细胞组接受PMA诱导后通过检测荧光显示各组对中性粒细胞形成NETs的影响,结果如图10、图11所示,模型组没有接受药物刺激。
结论:
通过CCK8检测细胞活力发现ACT001在细胞上使用最适宜的稀释倍数为1:100,最终浓度为14.2μg/mL。在NETs的实验中也以1:100稀释的方法进行稀释给药。
在脓毒症进程中,中性粒细胞会被募集到感染部位,吞噬病原微生物,从而发挥捕获病原体防止感染扩散的作用。然而,在其发挥作用后一些中性粒细胞会通过特殊的方式形成中性粒细胞外陷阱网(NETs),当NETs形成过多,不能被及时清除时,其中的一些物质如组蛋白会诱发凝血同时该结构也会给血栓提供附着点导致血栓块扩大,恶化弥散性凝血。在实验中通过PMA诱导中性粒细胞形成NETs,发现ACT001与XBJ处理细胞后均能有效降低中性粒细胞外陷阱网的形成,说明ACT001与XBJ均具有抑制NETs形成来抑制体内凝血的药效,且效果相当。
(二)、ACT001对体内凝血的影响
血流成像:
使用FeCl
肝素钠的临床使用浓度为100U/kg,按单位体重的剂量来算,鼠的等效剂量相当于人的6.3倍,换算成鼠的使用浓度则为630U/kg,小鼠按25g/只计算每只每次为630U/kg×0.025kg=15.75U,每只每次注射0.25mL,则浓度为15.75U/kg÷0.025kg=63U/mL,肝素钠安瓿瓶中浓度为12500U/2mL,取0.1mL肝素钠原药加9.9mL PBS即得使用浓度的肝素钠。
5% FeCl
提前4天对小鼠进行给药刺激,所有药物通过尾静脉注射给药,每天2次间隔12h。给药四天后,对小鼠进行实验操作。将小鼠麻醉后放置于鼠板上伸展其四肢并使用胶带固定,放置于活体显微镜下,随后用眼科剪刀沿小鼠颈部中线剪开一条1.5cm小口并用显微镊逐层剥开皮下组织显露出气管,继续在气管的右侧拨开组织找到颈总动脉,小心挑起动脉并轻轻剥离其表面组织同时避免损伤动脉表面刺激其形成血栓。将浸泡于生理盐水中的疏水纸垫于血管下面,作为血流成像背景。
滤纸裁剪为0.5mm宽长度略短于背景纸宽度的小条将其浸泡于5% FeCl
对比各组血栓形成时间与最终血流值作评价药物的抗凝血效果。
药物安全性研究:
血液的正常流通对机体来说异常重要,脓毒症过程中常常发生体内凝血产生血栓堵塞体内微血管,造成组织的营养和氧气供给不足因而发生器官功能障碍和器官衰竭,严重的甚至会出现部分组织坏死进而危机生命。我们通过断尾出血与凝血实验检验ACT001与XBJ对凝血机制的影响。FeCl
断尾出血实验:准备100mL烧杯一个,预热到37℃的生理盐水,白色背景板一块,与烧杯等高泡沫砖一块,将预热的生理盐水倒入烧杯中,烧杯与泡沫砖之间放上背景板,烧杯底部垫上电热毯保持生理盐水温度。将小鼠麻醉后在距离尾尖3mm出切断尾尖并快速将其平躺于泡沫砖上尾巴浸入烧杯中,开始计时,观察出血情况,待血流停止时停止计时。
断尾凝血实验:准备干净的培养皿和玻片,用温水湿润培养皿内部,将干净的玻片放于皿中间,盖上盖子保持内部空气湿润,将小鼠尾尖切断使其自然出血,血液流出时即开始计时,待血滴落到玻片上立即盖上盖子,每隔15秒左右开盖用大头针刺入血滴中并挑起,如观察到纤维蛋白丝即代表凝血,停止计时。
结果:
通过手术暴露出小鼠颈总动脉血管,使用FeCl
结论:
通过FeCl
实施例2说明:
1、通过一系列实验发现ACT001与XBJ都具有体内抗凝效果,在FeCl
2、血液作为载体将营养和氧气送往全身,而心脏则为血液的流动提供充足的动力,心脏功能受损会导致血液流通的动力不足,甚至危及患者生命,所以保护心脏功能有重要的临床意义。ACT001与XBJ都显著抑制了CLP导致的心功能损伤,它们在各项指标中表现略有不同,但均能保护心脏功能,降低心脏形态学损伤。
实施例3:ACT001对小鼠的心功能改善和抗凝的作用机制研究
(一)、小鼠心脏组织转录组测序
分组:
小鼠分组为4组,每组5只,Sham(假手术)组、CLP(模型)组、ACT001组、XBJ组。实验操作与之前的实验一样,术前一天通过尾静脉注射给药两次后进行CLP手术,CLP手术完成2h后开始注射给药,手术后24h将小鼠处死后取出心脏及其他器官,在预冷的生理盐水中清洗掉心腔中残余血液后立即包上锡纸装入冻存管,浸入液氮中速冻,取材结束后转移至-80℃暂时保存等待后续操作。
RNA提取:
提前将研钵后超声清洗后用超纯水清洗,包裹上锡纸用牙签扎几个孔排气,再放入烘箱中160℃、2h干热灭菌,冷却后放入超净台中用于研磨组织提取RNA。
准备足够的冰盒,将组织从-80℃冰箱中取出插冰上拿到超净台外准备进行组织研磨,研钵中加入液氮对研钵进行预冷,在研钵中加入1mL裂解液,将组织放入研钵研磨成匀浆,一个研钵只能研磨一个组织,研磨期间要补充液氮保持低温,得到的匀浆转移到1.5mL的无菌无酶管中通过下列步骤处理:
(a)12000g,4℃,10min离心得到上清液;
(b)步骤(a)中得到的上清液按每1mL体积加入200uL氯仿,混匀分离RNA,12000g,4℃,10min离心得到沉淀;
(c)每1mL裂解液加入500uL异丙醇纯化RNA,12000g,4℃,10min离心得到沉淀;
(d)75%乙醇洗涤RNA,12000g,4℃,10min离心得到沉淀;
(e)加入适量体积的超纯水溶解,得到心脏组织的RNA备用;
(f)使用Nanophotometer分光光度计测量RNA浓度、纯度和完整性。
转录组测序:
提取得到的心脏组织RNA构建基因文库,然后进行Illumina高通量测序。将原始数据中包含的poly-N、adapter和低质量的Reads删除获得Clean Reads以保证下游数据分析的质量和可靠性;然后使用对比软件HISAT2(The Johns Hopkins University,Baltimore,Maryland,United States)将得到的Clean Reads与小鼠基因进行对比,根据看考基因组所在位置,计算每个基因的读取次数;使用Subread软件的Feature Counts工具来量化基因表达水平;使用DESeq2软件进行各组间差异表达的分析,设置变化倍数大于≥1且p≤0.05作为表达差异的显著性阈值。
结果:
如图14所示,各组与CLP组相比的差异基因数量如下
Sham组:共有2662个,上调1234个,下调1428个;
ACT001组:共有1199个,上调884个,下调315个;
XBJ组:共有2149个,上调1546个,下调603个。
在实施例1中已经表明ACT001具有显著的心脏保护作用和抗凝血效果,ACT001和CLP组间的差异基因可望揭示其药效作用的分子机制。
结论:
通过心脏转录组测序,得到了大量数据,并确定了ACT001与CLP组有1903个差异基因,聚类图显示ACT001样品和XBJ基因表达谱与sham组更相似,与CLP组有明显区别,说明ACT001部分逆转了脓毒症造成的基因异常表达,起到一定疗效。
(二)、ACT001转录组数据分析及验证
转录组数据分析:
使用
RT-PCR验证:
通过CLP手术处理一批小鼠,分组与转录组实验分组一致:sham组、CLP组、ACT001组、XBJ组这4组,给药处理与之前保持一致,术后24h时将小鼠安乐死,打开胸腔摘取心脏,在预冷的生理盐水中清洗干净,包上锡纸浸入液氮速冻后转移到-80℃冰箱暂存备用。
将取得的各组小鼠心脏进行研磨获取RNA并检测浓度,构建cDNA文库步骤如下:
(a)按照cDNA合成试剂盒说明进行操作将得到的RNA反转录为cDNA,每个样本的RNA均与Anchored-Oligo(dT),PCR-grade Primer充分混匀溶解在1.5mL无酶离心管中,设置20μL总体积的反应体系,组成如表1所示:
表1反转录体系1
(b)加完上述成分的离心管置于65℃金属浴中加热10min,随后立即插入冰中终止反应,按表2加入所需成分。
表2反转录体系2
加完上述成分后,用移液枪轻轻混匀,室温静置25min后,置于金属浴上加热使Transcriptor Reverse Transcriptase酶失活,55℃~30min,85℃~5min,置于冰上终止反应,-20℃冰箱保存备用或存放于-80℃冰箱中。
(c)按表3所示在1.5mL无酶离心管中加入底物。
表3PCR扩增体系
上表成分为一个孔的底物量,按照需要的孔数计算需要量后进行配置,在八连排的孔中加入上述19μL体系后再加入1μL cDNA模板后吹匀,盖上盖子,瞬离一下以使反应物集中于孔底。
(d)将上述PCR八连排管置于
引物序列如表4所示:
表4引物及序列
蛋白印迹验证:
(i)试剂配制:
10%过硫酸铵(AP):精密称取0.1g过硫酸铵粉末,加入1mL纯水,涡旋混匀,4℃保存。
5×电泳液:依次精密称取15.15gTris、98.35g甘氨酸、5gSDS粉末放入1L干净烧杯中,加800mL纯水,放入超声清洗机中进行超声助溶,全部溶解后转入1L容量瓶中,烧杯中加入少量纯水润洗,将残留的溶液洗下来转入容量瓶,润洗三遍,再向容量瓶中加入纯水直至刻度定容,盖上盖子上下颠倒数次混匀,倒出到干净的瓶子中,4℃冰箱保存,使用时稀释至1×使用,即200mL5×电泳液+800mL纯水混匀既得,可以重复使用3次。
封闭液配置:称取2.5gBSA粉末放于100mL烧杯中加40mLTBS-T溶解后继续加TBS-T到50mL,混匀既得,需要现配现用。
(ii)蛋白提取:
从-80℃冰箱中取出组织,插到冰上,对需要提蛋白的组织称重并裁剪到差不多一致的重量,每mg组织加10ul含1%蛋白酶抑制剂的高效RIPA组织裂解液,准备冰盒将装有组织和裂解液的离心管插入冰里,使用超声组织破碎仪对组织进行破碎,破碎仪的探针尖端必须浸没在液面以下,太靠近液面会瞬间形成大量泡沫无法破碎组织,破碎完成后去除组织碎块,1300g离心5min取上清液,-20℃存放备用。
(iii)蛋白定量:
按照蛋白定量试剂盒的使用说明书配置BCA工作液,BCA试剂:Cu=50:1,根据要检测的样本数量及标准品数量计算需要配置的体积,混匀备用。稀释标准品:在1.5mL离心管中,按表5将浓度为5mg/mL的BSA蛋白标准品进行稀释。
表5标准品配制
按上表准备完标准品梯度稀释液后,按每孔20μL的体积将标准品依次加入到96孔板中,每组设置3个复孔。接下来准备样品,为了节省样品和定量更加准确,将样品稀释15倍,即5μL样品加70μLPBS,混匀后每个样品3个复孔,每孔20μL加入到96孔板中,记录好每个样品对应的孔的位置。
加入配置好的BCA工作液,37℃孵育30min,酶标仪测量562nm处各孔的OD值,根据已知的标准品的浓度与OD值绘制标准曲线,得到回归方程及R2值将各个样品的OD值带入标准曲线方程计算出样品的浓度。
(iv)蛋白变性:
计算好所有蛋白样品的浓度后,取一个最低浓度作为统一浓度(7μg/mL),按比例计算出各个样品需要加入的5×上样缓冲液和PBS的体积,这样可以使所有样品的浓度都一样,跑胶时只需要加一样体积的样品即可达到上样量相同的目的,加完后混匀,95℃金属浴10min使蛋白变性,4℃冰箱短期存放,-20℃长期保存。
(v)分离胶的制备与灌注:
根据目标蛋白的大小选择相应的分离胶浓度,这里目的蛋白为STAT3大小88kD,选择8%的分离胶。准备制胶,将玻板的长板和矮板洗干净,先用洗洁精和刷子洗去可能残余的胶,再用自来水冲洗后用超纯水冲洗干净,用电吹风机迅速吹干,将长板和矮板组合起来置于夹子中间矮板朝向自己,夹紧后放到灌胶架上,夹紧防止漏液。分离胶和浓缩胶配制时各种试剂的加入顺序依次为:双蒸水,丙烯酰胺,Tris缓冲液,SDS,过硫酸铵,TEMED。每加完一种试剂就需要混匀一次,加完过硫酸铵和TEMED后快速彻底混匀,快速沿长板将胶加入玻板中,加约5mL,加至离矮板2cmm左右停止灌注,立即在胶液上面加满双蒸水,等待25min,可根据管中剩余分离胶的凝固情况判断板中的胶液是否凝固,将整个夹板装置倒置在吸水纸上沥干多余的双蒸水。接着配制浓缩胶,配制顺序与分离胶相同,加完过硫酸铵和TEMED后迅速混匀加入玻板直至加满,迅速插入梳子(有字面朝外),等待25min待其凝固。此时可以准备电泳装置,稀释5×电泳液至1×(1L即可),在电泳槽中倒入部分电泳液,胶凝固后取下玻板,两块玻板矮板朝内夹在电泳槽的板架上放入电泳槽,剩余的电泳液从两板中间加入溢出到槽中直至加满,取出梳子。
(vi)加样与电泳:
规划好样品加入位置后按计划的位置和顺序加入marker和样品,加入量为28μg即4μL每孔,每次电泳都需要两块胶,需要好哪块胶加的哪些样品以及在哪一面,转膜时可以在膜上剪上缺口做为区分记号,对好盖子和电泳槽里的电极盖上盖子(红对红,黑对黑),接上电泳仪,调节电压和时间,先60V恒压30min将样品压至分离胶界面,调节电压为100v恒压90min,等到溴酚蓝线快跑出胶的范围时即可停止。
(vii)转膜:
根据内参和目的蛋白的大小估计所需要的膜的大小,剪取相应大小的PVDF膜(稍大于估计的范围),先用甲醇浸泡PVDF膜15min将其激活使其带正电,能够更好的与带负电的蛋白结合,然后在史传仪配备的平衡液中浸泡1min中即可使用。将电泳槽中的玻板取出放入装有超纯水的不锈钢方盘中,用撬板轻轻撬开玻板,彩虹蛋白的标记切去多余的胶,在转膜夹上正极面放一块干海绵,将激活好的膜放在海绵上,迅速将膜也放在膜上防止干膜和干胶,注意胶不能在膜外,在胶上放上另一块干海绵与第一块海绵对齐,夹好夹子插入湿转仪中开始转膜,此过程16min。
(viii)封闭与孵育抗体:
转膜完成后立即取出夹子,打开弃去胶块用镊子取出膜,在TBS-T中泡一下使其冷却,然后放入加有25mL5%BSA的封闭盒中在摇床上常温封闭2h。
孵育一抗:按照抗体说明书用5%BSA稀释抗体,封闭结束后用TBS-T洗膜三遍每次10min,蛋白面(转模时与胶接触的面)朝上加入3mL稀释好的一抗,4℃冰箱过夜(保持水平)。
孵育二抗:取出盒子室温平衡45min,二抗用TBS-T稀释,平衡结束后回收一抗(可重复使用3次),膜用TBS-T洗三遍每次10min,加入稀释好的二抗3mL,摇床上常温孵育2h,回收二抗(可重复使用3次),TBS-T洗三遍每次10min,最后在加入5mLTBS-T防止膜变干。
(ix)检测蛋白条带:
在避光条件下,将ECL发光液的A、B各取1mL混匀备用,取出PVDF膜放入暗盒中,滴加上发光液,静置1min后放入凝胶成像仪中进行曝光,检测蛋白条带。
(x)数据分析:
PCR结果计算公式为:ΔCt=Ct目的基因–Ct基因Gapdh,与对照组进行比较以求ΔΔCt:ΔΔCt=ΔCt样品-ΔCt对照,取2
结果:
利用IPA对ACT001vs.CLP差异基因进行了GO分析和KEGG分析,结果如图15、图16所示,GO结果中排名靠前的都与免疫增强和应对损伤相关,这对脓毒症来说是有益的。图17显示,KEGG分析结果的下调通路中排名第一的是TNF-α信号通路,如前文所述ELISA检测中已经有了TNF-α相应的结果,结果与转录组一致。排名第二的则是JAK-STAT通路,通过查询文献,发现C Wang等人的研究表明抑制STAT3对脓毒症导致的肺损伤有益,Jahangiri,Amirhossein等人的研究发现抑制STAT3可减少HIFI-α依赖的免疫抑制细胞因子的产生从而增强免疫力,Shunyao Xu等人的研究发现STAT3的磷酸化与脓毒症的全身炎症和凝血有关,并且通过使用STAT3抑制剂证明了抑制STAT3的磷酸化可以改善全身炎症和凝血,ACT001相关的文献中有关于其抑制STAT3磷酸化的报道,以上结果支持ACT001通过抑制STAT3或其磷酸化来发挥治疗作用的假说。
本发明的转录组结果显示ACT001下调JAK-STAT信号通路,通过抑制STAT3及其磷酸化来发挥抗炎抗凝作用,进而保护心脏及其它脏器。使用RT-PCR与Western blot对转录组结果进行了验证,结果如图18、图19所示,JAK-STAT通路中的几个基因变化都与转录组一致,与sham组相比,CLP组的JAK3、STAT3、SOCS3显著上调,此外炎症和感染相关的IL6及CSF3也被上调,而在ACT001治疗组的结果中显著抑制了这些脓毒症相关指标的上升。
蛋白免疫印迹实验WB结果验证了mRNA的变化,与sham组相比CLP组的p-STAT3显著上调,ACT001治疗组则显著下调了。
结论:
转录组结果显示与CLP组相比,ACT001治疗组显著下调了JAK-STAT通路,通过RT-PCR对结果进行验证发现ACT001与XBJ组的IL-6显著下调了这与药效学部分ELISA结果一致,两个给药组的JAK3都未出现显著下降,但是STAT3却显著降低,这可能说明ACT001与XBJ可能是通过直接抑制STAT3或其磷酸化发挥作用的,SOCS3的结果显示ACT001可能直接抑制STAT3。SOCS3是STAT3的天然抑制剂,在STAT3过度激活时会使其激活从而发挥负反馈作用抑制STAT3的激活,而从SOCS3的PCR结果来看XBJ组的SOCS3mRNA显著上调,说明XBJ组的STAT3下调可能是SOCS3负反馈作用的结果。ACT001可能直接抑制STAT3或其磷酸化发挥抗凝抗炎作用。为了验证这一假说,我们对其中的STAT3的全蛋白与其磷酸化(p-STAT3)进行了蛋白水平的验证,结果与预期一致。基于Shunyao Xu等人的研究结果,我们认为ACT001通过抑制STAT3的表达及其磷酸化从而降低体内炎症因子表达与凝血因子的活化等,降低脓毒症小鼠死亡率,此外,抑制炎症因子风暴有益于心脏保护,提高脓毒症小鼠生存率。
实施例3的结论为:
1、一次转录实验设置了多个实验组,通过一次转录组测序工作得到了所需要的数据,同时也积累了大量其他药物组合的数据,为后续人员的研究准备了充足的数据供其发掘。
2、转录组分析得到ACT001治疗下调了TNF-α的信号通路与JAK-STAT通路,TNF-α下调与生存实验部分的ELISA检测结果相同,通过查阅文献发现STAT3对脓毒症的影响最高,通过抑制STAT3能够降低脓毒症小鼠的器官损伤,通过PCR与WB检测发现ACT001抑制STAT3mRNA表达,蛋白表达及其磷酸化,说明ACT001可能通过抑制STAT3相关的信号传导从而降低了炎症因子及凝血相关因子的分泌从而发挥抗炎抗凝效果,同时也防止了细胞因子风暴导致的包括心脏在内的器官损伤。
讨论例:
本发明将原本用于治疗肿瘤的小白菊内酯改良化合物ACT001用于脓毒症的治疗,用XBJ作为对比用的阳性药物,并在脓毒症模型小鼠的身上进行了体内药效研究并取得了良好的效果,主要表现如下:
1、提高脓毒症小鼠的生存率:
ACT001是由小白菊内酯改型得到的化合物,原用于肿瘤及帕金森的治疗,且取得了一定效果,由于其来源于小白菊内酯,根据报道小白菊内酯具有抗炎抗凝效果,认为ACT001虽然是小白菊内酯经过化学修饰的产物,但其可能依然存在与小白菊内酯相似的药效,故用脓毒症模型小鼠来检测其对脓毒症的治疗效果,ACT001显著提高脓毒症小鼠生存率,并显著降低脓毒症小鼠血清中促炎因子的水平,防止了细胞因子风暴的产生。
2、体内抗凝血效果:
血液负责将机体从食物吸收的营养物质和空气中获取的氧气运输到各个组织器官以并带走代谢废物以保证机体的正常生命活动,血液在组织中的正常流通对于机体来说显得无比重要。然而在脓毒症感染过程中常常发生体内凝血从而堵塞血管,导致凝血的原因有很多,病原体结构成分如LPS,体内过量的炎性因子,内皮损伤,中性粒细胞外陷阱网的形成等都会导致凝血的发生进而形成血栓,血栓堵塞血管导致组织或器官无法得到充足的氧气和营养的供给从而引发器官功能障碍与器官衰竭,严重的会导致部分器官缺氧坏死,而坏死的器官又会进一步对机体造成破坏,所以抑制凝血对脓毒症的治疗具有重要意义。通过FeCl
3、改善心功能:
心脏为循环系统提供动力,维持脓毒症患者的生命。脓毒症过程中常常并发心脏功能障碍。通过药效学实验发现CLP小鼠的心脏功能显著下降,ACT001治疗组的小鼠心脏功能显著恢复,且病理切片中心肌结构损伤也低于CLP组,显示出ACT001对心脏功能的治疗效果,在Zingarelli,Basilia等人也曾报道小白菊内酯对心脏具有保护作用,ACT001作为其改造物也显示出心脏保护作用。在转录组结果中JAK-STAT通路被显著下调,查询具体基因发现STAT3是最具代表性的一个基因,通过文献查询发现抑制STAT3能够对肺损伤起到治疗作用且能提高免疫力,Shunyao Xu等人的研究更是表明抑制STAT3的磷酸化可以降低体内的凝血与炎症相关细胞因子的水平,且提出STAT3的磷酸化与NF-κB、MAPK、AKT途径相关联,抑制JAK-STAT途径即抑制STAT3的磷酸化的同时NF-κB、MAPK、AKT这三个途径同样受到了抑制,保护了内皮细胞免受LPS的损伤,所以认为ACT001是通过抑制STAT3及其磷酸化来降低了体内的细胞因子水平,防止了细胞因子风暴与弥漫性血管内凝血的发生,从而保护心脏免受细胞因子的损伤从而发挥心脏保护作用。
在JAK-STAT通路中给药组的SOCS3也被显著抑制,而SOCS3是STAT3的抑制剂,自然条件下当STAT3过度激活,SOCS3也会被激活从而抑制STAT3的活力发挥负反馈调节作用,而在ACT001治疗组中SOCS3的水平与CLP相比显著下调,说明对STAT3的抑制作用绝大部分来自于药物,表明STAT3可能受ACT001的调节。
在转录组ACT001vs.CLP的KEGG结果上调部分中排名第一的为细胞外基质受体相互作用(ECM-receptor interaction),在这条通路中纤连蛋白、胶原蛋白、层粘连蛋白等细胞粘附相关的基因都显著上调,联系病理切片的结果,可以推测出小鼠经CLP手术后心脏病理损伤严重,心肌细胞变得松散甚至分离,这可能是导致心功能受损的直接原因,而进过ACT001治疗后上调了细胞粘附相关基因的表达增强了心肌细胞之间的连接从而使得心肌相比模型组变得更为紧密从而增强心脏功能。
4.炎症与凝血及器官损伤的联系:
脓毒症会并发细胞因子风暴,大量的细胞因子会导致内皮损伤和攻击各个器官诱发器官功能障碍和衰竭,内皮损伤会释放出组织因子从而引起凝血,炎症和凝血之间存在较多的关联,一些炎症因子会激活凝血,而凝血也会加重炎症,所以抑制炎症的放大就可以在一定程度上抑制凝血的发生,同时也避免了大量细胞对组织器官造成损伤从而保护器官降低死亡率。
5.ACT001给药方式:
ACT001在治疗肿瘤方面的研究中是通过口服给药的,但是在实验中前期进行药物给药方法试验时发现注射给药和口服给药方法均适用于脓毒症小鼠。为保证实验的一致性,选择了尾静脉注射给药。
改进例
通过成分分析得到了血必净中含量最高的两种化合物:芍药苷和羟基红花黄色素A,经过一定配比得到了一个新配方C0127-2,以下实验中简称2C。经深入研究发现,ACT001与新型化合物组合C0127-2能够联合治疗脓毒症,该药物组合在以下实验中简称AC2C组或AC+2C组,且发现在大部分实验中联用药效明显优于ACT001单用或C0127-2单用。C0127-2的具体成分及浓度为:芍药苷:1.92mg/ml;羟基红花黄色素A:0.582mg/ml。AC2C的具体成分及浓度为:ACT001:1.42mg/ml;芍药苷:1.92mg/ml;羟基红花黄色素A:0.582mg/ml。
(一)、在具体研究过程中设置如下组别,如表6所示。
表6组别种类
将上述组别对脓毒症模型小鼠分别进行注射,由图20可知,ACT001可以显著提高脓毒症小鼠七天生存率。
进一步设置如下组别,如表7所示。
表7组别种类
将上述组别对脓毒症模型小鼠分别进行注射,ACT001可以有效提高CLP小鼠生存(图21)。
(二)、按照标准溶液的配制方法确定芍药苷标准曲线和羟基红花黄色素A标准曲线,分别如图23和图24所示,芍药苷标准曲线的回归方程y=19168X+1189.6,R
分别配制羟基红花黄色素A的2C溶液(记为2C-Q),芍药苷的2C溶液(记为2C-S),ACT001溶液(记为AC),羟基红花黄色素A的AC2C溶液(记为AC2C-Q),芍药苷的AC2C溶液(记为AC2C-S)以及ACT001的AC2C溶液(记为AC2C-AC)。由图24可知,上述6种溶液于4℃条件下在0h、48h、96h三个时间点检测结果中浓度无显著性变化。故建议在4℃条件下于96h内使用完毕。
(三)、按照前文方法设置Sham组、CLP组、XBJ组、AC+2C组、AC组和2C组。由图25a可以看到,相比于XBJ组、AC组和2C组,AC+2C组(ACT001与C0127-2联合组)显著提高了脓毒症小鼠的生存率。从图25b、25c可以看出,AC2C组可以显著下调血清中促炎因子IL-6和TNF-α水平,达到与阳性药XBJ组相似的效果,说明联合给药可能显著缓解因子风暴对脓毒症小鼠的器官损伤。
(四)、7周龄ICR小鼠分为sham(假手术)组、CLP组、XBJ组、AC2C组、ACT001组和2C组,共6组,每组5只,与之前一样,CLP手术前先给药2次,12h/次,按照药效实验同样的动物处理方法对小鼠进行CLP手术,手术结束后2h时开始给药,24h时将所有小鼠安乐死,按照本领域的常规操作取心脏相关组织,并进行切片、染色。
结果如图26所示,结果显示CLP组小鼠心肌形态严重受损,发生了严重的心肌分离和丢失断裂,经AC2C治疗后小鼠心肌损伤明显好转,且联合用药药效明显优于AC或2C单用。
(五)、ICR小鼠分为Sham组、CLP组、XBJ组、AC2C组、ACT001组和C0127-2组,实验前给药一天,通过尾静脉注射给药,CLP手术后2h开始给药,给药周期为12h/次,给药体积为9mL/kg/次,sham组与CLP组给与等体积的生理盐水作为代替。手术后24h时使用高分辨率超声成像系统检测小鼠的心脏功能。
结果如图27、图28所示,结果显示与sham组相比,小鼠经过CLP手术造成脓毒症后其心脏超声成像检测结果显示射血分数(EF%)降低,缩短分数(FS%)降低,左室后壁舒张期(LVPWd)降低,左室后壁收缩期(LVPWs)增加,左室内径舒张期(LVIDd)增加,左室内径收缩期(LVIDs)增加,显著降低了心功能。AC2C及其单体给药治疗后EF%,FS%,LVPWd,LVPWs,LVIDd,LVIDs结果都得到显著改善。
(六)、如前文所述,使用FeCl
(七)、如图31所示,各组与CLP组相比的差异基因数量如下
2C组:共有856个,上调607个,下调249个;
AC2C组:共有1903个,上调1375个,下调528个。
由图31所示,结果显示AC2C组调控基因数量显著多于AC及2C组,显示出联合给药潜在的系统干预优势。
(八)、利用IPA对AC2CvsCLP差异基因进行了GO分析和KEGG分析,并对分析结果进行了PCR验证,结果如图32~图36所示,结果显示GO分析结果中排名靠前的基因都与免疫增强和应对损伤相关,这对脓毒症来说是有益的。KEGG分析结果显示,AC2C调控排名前两名的为补体及凝血级联反应通路与细胞外基质受体信号通路,提示AC2C可能在脓毒症抗凝血和内皮保护方面发挥主要作用。AC2C下调排名第一的为JAK-STAT通路,RT-PCR对转录组结果进行了验证,JAK-STAT通路中的几个基因变化都与转录组一致,与sham组相比,CLP组的JAK3、STAT3、SOCS3显著上调,此外炎症和感染相关的IL6及CSF3也被上调,而在AC2C治疗组的结果中显著抑制了这些指标的上升。
(九)、如前文所述,研究不同处理组的中性粒细胞组接受PMA诱导后通过检测荧光显示各组对中性粒细胞形成NETs的影响,结果如图38所示,模型组没有接受药物刺激。结果显示AC2C、AC及XBJ处理细胞后均能有效降低中性粒细胞外陷阱网的形成,说明ACT001与XBJ均具有抑制NETs形成来抑制体内凝血的药效,且效果相当。
总结论:
通过一系列实验证明ACT001配制成水溶液具稳定性和对脓毒症的治疗效果,可以达到和对照药物血必净相似的药效,体现在一下几方面:
1、通过HPLC测定ACT001配制成水溶液后不同时间点的浓度证明了ACT001的水溶液在4℃密封条件下96h内浓度不随时间改变,证明了ACT001水溶液在动物实验用药期间浓度保持稳定无浓度变化引起的药效改变。但是长期保存还是建议-20℃冻存或者现配现用。
通过ACT001治疗提高了CLP脓毒症模型小鼠的生存率并且降低了体内炎症水平,发挥了抗炎效果。
2、ACT001起到了显著的体内抗凝血效果,转录组分析结果揭示ACT001下调JAK-STAT通路,通过PCR和WB实验发现ACT001下调STAT3表达及其磷酸化,通过已有报道可知ACT001通过抑制STAT3磷酸化可以降低体内的炎症因子水平和与凝血相关细胞因子水平,从而发挥体内抗凝效果,同时降低体内细胞因子水平可以防止心脏受细胞因子攻击而发挥心脏保护作用,另外ACT001还降低了中性粒细胞外陷阱网的形成,这也对抗凝血和器官保护有一定贡献。
3、总之,ACT001通过抑制STAT3及其磷酸化降低体内炎症因子与凝血因子,从而发挥抗凝,抗炎症因子风暴,恢复心功能等效果,进而说明ACT001对其它关键脏器有相似的保护功能,展现其治疗脓毒症的临床应用前景。
4、ACT001与C0127-2联合治疗脓毒症,在动物实验中显现优于二者单独用药的疗效,显著提高脓毒症小鼠的生存率,降低了炎症因子风暴,发挥体内抗凝效果,减轻了脓毒症导致的心肌功能障碍,有望成为一种脓毒症的潜在治疗方案。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- EGR-1基因在制备治疗脓毒症药物中的用途及相关药物
- 岩藻黄素在预防或治疗脓毒症以及制备脓毒症药物的应用
- 一种药物组合物在制备治疗脓毒症药物中应用
