用于组织工程小血管或血管支架的双层薄膜及其制备和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及一种组织工程小血管和血管支架,尤其涉及一种用于组织工程小血管或血管支架的双层薄膜及其制备方法。
背景技术
心血管疾病是威胁人类健康的主要疾病,世界卫生组织最新研究报告显示,2019年全世界死于心脑血管疾病的人数约为1790万人,居各种死因首位。使用组织工程血管或者血管支架介入医疗,因具有创伤小、见效快和手术成功率高等优点,成为心血管疾病治疗的主要手段。
组织工程血管是指仿照理想血管的组成成分和生理功能,制造出拥有一定生物相容性的血管组织替代物。当前大口径人工血管的临床应用效果较为理想,但小口径(直径≤6mm)人工血管的效果却不尽人意,容易形成血栓,而快速内皮化被认为是解决这一问题的关键。这种情况下,组织工程小血管应运而生,其在植入前,先在人造小血管内表面铺展内皮细胞,促使其增殖分化并实现内皮化,这种方式不仅能够降低材料的血小板黏附率以及溶血率,还可以够降低血管内表面的凝血酶原的活性。但是,在人造小血管内种植内皮细胞不仅操作困难,难以形成均匀的细胞层;而且,面对不同的病人以及不同的病变部位,小血管的尺寸也不相同,因此,需要一种简单的构造组织工程小血管的方法,以满足紧急情况下的临床需求。
不同于组织工程小血管,血管支架主要在血管病变段置入以达到支撑狭窄闭塞段血管,减少血管弹性回缩及再塑形,保持管腔血流通畅的目的。现在使用较多的是金属支架,但是金属支架具有血液相容性差和晚期支架内再狭窄等缺陷。相比之下,形状记忆聚合物血管支架不仅具有良好的血液相容性和可加工性,还可在外界刺激下自发产生可控形状回复,撑开病变处狭窄的血管,是目前新型血管支架研究领域的最前沿方向之一。申请号为CN202110353590.6的中国发明专利公开了一种抗再狭窄3D打印自扩张可降解血管支架及其制备方法,该支架通过3D打印制备出的可降解高分子血管支架,可实现水响应自扩张撑开狭窄血管。和组织工程小血管类似,面对不同的病人以及不同的病变部位,所需的血管支架尺寸不同,同样需要一种简单的构造血管支架的方法,以满足紧急情况下的临床需求。
在组织工程小血管方面,因为2D结构易于制造,且容易植入细胞,所以研究人员开发了一种2D支架转化为3D结构的技术。如Cheng等人将平面上的细胞图案化技术和应力引发自卷曲技术结合,实现了多种细胞在三维管状结构上的层状分布,从而可以快速地获得组织工程小血管(Cheng S,et al.Adv Mater 2017;1700171)。但是在血管支架方面,目前尚没有一种能够根据需要快速构建所需尺寸的血管支架的技术。不仅如此,目前还没有一种技术或材料,在紧急情况下,可以根据需要,能够同时快速地获得组织工程小血管或者血管支架。
发明内容
针对上述现有技术,本发明提供一种用于组织工程小血管或血管支架的双层薄膜,该双层薄膜由两层不同厚度的非水溶性聚合物和壳聚糖/聚乙烯醇复合而成,其中壳聚糖/聚乙烯醇可经液体环境刺激产生自卷曲行为,因此,该血管支架可以在再生壳聚糖/聚乙烯醇表面种植内皮细胞,经液体环境刺激自卷曲获得所需尺寸的组织工程小血管;或可以根据需要,制成所需尺寸的血管支架,再进一步的经液体环境刺激实现自扩张。
为了解决上述技术问题,本发明提出的一种用于组织工程小血管或血管支架的双层薄膜,该双层薄膜通过3D打印制得,一层是以壳聚糖/聚乙烯醇配置的打印墨水通过3D打印制得的厚度为0.2~0.4mm的再生壳聚糖/聚乙烯醇薄膜,另一层是以生物相容好的非水溶性可降解聚合物配置的打印墨水通过3D打印在所述的再生壳聚糖/聚乙烯醇薄膜表面上制得厚度为0.4~0.6mm的非水溶性可降解聚合物薄膜。
进一步讲,本发明所述的双层薄膜,其中,所述的非水溶性可降解聚合物为聚己内酯、聚乳酸、聚对二氧环己酮或他们共聚物中的任一种。
同时,本发明还提出了上述双层薄膜的制备方法,包括以下步骤:
1)打印墨水A的制备:将壳聚糖与溶剂按照质量百分比为1~3%加入带有温度计的溶解釜中,于温度40~60℃搅拌溶解,获得再生壳聚糖均相溶液;配制质量百分比为5~10%的聚乙烯醇水溶液;将再生壳聚糖均相溶液与聚乙烯醇水溶液按照质量百分比为10~20%进行混合,得到均相溶液A;随后,在均相溶液A中加入沉淀剂,其中,沉淀剂与均相溶液A的质量百分比为100~200%,获得白色絮状物,经过滤、干燥后可得到打印墨水A;
2)打印墨水B的制备:将光引发剂、光交联剂和乙醇按照质量比为0.1~0.3:0.1~0.3:40~60混合均匀后,获得均相溶液B;随后,在均相溶液B中加入非水溶性可降解聚合物,其中,非水溶性可降解聚合物与均相溶液B的质量比为8~12:1~3,快速搅拌,待乙醇挥发后获得打印墨水B;
3)双层薄膜的制备:将打印墨水A和打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度100~120℃,打印压力600~800kPa进行打印,通过调整3D打印的层数,获得厚度为0.2~0.4mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度90~140℃,打印压强600~900kPa在上述再生壳聚糖/聚乙烯醇薄膜的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,获得厚度为0.4~0.6mm的非水溶性可降解聚合物薄膜,最终制得双层薄膜。
进一步讲,本发明所述的双层薄膜制备方法,其中:
步骤1)中,所述溶剂为稀乙酸、稀苹果酸、稀抗坏血酸中的至少一种。所述沉淀剂为氢氧化钠、氢氧化镁、碳酸氢钠中的一种。
步骤2)中,所述光引发剂为二苯甲酮、甲基二苯甲酮、苯基二苯甲酮中的一种。所述光交联剂为三烯丙基异氰脲酸酯、三甲代烯丙基异氰酸酯、三烯丙基异氰酸酯中的一种。
步骤2)中,快速搅拌时,搅拌速率为500~1000rpm,搅拌温度为20~30℃。
将本发明制备得到的上述双层薄膜在液体环境下自卷曲成组织工程小血管或者进一步地在液体环境下制备具有自扩张功能的血管支架;其中,所述的液体为水、模拟体液、磷酸盐缓冲溶液中的一种。具体应用如下:
将上述双层薄膜用于制备组织工程小血管的应用是:采用厚度为0.4~0.8mm的双层薄膜,该双层薄膜在常温、自然状态下为平面双层薄膜,将该双层薄膜置于液体环境中,经液体环境刺激该双层薄膜自卷曲后成为内径为4.0~6.0mm,壁厚为0.4~0.8mm的管状物。
将上述双层薄膜用于制备具有自扩张功能的血管支架的应用是:将上述自卷曲的管状物置于液体环境中,经液体环境刺激该管状物扩张后的内径为8.0~10.0mm,壁厚基本不变。
与现有技术相比,本发明的有益效果是:
(1)本发明可以根据需要由3D打印获得不同厚度及尺寸的智能薄膜。
(2)该智能薄膜可以根据需求,快速地获得所需尺寸的组织工程小血管或血管支架,以满足紧急情况下的临床需求。
(3)该智能薄膜能够响应液体环境,大大方便了其在人体内的应用。
附图说明
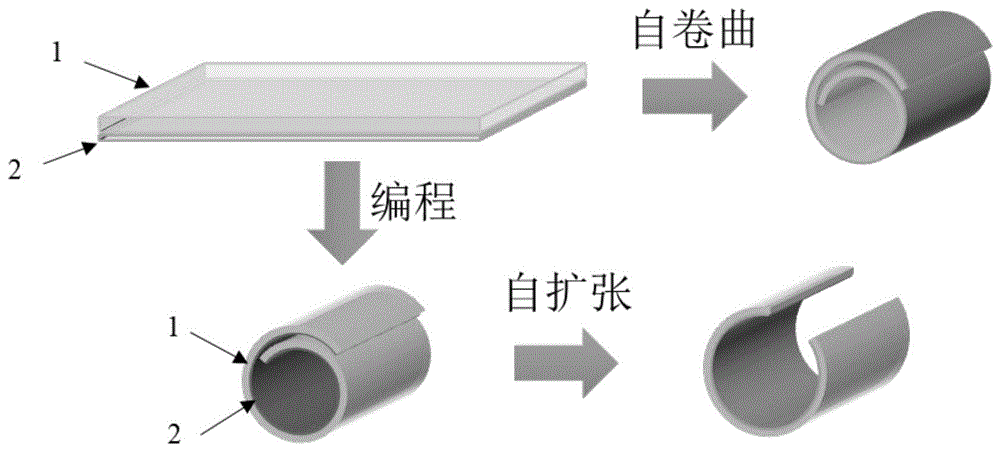
图1是双层薄膜自卷曲及自扩张过程示意图。
图2是双层薄膜自卷曲(a)及自扩张(b)的宏观照片;
图3是商用膨体聚四氟乙烯(ePTFE)、聚己内酯和再生壳聚糖/聚乙烯醇的溶血率,图中,NS表示没有统计学差异(not significant),*表示p值<0.05,p值是统计学上用来判定假设检验结果的一个参数,p值<0.05表示结果具有显著统计学差异。
图4是针对实施例1,内皮细胞分别在聚己内酯和再生壳聚糖/聚乙烯醇表面培养1、3和5天的活死染色照片。
具体实施方式
本发明提出的一种用于组织工程小血管或血管支架的双层薄膜,该双层薄膜由两种打印墨水(分别为生物相容好的非水溶性可降解聚合物和壳聚糖/聚乙烯醇)分别通过3D打印制得,即首先制备再生壳聚糖/聚乙烯醇薄膜,然后在所述的再生壳聚糖/聚乙烯醇薄膜表面上制得厚度为0.4~0.6mm的非水溶性可降解聚合物薄膜。其中,非水溶性可降解聚合物为聚己内酯、聚乳酸、聚对二氧环己酮或他们共聚物中的任一种。该双层薄膜的制备步骤如下:
(1)打印墨水A的制备:将壳聚糖与溶剂按照质量百分比为1~3%加入带有温度计的溶解釜中,于温度40~60℃搅拌溶解,获得再生壳聚糖均相溶液;配制质量百分比为5~10%的聚乙烯醇水溶液;将再生壳聚糖均相溶液与聚乙烯醇水溶液按照质量百分比为10~20%进行混合,得到均相溶液A;随后,将均相溶液与沉淀剂按照质量百分比为40~60%进行混合,获得白色絮状物,经过滤、干燥后可得到打印墨水A;其中,溶剂为稀乙酸、稀苹果酸、稀抗坏血酸中的至少一种,沉淀剂为氢氧化钠、氢氧化镁、碳酸氢钠中的任一种
(2)打印墨水B的制备:将光引发剂、光交联剂和乙醇按照质量比为0.1~0.3:0.1~0.3:40~60混合均匀后,获得均相溶液B;随后,在均相溶液B中加入非水溶性可降解聚合物,其中,非水溶性可降解聚合物与均相溶液B的质量比为8~12:1~3,以搅拌速率为500~1000rpm,搅拌温度为20~30℃进行快速搅拌,待乙醇挥发后获得打印墨水B;其中,光引发剂为二苯甲酮、甲基二苯甲酮、苯基二苯甲酮中的任一种。光交联剂为三烯丙基异氰脲酸酯、三甲代烯丙基异氰酸酯、三烯丙基异氰酸酯中的任一种。
(3)双层薄膜的制备:将打印墨水A和打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度100~120℃,打印压力600~800kPa进行打印,通过调整3D打印的层数,获得厚度为0.2~0.4mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度90~140℃,打印压强600~900kPa在上述再生壳聚糖/聚乙烯醇薄膜的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,获得厚度为0.4~0.6mm的非水溶性可降解聚合物薄膜,最终制得双层薄膜。
由于双层薄膜中的壳聚糖/聚乙烯醇可经液体环境刺激产生自卷曲行为,所述的液体环境为水、模拟体液、磷酸盐缓冲溶液中的任一种。可以根据需要将上述制备得到的双层薄膜在液体环境下自卷曲成组织工程小血管或者进一步制成在液体环境下具有自扩张功能的血管支架,如图1所示。本发明制备得到的厚度为0.4~0.8mm的平面双层膜,经液体环境刺激自卷曲后形成内径为4.0~6.0mm,壁厚为0.4~0.8mm的管状物,将该管状物作为组织工程小血管支架。将上述内径为4.0~6.0mm,壁厚为0.4~0.8mm的管状物制备为自扩张血管支架,所述的管状物进一步经所述液体环境刺激内径可扩张为8.0~10.0mm。
下面结合附图及具体实施例对对本发明进行具体描述,有必要在此指出的是本实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,该领域的技术熟练人员可以根据上述本发明的内容做出一些非本质的改进和调整。
实施例1
将壳聚糖1.5g,乙酸2g,超纯水96.5g,加入带有温度计的溶解釜中,于温度60℃搅拌溶解,获得再生壳聚糖均相溶液;配制质量百分比为8%的聚乙烯醇水溶液,将再生壳聚糖均相溶液15g与聚乙烯醇水溶液85g进行混合制备再生壳聚糖/聚乙烯醇均相溶液;随后,在此均相溶液中加入氢氧化钠100g,获得白色絮状物,经过滤、干燥后可得到打印墨水A。
将二苯甲酮0.2g,三烯丙基异氰脲酸脂0.2g,乙醇50ml,加入溶解釜中混合均匀,获得均相溶液,随后,加入6g聚己内酯,以搅拌速度400rpm,温度26℃进行快速搅拌,待乙醇挥发后获得打印墨水B。
将2g打印墨水A和2g打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度100℃,打印压强800kPa进行打印,通过调整3D打印的层数,获得厚度为0.4mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度90℃,打印压强800kPa在上述壳聚糖/聚乙烯醇层的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,在所述的再生壳聚糖/聚乙烯醇薄膜上获得厚度为0.2mm的聚己内酯薄膜,最终得到由聚己内酯和再生壳聚糖/聚乙烯醇复合而成的双层薄膜。
实施例2
将壳聚糖2g,乙酸2g,超纯水96g,加入带有温度计的溶解釜中,于温度60℃搅拌溶解,获得再生壳聚糖均相溶液;配制10%的聚乙烯醇水溶液,将再生壳聚糖均相溶液15g与聚乙烯醇水溶液85g进行混合制备再生壳聚糖/聚乙烯醇均相溶液;随后,在此均相溶液中加入氢氧化钠沉淀剂100g,获得白色絮状物,经过滤、干燥后可得到打印墨水A。
将二苯甲酮0.1g,三烯丙基异氰脲酸脂0.1g,乙醇40ml,加入溶解釜中混合均匀,获得均相溶液,随后,加入6g聚对二氧环己酮,快速搅拌,待乙醇挥发后获得打印墨水B,其中搅拌速度400rpm,温度28℃。
将3g打印墨水A和1g打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度110℃,打印压强800kPa进行打印,通过调整3D打印的层数,获得厚度为0.6mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度110℃,打印压强800kPa在上述壳聚糖/聚乙烯醇层的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,在所述的再生壳聚糖/聚乙烯醇薄膜上获得厚度为0.2mm的聚对二氧环己酮薄膜,最终得到由聚对二氧环己酮和再生壳聚糖/聚乙烯醇复合而成的双层薄膜。
实施例3
将壳聚糖1g,乙酸1g,超纯水98g,加入带有温度计的溶解釜中,于温度60℃搅拌溶解,获得再生壳聚糖均相溶液;配制8%的聚乙烯醇水溶液,将再生壳聚糖均相溶液20g与聚乙烯醇水溶液80g进行混合制备再生壳聚糖/聚乙烯醇均相溶液;随后,在此均相溶液中加入氢氧化钠沉淀剂100g,获得白色絮状物,经过滤、干燥后可得到打印墨水A。
将二苯甲酮0.2g,三烯丙基异氰脲酸脂0.2g,乙醇50ml,加入溶解釜中混合均匀,获得均相溶液,随后,加入10g聚己内酯/聚对二氧环己酮共聚物,快速搅拌,待乙醇挥发后获得打印墨水B,其中搅拌速度500rpm,温度28℃。
将2g打印墨水A和2g打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度110℃,打印压强800kPa进行打印,通过调整3D打印的层数,获得厚度为0.4mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度100℃,打印压强800kPa在上述壳聚糖/聚乙烯醇层的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,获得厚度为0.4mm的聚己内酯/聚对二氧环己酮共聚物薄膜,最终得到由聚己内酯/聚对二氧环己酮共聚物和再生壳聚糖/聚乙烯醇复合而成的双层薄膜。
实施例4
将壳聚糖2g,苹果酸2g,超纯水96g,加入带有温度计的溶解釜中,于温度60℃搅拌溶解,获得再生壳聚糖均相溶液;配制8%的聚乙烯醇水溶液,将再生壳聚糖均相溶液15g与聚乙烯醇水溶液85g进行混合制备再生壳聚糖/聚乙烯醇均相溶液;随后,在此均相溶液中加入氢氧化钠沉淀剂100g,获得白色絮状物,经过滤、干燥后可得到打印墨水A。
将二苯甲酮0.2g,三烯丙基异氰脲酸脂0.2g,乙醇50ml,加入溶解釜中混合均匀,获得均相溶液,随后,加入10g聚乳酸/聚己内酯共聚物,快速搅拌,待乙醇挥发后获得打印墨水B,其中搅拌速度400rpm,温度28℃。
将2g打印墨水A和2g打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度100℃,打印压强700kPa进行打印,通过调整3D打印的层数,获得厚度为0.2mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度110℃,打印压强800kPa在上述壳聚糖/聚乙烯醇层的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,获得厚度为0.6mm的聚乳酸/聚己内酯共聚物薄膜,最终得到由聚乳酸/聚己内酯共聚物聚和再生壳聚糖/聚乙烯醇复合而成的双层薄膜
实施例5
将壳聚糖2g,苹果酸2g,超纯水96g,加入带有温度计的溶解釜中,于温度60℃搅拌溶解,获得再生壳聚糖均相溶液;配制10%的聚乙烯醇水溶液,将再生壳聚糖均相溶液15g与聚乙烯醇水溶液85g进行混合制备再生壳聚糖/聚乙烯醇均相溶液;随后,在此均相溶液中加入氢氧化钠沉淀剂100g,获得白色絮状物,经过滤、干燥后可得到打印墨水A。
将二苯甲酮0.2g,三烯丙基异氰脲酸脂0.2g,乙醇50ml,加入溶解釜中混合均匀,获得均相溶液,随后,加入10g聚乳酸/聚对二氧环己酮共聚物,快速搅拌,待乙醇挥发后获得打印墨水B,其中搅拌速度400rpm,温度28℃。
将2g打印墨水A和2g打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度110℃,打印压强700kPa进行打印,通过调整3D打印的层数,获得厚度为0.4mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度140℃,打印压强900kPa在上述壳聚糖/聚乙烯醇层的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,获得厚度为0.4mm的聚乳酸/聚对二氧环己酮共聚物薄膜,最终制得由聚乳酸/聚对二氧环己酮共聚物和再生壳聚糖/聚乙烯醇复合而成的双层薄膜。
实施例6
将壳聚糖2.5g,苹果酸2g,超纯水95.5g,加入带有温度计的溶解釜中,于温度60℃搅拌溶解,获得再生壳聚糖均相溶液;配制5%的聚乙烯醇水溶液,将再生壳聚糖均相溶液10g与聚乙烯醇水溶液90g进行混合制备再生壳聚糖/聚乙烯醇均相溶液;随后,在此均相溶液中加入氢氧化钠沉淀剂150g,获得白色絮状物,经过滤、干燥后可得到打印墨水A。
将二苯甲酮0.2g,三烯丙基异氰脲酸脂0.2g,乙醇50ml,加入溶解釜中混合均匀,获得均相溶液,随后,加入10g聚己内酯,快速搅拌,待乙醇挥发后获得打印墨水B,其中搅拌速度400rpm,温度28℃。
将2g打印墨水A和2g打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度110℃,打印压强700kPa进行打印,通过调整3D打印的层数,获得厚度为0.4mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度100℃,打印压强800kPa在上述壳聚糖/聚乙烯醇层的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,获得厚度为0.4mm的聚己内酯薄膜,最终制得由聚己内酯和再生壳聚糖/聚乙烯醇复合而成的双层薄膜。
实施例7
将壳聚糖3g,乙酸3g,超纯水94g,加入带有温度计的溶解釜中,于温度60℃搅拌溶解,获得再生壳聚糖均相溶液;配制6%的聚乙烯醇水溶液,将再生壳聚糖均相溶液10g与聚乙烯醇水溶液90g进行混合制备再生壳聚糖/聚乙烯醇均相溶液;随后,在此均相溶液中加入氢氧化钠沉淀剂200g,获得白色絮状物,经过滤、干燥后可得到打印墨水A。
将二苯甲酮0.2g,三烯丙基异氰脲酸脂0.2g,乙醇50ml,加入溶解釜中混合均匀,获得均相溶液,随后,加入10g聚乳酸/聚对二氧环己酮共聚物,快速搅拌,待乙醇挥发后获得打印墨水B,其中搅拌速度400rpm,温度28℃。
将2g打印墨水A和2g打印墨水B分别加入3D打印机的两个料筒中进行预热;使用打印墨水A以打印温度110℃,打印压强700kPa进行打印,通过调整3D打印的层数,获得厚度为0.4mm的再生壳聚糖/聚乙烯醇薄膜;使用打印墨水B以打印温度140℃,打印压强900kPa在上述壳聚糖/聚乙烯醇层的表面继续进行打印,同时开启紫外灯,紫外波长365nm;通过调整3D打印的层数,获得厚度为0.4mm的聚乳酸/聚对二氧环己酮共聚物薄膜,最终制得由聚乳酸/聚对二氧环己酮共聚物和再生壳聚糖/聚乙烯醇复合而成的双层薄膜。
研究材料
图1为本发明所制备的用于组织工程小血管或血管支架的双层薄膜自卷曲及自扩张过程示意图,其中,附图标记1处为再生壳聚糖/聚乙烯醇薄膜,附图标记2处为非水溶性可降解聚合物薄膜。该双层薄膜可以在液体环境刺激下,由平面薄膜自卷曲为组织工程小血管,也可以由平面薄膜“编程”为管状从而作为血管支架植入体内,本发明中,“自卷曲”是指平面双层薄膜在液体环境下自发卷曲成为管状结构的行为,“编程”是指将平面双层薄膜置于110℃在完全无定形状态下手动卷曲为管状后在0℃中固定临时形状,“自扩张”是指“编程”后的管状支架在液体环境下自发扩张的行为。
(1)在液体环境刺激下的自曲卷和扩张
如实施例1中所述双层薄膜,该双层薄膜经水的刺激展现出了较为明显的自卷曲和自扩张行为,如图2所示,其中,(a)是实施例1制得的双层薄膜自卷曲的宏观照片,标尺:10mm;(b)是(a)所示自曲卷后进一步自扩张的宏观照片,标尺:10mm。双层薄膜自卷曲前为平面双层膜(20×20mm),自卷曲后的直径为5mm;自扩张过程中,自扩张前的直径为6mm,自扩张后的直径为8mm。
(2)血液相容性
无论是组织工程小血管或血管支架,都需要对其血液相容性进行评价,通常情况下,溶血率低于5%意味着对红细胞的伤害很小,其血液相容性较好。对实施例1中制得的双层薄膜进行溶血率实验,所选用血液为新鲜抗凝兔血。由图3可以看出,聚己内酯的溶血率为0.38±0.04%,再生壳聚糖/聚乙烯醇的溶血率为0.41±0.06%,溶血率均低于商业化人工血管膨体聚四氟乙烯(ePTFE)的溶血率0.62±0.06%%,表明该双层薄膜具有很好的血液相容性。同样对实施例2-7进行溶血率实验,结果如表1所示。
表1
(3)生物相容性
内皮细胞是血管组织中最重要的细胞类型,因此,选择内皮细胞来分析双层薄膜的生物相容性。针对实施例1制得的双层薄膜,图4示出了内皮细胞在聚己内酯和再生壳聚糖/聚乙烯醇表面培养1、3和5天的活死染色照片,标尺:100μm。从图4中可以看出,内皮细胞在聚己内酯和再生壳聚糖/聚乙烯醇材料表面增殖较快,在第3天有较多的铺展,并且增殖情况随着培养时间加长而越好,这说明所选用的材料细胞相容性好,可以快速内皮化。
尽管上面结合附图对本发明进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨的情况下,还可以做出很多变化,这些均属于本发明的保护之内。
- 一种双层小口径纳米纤维组织工程血管支架及其制备方法
- 用于组织工程化血管支架构建的功能化取向纤维及其制备方法
