PVDF@PDA-g-PAPTMAC膜材料及其制备方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于分离膜技术领域,具体涉及一种PVDF@PDA-g-PAPTMAC膜材料及其制备方法,另外,本发明还涉及PVDF@PDA-g-PAPTMAC膜材料在肝素分离和蛋白浓缩中的应用。
背景技术
膜材料分离技术是近年来研究比较热的一种新型分离吸附材料,因其具有环境友好、空间要求小、压力低、选择性高、分离效率高等一系列优点而被广泛应用于废水处理、食品、环境、生物医学等领域。而聚偏氟乙烯(PVDF)因其优异的耐化学性能、优异的机械性能和良好的热稳定性而被广泛地作为膜材料应用,其在超滤和微滤(MF)膜、蛋白吸附、固定化和分离、废水处理、质子传导、刺激响应控制释放和生物技术中均具有广泛应用。
肝素是一种糖胺聚糖,是由糖醛酸(L-艾杜糖醛酸IdoA;D-葡萄糖醛酸G1cA)和葡萄糖胺(a-D葡萄糖胺G1cN)组成的具有双糖重复单位的长链黏多糖,由于羧酸和硫酸基的存在而具有高密度的负电荷。作为一种药物,肝素在治疗动脉血栓、心房纤颤、急性冠状动脉综合征和肺栓塞方面有许多应用,除了这一主要应用外,肝素还显示出抗肿瘤细胞增殖、抗炎症、抗转移和抗血管生成的特性。此外它也被广泛应用于与药物输送和组织工程相关的各种技术中。
商业上主要从猪肠粘膜中提取肝素,目前常用到的技术主要包括提取和精制两方面,提取技术主要包括酶解、离子交换、醇沉等,但是上述提取分离技术都存在着工艺繁琐的问题,而现有技术中也没有报道采用膜材料对肝素进行选择性吸附分离纯化的研究。
发明内容
基于上述背景问题,本发明旨在提供一种PVDF@PDA-g-PAPTMAC膜材料,能够选择性吸附肝素,并且在连续过滤体系中可实现对蛋白质的浓缩;本发明的另一目的在于提供PVDF@PDA-g-PAPTMAC膜材料的制备方法和应用。
为实现上述目的,一方面,本发明实施例提供的技术方案是:
PVDF@PDA-g-PAPTMAC膜材料,包括PVDF膜、锚定在所述PVDF膜表面的PDA以及接枝在所述PDA上的PAPTMAC。
另一方面,本发明实施例提供一种PVDF@PDA-g-PAPTMAC膜材料的制备方法,通过多巴胺自聚合在PVDF膜表面锚定一层PDA,再通过原子转移自由基聚合法将PAPTMAC接枝到PDA上。
在一个实施例中,先在PVDF膜表面通过多巴胺自聚合锚定一层PDA得到PVDF@PDA膜;之后在所述PVDF@PDA膜上接枝引发剂得到PVDF@PDA-Br膜,最后在PVDF@PDA-Br膜上通过原子转移自由基聚合法接枝PAPTMAC即可得到PVDF@PDA-g-PAPTMAC膜材料。
在一个实施例中,PVDF@PDA-g-PAPTMAC膜材料的制备方法包括以下步骤:
S1、将PVDF膜浸泡在pH=8.5的多巴胺的Tris-HCl缓冲液中,与氧气接触,并进行振摇处理,之后将膜用乙醇和水洗涤,经干燥后得到PVDF@PDA膜;
S2、将PVDF@PDA膜浸泡在二氯甲烷溶液中,冰浴条件下加入三乙胺,搅拌均匀后滴加2-溴异丁酰溴,之后在氮气氛围下进行反应,反应结束后依次用丙酮、乙醇和蒸馏水洗涤即可得到PVDF@PDA-Br膜;
S3、将PVDF@PDA-Br膜浸泡在甲醇水溶液中,在搅拌条件下加入溴化亚铜,之后充氮气去除氧气,然后在氮气氛围下加入由(3-丙烯酰胺丙基)-三甲基氯化铵和三[2-(二甲氨基)乙基]胺配制的脱氧溶液进行反应,反应结束后用蒸馏水洗涤即可得到PVDF@PDA-g-PAPTMAC膜材料。
进一步地,S1步骤中,所述多巴胺的Tris-HCl缓冲液中多巴胺的浓度为2-5mg/mL,振摇处理时的温度为20-30℃,振摇时间为14-18h。
进一步地,S2步骤中,反应温度为20-30℃,反应时间为20-30h。
进一步地,S3步骤中,反应温度为20-40℃,反应时间为30-240min。
进一步地,S3步骤中,所述脱氧溶液通过将(3-丙烯酰胺丙基)-三甲基氯化铵水溶液、三[2-(二甲氨基)乙基]胺与水的混合液在氮气下鼓泡脱氧形成,且所述脱氧溶液中,(3-丙烯酰胺丙基)-三甲基氯化铵水溶液、三[2-(二甲氨基)乙基]胺与水的体积比为0.8-0.9:0.06-0.07:1。
第三方面,本发明实施例提供上述PVDF@PDA-g-PAPTMAC膜材料在肝素吸附分离中的应用。
第四方面,本发明实施例提供上述PVDF@PDA-g-PAPTMAC膜材料在蛋白质浓缩中的应用。
与现有技术相比,本发明实施例至少具有以下效果:
本发明提供一种PVDF@PDA-g-PAPTMAC膜材料,PAPTMAC的官能团与肝素硫酸盐的官能团之间存在很强的静电相互作用,从而能够用于可选择性吸附肝素,相较于商业上广泛应用的用于回收肝素的Amberlite树脂,本发明的膜材料具有更高的吸附容量,从而提高肝素的回收率,并且相比于吸附剂,本发明的膜材料更加环保,环境友好;此外,本发明的膜材料在连续过滤体系中可实现对蛋白质的浓缩。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍。
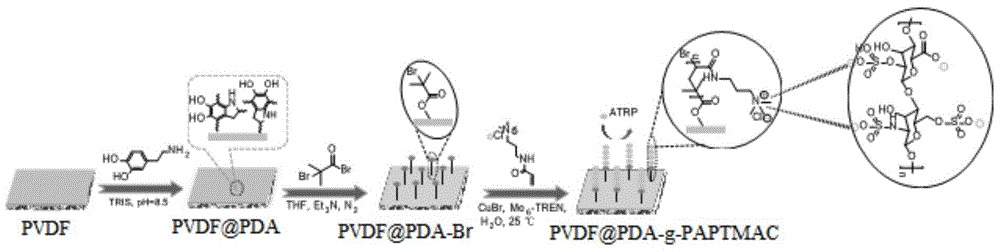
图1为本发明实施例中PVDF@PDA-g-PAPTMAC膜材料的制备示意图;
图2为本发明实施例中M0-M5膜的红外光谱图;
图3为本发明实施例中M0-M5膜的扫描电镜图;
图4为本发明实施例中M5膜和肝素的Zeta电位图;
图5为本发明实施例中M0-M5膜的静态接触角测试结果图;
图6为本发明实施例中M0-M5膜的动态接触角测试结果图;
图7为本发明实施例中M0-M5膜的水通量测试结果图;
图8为本发明实施例中M0-M5膜对肝素的通量和截留率的测试结果图;
图9为本发明实施例中M5膜在静态下的再生性能测试结果图;
图10为本发明实施例中M5膜对蛋白质的通量和截留率的测试结果图;
图11为本发明实施例中M5膜对蛋白质浓缩性能测试结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
为了解决现有肝素分离技术存在的问题,本发明实施例提供一种PVDF@PDA-g-PAPTMAC膜材料,PAPTMAC的官能团与肝素硫酸盐的官能团之间存在很强的静电相互作用,从而能够用于可选择性吸附肝素,相较于商业上广泛应用的用于回收肝素的Amberlite树脂,本发明的膜材料具有更高的吸附容量,从而提高肝素的回收率,并且相比于吸附剂,本发明的膜材料更加环保,环境友好。
需要说明的是,本发明实施例中使用的PVDF膜采用非溶剂诱导相分离法(NIPS)制备而成,具体制备方法包括以下步骤:
将质量分数为2%的PVP成孔剂混合到质量分数为82%的DMF溶剂中,在60℃下超声30min,使成孔剂分散均匀;然后在铸膜液中加入16%的PVDF粉末,在60℃下搅拌24h,得到均匀的溶液;将铸膜液静置12h去除气泡,之后用250μm厚的铸膜刀流延至玻璃板上,立即在凝固浴中进行相转移;最后将膜置于新制的去离子水中,25±3℃保存24h,去除残留溶剂即可。
接下来将通过具体实施例对本发明的技术方案进行描述。
实施例1
PVDF@PDA-g-PAPTMAC膜材料,其制备示意图如图1所示,具体通过以下步骤制备而成:
S1、将PVDF膜浸泡在含2mg/mL的多巴胺的Tris-HCl(pH 8.5)缓冲液中,与氧气接触,在20℃下振摇18h,之后将膜用乙醇和水反复洗涤以去除弱结合聚多巴胺,经60℃减压干燥后得到PVDF@PDA膜;
S2、将PVDF@PDA膜浸泡在100mL二氯甲烷溶液中,在冰浴条件下加入1.4mL(10mmol)三乙胺,磁力搅拌30min后,将1.25mL的引发剂2-溴异丁酰溴(10mmol)通过滴液漏斗缓慢计入反应溶液中,之后在氮气氛围下于20℃反应30h,反应结束后依次用丙酮、乙醇和蒸馏水反复洗涤即可得到PVDF@PDA-Br膜,将PVDF@PDA-Br膜保存在去离子水中备用;
S3、将PVDF@PDA-Br膜浸泡在160mL体积分数为50%甲醇水溶液中,在磁力搅拌条件下快速加入350.5mg溴化亚铜(2.44mmol),之后充氮气5min去除氧气,然后在氮气氛围下加入由(3-丙烯酰胺丙基)-三甲基氯化铵(APTMAC)和三[2-(二甲氨基)乙基]胺(Me
其中,脱氧溶液通过将8mL APTMAC单体(75wt%水溶液)、0.6ml Me
实施例2
PVDF@PDA-g-PAPTMAC膜材料,通过以下步骤制备而成:
S1、将PVDF膜浸泡在含5mg/mL的多巴胺的Tris-HCl(pH 8.5)缓冲液中,与氧气接触,在30℃下振摇14h,之后将膜用乙醇和水反复洗涤以去除弱结合聚多巴胺,经60℃减压干燥后得到PVDF@PDA膜;
S2、将PVDF@PDA膜浸泡在100mL二氯甲烷溶液中,在冰浴条件下加入1.4mL(10mmol)三乙胺,磁力搅拌30min后,将1.25mL的引发剂2-溴异丁酰溴(10mmol)通过滴液漏斗缓慢计入反应溶液中,之后在氮气氛围下于30℃反应20h,反应结束后依次用丙酮、乙醇和蒸馏水反复洗涤即可得到PVDF@PDA-Br膜,将PVDF@PDA-Br膜保存在去离子水中备用;
S3、将PVDF@PDA-Br膜浸泡在160mL体积分数为50%甲醇水溶液中,在磁力搅拌条件下快速加入350.5mg溴化亚铜(2.44mmol),之后充氮气5min去除氧气,然后在氮气氛围下加入由(3-丙烯酰胺丙基)-三甲基氯化铵(APTMAC)和三[2-(二甲氨基)乙基]胺(Me
其中,脱氧溶液通过将9mL APTMAC单体(75wt%水溶液)、0.7ml Me
实施例3
PVDF@PDA-g-PAPTMAC膜材料,通过以下步骤制备而成:
S1、将PVDF膜(M0)浸泡在含2mg/mL的多巴胺的Tris-HCl(pH 8.5)缓冲液中,与氧气接触,在25℃下振摇16h,之后将膜用乙醇和水反复洗涤以去除弱结合聚多巴胺,经60℃减压干燥后得到PVDF@PDA膜(M1);
S2、将PVDF@PDA膜浸泡在100mL二氯甲烷溶液中,在冰浴条件下加入1.4mL(10mmol)三乙胺,磁力搅拌30min后,将1.25mL的引发剂2-溴异丁酰溴(10mmol)通过滴液漏斗缓慢计入反应溶液中,之后在氮气氛围下于25℃反应24h,反应结束后依次用丙酮、乙醇和蒸馏水反复洗涤即可得到PVDF@PDA-Br膜(M2),将PVDF@PDA-Br膜保存在去离子水中备用;
S3、将PVDF@PDA-Br膜浸泡在160mL体积分数为50%甲醇水溶液中,在磁力搅拌条件下快速加入350.5mg溴化亚铜(2.44mmol),之后充氮气5min去除氧气,然后在氮气氛围下加入由(3-丙烯酰胺丙基)-三甲基氯化铵(APTMAC)和三[2-(二甲氨基)乙基]胺(Me
其中,脱氧溶液通过将8.5mL APTMAC单体(75wt%水溶液)、0.65ml Me
实施例4
与实施例3不同的是,S3步骤中,反应时间为60min,反应结束后用蒸馏水洗涤即可得到PVDF@PDA-g-PAPTMAC膜材料(M4)。
实施例5
与实施例3不同的是,S3步骤中,反应时间为4h,反应结束后用蒸馏水洗涤即可得到PVDF@PDA-g-PAPTMAC膜材料(M5)。
对上述制备的M0-M5膜的结构进行表征,并对性能进行测试,具体如下所示:
1、红外光谱测试
采用傅里叶变换红外光谱仪(Nicolet 6700,Thermo Fisher Scientific)进行测试,测试范围为4000-400cm
从图2可以看出,M0-M5均在1410cm
对于M3-M5,不同长度的PAPTMAC聚合物刷的在1480cm
对比M3、M4、M5可以看出,当聚合时间从30min增加到90min时,PAPTMAC聚合物刷在3250-3380cm
2、扫描电镜测试
采用扫描电镜(SEM,JSM-6610LV)观察了膜的表面和截面形貌,结果如图3所示。
从图3可以看出,M0初始PVDF膜表面比较光滑,膜表面没有裂纹和明显的包覆物,沉积聚多巴胺后,M1膜表面出现了许多清晰可见的小颗粒物,说明多巴胺通过自聚合涂覆在PVDF膜表面。M3-M5,由于接枝了PAPMTAC聚合物刷后,膜上出现了一层薄膜,初步判断该薄膜是APMTAC的聚合物层,从而验证了PAPTMAC在PVDF膜表面的接枝成功。
此外,由图M0-1—M5-1可以看出,所有膜的截面结构主要由两部分组成:从上表面延伸出的致密的皮层结构,其次是指状的大孔支撑层结构,所有的膜都呈现不对称形态。与原始PVDF膜截面M0-1相比,M1-1—M5-1的表层结构更加致密,原因如下:(1)多巴胺涂覆层浸没在PVDF膜的表面孔隙中,(2)APTMAC通过ATRP聚合成功接枝到膜表面,使膜表面形成一层聚合物层,导致膜表面更加的致密。
3、Zeta电位分析
对M5膜和肝素采用固体Zeta电位分析仪(奥地利-Anton Paar-SurPASS 3)进行测试,测试pH范围3-10,根据ζ-电位估算吸附剂的表面电荷在pH值为3-10的范围内,以评估肝素分子和膜之间的静电相互作用,测试结果如图4所示。
从图4可以看出,肝素作为一种具有众多硫酸盐基团的多功能聚阴离子化合物,在所研究的pH值下都具有负的ζ相电位,这可能是因为肝素结构中的带负电的硫酸盐基团,在这些条件下它们保持永久电离。而本发明制备的PVDF@PDA-g-PAPTMAC膜(M5)的ζ相电位在较宽的pH值(3-10)范围内为正,结果说明了PVDF@PDA-g-PAPTMAC膜与肝素分子之间能够通过静电吸引的作用结合。
4、静态接触角、动态接触角
采用测角仪(JC2000D1,上海中辰数码技术仪器有限公司)对膜的静态和动态水接触角(WCA)在25℃进行测量,以膜的静态接触角和动态接触角来评价膜的相对亲水性和相对疏水性。测试方法为:快速滴入3μL去离子水在样品表面,用专用软件测量其接触角,静态接触角的结果如图5所示,动态接触角的结果如图6所示。
从图5可以看出,原始PVDF膜(M0)的静态水接触角为60.54°,涂层多巴胺后下降到42.43°(M1),表明膜表面涂覆PDA的酚羟基簇有助于提高PVDF膜的亲水性。当PVDF@PDA膜上接上BIBB引发剂时,水接触角增加到67.77°(M2);当APTMAC通过ATRP自由基聚合接枝到膜表面时,与膜M0-M2相比,M3-M5的接触角显著降低,表明带正电的聚合物可以显著提高膜的亲水性。
从图6可以看出,在设定的360s内,接触角随接触时间的增加而减小,且M3-M5膜的动态接触角衰减率较高,证明了PAPTMAC聚合物刷在膜表面成功接枝。
5、纯水通量
纯水通量是衡量分离膜性能的一个重要指标。在25℃条件下,采用末端超滤杯(MSC300,上海摩塑科技设备有限公司)进行纯水膜通量,具体测试方法为:将圆形面积12.56cm
纯水通量JW根据式(1)计算,结果如图7所示。
式(1)中,V为通过膜的体积(L),A为有效膜面积(m
从图7可以看出,原始PVDF膜(M0)由于具有指状大孔支撑层结构,且较薄的表层结构,因此具有较高的水通量。膜表面负载PDA后,会使M1表面结构致密,PDA分子会进入到膜表面的孔结构中,这些原因都会增大水渗透阻力。与膜M0-M2相比,M3-M5的水通量显著降低,这证实了PAPTMAC聚合物刷接枝到膜导致膜的表面结构更加致密,纯水通量降低。
实施例6
PVDF@PDA-g-PAPTMAC膜材料在肝素吸附分离中的应用。
首先,采用有效表面积为10.18cm
从图8可以看出,M3-M5膜对肝素的截留率均大于95%,而M0-M2的肝素截留率较低,一方面可能是接枝在膜表面的PAPTMAC聚合物覆盖膜表面,从而减小了膜孔径和孔隙率,另一方面可能是正电荷通过静电相互作用吸附了肝素,其中M5膜对肝素吸附效率高达95.8%,说明通过吸附作用增大了肝素截留率。
对比M3-M5的截留率可以看出,随着聚合时间的增加,肝素的截留率增加,这表明通过控制聚合时间可以调节肝素截留率。
其次,为研究PVDF@PDA-g-PAPTMAC膜材料的再生性能,以饱和氯化钠为洗脱溶液对吸附饱和的M5膜进行再生,结果如图9所示。
从图9可以看出,在经过6次吸附-脱附循环后,M5膜的吸附量从610降到502μg/cm
实施例7
PVDF@PDA-g-PAPTMAC膜材料在蛋白浓缩中的应用。
采用有效表面积为10.18cm
从图10可以看出,M5膜对BSA的截留率为98.0%,对BSA的吸附率仅为3.9%;从图11可以看出,浓缩液中BSA浓度为8360mg/L,约为初始浓度(458mg/L)的18倍。
由此可知,本发明的膜材料一方面可以实现对大分子蛋白BSA(MW=67kDa)的超滤膜排斥,并通过粒径筛分机制使水分子透过,从而达到对BSA的高度浓度;另一方面,带正电荷的吸附膜可诱导蛋白质分子形成电双层,导致膜表面对BSA产生静电排斥,也会阻碍BSA的透过。因此,由于孔径筛分和静电斥力机制的协同作用,在浓缩比为18.0时,获得了良好的BSA截留效果。
此外,由于PAPTMAC接枝材料具有良好的亲水性和丰富的正电荷密度,吸附膜可以通过氢键和静电相互作用与水分子结合,在膜表面形成致密而稳定的空间位阻排斥水合层,阻碍蛋白质分子接近吸附位点。因此,本发明的膜材料对蛋白质具有良好的防污性能。
应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 高延展性聚酯材料的制备方法及采用该材料制备复合成膜的方法
- 低表面张力PET共聚酯材料的制备方法及采用该材料制备的非涂布低表面张力PET膜
- 一种基于金属有机骨架材料的吸附膜、制备方法及应用
- 一种光热海水淡化用的多孔陶瓷膜材料及制备方法和应用
- 一种基于鸡蛋膜的光催化复合材料及其制备方法与应用
- 一种降温复合膜材料组合物、降温复合膜材料及其制备方法和应用
- 微孔膜材料的电沉积制备方法和微孔膜材料及其应用
