一种基于荧光共振能量转移的人血清AFP-L3检测试剂盒及其检测方法与应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于生物检测技术领域,具体涉及一种基于荧光共振能量转移的人血清AFP-L3%检测试剂盒及其检测方法与应用。
背景技术
肝细胞癌(Hepatocellular carcinoma,HCC)是世界上第六大常见癌症,每年大约有90万患者确诊。同时,肝癌也是全球第三大肿瘤致死成因,大约只有7%的晚期患者生存期超过5年。HCC患者早期临床症状并不明显,多数患者直到肝细胞癌的中晚期才被发现,导致患者错过最佳的治疗时间。因此,要改善疗效,提高患者生存率依赖于提高HCC的早期诊断率,这对于患者的预后也具有重要意义。
传统意义上,研究人员利用血清学生物标志物——甲胎蛋白(AFP)的总浓度检测肝癌,已经有研究表明,HCC患者血清中总AFP的浓度持续上升。但这种方法存在一定的局限性,敏感性弱、特异性低等,AFP在肝脏慢性疾病中(慢性肝炎、肝硬化等)也会有不同程度的升高,且并非所有HCC患者中AFP均会升高。最近的研究表明,不同的肝疾病患者所产生的AFP在糖链上有所区别,根据与扁豆凝集素(LCA)反应的亲和力,AFP存在三种分型,AFP-L1、AFP-L2与AFP-L3,AFP-L1主要来源于良型肝细胞,AFP-L2来自孕妇,AFP-L3则主要来源于癌变的肝细胞,对肝癌的特异性高达95%。美国食品药品监督管理局(FDA)已批准将AFP-L3分析应用于HCC的预警。将AFP-L3占AFP总含量的10%作为阳性临界值,超过该比值表明HCC的发病率超过95%。因此,AFP-L3不仅可以用于HCC的早期诊断,还可以用于疾病预后的判断及复发监测。
目前AFP-L3的常规检测方法有亲和免疫交叉电泳法、亲和印迹法、凝集素酶联免疫吸附试验法(lectin-ELISA)等。这些方法有的已经应用于临床,有的还停留在科研阶段,但其检测的根本原理大都先将AFP-L3与AFP分开后再进行测定,由于检测敏感性和重复性仍需进一步优化,同时检测成本较高,不适合市场大规模运用。基于临床研究和市场应用的需求,迫切需要开发一种可作为AFP-L3定量检测的简便、快速、低成本的检测手段。
荧光共振能量转移(FRET)的原理是当供体分子的荧光光谱与受体分子的激发光谱部分重叠,并且两者之间的距离小于10nm时,供体分子的激发能诱发受体分子发出荧光,同时供体分子自身的荧光衰减。由于FRET具有高灵敏度、低背景和巨大的应用潜力,已经开发了几种基于FRET邻近连接的策略用于检测蛋白特异性糖基化,例如检测EGFR和MUC1的特异性糖型。目前,FRET策略还没有应用到AFP-L3的检测,原因可能是识别AFP-L3标志性核心岩藻糖的凝集素均为大分子蛋白,由于标记分子本身的尺寸过大,导致供受体之间的距离大于10nm,无法发生FRET作用。翘鳞环锈伞凝集素(PhoSL)是一种新型凝集素,分子量小,且对核心岩藻糖有良好的特异性识别能力,此外,它在宽范围的pH和温度下高度稳定,并且在各种缓冲液中高度可溶。这些优势均表明PhoSL有望成为分析AFP-L3的有力工具,并在不久的将来成为诊断试剂。
发明内容
发明目的:针对现有技术存在的问题,本发明提供了一种基于荧光共振能量转移的人血清AFP-L3%检测试剂盒,该试剂盒具有样本损耗量小、检测快速、灵敏度高、选择性良好等优点,可提高肝细胞癌的早期检出率。
本发明还提供基于荧光共振能量转移的人血清AFP-L3%试剂盒的检测方法及其应用。
技术方案:为了实现上述目的,本发明所述一种基于荧光共振能量转移的人血清AFP-L3%检测试剂盒,包括磁珠试剂、核酸适配体试剂、互补DNA试剂、凝集素试剂、AFP标准品、AFP-L3标准品、缓冲溶液I以及缓冲溶液II。
进一步地,所述磁珠试剂为链霉亲和素修饰的磁性微珠溶液,磁珠尺寸在0.1-10μm之间,磁珠溶液浓度为5-10mg/mL。
作为优选,磁珠尺寸为1μm。
进一步地,所述核酸适配体试剂为荧光探针标记的可特异性识别甲胎蛋白AFP的寡聚核苷酸链溶液,浓度为10-100μM,所述核酸适配体序列如SEQ ID NO.1所示。
进一步地,所述互补DNA试剂为生物素修饰的与核酸适配体互补的寡聚核苷酸链溶液,浓度为10-100μM,所述互补的DNA序列如SEQ ID NO.2-SEQ ID NO.6任意所示。
作为优选,所述互补DNA试剂为生物素修饰的与核酸适配体互补的寡聚核苷酸链溶液,浓度为10μM,所述互补的DNA序列如SEQ ID NO.5所示。
进一步地,所述凝集素试剂为荧光猝灭剂修饰的新型凝集素PhoSL-Dabcyl溶液,浓度为200-800ng/mL。
进一步地,标记核酸适配体的荧光探针需与标记凝集素的荧光猝灭剂匹配,荧光探针-荧光猝灭剂为FAM-BHQ1或FAM-Dabcyl或Cy3-BHQ2或Cy5-BHQ3任意一种。
进一步地,所述AFP标准品为AFP-L1与AFP-L3等浓度混合溶液,其总浓度为100-300ng/mL,所述AFP-L3标准品为AFP-L1与AFP-L3不同浓度比例混合溶液,其总浓度为5-10ng/mL,AFP-L3占比0-50%。
作为优选,所述AFP标准品为AFP-L1与AFP-L3浓度1:1混合溶液,其总浓度为200ng/mL,所述AFP-L3标准品为AFP-L1与AFP-L3不同浓度比例混合溶液,其总浓度为8ng/mL,AFP-L3占比0-50%。
进一步地,所述缓冲溶液I组分为10-100mM Tris-HCl,pH 7.5,1-10mM EDTA,1-10M NaCl,0.01%-0.1% Tween-20,所述缓冲溶液II组分为10-100mM PBS,5-10g/L葡萄糖,5-10mmol/L MgCl
本发明所述试剂盒在检测人血清中AFP-L3%的方法,具体包括如下步骤:
(1)在磁珠试剂(链霉亲和素修饰的磁珠,MB-SA)中加入缓冲溶液Ⅰ,洗涤分离,弃上清,加入互补DNA试剂(生物素化互补DNA(C-DNA-Biotin)),震荡混悬,分离,弃上清,构成互补DNA磁珠(C-DNA-MB复合物),经磁性分离与缓冲溶液Ⅰ清洗,获得纯净C-DNA-MB复合物;
(2)将核酸适配体试剂(Aptamer-FL)加入AFP标准品以及缓冲溶液Ⅱ,获得AFP-Aptamer-FL复合物溶液,此外,溶液中还包含过量的游离Aptamer-FL;
(3)将(1)、(2)步所得固体和溶液全部混合,游离Aptamer-FL与C-DNA-MB合成Aptamer-FL-C-DNA-MB复合物,经磁性分离去除Aptamer-FL-C-DNA-MB复合物,获得只含有AFP-Aptamer-FL复合物的溶液;
(4)将(3)步中所得溶液进行荧光光谱测定,测得荧光强度为PL1;
(5)在(3)步所得溶液中加入凝集素试剂(PhoSL-FQ);
(6)将(5)步中所得溶液进行荧光光谱测定,测得荧光强度为PL2;
(7)通过对比PL1与PL2值,计算得到待测血清中AFP-L3%=(PL1-PL2)/PL1。
其中,磁珠试剂为链霉亲和素修饰的磁性微珠溶液,核酸适配体试剂为荧光探针标记的可特异性识别甲胎蛋白AFP的寡聚核苷酸链溶液,互补DNA试剂为生物素修饰的与核酸适配体互补的寡聚核苷酸链溶液,凝集素试剂为荧光猝灭剂修饰的新型凝集素PhoSL溶液。
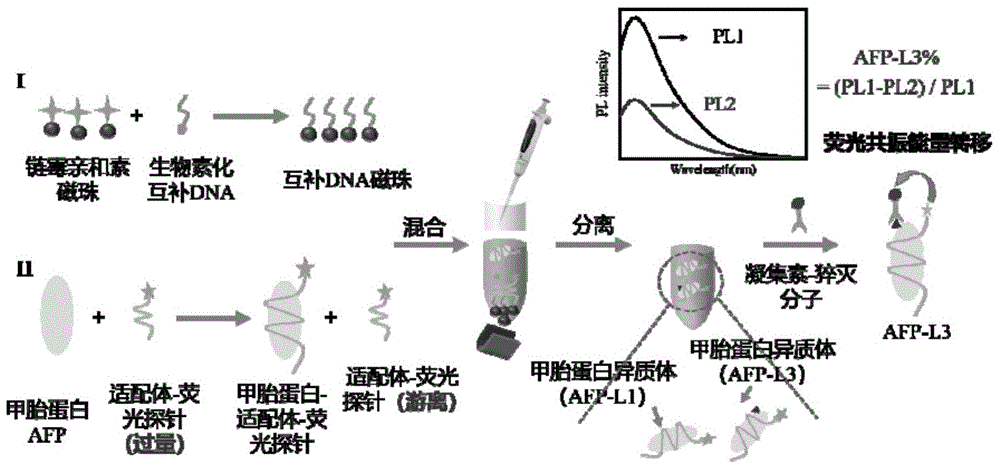
利用该试剂盒进行AFP-L3%检测时,首先将链霉亲和素修饰的磁珠与生物素修饰的互补DNA反应,并将核酸适配体试剂与待测血清中的AFP结合,将上述两溶液混合,利用核酸互补配对原理及磁分离去除多余核酸适配体,测得剩余AFP-荧光探针修饰核酸适配体复合物荧光强度为PL1;进一步,将所获得的复合物与荧光猝灭剂修饰的凝集素作用,发生荧光共振能量转移,测得荧光强度为PL2;通过对比PL1与PL2值,计算得到AFP-L3%=(PL1-PL2)/PL1。
本发明所述基于荧光共振能量转移的人血清AFP-L3%检测试剂盒在肝细胞癌早期检测中的应用。
本发明所述检测试剂盒的检测方法在肝细胞癌早期检测中的应用。
本发明所述检测试剂盒在制备检测人血清AFP-L3%或者肝癌细胞的工具或者试剂中的应用。
目前AFP-L3的常规检测方法有亲和免疫交叉电泳法、亲和印迹法、凝集素酶联免疫吸附试验法(lectin-ELISA)等。这些方法有的已经应用于临床,有的还停留在科研阶段,但其检测的根本原理大都先将AFP-L3与AFP分开后再进行测定,由于检测敏感性和重复性仍需进一步优化,同时检测成本较高,不适合市场大规模运用。基于临床研究和市场应用的需求,迫切需要开发一种可作为AFP-L3定量检测的简便、快速、低成本的检测手段。
现有技术中还没有基于荧光共振能量转移原理的AFP-L3%检测方法,其主要原因在于常规方法使用的凝集素主要包括LCA,ConA等,这些凝集素都是大分子蛋白,本身尺寸较大,无法满足荧光共振能量转移对于荧光供体与受体距离的要求(<10nm),此外,较大的识别分子也带来了较大的空间位阻,造成反应及检测效率的降低。本发明中,创新性地使用PhoSL凝集素,该凝集素仅包含40个氨基酸,尺寸约3-4nm,满足荧光共振能量转移的要求,且空间位阻较小,可有效提高检测效率。
发明原理:本申请提供了一种基于荧光共振能量转移的原理进行AFP-L3的检测方法,供体分子(荧光探针)连接目标蛋白AFP,受体分子(荧光猝灭剂)连接甲胎蛋白异质体上的α-连接甘露糖残基的序列,通过检测荧光强度的变化,定量检测AFP-L3。利用磁珠和互补链DNA通过链霉亲和素和生物素相互作用连接。
选用适配体去识别AFP,适配体相对于抗体来说,有以下几种优势:(1)特异性高,对目标靶分子具有与抗体相当甚至更高的亲和性;(2)适配体较抗体更容易获得,可以大量快速的在体外合成,制备方法更为简单;(3)可以针对不同种类的目标靶进行筛选,拓宽了其应用范围;(4)稳定性优于抗体,利于储存。(5)空间位阻小,更利于发生荧光共振能量转移。选用凝集素去识别甲胎蛋白异质体上的α-连接甘露糖残基的序列,控制凝集素的种类,使得凝集素能有效的捕获AFP-L3,提高后续检测的准确性。
该方法依赖于互补链DNA-适配体与适配体-目标物的竞争反应,通过设计不同长度的互补链,使得互补链不能竞争与目标物结合的适配体。将过量的适配体与目标物先混和,之后再加入适量的互补链,经过筛选后,互补链会与游离的适配体结合,与磁珠一起形成沉淀,溶液中适配体-荧光探针的浓度相当于目标物的浓度,最后加入修饰有猝灭基团的凝集素特异性识别AFP-L3,充分反应后,溶液的荧光强度发生明显的猝灭,最终经计算得出AFP-L3%
有益效果:与现有技术相比,本发明具有如下优点:
(1)本发明首次提出利用基于荧光共振能量转移的荧光分析方法检测人血清中AFP-L3%,创造性地使用PhoSL凝集素,该凝集素仅包含40个氨基酸,尺寸约3-4nm,满足荧光共振能量转移的要求,且空间位阻较小,可有效提高检测效率。
(2)本发明具有样本消耗量少、检测简便、选择性好、灵敏度高和特异性高等优点。
(3)本发明利用适配体以及凝集素等产品去识别目标物,具有特异性高,选择性良好等优势。
(4)本发明可以直接用于检测血清中的AFP-L3%,无需将AFP和AFP-L3分离,即可完成AFP-L3%的检测。
附图说明
图1为本发明试剂盒人血清中AFP-L3%的检测方法;
图2为AFP标准曲线;
图3为AFP-L3%标准曲线;
图4中的4A为本发明建立的检测方法检测人血清AFP-L3%以及试剂盒ELISA检测AFP-L3%的相关性曲线,4B为正常人、肝硬化患者、肝癌患者血清的AFP-L3%检测结果图;
图5互补序列荧光反应对比图。
具体实施方式
药品和试剂:实验中所使用的所有DNA均由上海生工合成。磁珠试剂MB-SA,购于上海阿拉丁S8040-A1μm-1EA;凝集素试剂购于国平药业;AFP-L1以及AFP-L3均购于上海酶联生物,编号分别为ml023557,ml058717;酵母tRNA购于上海默克西格玛,编号为9014-25-9。
缓冲溶液I和缓冲溶液II由实验室配置。
实施例1
一种用于测定人血清中AFP-L3%的试剂盒,所述试剂盒包括磁珠试剂、核酸适配体试剂、互补DNA试剂、凝集素试剂、AFP标准品、AFP-L3标准品、缓冲溶液I和缓冲溶液II。
磁珠试剂为链霉亲和素修饰的磁性微珠溶液,磁珠尺寸为1μm,磁珠溶液浓度为10mg/mL;
核酸适配体试剂为荧光探针标记的可特异性识别甲胎蛋白AFP的寡聚核苷酸链溶液,其中核酸适配体序列如表SEQ ID NO.1所示,核酸适配体浓度为10μM;
互补DNA试剂为生物素修饰的与核酸适配体互补的寡聚核苷酸链溶液,互补DNA试剂浓度为10μM,互补DNA序列如SEQ ID NO.5所示,其他互补DNA序列SEQ IDNO.2-SEQ IDNO.4,SEQ ID NO.6按上述方法,也可以构建出互补DNA试剂。
凝集素试剂为荧光猝灭剂修饰的新型凝集素PhoSL溶液,浓度为200ng/mL;标记核酸适配体的荧光探针需与标记凝集素的荧光猝灭剂匹配,也就是说,荧光探针的荧光发射波长范围需位于荧光猝灭剂的猝灭波长范围中,其中选择荧光探针-荧光猝灭剂FAM-Dabcyl组合,即FAM标记核酸适配体,Dabcyl标记凝集素PhoSL,Dabcyl标记的凝集素PhoSL序列如SEQ ID NO.7所示。其他荧光探针-荧光猝灭剂对如FAM-BHQ1、FAM-Dabcyl、Cy3-BHQ2、Cy5-BHQ3按上述方法,也可以构建出凝集素试剂。
AFP标准品为AFP-L1与AFP-L3浓度1:1混合溶液,其初始浓度为200ng/mL(后续稀释到不同浓度使用);AFP-L3%标准品为AFP-L1与AFP-L3不同浓度比例混合溶液,AFP-L1和AFP-L3总浓度为8ng/mL,AFP-L3浓度占比0-50%(即0-4ng/mL);缓冲溶液I组分为10mMTris-HCl,pH 7.5,1mM EDTA,1M NaCl,0.01%-0.1%Tween-20;缓冲溶液II组分为10mMPBS,4.5g/L葡萄糖,5mmol/L MgCl
表1核酸序列表
实施例2
一种基于所述试剂盒的人血清中AFP-L3%的检测方法,其中按实施例1中试剂盒组成。
如图1所示,第一步,互补DNA磁珠(C-DNA-MB)复合物的制备:
取10μL将链霉亲和素修饰的磁珠(磁珠尺寸为1μm,磁珠溶液浓度为10mg/mL)MB-SA充分混悬,可置于混合器上涡旋振荡20s,移取重悬后的液体MB-SA到新的EP管中,置于磁力架,磁性分离,弃上清液。加入200μL缓冲溶液Ⅰ(10mM Tris-HCl,pH 7.5,1mM EDTA,1MNaCl,0.01%-0.1% Tween-20),充分洗涤磁珠,磁性分离,弃上清。加入10μL,10μM互补DNA试剂(序列如SEQ ID NO.5所示,生物素化互补链DNA(C-DNA-Biotin)),充分震荡混悬,室温下振荡3h,磁性分离,弃上清,构成互补DNA磁珠(C-DNA-MB)复合物,经三次磁性分离与实施例1的缓冲溶液Ⅰ清洗,获得纯净C-DNA-MB复合物固体;
第二步,荧光探针修饰核酸适配体标记目标物甲胎蛋白AFP:
取5μL核酸适配体试剂(Aptamer-FL)(10μM)溶液,加入实施例1制备的AFP标准品(10μL)以及185μL缓冲溶液Ⅱ(10mM PBS,4.5g/L葡萄糖,5mmol/L MgCl
第三步,适配体与目标物及其与互补链之间的竞争反应
将一、二步所得固体和溶液全部混合,重悬,4℃孵育2h,步骤二制备的游离Aptamer-FL与步骤一制备的C-DNA-MB通过碱基互补配对形成双链DNA,经磁性分离,去除沉淀Aptamer-FL-C-DNA-MB复合物,保留上清液,加入50μL缓冲溶液Ⅱ后,获得只含有AFP-Aptamer-FL复合物的溶液。
第四步,荧光检测
将第三步中所得溶液进行荧光光谱测定,激发波长为495nm,测得520nm处荧光强度为PL1。
第五步,凝集素特异性识别AFP上核心岩藻糖
在第三步中所得溶液(200μL)中加入50μL凝集素试剂PhoSL-DabcyL溶液(200ng/mL),充分混合,37℃孵育1h,凝集素PhoSL与AFP-L3上的核心岩藻糖特异性结合,AFP-L3上结合的荧光探针与荧光猝灭剂发生荧光共振能量转移,实现荧光的猝灭。
第六步,荧光检测
将第五步中所得溶液进行荧光光谱测定,激发波长为495nm,测得520nm处荧光强度为PL2。
第七步,AFP或者AFP-L3%的计算
通过对比PL1与PL2值,计算得到待测血清中AFP-L3%=(PL1-PL2)/PL1。
第八步,AFP标准曲线的建立
将实施例1制备的AFP标准溶液按照不同比例稀释使得步骤二体系中终浓度0.2,10,40,80,100,150ng/mL,采用上述一至四步骤测定每个浓度对应PL1值,每个比例溶液平行配制3个重复样品并进行测定,以浓度为横坐标,PL1值为纵坐标,根据梯度AFP标准溶液测定荧光结果绘制标准曲线,如图2所示,检测范围为0.1-100ng/mL,检测限为0.66ng/mL.
第八步,AFP-L3%标准曲线的建立
保持AFP总浓度不变,将改变AFP-L1和AFP-L3的浓度比例(AFP-L3%浓度占比分别为3.13%,6.25%,12.5%,25%,50%)采用上述一至七步骤测定每个比例溶液对应PL1、PL2值,每个浓度平行配制3个重复样品并进行测定,以AFP-L3%为横坐标,(PL1-PL2)/PL1值为纵坐标,根据梯度AFP-L3%标准溶液测定荧光结果绘制标准曲线。如图3所示,再根据标准曲线计算待测血清样品中AFP-L3%。
实施例3
本试剂盒及AFP-L3%测试方法在肝疾病检测中的应用
收集肝癌患者、肝硬化患者和正常人的血清样品,1-10号分别为:1-4号代表正常人Healthy,5-7号BLD代表肝硬化患者,8-10号HCC代表肝癌患者,每个血清溶液分别用实施例2中AFP-L3%检测方法以及标准ELISA方法测定AFP-L3%,并对测定结果进行比较。所得结果如图4所示,线性曲线如图4A所示,两者测定的结果呈现高度一致性,表明本发明的真实性、可靠性。将正常人Healthy、肝硬化患者BLD、肝癌患者HCC的AFP-L3%检测结果进行对照,发现肝癌患者的AFP-L3%超过临界值10%,肝硬化患者以及健康人的AFP-L3%都低于10%,如图4B所示,表明本发明的真实性、可靠性。本发明的检测结果与市面上ELISA试剂盒的检测结果呈现高度一致性,表明本发明的准确性。将正常人、肝硬化患者、肝癌患者血清样品的AFP-L3%检测结果进行对照,发现肝癌患者的AFP-L3%超过临界值10%,肝硬化患者以及健康人的AFP-L3%都低于10%
ELISA试剂盒只能单个的检测AFP-L1或者AFP-L3的浓度,最后通过对比才能得到AFP-L3%,本发明的方法只要知道了线性曲线,就能知道AFP-L3%。综上所述,本发明的试剂盒可用于准确测定人血清AFP-L3%,为肝癌的早期检出率提供有效的参考。
实施例4
互补DNA序列SEQ ID NO.2-SEQ ID NO.6的优化
用分子杂交的方式将不同长度的Aptamer-FAM和C-DNA形成双链复合物。利用实施例2的方法,采用不同的互补DNA试剂,序列如SEQ ID NO.2-SEQ ID NO.6所示,制备不同的C-DNA-MB复合物固体,取5μL50 pmol核酸适配体试剂Aptamer-FL和2ng/mL AFP标准品(10μL)在185μL缓冲液Ⅱ中混合,体积为200μL。然后通过步骤三C-DNA-MB进行竞争反应。在室温下孵育60分钟后,磁性分离,取上清液测量反应体系上清液的荧光强度。激发波长为495nm,发射波长范围为500nm至650nm。阳性对照为等量的Aptamer-FL,显示明显的高荧光信号。理论上,与磁珠混合后会存在两种情况。一是F
- 基于荧光共振能量转移的均相荧光检测血清蛋白的方法
- 基于荧光共振能量转移的均相荧光检测血清蛋白的方法
