一种中国樱桃再生体系的建立方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及植物组培技术领域,具体而言,涉及一种中国樱桃再生体系的建立方法。
背景技术
中国樱桃俗称小樱桃,是蔷薇科(Rosaceae)樱属(Cerasus)的多年生木本果树,在我国已有3000年的栽培历史,其果实风味浓郁,外观鲜艳,具有极高营养、保健和经济价值。当前,中国樱桃生产中存在果实偏小、酸度偏高、不耐储运等缺点,亟需进行种质创新及遗传改良,培育综合性状优良的中国樱桃新品种。
植物离体再生技术是种质创新、遗传改良等研究的基础。目前,用于建立植物离体再生体系常用的外植体包括叶片、子叶、胚轴及茎段等器官。近年来,有研究者以‘Summit’、‘SL64’、‘CAB-6P’、‘Gisela 5’和‘Gisela 6’等的离体叶片为外植体获得欧洲甜樱桃再生植株的报道。目前中国樱桃再生体系的建立还鲜见报道,仅有以中国樱桃叶片为外植体进行不定芽诱导的研究,且诱导效果不理想。
中国樱桃再生体系建立难度大,存在愈伤组织易褐化、再生困难、再生频率低等许多问题,但高效、稳定的再生体系是遗传转化体系的关键步骤。因此,建立一种高效稳定的中国樱桃再生体系是亟待解决的问题,也将为中国樱桃种质创新及遗传改良提供技术支撑。
有鉴于此,特提出本申请。
发明内容
现有技术的问题在于中国樱桃再生体系建立难度大,存在愈伤组织易褐化、再生困难、再生频率低等许多问题,本发明目的在于提供一种中国樱桃再生体系的建立方法,以中国樱桃子叶为外植体,诱导分化出芽和根,构建中国樱桃子叶再生体系的方法,解决了中国樱桃再生困难等问题。
本发明通过下述技术方案实现:
一种中国樱桃再生体系的建立方法,包括以下步骤:
(1)材料预处理:将中国樱桃的果核破除种壳,取出完整种胚;
(2)灭菌:将种胚依次用75%酒精和0.1%升汞浸泡灭菌;
(3)无菌苗培养:将灭菌处理过的种胚接种于培养基上,暗培养使其萌发幼苗;
(4)不定芽诱导:当中幼苗生长至两叶一心状态,切下子叶,接种于不定芽诱导培养基,暗培养后转光下培养;
(5)生根培养:当培养材料长至2-3cm时,转到生根培养基,光下培养得到组培苗;
(6)移栽:将组培苗移栽到灭菌后的基质中培养,获得根系发达的中国樱桃完整植株。
本发明以中国樱桃花后30-36d的子叶作为外植体,诱导分化出芽和根,能够高效完成离体再生,完整保留中国樱桃的遗传性状,构建了高效稳定的中国樱桃子叶再生体系,解决了中国樱桃再生困难的问题。
本发明一种中国樱桃再生体系的建立方法,其具体步骤如下:
(1)材料预处理:将放于4℃条件下冷藏30d后的中国樱桃果核用尖嘴钳破除种壳,取出完整种胚;
(2)灭菌:将经步骤(1)处理过的所述中国樱桃种胚用酒精浸泡30-35s后用无菌水冲洗2-3次,再用升汞浸泡6-8min,最后用无菌水冲洗2-3次;
(3)无菌苗培养:将经步骤(2)处理过的所述中国樱桃种胚接种于培养基上,暗培养萌发幼苗;
(4)不定芽诱导:当步骤(3)中幼苗生长至两叶一心状态,切下子叶,切掉近轴端和远轴端的部分子叶后,接种于不定芽诱导培养基,暗培养14d后转至光下培养;
(5)生根培养:当步骤(4)培养材料长至2-3cm时,转到生根培养基,光下培养30-40d;
(6)移栽:将步骤(5)中的所述组培苗移栽到灭过菌的基质中,置于25℃室内环境中培养,获得根系发达的中国樱桃完整植株。
进一步的,步骤(1)中所述的中国樱桃为花后30-36d的中国樱桃。
进一步的,步骤(3)中培养基的组分为:MS+30.0g/L蔗糖+7.0g/L琼脂,pH为5.8-6.0。
进一步的,步骤(3)的培养条件为:温度25±1℃、暗培养的条件下进行幼苗的萌发。
进一步的,步骤(4)中不定芽诱导培养基的组分为:MS+2.0mg/L 6-BA+0.5-0.8mg/LIBA+30.0g/L蔗糖+7.0g/L琼脂,pH为5.8-6.0;培养条件为:温度25±1℃、暗培养14d后转至光照强度为2500Lx,光照时间12h/d的条件下进行不定芽诱导。
进一步的,步骤(5)中生根培养基的组分为:1/2MS+0.5mg/L IBA+30g/L蔗糖+7g/L琼脂,pH为5.8-6.0;培养条件为:温度25±1℃、光照强度为2500Lx,光照时间12h/d的条件下进行再生芽的诱导生根。
进一步的,步骤(6)中基质的成分为:有机质、蛭石、珍珠岩的混合物,三者的比例为3:1:1,培养条件为:温度25±1℃、光照强度为2500Lx,光照时间12h/d的条件下进行培养。
本发明与现有技术相比,具有如下的优点和有益效果:
1、本发明实施例提供的一种中国樱桃再生体系的建立方法,用中国樱桃种胚进行培养得到无菌苗,采用无菌苗子叶作为外植体进行不定芽诱导及生根培养,进行炼苗驯化移栽,获得根系发达的中国樱桃完整植株,建立了一个高效稳定的再生体系,为中国樱桃的工厂化育苗及后续基因功能验证实施奠定基础。
2、本发明实施例提供的一种中国樱桃再生体系的建立方法,以中国樱桃花后30-36d的子叶作为外植体,诱导分化出芽和根,能够高效完成离体再生,完整保留中国樱桃的遗传特性,构建了高效稳定的中国樱桃子叶再生体系,解决了中国樱桃再生困难的问题。
3、本发明实施例提供的一种中国樱桃再生体系的建立方法,使用花后30-36d的中国樱桃种胚,诱导培养基组分为MS+2.0mg/L 6-BA+0.5-0.8mg/L IBA+30.0g/L蔗糖+7.0g/L琼脂,使得中国樱桃子叶再生芽诱导率能够达到33.75%;同时生根培养基的组分为1/2MS+0.5mg/LIBA+30.0g/L蔗糖+7.0g/L琼脂,培养30-40d,生根率达到95%,平均生根数为12根,且根系较粗,有利于移栽成活,能够实现中国樱桃的高效离体再生。
附图说明
为了更清楚地说明本发明示例性实施方式的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
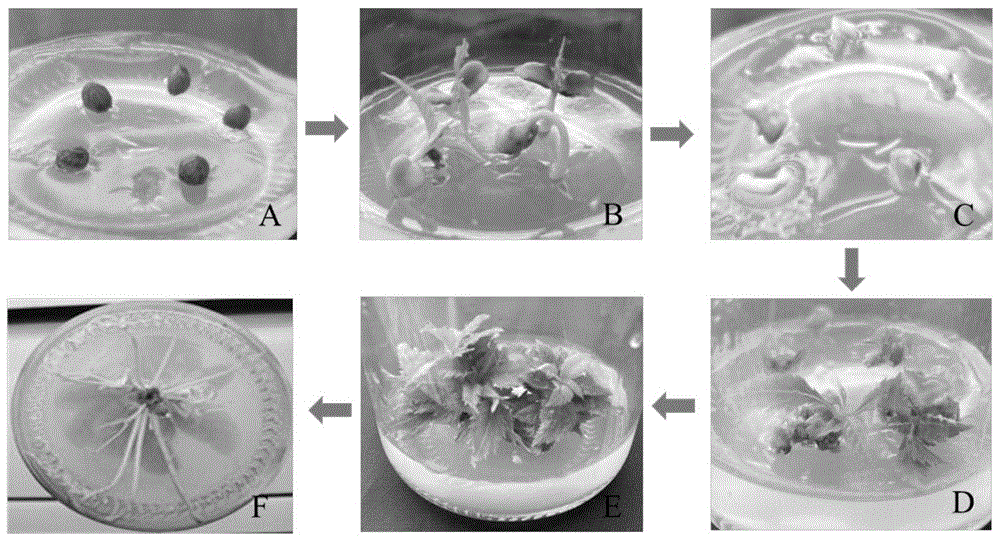
图1为本发明实施例提供的中国樱桃‘红妃’胚培养及子叶再生体系流程图;
A为中国樱桃‘红妃’种胚培养;B为中国樱桃‘红妃’种胚萌发出无菌苗;
C为中国樱桃‘红妃’子叶剥离;D为中国樱桃‘红妃’子叶诱导出不定芽;
E为中国樱桃‘红妃’不定芽增殖;F为中国樱桃‘红妃’不定芽生根。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例和附图,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
在以下描述中,为了提供对本发明的透彻理阐述了大量特定细节。然而,对于本领域普通技术人员显而易见的是:不必采用这些特定细节来实行本发明。在其他实施例中,为了避免混淆本本发明,未具体描述公知的材料或方法。
在整个说明书中,对“一个实施例”、“实施例”、“一个示例”或“示例”的提及意味着:结合该实施例或示例描述的特定特征、结构或特性被包含在本发明至少一个实施例中。因此,在整个说明书的各个地方出现的短语“一个实施例”、“实施例”、“一个示例”或“示例”不一定都指同一实施例或示例。此外,可以以任何适当的组合和、或子组合将特定的特征、结构或特性组合在一个或多个实施例或示例中。此外,本领域普通技术人员应当理解,在此提供的示图都是为了说明的目的,并且示图不一定是按比例绘的。这里使用的术语“和/或”包括一个或多个相关列出的项目的任何和所有组合。
在本发明的描述中,术语“前”、“后”、“左”、“右”、“上”、“下”、“竖直”、“水平”、“高”、“低”“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明保护范围的限制。
实施例1
如图1所示,本发明实施例提供一种中国樱桃再生体系的建立方法,以中国樱桃‘红妃’子叶为外植体,完成离体再生,包括以下步骤:
(1)材料预处理:采集花后30d的中国樱桃‘红妃’果实,去除果肉,洗净果核,置于4℃下冷藏30d后,用尖嘴钳破除种壳,取出完整种胚;
(2)灭菌:将经步骤(1)处理过的所述种胚用75%酒精浸泡30-35s,用无菌水冲洗2-3次,再用0.1%升汞浸泡6-8min,用无菌水冲洗2-3次;
(3)无菌苗培养:将经步骤(2)处理过的所述种胚接种于培养基上,暗培养萌发幼苗;幼胚萌发的培养基组分为:MS+30.0g/L蔗糖+7.0mg/L琼脂;
(4)不定芽诱导:当步骤(3)中幼苗生长至两叶一心状态,切下子叶,切掉近轴端和远轴端的部分子叶后,接种于不定芽诱导培养基,暗培养14d后转光下培养;不定芽诱导培养基的组分为:MS+2.0mg/L 6-BA+0.5mg/L IBA+30.0g/L蔗糖+7.0mg/L琼脂;
(5)生根培养:当步骤(4)培养材料长至2-3cm时,转到生根培养基,光下培养30-40d;生根培养基的组分为:1/2MS+0.5mg/L IBA+30.0g/L蔗糖+7.0mg/L琼脂;
(6)移栽:将步骤(5)中的所述组培苗移栽到灭过菌的基质中,置于25℃室内环境中培养,获得根系发达的中国樱桃完整植株。
实施例2
本发明实施例提供一种中国樱桃再生体系的建立方法,以中国樱桃‘红妃’子叶为外植体,完成离体再生,包括以下步骤:
(1)材料预处理:采集花后33d的中国樱桃‘红妃’果实,去除果肉,洗净果核,置于4℃下冷藏30d后,用尖嘴钳破除种壳,取出完整种胚;
(2)灭菌:将经步骤(1)处理过的所述种胚用酒精浸泡30-35s,用无菌水冲洗2-3次,再用0.1%升汞浸泡6-8min,用无菌水冲洗2-3次;
(3)无菌苗培养:将经步骤(2)处理过的所述种胚接种于培养基上,暗培养萌发幼苗;幼胚萌发的培养基组分为:MS+30.0g/L蔗糖+7.0mg/L琼脂;
(4)不定芽诱导:当步骤(3)中幼苗生长至两叶一心状态,切下子叶,切掉近轴端和远轴端的部分子叶后,接种于不定芽诱导培养基,暗培养14d后转光下培养;不定芽诱导培养基的组分为:MS+2.0mg/L 6-BA+0.8mg/L IBA+30.0g/L蔗糖+7.0mg/L琼脂;
(5)生根培养:当步骤(4)培养材料长至2-3cm时,转到生根培养基,光下培养30-40d;生根培养基的组分为:1/2MS+0.5mg/L IBA+30.0g/L蔗糖+7.0mg/L琼脂;
(6)移栽:将步骤(5)中的所述组培苗移栽到灭过菌的基质中,置于25℃室内环境中培养,获得根系发达的中国樱桃完整植株。
实施例3
本发明实施例提供一种中国樱桃再生体系的建立方法,以中国樱桃‘红妃’子叶为外植体,完成离体再生,包括以下步骤:
(1)材料预处理:采集花后36d的中国樱桃‘红妃’果实,去除果肉,洗净果核,置于4℃下冷藏30d后,用尖嘴钳破除种壳,取出完整种胚;
(2)灭菌:将经步骤(1)处理过的所述胚用75%酒精浸泡30-35s,用无菌水冲洗2-3次,再用0.1%升汞浸泡6-8min,用无菌水冲洗2-3次;
(3)无菌苗培养:将经步骤(2)处理过的所述接种于培养基上,暗培养萌发幼苗;幼胚萌发的培养基组分为:MS+30g/L蔗糖+7mg/L琼脂;
(4)不定芽诱导:当步骤(3)中幼苗生长至两叶一心状态,切下子叶,切掉近轴端和远轴端的部分子叶后,接种于不定芽诱导培养基,暗培养14d后转光下培养;不定芽诱导培养基的组分为:MS+2.0mg/L 6-BA+0.8mg/L IBA+30g/L蔗糖+7mg/L琼脂;
(5)生根培养:当步骤(4)培养材料长至2-3cm时,转到生根培养基,光下培养30-40d;生根培养基的组分为:1/2MS+0.5mg/L IBA+30g/L蔗糖+7mg/L琼脂;
(6)移栽:将步骤(5)中的所述组培苗移栽到灭菌后的基质中,置于25℃室内环境中培养,获得根系发达的中国樱桃完整植株。
对比例1
本对比例与实施例1的区别在于,步骤1)中采用花后18d的中国樱桃‘红妃’果核。
对比例2
本对比例与实施例1的区别在于,步骤(1)中采用花后21d的中国樱桃‘红妃’果核。
对比例3
本对比例与实施例1的区别在于,步骤(1)中采用花后24d的中国樱桃‘红妃’果核。
对比例4
本对比例与实施例1的区别在于,步骤(1)中采用花后27d的中国樱桃‘红妃’果核。
对比例5
本对比例与实施例1的区别在于,步骤(1)中采用花后39d的中国樱桃‘红妃’果核。
对比例6
本对比例与实施例2的区别在于,步骤(4)中不定芽诱导培养基组分为:MS+1.0mg/L6-BA+0.5mg/L IBA+30g/L蔗糖+7mg/L琼脂。
对比例7
本对比例与实施例2的区别在于,步骤(4)中不定芽诱导培养基组分为:MS+1.0mg/L6-BA+0.8mg/L IBA+30g/L蔗糖+7mg/L琼脂。
对比例8
本对比例与实施例2的区别在于,步骤(4)中不定芽诱导培养基组分为:MS+1.0mg/L6-BA+1.2mg/L IBA+30g/L蔗糖+7mg/L琼脂。
对比例9
本对比例与实施例2的区别在于,步骤(4)中不定芽诱导培养基组分为:MS+2.0mg/L6-BA+1.2mg/L IBA+30g/L蔗糖+7mg/L琼脂。
对比例10
本对比例与实施例2的区别在于,步骤(4)中不定芽诱导培养基组分为:MS+3.0mg/L6-BA+0.5mg/L IBA+30g/L蔗糖+7mg/L琼脂。
对比例11
本对比例与实施例2的区别在于,步骤(4)中不定芽诱导培养基组分为:MS+3.0mg/L6-BA+0.8mg/L IBA+30g/L蔗糖+7mg/L琼脂。
对比例12
本对比例与实施例2的区别在于,步骤(4)中不定芽诱导培养基组分为:MS+3.0mg/L6-BA+1.2mg/L IBA+30g/L蔗糖+7mg/L琼脂。
对比例13
本对比例与实施例2的区别在于,步骤(5)中生根培养基组分为:1/2MS+0.1mg/LIBA+30.0g/L蔗糖+7.0mg/L琼脂。
对比例14
本对比例与实施例2的区别在于,步骤(5)中生根培养基组分为:1/2MS+0.2mg/LIBA+30.0g/L蔗糖+7.0mg/L琼脂。
对比例15
本对比例与实施例2的区别在于,步骤(5)中生根培养基组分为:1/2MS+0.8mg/LIBA+30.0g/L蔗糖+7.0mg/L琼脂。
对比例16
本对比例与实施例2的区别在于,步骤(5)中生根培养基组分为:1/2MS+1.0mg/LIBA+30.0g/L蔗糖+7.0mg/L琼脂。
由表1可知,中国樱桃种胚的败育率、污染率、萌发率随着花后天数的增加而增大,而不定芽的产生则集中在花后30-36d,其中花后33d不定芽诱导率最高,达到32.22%,这说明本发明采用花后30-36d的中国樱桃种胚能够成功高效地实现不定芽诱导。
表1采用不同成熟度中国樱桃种胚进行离体再生的败育率、污染率、萌发率及对不定芽诱导的影响
由表2可知,当6-BA浓度为2.0mg/L,IBA浓度为0.8mg/L时,中国樱桃‘红妃’的不定芽诱导率最高,达到33.75%。
表2采用不同组分不定芽诱培养基对花后33d中国樱桃‘红妃’子叶不定芽诱导的影响
由表3可知,当生根培养基中IBA浓度为0.5mg/L时,再生苗生根率最高,为95%。
表3生根培养基采用不同IBA浓度的培养基中中国樱桃‘红妃’的生根情况
综上,本发明使用的中国樱桃种胚为花后30-36d,诱导培养基组分为MS+2.0mg/L6-BA+0.5-0.8mg/L IBA+30.0g/L蔗糖+7.0g/L琼脂,中国樱桃子叶再生芽诱导率达到33.75%;生根培养基的组分为1/2MS+0.5mg/L IBA+30.0g/L蔗糖+7.0g/L琼脂,培养30-40d,生根率为95%,平均生根数为12根,且根系较粗,有利于移栽成活。
以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 一种建立中国石蒜或忽地笑再生体系的组培培养基及其方法
- 一种建立农杆菌介导中国水仙高效遗传转化体系的方法
