一种双壳贝类生长调控基因的功能验证方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于双壳贝类RNA干扰技术领域,特别是一种双壳贝类生长调控基因的功能验证方法。
背景技术
我国是世界第一水产养殖大国,水产养殖产量占世界水产养殖总产量的70%,其中,贝类增养殖是我国水产养殖的支柱产业之一,具有十分重要的产业地位。培育生长快、产量高的优良品种一直是贝类遗传育种的中心目标,也是贝类养殖产业发展的迫切需求。贝类生长调控相关基因的筛查及功能解析可为贝类高产良种培育提供有效的分子工具,从而加快育种进程。目前,双壳贝类生长性状相关基因或者分子标记主要是通过全基因关联分析、数量性状基因位点以及转录组学分析等方法进行筛查获得的。虽然生长相关候选基因的鉴定极大的增强了我们对贝类生长变异遗传基础的理解,但由于绝大多数贝类繁殖周期较长,而且在实验室条件下进行长期养殖和繁育存在困难性,这些生长相关基因的功能验证在双壳贝类中十分受限。
侏儒蛤(Mulinia lateralis)属于软体动物双壳纲、帘蛤目、蛤蜊科的一种小型埋栖贝类,它具有体型小、生长速度快、世代周期短等优点,而且养殖条件温和,易于在实验室条件下进行人工养殖和繁育,是贝类生长调控基因功能研究的良好实验模型。因此,利用模式贝类侏儒蛤进行生长相关基因的研究可以填补目前在双壳贝类中难以进行生长基因功能验证的研究空白。
RNA干扰技术是通过dsRNA介导的内源特异性mRNA转录后沉默机制,该技术是一种功能研究的重要手段,目前广泛应用于哺乳动物、斑马鱼、昆虫、植物等生物体的功能缺失效应研究。但是,RNA干扰技术在贝类生长调控基因功能研究上的应用潜力尚不清楚。RNA干扰可以通过多种途径实现,常见的方法是体外直接合成双链RNA后注射于动物特定组织中,但该方法会对机体产生损伤,而且可能存在引起动物应激反应的风险。因此,在贝类生长功能研究领域,建立一种高效快速制备双链RNA而且具有非侵入性的RNA干扰方法,是长期开展贝类生长相关功能基因研究的重要基础。
发明内容
本发明的目的是提供一种双壳贝类生长调控基因的功能验证方法,以弥补现有技术的不足。
为了达到上述目的,本发明采取以下的技术方案为:
一种双壳贝类生长调控基因的功能验证方法,该方法基于RNA干扰方法,选用侏儒蛤作为验证贝类。
上述方法具体为:
(1)首先筛选双壳贝类生长调控基因,所述双壳贝类选用侏儒蛤;
(2)基于所述生长调控基因,即目的基因,构建RNA干扰质粒;
(3)通过投喂方法进行RNA干扰质粒干扰;
(4)所述目的基因的表达量检测;
(5)侏儒蛤表型变化的统计分析,用以进行功能验证。
进一步的,所述步骤(2)中,生长调控基因选为胰岛素样肽ILP基因。
进一步的,所述步骤(2)中,构建RNA干扰质粒具体为:
1)设计引物:首先选择目标干扰片段,再根据选定的干扰片段序列设计正反引物:正向引物是MulILP-RNAi-F-XhoI:CCGCTCGAGGTTCAACTTCCGCCGAAAAC,反向引物是MulILP-RNAi-R-SacII:TCCCCGCGGAATGCCCACAAGCTTATCAA;干扰片段的序列为SEQ ID NO:1;
2)扩增目标干扰片段:从侏儒蛤组织中提取目标干扰片段的RNA,随后反转录成cDNA,进行PCR反应,PCR产物进行琼脂糖凝胶电泳检测,目标干扰片段进行回收纯化,对回收产物的浓度进行测定并测序;
3)测序合格后进行质粒提取,随后对目标干扰片段和L4440载体分别进行双酶切反应;酶切后的产物用凝胶回收试剂盒纯化后进行电泳检测;
4)将上述酶切产物与L4440质粒载体进行连接反应,再将ILP-L4440重组质粒以及L4440空载质粒分别转化HT115(DE3)感受态细胞中培养;
5)重组质粒的测序检测;
6)将上述含有ILP-L4440质粒的E.coli HT115细菌进行培养并诱导其表达dsRNA;
7)dsRNA的检测。
进一步的,所述步骤(3)具体为:
1)实验分组:选择同一群体、大小均一的同龄侏儒蛤进行干扰实验,共分为2组;其中,空白对照组侏儒蛤投喂小球藻和L4440空载质粒的大肠杆菌、实验组侏儒蛤投喂小球藻和ILP-L4440质粒的大肠杆菌;
2)dsRNA的制备:菌液进行离心,弃掉上清,然后加入小球藻,得到菌藻混合液;
3)投喂实验:实验组和对照组均同时同量投喂小球藻,培养一段时间。
进一步的,所述步骤(4)中,对实验组和对照组获得的组织材料进行RNA提取并反转录得到cDNA,计算实验组和对照组中目的基因表达量差异的显著性。
本发明的优点和有益效果:
本发明建立了细菌介导的RNA干扰技术沉默目的基因,探索了适宜进行生长功能验证的合适侏儒蛤年龄个体。通过基因表达量的检测评估dsRNA的有效作用时间,并结合侏儒蛤表型变化来评估该方法的可行性。该方法的建立为今后其他基因在贝类生长过程中的功能研究提供了重要的技术支持。
经过实验验证,本发明通过细菌介导的RNA干扰技术成功实现了对目的基因的敲降,ILP基因的表达量显著降低了81.4%。而且目的基因沉默后抑制了快速生长的二月龄侏儒蛤的生长,在持续干扰十天后实验组的侏儒蛤壳长和壳宽与对照组相比显著减少了20.5%和18.7%。而对于慢速生长的六月龄侏儒蛤并没有显著的干扰效果。因此,本发明提供了一种可用于模式贝类侏儒蛤进行生长相关基因功能研究的有效方法,并评估了适用于进行生长功能验证的合适侏儒蛤个体。
附图说明
图1为侏儒蛤ILP基因dsRNA的诱导表达图。
图2为二月龄和六月龄侏儒蛤在干扰组和对照组的表型性状比较结果图。
图3为RNA干扰10天后目的基因在二月龄侏儒蛤消化腺中的表达变化图。
具体实施方式
下面结合具体实施例及附图对本发明进行进一步描述,但本发明的保护范围并不限于此。
实施例1:筛选侏儒蛤生长性能相关的目的基因ILP
通过前期差异生长的侏儒蛤转录组分析中显著富集到了胰岛素信号通路,其中,该信号通路的上游信号因子胰岛素样肽(ILP)基因存在显著的差异表达,可能是调控侏儒蛤生长的关键上游因子。
随后,从侏儒蛤基因组数据库中获得目的基因,该基因全长5812bp,cDNA全长913bp,其中5’UTR序列长度为240bp,3’UTR序列长度为190bp,CDS长度为483bp,编码161个氨基酸,预测蛋白分子量是18.87kDa,等电点为9.33。
实施例2:通过RNA干扰进行目的基因的功能验证
构建RNA干扰质粒以及dsRNA的诱导表达
(1)引物设计:首先将侏儒蛤ILP基因的mRNA序列提交到在线网站si Directversion2.0(http://sidirect2.rnai.jp/),RNA干扰片段通常选择预测的小干扰RNA数目多且干扰效率高的片段。随后,将选定的干扰片段序列提交到在线网站NEBcutter V2.0(http://nc2.neb.com/NEBcutter2/)预测酶切位点,选择0cutter的核酸内切酶作为后续双酶切反应的候选酶,最终通过Primer premier5软件对选取的干扰片段设计正反引物,引物需要具有基因组唯一比对的特点,保证后续片段扩增的特异性。正向引物是MulILP-RNAi-F-XhoI:CCGCTCGAGGTTCAACTTCCGCCGAAAAC,反向引物是MulILP-RNAi-R-SacII:TCCCCGCGGAATGCCCACAAGCTTATCAA。
(2)RNA干扰片段的扩增;从侏儒蛤组织中提取RNA,随后反转录成cDNA,按照如下体系进行PCR反应:
混匀之后进行PCR反应,反应条件设置如下:98℃预变性30s,随后进行30个循环(98℃变性10s,60℃退火30s,72℃延伸1min),最后72℃延伸5min。随后,PCR产物用1.5%的琼脂糖凝胶电泳进行检测,随后利用胶回收试剂盒对扩增得到的ILP基因的RNA干扰片段进行回收纯化,利用分光光度计Nanodrop对回收产物的浓度进行测定。
(3)随后取4μl回收产物与1μl blunt载体于PCR管中,充分吹打混匀后置于PCR仪上,25℃进行连接反应15min。随后,将该连接产物利用热激法导入感受态细胞中,将菌液涂布于含氨苄青霉素的固体培养基上,随后置于培养箱中37℃过夜培养。次日挑取阳性克隆菌株送至青岛生工公司进行测序。
(4)将上述测序合格的菌株进行质粒的提取,随后对目的干扰片段和L4440载体分别进行双酶切反应,酶切体系如下所示:
将上述体系混匀后置于PCR仪上37℃反应20min。酶切后的产物用凝胶回收试剂盒纯化后进行电泳检测。
(3)连接和转化反应:用T4 DNA连接酶将上述酶切产物与L4440质粒载体进行连接反应,连接反应体系如下:
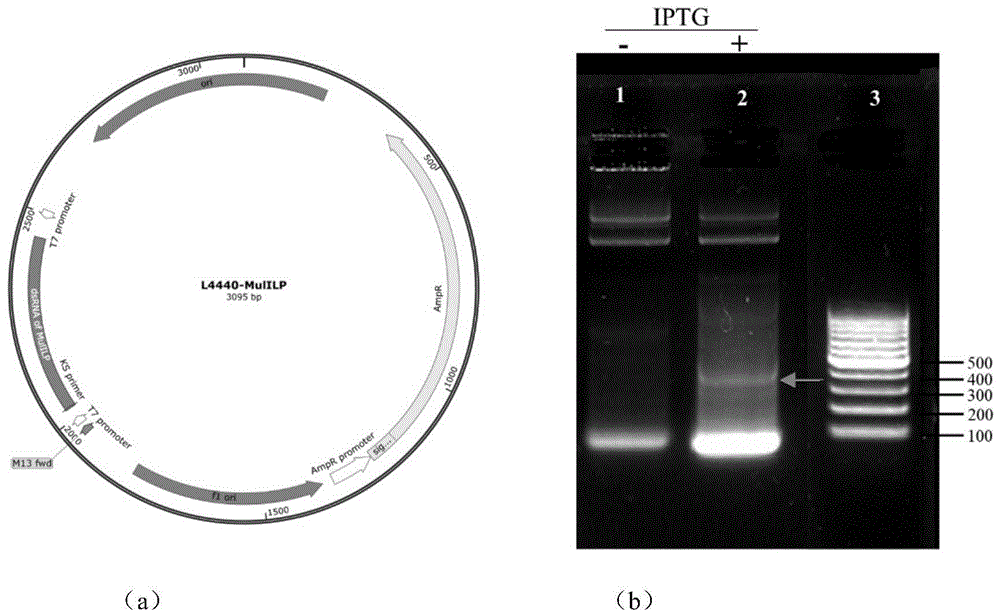
将上述组分加至PCR管中混匀后,置于PCR仪上25℃中反应10min,连接产物即ILP-L4440重组质粒,重组质粒图谱如图1(a)所示。随后,将ILP-L4440重组质粒以及L4440空载质粒分别转化HT115(DE3)感受态细胞中,随后将菌液涂布于含氨苄青霉素(Amp,50mg/ml)和四环素(Tet,12.5mg/ml)的固体培养基上,于37℃条件下倒置培养。
(4)重组质粒测序检测:用灭菌牙签分别挑取若干单克隆菌落,转移到800μl的含氨苄青霉素和四环素的LB液体培养基中,37℃条件下培养5h,取1μl作为PCR反应的模板。反应条件如下:95℃预变性5min,95℃变性30s,60℃退火30s,72℃延伸1min,进行25个循环,最后延伸10min。PCR产物用1.5%琼脂糖凝胶电泳检测,最终选取含有目的片段的阳性菌落进行测序分析。
(5)双链RNA的诱导表达:将上述含有ILP-L4440质粒的E.coli HT115细菌进行培养并诱导其表达dsRNA,具体方法如下:
取10μl上述测序正确的菌株接种于5ml含Amp和Tet的LB液体培养基中,37℃,220rpm条件下过夜培养。次日,以1:50的比例转接到新鲜的含双抗的LB液体培养基中进行扩大培养,待分光光度计检测菌液的OD值在04-0.6之间时,加入IPTG至终浓度为0.5mM诱导dsRNA的表达。诱导培养4h后收集菌液,离心后弃掉上清,收集细菌沉淀保存于-80℃冰箱中。
(8)双链RNA的检测:利用Trizol法提取细菌RNA,使用RNaseT1消化单链RNA。随后,利用分光光度计测定RNA的浓度和质量,最后,通过1.5%琼脂糖凝胶检测dsRNA条带位置,如图1(b)所示,泳道1表示未加IPTG诱导的MulILP菌株的RNA,泳道2表示加入IPTG诱导后MulILP菌株的RNA,泳道3表示100bp DNAladder。结果表明,经IPTG诱导后,大肠杆菌HT115成功表达出了侏儒蛤ILP基因的dsRNA,目的基因的dsRNA在图中已用箭头标出。
实施例3:菌藻共喂的RNAi实验
(1)实验分组:选择同一群体、大小均一的同龄侏儒蛤进行后续的干扰实验,共分为2组,每组80只侏儒蛤个体。其中,空白组侏儒蛤投喂小球藻和L4440空载质粒的大肠杆菌、实验组侏儒蛤投喂小球藻和ILP-L4440质粒的大肠杆菌。在充分了解了侏儒蛤的生长阶段后,分别选择了快速生长期的2月龄和缓慢生长期的6月龄的侏儒蛤进行了两次干扰实验,评估可用于该RNA干扰策略进行生长验证的合适大小的侏儒蛤。
(2)dsRNA的制备:收集IPTG诱导表达后的30ml菌液进行离心,弃掉上清的培养基,然后加入100μl的小球藻,涡旋震荡后得到菌藻混合液。
(3)投喂实验:每天早上9点实验组和对照组均投喂小球藻,晚九点按照分组分别投喂菌藻混合物,投喂的小球藻的水体密度为1x 10
表型性状测定:
对2月龄和6月龄侏儒蛤的ILP基因各进行了30天的持续干扰,其中每10天进行一次体尺性状的测定以及组织取材。如图2(a)所示,2月龄侏儒蛤的干扰实验中,实验组与对照组相比,侏儒蛤的平均壳长在干扰10天、20天和30天后分别显著降低了12.7%、15.8%和10.9%。如图2(b)所示,与对照组相比,2月龄侏儒蛤ILP基因在干扰10天、20天和30天后平均壳高分别显著降低了13.3%、16.1%和10.5%。实验结果表明,侏儒蛤ILP基因被抑制后造成侏儒蛤生长的显著迟缓。6月龄侏儒蛤的干扰实验中实验组和对照组并未产生显著的表型差异。如图2(c)图所示,实验组与对照组相比,侏儒蛤的平均壳长分别降低了3.8%、3.6%和3.3%,但并不显著。同样的,如图2(d)所示,实验组侏儒蛤的平均壳高分别降低了4.2%、4.0%和3.5%,也不显著。实验结果表明快速生长期的2月龄侏儒蛤更适合用于侏儒蛤生长相关基因的功能验证。
表型性状测定之后进行取材:每10只侏儒蛤混成一组进行取材,共三组重复。将各组织分别进行取材,于液氮中冷冻后置于冻存管中,最终保存于-80℃冰箱中。
qRT-PCR检测目的基因的干扰效率:
对实验组和对照组获得的组织材料进行RNA提取并反转录得到cDNA,设计目的基因的定量引物(mulILP-qPCR-F:ATGCTGGATGTTTACAATGTGGTT;mulILP-qPCR-R:GAGCATGGATAAAACCTCGTCA),选取RS23作为内参引物,引物序列为:mulRS23-qPCR-F:CCATCAAGATGGGTGAAAC;mulRS23-qPCR-R:CGAATCCAGCGACTAAGA。
qRT-PCR的反应体系如下:cDNA模板2μl,正向引物(10μm)0.4μl,反向引物(10μl)0.4μl,ChamQ SYBR Master Mix 10μl,ddH2O补至20μl,每个样品设计三个技术重复。qRT-PCR反应在LightCycler 480上进行。随后,利用2
综上所述,利用本发明制备的双链RNA可以在双壳贝类体内实现长期和高效的基因沉默,为双壳贝类生长调控功能基因的研究提供较好的技术手段和方法。
- 一种电转染双壳贝类基因编辑的方法
- 一种双壳贝类线粒体COI基因扩增引物的筛选方法
