用于肝癌初筛和预后的检测试剂盒及用途
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于分子生物学肿瘤筛查领域,具体涉及用于肝癌早期初筛和预后的检测试剂盒及用途。
背景技术
外泌体(exosome)由多种细胞分泌,直径大小40-160nm(平均100nm),双层脂质包裹的囊泡样结构,属于细胞外囊泡的一种。随着研究深入,外泌体的功能和价值逐渐凸显。1)用于液体活检,外泌体存在于各种体液中(如脑脊液、唾液、血液、尿液和母乳等),可作为疾病诊段和预后的观测指标。对于肿瘤细胞,研究发现外泌体可促进其形成、生长;可指导其定植于新的转移位点,因此可用于预测未来肿瘤转移倾向及其部位。2)细胞间通讯,可探究疾病发生发展机制。外泌体可以通过直接与细胞膜的融合释放胞内物质、受体-配体作用、内吞或胞饮进行信息传递。3)药物输送。具有生物膜结构的外泌体被开发为药物运送载体,其有着耐受性好、安全、免受酶降解、免受机体吞噬、具有归巢能力等优势。
伴随高通量测序的发展,大量非编码RNA(non-coding RNA,ncRNA)被发现,其生物学功能研究也逐渐展开。长链非编码RNA(Long non-coding RNA,LncRNA)受到了人们的关注。外泌体LncRNA也是细胞间通讯成分。其在肿瘤中的作用和外泌体类似,既可以作为诊断和预后的靶标,也能调控肿瘤的增值、迁移和凋亡,还能作用于肿瘤微环境,其在肿瘤耐药中还发挥作用。然而LncRNA的检测手段缺乏,主要为RT-qPCR和基因芯片的方式,前者检测灵敏度不够,后者成本较高。
基于环介导恒温扩增技术(Loop-mediated isothermal amplification,LAMP)技术从2000年建立至今已有20余年历史,检测原理和方法相对成熟,主要通过链的置换与合成对目标片段进行不断合成和延伸。其扩增方式经历哑铃状(两边呈环状)模板形成、循环、延伸和再循环过程。内引物先与目标链结合,生成的新片段被外引物置换出后与自身5’端互补形成环状结构的一端。在两侧内引物作用下两端均生成环状结构,形成带有目的片段的哑铃状模板。哑铃状结构本身的3’端继续延伸,此时内引物与哑铃状结构结合后延伸,将哑铃状结构的延伸链置换出来。延伸链由于自身互补片段存在生成环状后又开始以自身为模板进行延伸,最后置换出内引物合成的哑铃状环结构进入不断循环扩增,而最开始的哑铃状模板形成自身不断延伸、目的片段不断扩增的长链状结构。该方式扩增速度快,不足一小时即可将少量拷贝数的DNA片段扩增至10
肝癌现居全球最常见癌症第六位和恶性肿瘤死亡原因第四位,平均每年有84.1万人患病,78.2万人死于肝癌。肝细胞癌(Hepatocellular carcinoma,HCC)是原发性肝癌最常见的种类,比例高达75%~85%,主要危险因素可为慢性乙肝和丙肝病毒感染、使用黄曲霉污染的食物、大量饮酒、抽烟、肥胖和患有2型糖尿病等。中国是乙肝大国,通过接种疫苗和其他方式的干预,HCC的发病率和死亡率递降,但基于总人口数量大,中国HCC新发和死亡数仍占世界新发和死亡人数的50%以上,超过30万患者死于HCC。HCC患者早期无明显症状,确诊时间晚,已不适合手术治疗,生存时间短。因此,早发现、治疗能够有效延长患者的生存期、提高生存质量。甲胎蛋白(α-fetoprotein,AFP)是常用HCC的筛查和确诊指标,但是近年来却发现作为筛查指标,AFP存在灵敏度(39%-65%)和特异度(76%-94%)低的问题,肝癌早期阶段只有10%-20%的患者AFP水平升高,在慢性肝炎、肝硬化和部分胃肠道肿瘤患者中也会升高,因此AASLD和EASL在指南中不推荐AFP作为筛查和确诊的首选指标,中国和日本仍推荐AFP筛查肝癌,多采用超声和AFP联合模式来诊断。目前仍需要寻找对于肝癌筛查和诊断更为灵敏和特异的指标。
肝硬化和HCC患者外泌体数量明显高于正常、肝组织变性和肝纤维化期。Soon等人(Kim S S,Baek G O,Ahn H R,et al.Serum small extracellular vesicle-derivedLINC00853 as a novel diagnostic marker for early hepatocellular carcinoma[J].Molecular Oncology,2020,14(10):2646-2659.)通过TCGA和GEO公共数据库发现Linc00853在HCC患者中表达上调,并且表达量会随着肝脏疾病进展而增加;生存曲线显示高表达Linc00853和HCC不良预后有关;选取10个健康和10个HCC患者检测血浆和外泌体中Linc00853表达量发现血浆来源的Linc00853在健康人和HCC中无显著差别,但外泌体来源的Linc00853在两个组中有差异;扩大检测量,发现Linc00853在90个HCC和92个非HCC患者外泌体中仍有显著差异,与AFP相比,Linc00853的诊断价值更高,曲线下面积为0.934,Cut-Off值取14倍改变;细胞外囊泡Linc00853对HCC早期诊断的灵敏度和特异度高,针对AFP阴性的HCC患者检出率可达97%。
发明内容
针对现有技术的不足,本发明要解决的技术问题是为肝癌和肝硬化早期预测提供一种新选择。
本发明的技术方案是提供基于LAMP用于肝癌初筛和预后的检测试剂盒,包括扩增所需的如下引物:核苷酸序列如SEQ ID No.1~SEQ ID No.9所示:
其中,外引物为F3、B3,内引物为FIP、BIP,环引物为LF-1、LF-2、LB-1、LB-2、LB-3中至少一种。
进一步地,基于LAMP用于肝癌初筛和预后的检测试剂盒,包括扩增所需的如SEQID No.1~SEQ ID No.4所示引物和第1~7组中任意一组环引物:第1组:LF-1;第2组:LB-1、LF-2;第3组:LB-2、LF-2;第4组:LB-3、LF-2;第5组:LB-1、LF-1;第6组:LB-2、LF-1;第7组:LB-3、LF-1:
优选地,基于LAMP用于肝癌初筛和预后的检测试剂盒,包括扩增所需的如SEQ IDNo.1~SEQ ID No.4所示的引物、如SEQ ID No.8和SEQ ID No.7所示的环引物LB-2、LF-2。
其中,上述基于LAMP用于肝癌初筛和预后的检测试剂盒,包括对目的基因Linc00853进行检测,其核苷酸序列如SEQ ID No.14所示。
其中,上述基于LAMP用于肝癌初筛和预后的检测试剂盒,还包括Bst聚合酶、荧光染料、矿物质油。
其中,上述基于LAMP用于肝癌初筛和预后的检测试剂盒,其反应温度为61~67℃。优选地,反应温度为63℃。
其中,上述基于LAMP用于肝癌初筛和预后的检测试剂盒,内引物:环引物:外引物的浓度比例为4~8:1~4:1。优选地,内引物:环引物:外引物的浓度比例为8:4:1。
其中,上述基于LAMP用于肝癌初筛和预后的检测试剂盒,聚合酶酶量为0.5~2μL。优选地,所述酶量为1μL。
本发明还提供上述用于肝癌初筛和预后的检测试剂盒的使用方法,包括以下步骤:
a、以pUC57作为载体,构建含目的基因Linc00853的pUC57-Linc00853质粒;
b、通过选择最佳引物、反应温度、引物浓度及酶量来构建LAMP检测体系,测试试剂盒能检测到的pUC57-Linc00853质粒最低浓度及其Tt值。
其中,步骤b中,准备核苷酸如SEQ ID No.1~SEQ ID No.9所示的引物。
其中,步骤b中,所述LAMP检测体系还包括Bst聚合酶、荧光染料、矿物质油。
其中,步骤b中,检测程序为61~67℃孵育60min,使用罗氏LC96检测。优选地,检测温度为63℃。
其中,步骤b中,所述内引物:环引物:外引物的浓度为4~8:1~4:1。优选地,内引物:环引物:外引物的浓度比例为8:4:1。
其中,步骤b中,所述聚合酶的酶量为0.5~2μL。优选地,所述酶量为1μL。
本发明还提供上述用于肝癌初筛和预后的检测试剂盒在制备早期肝癌、肝硬化预警和筛查的制剂中的用途。
所述用途中,采用上述试剂盒检测血浆外泌体Linc00853的表达。
有益效果:本发明创造性地提供了能有效进行肝癌尤其是早期肝癌以及肝硬化预警和筛查的技术方法。将LAMP方法用于检测HCC患者Linc00853的表达,通过设计出LAMP核心引物(F3、B3、FIP和BIP)和环引物(LF、LB),核苷酸序列如SEQ ID No.1~9所示,扩增目的片段长度为231bp,并通过优化反应温度、引物浓度、酶量等参数,筛选LAMP检测Linc00853最适宜条件。
本发明通过对比LAMP法和PCR法检测Linc00853发现两种方法具有相关性,诊断HCC具有中度一致性,LAMP法相对于PCR法能更好区分HCC和健康对照组,筛查HCC时灵敏度较高,术前LAMP法检测Linc00853的Tt值越低,Linc00853水平越高,提示HCC预后不良。本发明提供的基于LAMP用于肝癌初筛和预后的检测试剂盒为本领域早期肝癌以及肝硬化预警和筛查提供了新的有效检测方法,且成本低,使用起来也非常方便,灵敏度高,特异性好,具有很好的应用前景。
附图说明
图1为本发明实施例1的1.5.1部分Linc00853基因序列BLAST结果;
图2为本发明实施例1的2.1部分外泌体鉴定结果A:外泌体的电镜图;B:外泌体的粒径分析;C:肝源性外泌体的WB鉴定;
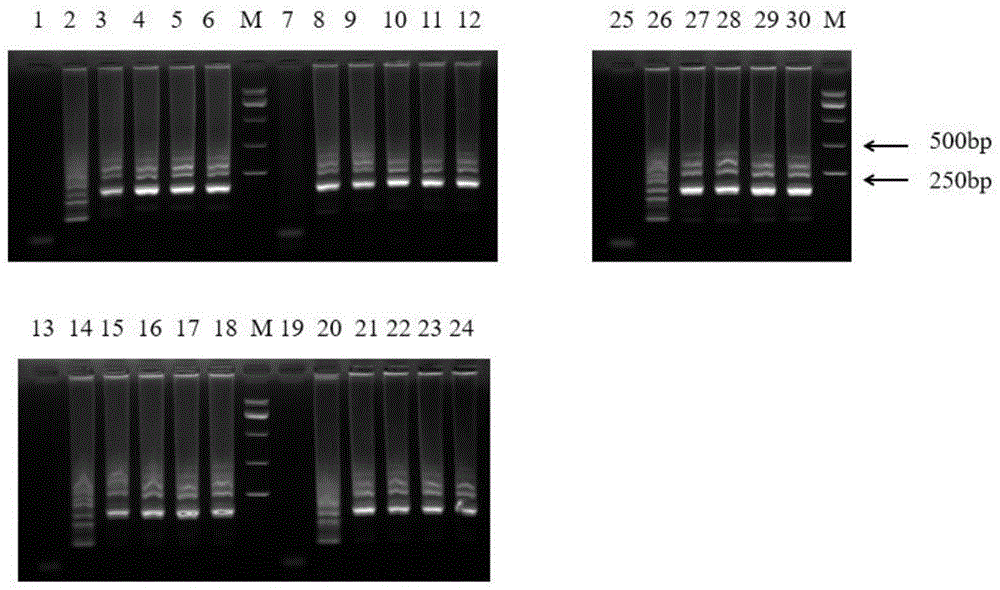
图3为本发明实施例1的2.2部分不同组引物LAMP扩增电泳图;
图4为本发明实施例1的2.3.1部分不同温度下LAMP扩增曲线图;
图5为本发明实施例1的2.3.2部分引物不同浓度时LAMP扩增曲线图;
图6为本发明实施例1的2.3.3部分不同酶量的LAMP扩增曲线图;
图7为本发明实施例1的2.4部分LAMP检测Linc00853的Tt值和临床指标相关性图(注:PCR为PCR法检测Linc00853的相对表达量(2
图8为本发明实施例1的2.4.2部分不同方法检测Linc00853诊断HCC的ROC曲线图;
图9为本发明实施例1的2.4.2部分不同水平Linc00853(LAMP法)的HCC生存曲线图;
图10为本发明实施例1的2.4.2部分多因素COX回归森林图A:Tt值为连续性数值变量B:Tt值转换为二分类型变量。
具体实施方式
外泌体LncRNA被发现可作为肿瘤标志物,用于肺癌、胃癌、肝癌、结直肠癌和膀胱癌等疾病的诊断与预后。其优势在于外泌体的脂质双分子层具有保护作用,其内含有的核酸物质可免受RNA酶的降解作用;外泌体具有异质性,其分泌来源的细胞不同,外泌体组成成分也不同,因此检测其特异的成分可对外泌体进行溯源。
本发明通过透射电子显微镜、纳米颗粒跟踪分析、蛋白免疫印迹法验证产物为血浆外泌体后提取HCC患者和健康对照组的血浆外泌体RNA逆转录,同时进行LAMP法和聚合酶链式反应(Polymerase Chain Reaction,PCR)检测Linc00853,并收集其临床资料进行相关性、HCC初筛和预后价值分析。
本发明的试剂盒是基于LAMP技术检测HCC患者血浆外泌体Linc00853,开发LncRNA检测的新方法;研究LAMP法检测血浆外泌体Linc00853对HCC的初筛、预后价值。
本发明基于Linc00853的基因序列,设计出LAMP核心引物(F3、B3、FIP和BIP)和环引物(LF、LB),其序列如SEQ ID No.1~9所示,其扩增目的片段长度为231bp。引物合成使用高效液相法进行纯化。
本发明同时通过设置7组引物序列,如上述1-7组所示;61~67℃的温度梯度;引物浓度:4~8:1~4:1;0.5~2μL的酶量;原倍、1:5、1:10和1:20的样本稀释度梯度来筛选LAMP检测Linc00853适宜条件。
与PCR法相比,LAMP法检测核酸操作简单,反应速度快(1小时扩增的目的基因拷贝数可为PCR法的100倍),扩增时间短,不需要热循环仪,甚至可以在保温杯中反应。但其引物设计相对麻烦,需要针对靶目标的6个区域设计至少2对引物,因此扩增产物特异性更高。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
1.临床样本收集
1.1.1受试者纳入排除标准
本项研究纳入2020年5月至2021年9月在四川大学华西医院首次确诊为HCC的患者以及同期体检的健康人群。纳入标准:年龄18-80岁;经临床指标诊断(临床表现、影像学检查和血清学检查等)或病理诊断(穿刺活检或术后病理检查)为HCC;临床信息、实验室结果完整。排除标准:恶病质;多器官衰竭;合并其余肿瘤。排除1名信息不全和2名HCC肝外转移患者的情况下,最终纳入23名HCC患者和30名健康对照者。本研究伦理审批号:2019年审977号(四川大学华西医院)。
1.1.2受试者临床信息以及实验室检查结果收集
针对纳入人群采集其年龄、性别、现病史。实验室检查主要收集肿瘤标志物:甲胎蛋白(α-fetoprotein,AFP)、异常凝血酶原(Protein Induced by Vitamin K Absence orAntagonist-II,PIVKA-Ⅱ)、癌胚抗原(Carcino-embryonic antigen,CEA)、糖类抗原CA199(Carbohydrate antigen199,CA199);肝肾功检查:丙氨酸氨基转移酶(Alanineaminotransferase,ALT)、门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、门冬氨酸氨基转移酶/丙氨酸氨基转移酶(AST/ALT)、总胆红素(Total Bilirubin,TB)、间接胆红素(Indirect bilirubin,IB)、直接胆红素(Direct bilirubin,DB)、总胆汁酸(Totalbile acid,TBA)、总蛋白(Total protein,TP)、白蛋白(Albumin,ALB)、球蛋白(Globulin,GLB)、白蛋白/球蛋白比(ALB/GLB)、碱性磷酸酶(Alkaline phosphatase,ALP)、谷氨酰转肽酶(Glutamyl transpeptidase,GGT)、尿酸(Uric acid,UA)、尿素(Urea,UREA)、肌酐(Creatinine,CREA)、胱抑素C(Cystatin C,Cys-C)、肾小球滤过率(Estimated Glomerularfiltration rate,eGFR);糖脂代谢检查:葡萄糖(Glucose,GLU)、总胆固醇(TotalCholesterol,TC)、甘油三酯(Triglycerides,TG)、高密度脂蛋白-胆固醇(High densitylipoprotein-cholesterol,HDL-C)、低密度脂蛋白-胆固醇(Low density lipoprotein-cholesterol,LDL-C);血常规检查:红细胞(Red blood cell,RBC)、红细胞比容(Hematocrit,HCT)、血红蛋白浓度(Hemoglobin,Hb)、平均红细胞体积(Mean corpuscularvolume,MCV)、红细胞分布宽度(Red blood cell distribution width,RDW)、平均红细胞血红蛋白量(Mean corpuscular hemoglobin,MCH)、红细胞平均血红蛋白浓度(Meancorpuscular hemoglobin concentration,MCHC)、血小板(Platelet,PLT)、白细胞(Whiteblood cell,WBC)、中性粒细胞(Neutrophil,NEUT)、淋巴细胞(Lymphocyte,LYMPH)、单核细胞(Monocyte,MONO)、嗜酸性粒细胞(Eosinophil,EO)、嗜碱性粒细胞(Basophil,BASO);血清酶检查:肌酸激酶(Creatine kinase,CK)、乳酸脱氢酶(Lactate dehydrogenase,LDH)、羟丁酸脱氢酶(Hydroxybutyrate dehydrogenase,HBDH)。
1.1.3受试者血浆样本收集
患者空腹8-12小时后对其使用真空采血管(BD,美国)收集静脉血,采血完成后均需将管子反复上下颠倒混匀至少3次,从而保证血液能和管中所含抗凝剂或者促凝剂充分混合。血常规检查使用含有EDTA-K2的2mL抗凝管,检测前需颠倒混匀8次及以上,无需离心;凝血检查使用含有枸橼酸钠的2.7mL抗凝管常温3000rpm离心10min后上机检测;肿瘤标志物、肝肾功检查、糖脂代谢检查、血清酶检查和输血检查使用4mL促凝管,需37℃孵育30min促进血清析出,然后常温3500rpm离心5min后上机检测;血浆外泌体提取样本使用含有EDTA-K2的6mL抗凝管,4℃4000rpm离心5min后取上层血浆继续4℃4000rpm离心5min,所得血浆转移至1.5mL EP管并冷冻至-80℃备用。
1.2血浆外泌体提取及鉴定
1.2.1血浆外泌体提取
为了排除凝血过程中血小板释放的大量外泌体干扰,选择提取血浆外泌体进行检测。将冻存血浆37℃快速复融后4℃3000g离心15min;吸取800μL上清和200μL ExoQuickTMexosome precipitation solution(SBI)于新的EP管中充分混匀(上下颠倒、轻弹管壁)呈絮状,放在4℃冰箱静置2小时;静置完成后4℃1500g离心30min丢弃上清,对于沉淀用500μL PBS(1×)重悬,然后4℃1500g离心5min,EP管底部所得白色沉淀即外泌体。
1.2.2血浆外泌体鉴定
外泌体鉴定的样本采用当天提取、4℃保存以及冰袋运输的形式。通过三种方法鉴定血浆外泌体:
透射电镜(Transmission electron microscope,TEM)聚焦成像外泌体,观察其大小、形态:100μL PBS(1×)重悬外泌体,滴加到铜网(直径2mm),静置10min,滤纸吸附后向继续滴注10μL醋酸双氧铀(1%),短暂静置后加滤纸吸干,室温干燥约20min,使用80kV透射电镜(日立H-600,日本)成像。
纳米颗粒跟踪分析(Nanoparticle tracking analysis,NTA)目的是测量exosome大小和浓度:使用100μL1×PBS重悬得到的外泌体溶液进行1000-5000倍的梯度稀释后上机检测,通过光散射和布朗运动追踪粒子的大小、分布和运动轨迹。
蛋白免疫印迹(Western blotting,WB)分析外泌体表面膜蛋白:向exosome滴加等量专用裂解液,吹打调匀,冰上放置30min,加入6×Protein loading Buffer,加热煮沸混合液10min,离心取上清;配置SDS-聚丙烯酰胺凝胶(上层5%,下层10%),成分表及配置过程见下表1;取适量上清上样,电泳时电压达160V,在溴酚蓝指示剂即将跑出胶面时停止电泳;取出电泳胶,转移蛋白至聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜上形成印迹;膜置放于脱脂奶粉(5%)的TBST封闭液,摇晃1h,增添一抗稀释液(1:3000),4℃孵育整夜;TBST缓冲液(1×)洗膜,重复3次,每次5min;增添辣根过氧化物酶标记的二抗(1:5000),摇动1h;TBST缓冲液(1×)洗膜,重复3次,每次5min;暗室中对膜条滴加ECL试剂盒中的A、B液进行显色后轻轻漂洗、吸干,置于曝光盒中曝光,然后进行显影、定影,在凝胶成像系统下显像。
表1:SDS-PAGE的制备
1.3血浆外泌体RNA提取及逆转录
1.3.1血浆外泌体RNA提取
使用miRNeasy Serum/Plasma Kit(Qiagen 217184)试剂盒提取血浆外泌体RNA。向上述步骤获得的外泌体白色沉淀中加入800μL Qiazol,使用加样枪迅速吹打混匀,以至肉眼看不见白色絮状沉淀,室温静置5min;向EP管内添加150μL氯仿后震荡混匀15s,肉眼可见溶液由粉红色变为乳白色,继续室温静置2min;4℃12000g离心15min后取上清450μL,添加900μL无水乙醇后吹打和颠倒混匀,避免产生气泡;将所有产物分2批次且每次不超过700μL加入到洗脱柱里瞬离(12000rpm离心15s),将下层废液倒掉;柱子里加入700μL BufferRWT后12000rpm离心20s,舍去废液;加500μL Buffer RPE离心,12000g15s,舍去废液;再加入500μL乙醇(80%)12000g离心2min,舍去废液;换新的废液管,开盖离心(14000rpm离心5min),舍去废液;换新的EP管,添加16μL无酶水,14000rpm离心1min,将EP管置于冰上,此时管里为外泌体RNA。由于所得RNA量少(12μL)且易降解,故不建议测浓度和纯度,直接用于后续实验。
1.3.2血浆外泌体RNA逆转录
使用QuantiNova Reverse Transcription Kit(Qiagen 205411)对提取的外泌体RNA逆转录,其转录体系、程序如下表2。
表2:血浆外泌体RNA逆转录体系及程序
1.4实时荧光PCR检测血浆外泌体Linc00853
使用QuantiNova SYBR-Green PCR Kit(Qiagen 208054)对上述cDNA进行QPCR检测,其反应体系、程序见下表3、4,引物序列见表5。目标物的相对表达量使用2
表3:实时荧光PCR反应体系
表4:实时荧光PCR反应程序
表5:Linc00853引物以及内参β-actin引物序列
1.5 LAMP检测血浆外泌体Linc00853
1.5.1引物设计
在NCBI数据库中查询并下载Linc00853的基因序列,GenBank号为NR_047498.1,全长669bp。对该基因进行BLAST同源比对(见图1),其特异性较好。
基于Linc00853的基因序列设计出LAMP核心引物(F3、B3、FIP和BIP)和环引物(LF、LB),见表6,其扩增目的片段长度为231bp。引物合成使用高效液相法进行纯化。
表6:LAMP引物序列
1.5.2 pUC57-Linc00853质粒制备
合成目的基因Linc00853,其核苷酸序列如SEQ ID No.14所示:
GCCGCGCCTGAAGCTCAACTTCCGAGGCTCTCATCAATCTACGCTTCCTTTGGAGCGTGCAGCCACCAGGTGGCAGCCGAGGCCACGGGCAGACAGAAAAGCTCCCGAAACTGAAGGACTGCCAGGCAGCAGAGTTCCGGAGGGCTCCCAGGACCTTCAACCAGAAAGAGACAGAGCATATGCGCATATCCCTGCAAGGAATGTACTATAGAGCCAATTTTACCGGCAAAGGAATGGAAGATCTGAAAGGCTAGGCGATCCCACAAGCATCGAGGAGCAGGCTGGAATTTGAACCAATCGGCATGATTCCCAAGCTCAAGCTTTTGGCCACCCCTGCACTGCCAGGGACAAAAAAAAAAAAAAAAAAAAACCCTGGGAGGAGAGCCAAGCTAGGGAGTCAAGACCCTCCAGCCAGGTCTGGATGGGAGGCAGGTGCCTCCACCCTGGTCCCAGAGCAAGTTCTGCTGGCTTCAGCCACCTGACTTCCCTGTGAAGGTGGGTAGAGGCCAGAGCAGACTGTGTGTGATTCTGGCCCCAGCCCCAGCACCTCTACCCCCACCTTTACTACCCCTAGGCTGCGGGAAGAGGCTTTGCCCAGCAATAGTCCTGATCTAATGGATCCTTGAAGCACAATAAACAGATAGTATTTCTGCATGTGTCAAAAAAAAA;
对pUC57和Linc00853进行双酶切;使用1%-1.2%的琼脂糖电泳凝胶进行产物检测;对带有目的片段的凝胶进行切割、溶胶和过柱回收;联结目标和载体DNA形成重组DNA;转化感受态细胞,取转化菌液接种在含有Amp、X-gal和IPTG储液的LB(Luria-Bertani)固体培养基上,如果出现白色菌落,则证明目的基因与载体基因连接成功,导致重组质粒的转化子中β-半乳糖苷酶失活;如果是蓝色菌落,则证明只有质粒载体导入受体菌内。获得目标质粒后使用miliq水进行浓度稀释。
1.5.3反应体系构建
使用LAMP试剂盒(双螺旋)构建LAMP检测体系,其主要成分和程序设置如下表7:
表7:LAMP检测体系及程序
1.5.4引物筛选
根据不同组引物能检测到的质粒最低浓度及其Tt值(反应荧光信号达到阈值时对应的扩增时间)大小、在琼脂糖凝胶电泳上验证产物并筛选出最优引物组。
1.5.5产物验证
产物用琼脂糖凝胶电泳法进行验证。首先配置浓度2%的琼脂糖(用40mL1×TAE溶解0.8g琼脂糖,使用微波炉加热至溶解),向溶液中加入20μL核酸红(Nucleic Acid Red,,NA-Red)染料。将上述溶液倒入插有加样梳的电泳槽中(注意最好不要有气泡),凝固好后取出加样梳。向孔中加入10μL用6×DNA Loading Buffer稀释后的核酸样本,电压100V下跑30min后在凝胶成像系统下显像。
1.5.6条件优化
对反应温度、引物浓度、酶量以及样本稀释度进行了优化。根据反应最适温度通常为63℃,设计61、63、65、67℃四种反应温度;对于引物浓度,设置了4种浓度比;对于酶量,设计0.5、1、2μL;对于样本稀释度,设置原倍、1:5、1:10和1:20的梯度。
1.5.7临床应用
我们将对检测Linc00853的LAMP法结果与临床相关指标进行相关性分析,与PCR法进行诊断HCC一致性比较,同时探究其对HCC筛查、预后的价值。
1.6统计分析
统计、绘图选用SPSS 22.0,R4.1.1,GraphPad Prism 9.0。连续变量用平均值(标准差)或中位数[P25,P75]表示,分类变量用频数表示。比较两组正态和非正态分布连续变量分别施用t检验和Mann-Whitney U检验;比较术前术后同一患者同一指标的变化时,服从正态分布则应用配对t检验,否则为Wilcoxon配对秩和检验。分类变量采用卡方检验。采用二元Logistic回归确定HCC的独立危险因子。采用受试者工作特征曲线(ReceiverOperating Characteristic,ROC)曲线分析诊断价值,以约登指数最大值(灵敏度+特异性-1)为最佳切点值。采用生存曲线和单因素、多因素COX回归进行生存分析。P<0.05,有统计学差异。
2.实验结果
2.1外泌体鉴定
通过电镜和粒径分析进行单囊泡的表征:电镜下观察到椭圆形的囊泡样物质,有非常明显的膜结构,大小100nm左右;进一步进行粒径分析显示颗粒的平均大小为100nm,浓度为8.3×10
2.2LAMP引物筛选
将质粒稀释成10
表8:不同组LAMP引物扩增不同浓度质粒Tt值结果
结合琼脂糖凝胶电泳(如图3所示),当质粒浓度为10
2.3 LAMP反应条件优化
2.3.1反应温度
在25μL的LAMP反应体系中,以质粒浓度10
2.3.2引物浓度
为保证LAMP反应成功进行,内引物浓度需要高于外引物从而达到先与外引物结合目标链的目的,设置三种不同的内引物(FIP、BIP):环引物(LF、LB):外引物(F3、B3)的比例,从图5发现引物浓度3为最适合浓度比例。保持该浓度比,我们增加一倍引物总量(总引物体积从1μL变为2μL),形成引物浓度4,将其添加进反应体系,但观察到该浓度下Tt值无明显增加。因此,最终体系中采用引物浓度3。注图5中:引物浓度1:内引物:环引物:外引物=4:2:1;引物浓度2:内引物:环引物:外引物=4:1:1;引物浓度3:内引物:环引物:外引物=8:4:1;引物浓度4:内引物:环引物:外引物=8:4:1,总引物体积2μL。
2.3.3酶量
酶量对扩增反应也有影响。我们简单设置3组不同酶量下的LAMP反应,分别是0.5μL、1μL和2μL。研究结果(图6)发现,1μL和2μL酶量下Tt值无明显差别,但两者相对于0.5μL都有明显降低。本着经济节约且优化体系的原则下选择添加酶量为1μL。
2.3.4样本稀释度
RNA的逆转录过程对于后续实时荧光PCR反应可能有抑制作用,因此需要调试样本稀释度促进目标产物检出。我们随机选择3个样本进行浓度梯度的稀释,设置稀释比例为1:5,1:10和1:20,同时与原倍进行比较发现样本无需稀释(见表9)。
表9:不同样本稀释度下Tt值结果
2.4临床应用评价
2.4.1参与研究者的基线特征
本研究纳入的23名HCC患者和30名健康体检人群在年龄和性别构成比上有统计学差异。在校正性别、年龄的影响后发现,HCC患者的MCV、DB、ALT、AST、Cys-C和ALP水平比健康人高,ALB、ALB/GLB、HDL-C和CK水平低,统计学差异显著(P<0.05)(表10)。LAMP方法检测Linc00853的Tt值在两组间有统计学差异(P<0.05),HCC组的Tt值更低,则其表达量高于健康组(见表10)。
表10:患者一般资料
/>
注:*校正性别、年龄后,黑色粗体表示P<0.05
在热图(图7)中,LAMP法的Tt值与年龄、PCR法检测Linc00853的相对表达量(2
2.4.2 LAMP法和PCR法检测Linc00853的比较
利用LAMP和PCR法检测Linc00853对HCC进行诊断价值分析(图8)发现,LAMP法检测Linc00853的Tt值切点值为17.275min,敏感性为95.7%,特异性为70.0%,阳性似然比3.19,阴性似然比0.06,阳性预测值0.71,阴性预测值0.95;PCR法检测Linc00853的相对表达量切点值为11.055,敏感性91.3%,特异性43.3%,阳性似然比1.61,阴性似然比0.20,阳性预测值0.55,阴性预测值0.87。
根据切点值对LAMP和PCR法检测Linc00853两种方法进行一致性检验发现(见表11),两者一致性中等(Kappa=0.47),结果有统计学差异(P<0.05)。
表11:PCR与LAMP方法一致性研究
2.4.3 HCC预后影响因素分析
收集的23例HCC患者中,1例行靶向加免疫药物联合治疗,4例进行手术切除,18例行TACE术。针对22例行手术或TACE术患者开展180天随访,进行HCC术后无进展生存评估。22例HCC患者临床信息如表12所示。
表12:HCC患者临床信息
/>
针对同一患者术前、术后同一实验室指标对比结果如表13。与术前相比,HCC患者术后血常规检查中WBC和NEUT升高,LYMPH、EO和BASO降低;肝功检查TB、DB、IB、ALT、AST升高;血清酶LDH和HBDH升高;肾功检查Cys-C、UA和脂代谢指标TG、TC降低,有统计学意义(P<0.05)。
表13:HCC患者术前术后实验室指标对比
/>
注:黑色粗体表示P<0.05
单因素COX回归分析发现,术前Tt值、术前DB和术后ALP、术后TBA水平是HCC预后影响因素且具有统计学意义(P<0.05)。由表14可以看出,LAMP法检测Linc00853的Tt值增加,表示Linc00853表达水平越低,发生HCC进展风险降低(HR=0.68<1),反之亦然。术前DB、术后ALP和术后TBA的增加会促进HCC进展,成为HCC术后无进展生存的阻碍因素。
表14:HCC患者预后影响因素
以Tt值中位数(13.90)为界,低于或等于中位数的为Linc00853表达高水平组,高于则为Linc00853表达低水平组,其风险比(Hazard Ratio,HR)为5.78(95%CI 1.16-28.7,P=0.032),两组在时间作用下对HCC无进展生存(Progression free survival,PFS)的影响见下图(图9),提示高水平Linc00853患者发生HCC进展风险更高,预后较差(P=0.0176)。
将上述单因素COX回归的指标纳入多因素COX回归并绘制森林图(图10),对LAMP法检测Linc00853的Tt值分别以连续型变量和二分类变量(高水平即Tt值≤13.9时赋值1,低水平赋值0)形式纳入模型,不同水平Linc00853的HR值差异均有统计学意义,且表达水平越高越会促进HCC进展。
需要说明的是,本说明书中描述的具体特征、结构、材料或者特点可以在任一个或多个实施例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例以及不同实施例的特征进行结合和组合。
- 一种用于SCID遗传病筛查的引物、检测试剂盒及检测方法
- FOXM1基因、用于检测其的试剂盒及其用途
- 一种外周循环血lncRNA用于诊断早期原发性肝癌、制备原发性肝癌筛查试剂盒的用途
- 一种用于肝癌患者预后风险评估的基因检测试剂盒及应用
