一种高产脂肽类物质的贝莱斯芽孢杆菌及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于微生物技术领域,更具体地,涉及一种高产脂肽类物质的贝莱斯芽孢杆菌及其应用。
背景技术
红鱼的学名为红鳍笛鲷,是我国南海重要的海产经济鱼类,其干制品因独特的风味受到广大百姓的青睐,为湛江本地渔业带来了巨大的商机。而红鱼干的制作工艺大部分保留着日晒、腌制等传统的做法,不可避免会受到环境因素的影响,被细菌、真菌及其毒素污染,导致红鱼干品质下降,甚至引发食品安全事件。添加剂的使用对保障产品的品质以及延长贮藏期有着明显的提高作用,但有关人工添加剂使用超标及其危害的新闻报道频发,寻找安全可靠且绿色的微生态制剂更加符合消费者对健康饮食的需要。
基于众多学者的研究发现,芽孢杆菌具有广谱抑菌的特性,并且由于芽孢这一结构的存在使该菌种具有较强的抗逆性,在合适的培养条件下,许多芽孢杆菌可分泌抗菌谱广的脂肽类代谢产物,这些代谢产物对酸碱度无严格的要求,且热稳定性强,无疑让该菌种成为益生菌和生物防治菌的引领菌种。目前研究最为广泛的脂肽类物质主要为表面活性素(Surfactins)和伊枯草菌素(Iturins),其抑菌机制也不尽相同,如表面活性素,能对细菌脂膜结构进行破坏,使细胞内物质释放而导致细菌死亡;再如伊枯草菌素,能够使真菌细胞膜产生微小的孔隙,导致细胞内的一些重要离子外漏,从而让微生物死亡。
近年来具有广谱抑菌活性的海洋源芽孢杆菌不断被人们发掘,但目前关于红鱼源芽孢杆菌的研究还鲜有报道,而红鱼生存在低水温、低氧量、高盐量、相对于陆地较少的营养物质等为特点的极端海洋环境,使生活在其中的芽孢杆菌具有更强的环境适应力,蕴含着丰富抗菌脂肽组分的可能,为绿色安全的微生态制剂开发提供良好的菌种,扩充海洋源芽孢杆菌获取的菌源库。
发明内容
本发明所要解决的技术问题是克服现有技术中存在的上述问题,首先提供一种高产脂肽类物质的贝莱斯芽孢杆菌。
本发明的第二个目的是提供上述贝莱斯芽孢杆菌的应用。
本发明的目的通过以下技术方案实现:
一种贝莱斯芽孢杆菌,该菌株保藏于广东省微生物保藏中心,保藏地址为广州市先烈中路100号大院59号楼5楼,保藏编号为GDMCC No:62769,保藏日期为2022年9月6号。
本发明通过分离红鱼肠道,得到一种对部分革兰氏阴性菌和真菌均有一定抑制活性的芽孢杆菌,经鉴定为贝莱斯芽孢杆菌。
因此,本发明还提供所述贝莱斯芽孢杆菌在抑制细菌和真菌中的应用,所述细菌为大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌;所述真菌为尖孢镰孢菌。
另外,本发明还提供所述贝莱斯芽孢杆菌在制备抑制细菌和真菌的微生态制剂中的应用,所述细菌为大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌;所述真菌为尖孢镰孢菌。
对于此次分离所得的红鱼源芽孢杆菌所产生的抗菌类物质,通过LC-MS检测出含有Surfactin与Iturin两种脂肽成分。
因此,本发明还提供所述贝莱斯芽孢杆菌在产脂肽类物质中的应用,所述脂肽类物质为Surfactin和Iturin。
贝莱斯芽孢杆菌高产脂肽类物质,由本发明的发酵方法经简单提纯后得到的Surfactin总产量约为10 854μg/mL,Iturin总产量约为537μg/mL。
作为一种具体的实施方式,上述应用是:菌株活化后,按照一定的接种量接种在培养基后,液体培养,除去菌体,得到含有脂肽类物质的粗提液。
更具体的,上述应用中,芽孢杆菌种子液的接种量为5%,发酵培养基为Landy培养基(g/L):葡萄糖20.0g,L-谷氨酸5.0g,MgSO
本发明还提供含有所述贝莱斯芽孢杆菌的微生态制剂,所述微生态制剂对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、尖孢镰孢菌有抑制作用。
与现有技术相比,本发明具有以下有益效果:
本发明提供了一种高产脂肽类物质的贝莱斯芽孢杆菌,该菌发酵后经简单提纯得到的Surfactin总产量约为10 854μg/mL,Iturin总产量约为537μg/mL;抑菌实验结果显示,其发酵液对大肠杆菌、铜绿假单胞菌和镰孢菌均有一定的抑制作用;经液相色谱串联质谱仪检测出其发酵产物中均含有表面活性素(Surfactin)和伊枯草菌素(Iturin)两类脂肽抗菌活性成分,表明分离菌株具有广谱抑菌的潜力。本研究以期为绿色微生态制剂的开发提供新的菌源库,丰富芽孢杆菌的获取途径。
附图说明
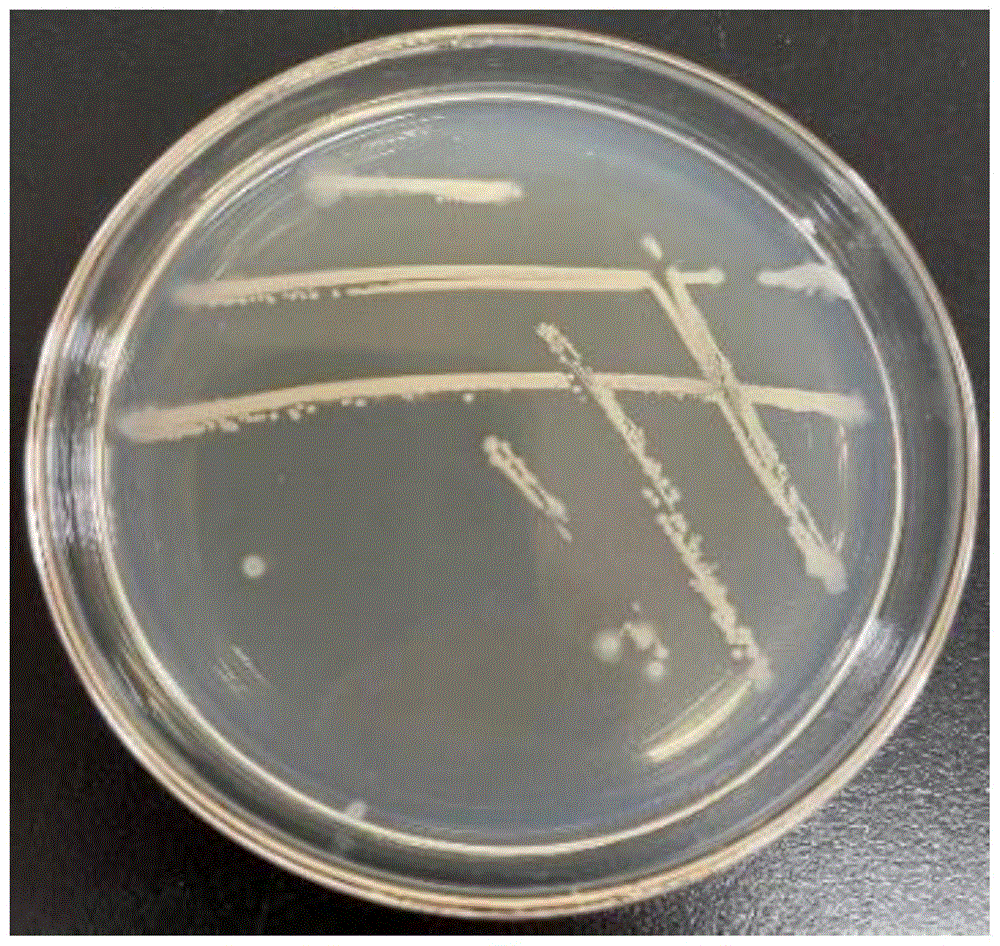
图1为分离得到的菌株的平板培养图;
图2为分离得到的菌株的显微镜图(×40);
图3为分离得到的菌株的16sRNA基因的PCR扩增结果;
图4为分离得到的菌株的系统发育树;
图5为分离得到的菌株的抗菌活性(牛津杯法);
图6为分离得到的菌株对尖孢镰孢菌的抗菌效果;
图7为Surfactin标准品离子流图;
图8为Iturin标准品离子流图;
图9为6种Surfactin组分的标准曲线;
图10为5种Iturin组分的标准曲线;
图11为分离得到的菌株发酵产物中各组分脂肽类物质的含量。
具体实施方式
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
下述实施例以及实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料;所用的设备,如无特殊说明,均为常规实验设备。
实验样品:供试样品红鳍笛鲷购于湛江海域附近的霞山水产品批发市场。将红鱼放血、去皮,取出肠道,鱼肉切块,并进行分装,放进-20℃冰箱保存备用。
指示菌:金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichiacoli)、铜绿假单胞菌(Pseudomonas aeruginosa)、尖孢镰孢菌(Fusarium oxysporum),本实验所用指示菌均来自广东海洋大学食品科技学院水产品绿色控制实验室保藏。
实施例1
1、菌株的鉴定
(1)分别称取鱼肠、鱼肉,剪碎,放入LB肉汤液体培养基中,在37℃下摇床培养24h,以获得富集菌液;将富集菌液置于80℃水浴锅中20min,杀死不耐热细菌,取1mL菌液加入到含9mL生理盐水试管中,依次稀释获得10
(2)形态学观察:挑取单菌落并纯化,自然光下观察菌落形态;按照革兰氏染色试剂盒中的方法,挑取单菌落进行涂片、固定、染色、镜检,观察菌体的染色特征、细胞形态。
(3)分子生物学鉴定:16S rRNA鉴定采用通用引物,菌株PCR反应体系(30μL):上游引物5’-GAGAGTTTGATCCTGGCTCAG-3’(27F)和下游引物5’-CGGCTACCTTGTTACGAC-3’(1492R)(10μmol/μL,各0.75μL),ddH
将扩增产物进行琼脂糖凝胶电泳检测,将预期产物送至生工生物工程(上海)股份有限公司测序。测序结果在NCBI官网数据库进行同源性分析,下载相似性最高的相关菌株序列,利用MEGA5.1软件构建系统发育树。
从图1和图2看出,从海洋环境的红鱼样品中初步分离出的1株分离菌株,菌落圆形、表面粗糙不透明、微黄、边缘有褶皱;经革兰氏染色后在显微镜下观察呈紫色杆状,为革兰氏阳性菌。将其分别命名为HY02,来源于红鱼的肠道。
分离菌株通过PCR扩增后,产物电泳后在凝胶成像系统中观察,结果如图3所示,目的条带基因片段长度约为1500bp,将扩增产物送检测序,得到疑似芽孢杆菌的16S rRNA序列。
根据反馈出的16S rRNA核苷酸序列,在NCBI官网数据库上进行比对,结果显示海洋红鱼源芽孢杆菌HY02与Bacillus velezensis(MG752876.1)的相似度最高,对比相似性为99.51%,因而将该菌株鉴定为贝莱斯芽孢杆菌(Bacillus velezensis),该菌株保藏于广东省微生物保藏中心,保藏地址为广州市先烈中路100号大院59号楼5楼,保藏编号为GDMCC No:62769,保藏日期为2022年9月6号。
将分离菌株的序列利用MEGA5.1软件进行比对分析,进而构建系统进化树,如图4。
2、分离菌株抑菌活性测定
(1)发酵液的制备:取斜面保存的分离菌株进行活化,挑取1-2环活化后的菌体接种于100mL LB液体培养基中,于37℃150r/min培养24h。再按照5%(v/v)的接种量接种于的Landy培养基中,30℃、180r/min培养36h。10 000r/min离心20min除去菌体,备用。
(2)菌悬液的制备:将金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌分别接种于琼脂斜面,培养12-24h后,添加适量的生理盐水并稀释混匀,用紫外可见分光光度计测定其OD
(3)细菌抑菌活性测定:采用双层琼脂牛津杯抑菌实验法,分别吸取1.5mL指示菌菌悬液,加入到冷却至55-60℃的营养琼脂中,混匀,制得指示菌培养基。在培养皿上倒入一层素琼脂,凝固后在琼脂上放置牛津杯,将指示菌培养基平铺于素琼脂上作为第二层琼脂,冷却后取出牛津杯,在杯孔中加入150μL发酵液,37℃培养12-24h,观察杯孔周围的透明抑菌圈,并测量记录其直径。
(4)真菌抑菌活性测定:将2mL贝莱斯芽孢杆菌发酵液加入到冷却至55-60℃、50mL的PDA培养基中,混匀,制得发酵液-PDA培养基,用打孔器(内径4mm)将镰孢菌菌饼置于培养基平板中央,置于28℃生化培养箱中培养,测量生长菌丝的直径,与空白组对照,计算培养7天后的菌丝抑制率。菌丝抑制率的测定公式为:抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
如图5所示,分离菌株的发酵液对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌三种常见致病菌有不同程度的拮抗作用,推测菌株的发酵产物中含有抑菌活性物质,展示了海洋红鱼源芽孢杆菌所具有的广谱抗菌潜力。
如表1所示,菌株HY02对以上三种指示菌都有抑菌活性。
表1菌株发酵液在不同指示菌的抑菌直径比较
注:不同字母表示在同一行中数据存在显著性差异(p<0.05)。
将镰孢菌接种于发酵液-PDA平板上,培养7天后观察菌丝生长情况,如图6和表2所示,与菌丝生长旺盛的空白组对照相比,分离菌株的发酵液能在一定程度上抑制红鱼干内优势腐败霉变真菌镰孢菌菌丝的生长,该实验证实了分离菌株分泌的抗菌活性物质能阻碍真菌的生长,也为其应用于病害微生物的防治提供了可能。
表2分离菌株发酵液的抑真菌活性
3、分离菌株脂肽粗提物的鉴定
取分离菌株的发酵上清液,用甲酸调pH至2.0,低温过夜,5 000r/min离心15min取沉淀用甲醇溶解,用氨水调节pH至7.0,4℃5 000r/min离心20min,取上清液氮吹至无流动液体,制得脂肽粗提物,采用LS-MS/MS检测产物中抗菌脂肽的成分,取脂肽粗提物加入等体积的7:3乙腈/水溶液(含0.1%甲酸),超声溶解30min,用0.45μm的有机相滤膜过滤至进样小瓶中,进行上样测定,参考DENG等的方法进行参数设置。
选取浓度为5μg/mL的Surfactin标准溶液和Iturin标准溶液检测,得到Surfactin和Iturin标准品的离子流图,如图7、图8所示,Surfactin标准品对应的分子离子峰为995、1008、1 022、1058;Iturin标准品对应的分子离子峰为1036、1 044、1 057、1 071。
分别配制浓度为0、0.5、1.0、2.0、5.0μg/mL的Surfactin工作液和同一浓度梯度的Iturin工作液,上机测定,以横坐标为质量浓度(μg/mL),纵坐标为峰面积,得出各自同系物的标准曲线,如图9、10所示,两种脂肽同系物标准曲线的相关系数r
将芽孢杆菌发酵产物组分峰面积经标准曲线计算得到各组分脂肽产量,如图11所示,菌株的发酵产物中均存在Surfactin和Iturin族脂肽,其质荷比分别为995、1 008、1022、1058(Surfactin)、1036、1 044、1 057、1 071(Iturin)。
脂肽同系物成分与含量的差异也许是导致菌株抑菌能力不同的原因之一,根据峰面积对应标准曲线计算得出芽孢杆菌Surfactin总产量和Iturin总产量,如表3所示,表明其在微生态制剂的研发中具有良好的应用潜力。
表3芽孢杆菌Surfactin总产量和Iturin总产量
注:不同字母表示在同一行中数据存在显著性差异(p<0.05)。
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
- 一株耐盐并高产脂肽的贝莱斯芽孢杆菌及应用
- 一株贝莱斯芽孢杆菌产抗菌脂肽及其在化妆品和食品的应用
