树突状细胞肿瘤疫苗的制备方法及其应用
文献发布时间:2023-06-19 19:32:07
技术领域
本发明专利涉及一种树突状细胞肿瘤疫苗的制备方法及应用,属于细胞免疫学技术领域。
背景技术
急性髓细胞白血病(Acute Myeloid Leukemia,AML)是一类异质性强、复发率极高的常见血液系统恶性肿瘤。AML是成人中最常见的一种急性白血病类型,在儿童中是继急性淋巴细胞白血病之后第二常见的儿童白血病。成人AML患者的5年生存率只有25%,在高于65岁的老年患者中生存率低至10%,儿童AML患者5年生存率根据地域不同各有差异,在发达国家可达65%,在相对落后国家低至20%。AML治疗的难点在于其治疗缓解后复发率高且复发后患者治疗反应性差,亟需开发新的有效治疗策略防治复发。
免疫细胞治疗是指通过回输具有抗肿瘤作用的免疫细胞至患者体内从而控制或清除肿瘤的治疗方案。树突状细胞(dendritic cells,DCs)是固有免疫系统中关键的抗原提呈细胞,其可摄取外界或非自体的抗原(如肿瘤抗原)并提呈至
迄今为止,临床前研究或临床试验使用DCs防治AML有以下三种主要情形:①造血干细胞移植后复发;②难治复发没有其他治疗方案;③化疗诱导缓解后防止或延迟复发。在不同的情形下,DCs治疗均显示了不同程度的作用,表现在输注后诱导患者体内抗原特异性T细胞免疫反应、病情稳定无进展、提高完全/部分缓解率、提高整体生存率等。尽管如此,依然只有少部分临床试验显示了临床获益,DCs免疫治疗的疗效有限,是亟待解决的重要问题。目前临床前和临床试验常用的DCs绝大部分来源于自体或供体的外周单核细胞在体外经过GM-CSF等细胞因子的诱导培养获得成熟的DCs(monocyte-derived DCs,简称moDCs)。然而,鉴于目前传统moDCs在临床AML患者中疗效的有限性,开发新型有效的DCs及相应的细胞治疗方案将为领域带来新的突破,意义重大。
DLL4(delta like ligand 4),是Notch信号通路的其中一个配体,其氨基酸序列如中国专利文献CN113832102A所示。Notch信号参与多种生理过程的调控,包括细胞分化、个体发育、T细胞免疫反应等。Notch信号通路由5个Notch配体(Jagged1/2和DLL1/3/4)和4个Notch受体(notch1/2/3/4)组成。Notch受体包括胞膜区段和胞内区段(NICD)。当Notch配体结合到Notch受体后,NICD被γ-secretase复合体酶切释放进入胞内,并进一步进入细胞核内。胞内段NICD进入细胞核内后,与互作蛋白结合引起转录抑制复合体构象改变,并形成转录活化复合体,最终引起Notch靶基因的转录活化。
因此,制备DLL4+DC疫苗并评估其诱导杀伤性T细胞免疫反应的能力,对提高DC疫苗的临床应用价值具有重要作用,不仅在治疗白血病中,而且可以推广到多种肿瘤治疗应用中。
发明内容
本发明的目的是提供一种树突状细胞肿瘤疫苗的制备方法,通过慢病毒感染的方法向DC细胞中导入外源人DLL4表达。培养获得的DC(树突状细胞)不仅具有成熟的DC表型,且在细胞表面表达DLL4,其诱导杀伤性T细胞分化和产生的能力显著增强。杀伤性T细胞是抗肿瘤的主要效应细胞,对肿瘤免疫治疗疗效极为重要。
本发明的技术方案为:一种树突状细胞肿瘤疫苗的制备方法,在树突状细胞培养过程中,用DLL4慢病毒感染树突状细胞,使其表达外源性人DLL4。
优选的,所述DLL4慢病毒的制备过程为:将人DLL4的CDS编码区序列构建到慢病毒表达载体上,使用293T工具细胞,同时转染DLL4慢病毒载体及辅助包装载体,生产包装DLL4慢病毒。
优选的,用单核细胞诱导培养DC,其步骤包括:
(1)分离健康供体外周血单核细胞;
(2)用含有GM-CSF和IL-4的完全培养基培养5天,在第一天培养的时候感染权利要求1-3中任一项所述的DLL4慢病毒;
(3)用含有GM-CSF、IL-4和TNF-α的完全培养基诱导树突状细胞成熟,培养2-3天,获得树突状细胞肿瘤疫苗;
整个培养过程中使用MS5基质细胞作为饲养层细胞。
优选的,细胞因子终浓度为GM-CSF 5-10ng/ml,IL-4 4-10ng/ml,TNF-α4-10ng/ml。
优选的,步骤(2)中加入的DLL4慢病毒MOI=1.0,同时加入终浓度为8ug/ml促感染试剂polybrene,离心3000rpm,3小时,30℃。
优选的,造血干细胞诱导培养DC,其步骤包括:
(1)分离脐带血或G-CSF动员后的外周血中的CD34+造血干细胞;
(2)用含有FLT3L、SCF、IL-3和TPO的完全培养基诱导细胞扩增,培养5-7天,在第一天培养的时候感染权利要求1-3中任一项所述的DLL4慢病毒;
(3)用含有FLT3L、IL-3和IL-4的完全培养基诱导DC分化,培养5-7天;
(4)使用LPS刺激诱导DC成熟12-16小时;
整个培养过程中使用MS5基质细胞作为饲养层细胞。
优选的,细胞因子终浓度为FLT3L 50-100ng/ml,SCF 10-30ng/ml,IL-3 10-20ng/ml,IL-410-20ng/ml,TPO 10-30ng/ml。
优选的,步骤(2)中加入的DLL4慢病毒MOI=1.0,同时加入终浓度为8ug/ml促感染试剂polybrene,离心3000rpm,3小时,30℃。
本发明还公开了上述树突状细胞肿瘤疫苗的制备方法制备得到的树突状细胞肿瘤疫苗。
本发明还公开了上述的树突状细胞肿瘤疫苗在制备预防或治疗肿瘤的药物中的应用。
优选的,所述肿瘤为白血病。
本发明制备得到的树突状细胞具有成熟DC细胞的表型,表达抗原提呈分子HLA-DR,共刺激分子CD40/CD80/CD83,可分泌大量IL-12,诱导更高水平的Th1和CTL细胞分化,加强T细胞的肿瘤杀伤作用。
附图说明
图1:DLL4慢病毒表达元件示意图。
图2:单核细胞来源的DC表型。
图3:造血干细胞细胞来源的DC表型。
图4:单核细胞来源DC细胞因子IL-12表达。
图5:单核细胞来源DC与CD4+T细胞共培养。
图6:造血干细胞来源DC与CD4+T细胞和CD8+T细胞共培养。
具体实施方式
下面结合具体的实施例,对本发明做进一步说明,这些具体实施例不应以任何方式被解释为限制本发明的应用范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:DLL4慢病毒载体构建及病毒制备
1.将人DLL4 CDS(NM_019074,location 330-2387)基因片段合成并构建至慢病毒表达载体(图1);
2.将构建好的载体转化至stbl3细菌感受态中,摇菌扩增质粒,使用质粒抽提试剂盒获得纯化质粒;
3.在293T工具细胞中,转染DLL4目的载体以及病毒辅助包装载体(pspax和pMD2G),
在转染后48小时收集上清,离心除去细胞碎片后,使用超速离心获得浓缩后的病毒颗粒;4.病毒滴度检测:使用293T细胞铺板,96孔板,每孔1万细胞,过夜培养,使其贴壁。
将浓缩后的病毒按照3倍做倍比稀释,取不同稀释倍数的病毒10ul加入至孔板细胞中,置于细胞培养箱中培养72小时,收集细胞检测GFP阳性率,使用阳性率在10-20%的数据计算病毒滴度,计算公式为,病毒滴度=病毒稀释倍数*阳性率*10^6TU/ml。例如,当病毒稀释倍数为81倍时,阳性率为15%,则病毒原液滴度为
81*0.15*10^6=12.15*10^6TU/ml。
实施例2:单核细胞来源的DLL4
1.采集健康供体外周血50ml,使用含2mM EDTA的PBS稀释至100ml,将淋巴细胞分离液Ficoll加入离心管底部,按照Ficoll:细胞悬液=1:2的比例在Ficoll上方缓慢加入细胞悬液,1500g,12分钟,30℃,升降度加速度为0。收集中间白膜层细胞,用含2.5%胎牛血清的PBS洗涤细胞,两次,离心条件为1000g,5分钟,4℃。沉淀即为外周血单个核细胞PBMC。
2.按照说明书,使用miltenyi CD14 microbeads分选PBMC中单核细胞,大致过程为:使用含0.5% BSA和2mM EDTA的PBS重悬细胞沉淀,每1*10^7细胞使用80ul上述缓冲液重悬细胞,加入20ul microbeads,混匀孵育,4℃,15分钟;使用上述缓冲液洗涤细胞一次后,重悬细胞沉淀,加入磁柱中进行细胞分选,最后将被磁柱结合的细胞冲洗脱离柱子,即为纯化后的单核细胞。
3.配制分化培养基:在X-VIVO15培养基中加入如下重组人源细胞因子,使其终浓度分别为GM-CSF 20ng/ml,IL-4 10ng/ml。使用分化培养基重悬单核细胞,铺板于24孔板,密度为2*10^6细胞/ml。每2天更换一次培养基,培养5天。
4.病毒感染:铺板24小时后,将DLL4慢病毒颗粒按照MOI=1.0,即1个细胞对应1个病毒颗粒,加入至孔板细胞中,同时加入终浓度为8ug/ml的促感染试剂polybrene,离心3000rpm,3小时,30℃。离心结束后,将细胞放回细胞培养箱中继续培养。以GFP空载病毒作为对比例。
5.配制成熟培养基:在X-VIVO15培养基中加入如下重组人源细胞因子,使其终浓度分别为GM-CSF 20ng/ml,IL-4 10ng/ml,TNF-α10ng/ml。将细胞更换至成熟培养基中,继续培养2天。
6.收集树突状细胞:使用枪尖轻轻吹打细胞,收集悬浮及轻微贴壁的细胞即为树突状细胞,取部分细胞进行表面染色,鉴定细胞表型,结果如图2所示,图2展示了单核细胞来源的DC,在有无DLL4慢病毒感染条件下产生的DC表型,抗原提呈分子HLA-DR、共刺激分子CD40/CD80/CD86表达以及DLL4表达。从图2可以看出DLL4慢病毒感染显著增加了DC表面DLL4的表达,并且DLL4病毒感染DC均高表达抗原提呈分子和共刺激等功能分子。
实施例3:造血干细胞来源的DLL4
1.获取脐带血或G-CSF动员后的外周血,使用含2mM EDTA的PBS稀释1倍体积,将淋巴细胞分离液Ficoll加入离心管底部,按照Ficoll:细胞悬液=1:2的比例在Ficoll上方缓慢加入细胞悬液,1500g,12分钟,30℃,升降度加速度为0。收集中间白膜层细胞,用含2.5%胎牛血清的PBS洗涤细胞,两次,离心条件为1000g,5分钟,4℃。沉淀即为单个核细胞MNC。
2.按照说明书,使用miltenyi CD34 microbeads分选MNC中CD34
行细胞分选,最后将被磁柱结合的细胞冲洗脱离柱子,即为纯化后的CD34
3.MS5饲养层细胞铺板:将培养的MS5细胞使用胰酶消化,得到MS5细胞悬液,加入终浓度为10ng/ml的丝裂霉素,置于37℃,孵育3小时。使用PBS洗涤细胞,2次,完全去除丝裂霉素。将处理后的MS5细胞铺板于96孔板,每孔2.5万细胞,置于培养箱过夜,使其贴壁。
4.配制扩增培养基:在X-VIVO15培养基中加入如下重组人源细胞因子,使其终浓度分别为FLT3L 100ng/ml,SCF 20ng/ml,IL-3 20ng/ml,TPO 10ng/ml。使用扩增培养基重悬造血干细胞,铺板于含有MS5饲养层细胞的96孔板,1万造血干细胞/孔。每2天更换一次培养基,培养6天,期间根据细胞增殖情况确定是否扩孔,如扩孔,需提前准备MS5饲养层细胞。
5.配制分化培养基:在X-VIVO15培养基中加入如下重组人源细胞因子,使其终浓度分别为FLT3L 100ng/ml,IL-3 10ng/ml,IL-4 20ng/ml。
6.病毒感染:收集培养6天后得到的扩增细胞,将DLL4慢病毒颗粒按照MOI=1.0,即1
个细胞对应1个病毒颗粒,加入至孔板细胞中,同时加入终浓度为8ug/ml的促感染试剂polybrene,离心3000rpm,3小时,30℃。离心结束后,将细胞重悬于分化培养基中。
以GFP空载病毒作为对比例。
7.诱导DC分化:将上一6中细胞铺于MS5饲养层中,96孔板5万细胞/孔。每2天更换一次培养基,培养6天,期间根据细胞增殖情况确定是否扩孔,如扩孔,需提前准备MS5饲养层细胞。
8.诱导DC成熟:在细胞培养液中加入100ng/ml LPS活化未成熟DC,刺激过夜。
9.收集树突状细胞:使用枪尖轻轻吹打细胞,收集悬浮及轻微贴壁的细胞即为树突状细胞,取部分细胞进行表面染色,鉴定细胞表型,图3表示造血干细胞来源的DC,在有无DLL4慢病毒感染条件下产生的DC表型,抗原提呈分子HLA-DR、共刺激分子CD40/CD80/CD86表达以及DLL4表达,从图中可以看出造血干细胞来源DC在经过培养和刺激后显著表达DLL4;收集mRNA检测细胞因子表达,从图4可以看出,造血干细胞来源DC经LPS刺激后显著上调表达IL-12。
实施例4:单核细胞来源DLL4
1.CD4
2.共培养:将实施例2中收集得到的单核来源DC(DLL4病毒感染及对照GFP空载病毒感染组)与异体健康供体来源的CD4
细胞为2*10^5/孔,培养基为RPMI 1640+10%FBS+10ng/ml IL-2+50mMβ-2ME。
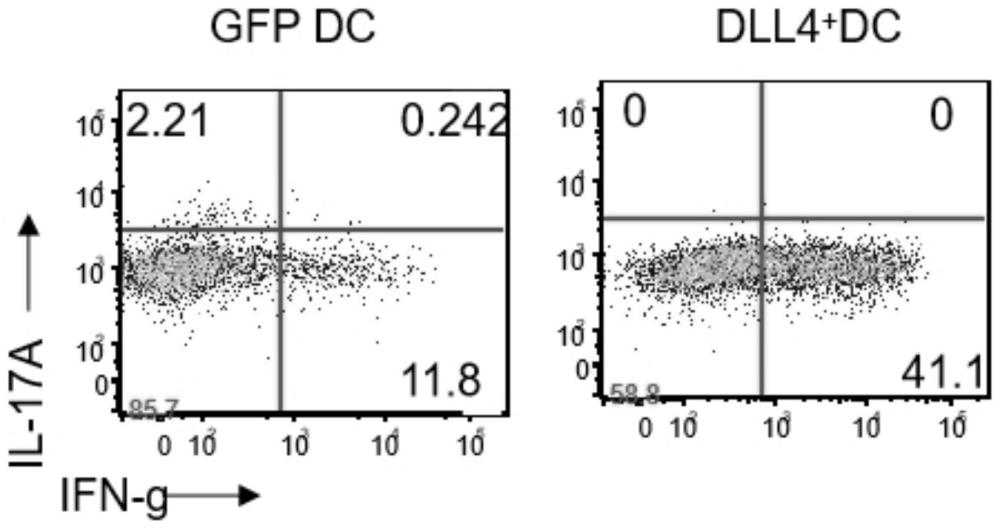
3.共培养第5天,收集细胞。使用抗CD3抗体包板,1ug/ml,用于刺激T细胞TCR信号通路活化,加入高尔基体阻断剂,使用流式抗体检测T细胞胞内细胞因子的产生,结果如图5所示,从图5可以看出,单核细胞来源DLL4+DC在共培养系统中,可以显著增强Th1细胞分化,表明其可以明显增强T细胞的抗肿瘤效应。
实施例5:造血干细胞来源DLL4
1.CD4
2.共培养:将实施例3中收集得到的造血干细胞来源DC(DLL4病毒感染及对照GFP空载病毒感染组)进行流式分选,获得CD66b
培养基为RPMI 1640+10%FBS+10ng/ml IL-2+50mMβ-2ME。
共培养第5天,收集细胞。使用抗CD3抗体包板,1ug/ml,用于刺激T细胞TCR信号通路活化,加入高尔基体阻断剂,使用流式抗体检测T细胞胞内细胞因子的产生,结果如图6所示,从图6可以看出,造血干细胞来源DLL4+DC在共培养系统中,可以显著增强Th1和CTL细胞分化,表明其可以明显增强T细胞的抗肿瘤效应。
- 一种人树突状细胞肿瘤疫苗的制备方法
- 负载凋亡的热休克肿瘤细胞的树突状细胞肿瘤疫苗及其制备方法与应用
- 负载凋亡的热休克肿瘤细胞的树突状细胞肿瘤疫苗及其制备方法与应用
