负载喜树碱掺杂二氧化锰的聚多巴胺纳米药物的制备方法与应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明公开了一种负载喜树碱(CPT)的掺杂二氧化锰(MnO
背景技术
肺癌,是起源于支气管黏膜或腺体的恶性肿瘤。肺癌是全世界最常见的恶性肿瘤之一,病死率极高,预后相对较差。西医手术创伤大,化疗药物毒副作用大,靶向治疗易产生耐药性,免疫治疗适应人群有限。中医药毒副作用小,但治疗肿瘤见效慢,抗癌效果不佳。肺癌的治疗仍面临巨大挑战。开发出对肿瘤组织疗效良好、对正常组织毒性低的理想抗癌药物势在必行。采用中西医结合的思路,取长补短,才能更有效的治疗肺癌。近年来,从中草药中分离出的抗肿瘤活性物质用纳米技术进行剂型改变成为抗癌药物的研究热点。
喜树碱(CPT)是中药喜树的主要活性成分,喜树碱在结肠、肺、乳腺癌、卵巢、黑色素瘤等癌症中具有优越的抗肿瘤作用,抗增殖作用和凋亡诱导能力。然而,CPT固有的高毒性、水溶性差和结构不稳定的缺点,导致其临床的应用受限。医药学家努力通过各种手段来提高CPT的性能,以满足临床应用的要求,如结构修饰、纳米配方、原药等。但存在体内循环不良和副作用仍较多,封装不稳定,CPT容易泄漏,包封率低等问题。
受贻贝粘附蛋白的启发,人们研究发现,人体内的一种神经递质,多巴胺(DA)分子具有与之相似的官能团,其氧化自聚形成聚多巴胺(PDA),PDA具有良好的生物相容性。使用PDA可以在基体表面达到相似的粘附性能。在本研究中,我们通过仿贻贝粘性物质中的代表DA自聚合形成PDA,粘附在CPT纳米晶体表面,以此来提高CPT的溶解率和稳定性。此外PDA是性能良好的红外光热转换剂,可以进行光热治疗(PTT)。PTT是利用具有较高光热转换效率的材料,将其注射入人体内部,循环聚集在肿瘤组织里面,并在近红外光的照射下将光能转化为热能来杀死癌细胞的一种治疗方法。PDA光热治疗作为一种利用PDA良好的光热转换效能来产生热量的疗法,可以通过多药物化疗的协同作用提高治疗效果。此外PDA层还可以利用氨基进行表面修饰,连接一些不同的功能组件,如药物分子,金属离子等。
有磁性的物质如Fe、Mn、Gd等常用作磁共振造影剂,造影剂能改变体内局部组织中水质子的弛豫速率,提高正常与患病部位的成像对比度和分辨率,为病变定位和诊断提供更多的信息。目前应用最广泛的造影剂是二乙三胺五醋酸钆(Gd-DTPA)。但Gd-DTPA的毒副作用较多,多表现为头晕、恶心呕吐、皮疹、呼吸困难、血压降低、支气管哮喘、肺水肿,严重者可导致死亡。这主要与钆剂本身的化学毒性有关。而锰是人体必需的微量元素之一,人体含锰总量为12~20mg,分布于全身各组织细胞之内。在MR成像中,Mn
发明内容
针对现有技术的上述不足,根据本发明的实施例,希望提出一种具有化疗-光热治疗、T1加权MR成像的具有诊疗一体化的多功能纳米药物CPT-PDA-MnO
根据实施例,本发明提供的一种负载喜树碱掺杂二氧化锰的聚多巴胺纳米药物的制备方法,包括以下步骤:
(1)取无水乙醇0.5-50mL、去离子水1-100mL和氨水20-2000μL,混匀,搅拌;混合液体中加入喜树碱、羟基喜树碱、喜树碱衍生物的一种或两种以上的混合物5-500mg,搅拌,再加入多巴胺10-1000mg,磁力搅拌12h;将纳米混合溶液在10000rpm下离心,沉淀物用去离子水清洗,制得负载喜树碱聚多巴胺纳米粒子;
(2)将步骤(1)制得的聚多巴胺纳米粒子分散于去离子水中,加入高锰酸钾粉末3-300mg,磁力搅拌2-8h;将纳米混合溶液在10000rpm下离心,沉淀物用去离子水清洗,制得负载喜树碱掺杂二氧化锰的聚多巴胺纳米药物。
根据实施例,本发明负载喜树碱掺杂二氧化锰的聚多巴胺纳米药物可用于肿瘤光热治疗联合化疗和T1加权的核磁成像,聚多巴胺外所掺杂的二氧化锰用作T1加权的核磁成像的锰基元素。
根据实施例,本发明负载喜树碱掺杂二氧化锰的聚多巴胺纳米药物还可用于肿瘤光热治疗时的近红外光照射,照射波长为808nm,照射功率为2W·cm
相对于现有技术,本发明合成了一种负载喜树碱的掺杂二氧化锰的聚多巴胺纳米药物,此纳米药物具有良好的生物相容性,不仅提高了喜树碱的水溶性、稳定性和消除半衰期,还减轻了喜树碱的毒副作用。这种新制备的CPT-PDA-MnO
本发明的有益效果如下:
(1)PDA具有良好的生物相容性,不仅提高了喜树碱的水溶性、稳定性和消除半衰期,还减轻了喜树碱的毒副作用。
(2)本发明方法制备的CPT-PDA-MnO
(3)本发明方法制备的纳米药物复合体对CPT药物载药量大,稳定性好,并且其粒径小,具有良好的穿透性且粒径均一,光热和PH控释效果明显,在体内具有长循环效果,生物安全性良好,对肿瘤细胞具有明显的杀伤效果,特别是结合光热治疗,效果更加明显。
(4)本发明方法制备的CPT-PDA-MnO
(5)本发明制备方法简单,条件温和,成本较低,易于推广和应用。
附图说明
图1显示诊疗一体化纳米药物的构建示意图。
图2显示纳米药物合成、表征以及核磁成像检测,其中:A.CPT-PDA-MnO
图3显示纳米药物的光热效率测定,光热稳定性和纳米药物中喜树碱的释放,其中:A.纳米药物及对照溶液的近红外光照射后光热升温曲线图与近红外相机热成像图;B.纳米药物的光热稳定性;C.显示纳米药物中喜树碱的释放。
图4显示纳米药物的生物相容性。
图5显示纳米药物溶酶体定位。
图6显示纳米药物对人肺癌A549细胞的体外抑制作用,其中:A.纳米药物对人肺癌A549细胞的体外抑制效果;B.流式细胞仪检测纳米药物对人肺癌A549细胞的凋亡情况;C.流式细胞仪检测纳米药物对人肺癌A549细胞的凋亡率统计图(**P<0.01);D.Western blot实验检测纳米药物对人肺癌A549细胞凋亡相关蛋白的表达情况。
图7显示纳米药物对小鼠肺癌LLC细胞的体外抑制作用,其中:A.纳米药物对小鼠肺癌LLC细胞的体外抑制效果;B.流式细胞仪检测纳米药物对小鼠肺癌LLC细胞的凋亡情况;C.流式细胞仪检测纳米药物对小鼠肺癌LLC细胞的凋亡率统计图(***P<0.001);D.Western blot实验检测纳米药物对小鼠肺癌LLC细胞凋亡相关蛋白的表达情况。
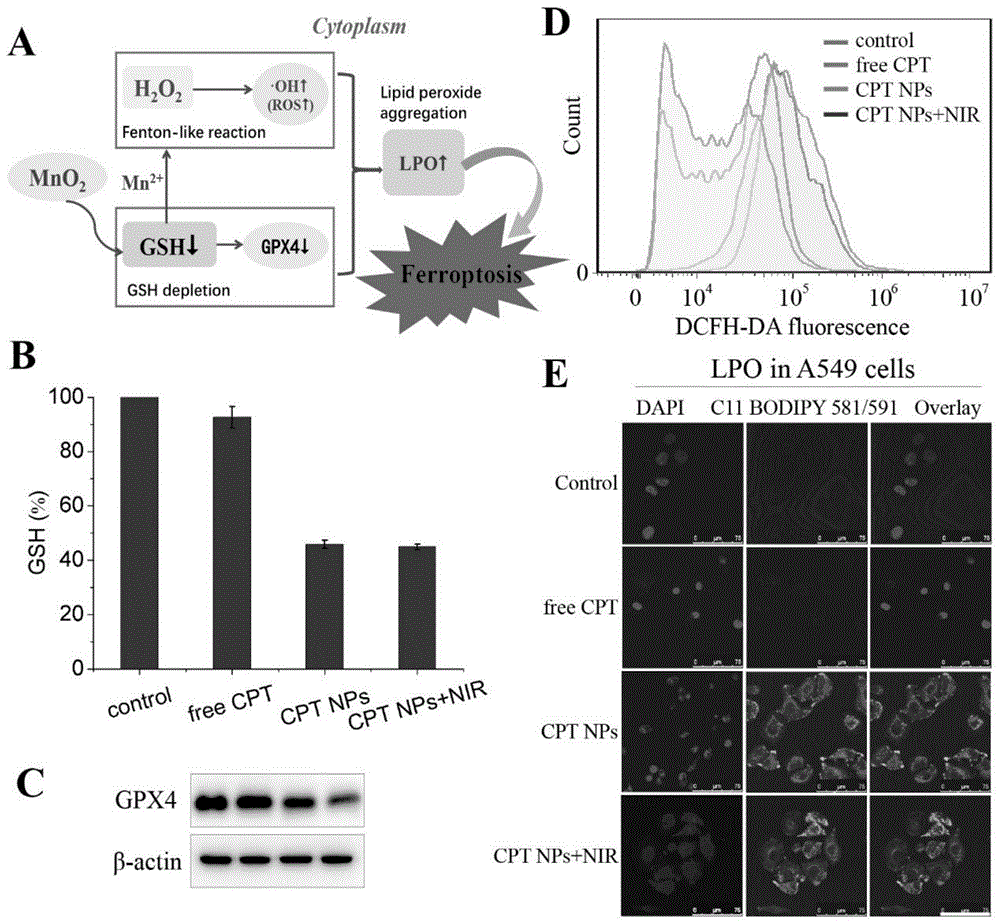
图8显示CPT纳米药物联合光热治疗诱导人肺癌细胞A549的铁死亡,其中:A.纳米药物中的二氧化锰引起肺癌细胞铁死亡的示意图;B.实验检测CPT纳米药物联合光热治疗诱导A549细胞的铁死亡的GSH水平的变化;C.Western blot实验检测CPT纳米药物联合光热治疗诱导A549细胞的铁死亡的相关蛋白表达;D.流式检测CPT纳米药物联合光热治疗诱导A549细胞产生的ROS含量的变化;E.CPT纳米药物联合光热治疗诱导A549细胞产生脂质过氧化物LPO的荧光共聚焦图。
图9显示CPT纳米药物联合光热治疗诱导小鼠肺癌细胞LLC的铁死亡,其中:A.实验检测CPT纳米药物联合光热治疗诱导小鼠肺癌LLC细胞的铁死亡的GSH水平的变化;B.Western blot实验检测CPT纳米药物联合光热治疗诱导LLC细胞的铁死亡的相关蛋白表达;C.流式检测CPT纳米药物联合光热治疗诱导LLC细胞产生的ROS含量的变化;D.CPT纳米药物联合光热治疗诱导LLC细胞产生脂质过氧化物LPO的荧光共聚焦图;E.纳米药物中的二氧化锰引起肺癌细胞铁死亡的相关通路的组分变化示意图。
图10显示纳米药物的体内核磁成像及光热成像,其中:A.纳米药物的体内核磁成像;B.纳米药物的体内核磁成像检测中T1信号强度与随时间变化的线性图;C.纳米药物的体内光热成像;D.纳米药物的体内光热成像温度统计图。
图11显示纳米药物在小鼠体内分布。
图12显示动物实验小鼠体重。
图13显示纳米药物对肺实体瘤的抑制作用,其中:A.小鼠的实体瘤体积变化;B.小鼠的实体瘤照片;C.肿瘤生长的重量变化;D.Western blot实验检测纳米药物对小鼠肿瘤组织凋亡相关蛋白表达的影响情况;E.Western blot实验检测纳米药物对小鼠肿瘤组织中铁死亡相关蛋白表达的影响情况。
图14显示动物实验小鼠的肝肾功能,其中:A.小鼠血清ALT;B.小鼠血清AST;C.小鼠血清CRE。
具体实施方式
下面结合附图和具体实施例,进一步阐述本发明。这些实施例应理解为仅用于说明本发明而不用于限制本发明的保护范围。在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等效变化和修改同样落入本发明权利要求所限定的范围。
实施例1-合成喜树碱纳米药物
步骤(1):取无水乙醇5mL,去离子水10mL,氨水200μL,混匀,搅拌30min;混合液体中再依次加入喜树碱50mg,搅拌10min,再加多巴胺100mg,室温下磁力搅拌12h。将制得的纳米混合溶液在10000rpm下离心20min,离心取药物沉淀,应用去离子水清洗3遍,离心即制得负载喜树碱聚多巴胺纳米粒。
步骤(2):将步骤(1)制得的聚多巴胺纳米粒分散于去离子水中,加入高锰酸钾粉末30mg,磁力搅拌2-8h;将制得的纳米混合溶液在10000rpm下离心20min,离心取药物沉淀,应用去离子水清洗3遍,离心,得到负载喜树碱掺杂二氧化锰的聚多巴胺纳米药物。
聚多巴胺-二氧化锰纳米粒子合成在上述步骤(1)中不加喜树碱,其余相同。
实施例2-纳米粒子的表征
本实施例采用透射电镜和动态光散射仪对合成的纳米粒子进行了表征测定以及对纳米药物中的进行纳米药物核磁成像能力的检测。
采用透射电镜和动态光散射仪对纳米粒子进行了表征测定。首先将悬液滴加到湿润的培养皿中的副膜上,并将小泡沉积在碳包覆的网格上(300网)3分钟。随后,使用透射电子显微镜(JEM-1230,JEOL)对网格进行分析。采用动态光散射体(Malvern ZetaSizer NanoZS90)进行粒度分布。采用EDX能谱分析仪检测二氧化锰是否成功接枝到PDA层。如图2-A所示:使用透射电子显微镜(JEM-1230,JEOL)对网格进行分析,结果显示合成的纳米粒子呈球形,大小比较均一,分散性较好,采用动态光散射体(Malvern ZetaSizer Nano ZS90)进行粒度分布。如图2-B所示:喜树碱纳米粒子粒径在340nm左右。如图2-C所示:采用EDX能谱分析仪检测,通过能谱图显示二氧化锰成功接枝到PDA层。
用核磁成像仪对不同浓度梯度的纳米药体外进行核磁成像,取合成的CPT-PDA-MnO
实施例3-纳米药物中CPT的包封率测定
为了测定CPT负载的PDA纳米药物中CPT的含量,对NPs进行纯化,分散在去离子水中,取20μL溶解于1ml乙腈中。随后,使用Agilent 1260infinity LC(液相色谱仪)系统,Thermo Accucore C18柱(100mm,2.1mm,2.6m)测定样品中CPT的浓度,流动相为0.1%甲酸和乙腈。洗脱液在3.5-7.5分钟之间被转移到MS(质谱仪)。通过多反应监测,对阳性离子电喷雾模式进行MS检测。CPT的包封率计算方法为NPs中CPT的包封量与CPT灌封量的比值。测得PDA纳米药物中CPT的含量在60%左右。
实施例4-测定纳米粒子的光热转换效率与光热稳定性。
比较CPT纳米药、纳米材料组、PBS在光照条件下的吸热效能,探讨了PDA纳米药物的光热响应和光热稳定性。
用808nm NIR(2W·cm
用808nm NIR(2W·cm
实施例5-纳米药物中喜树碱的释放
选用pH=5.0和pH=7.4的PBS作为药物释放液模拟癌细胞与组织间环境。在预定的时间点,分别1mg CPT纳米药置于不同的药物释放液中,充分分散,各设置有无808nm NIR光照(2W·cm
实施例6-纳米材料生物相容性研究
纳米材料对肿瘤细胞的杀伤效果测定,多巴胺(DA)是一种神经递质,自聚形成聚多巴胺(PDA),PDA具有良好的生物相容性。锰元素也是人体的微量元素,因此,CPT-PDA-MnO
实施例7-纳米药物和溶酶体共定位
通过免疫荧光共聚焦实验来探究正常肺Beas2B细胞、人肺癌A549细胞、小鼠肺腺癌LLC细胞对CPT纳米药物的摄取情况,CPT在紫外光谱下有较强的蓝色荧光,通过溶酶体红色荧光探针染色,进行CPT和溶酶体共定位,来观察纳米药物共孵育8h后,其在细胞内能否进行溶酶体逃逸。如图5所示:蓝色荧光是喜树碱自身的荧光,红色荧光是溶酶体红色荧光探针,两者未完全重叠,说明纳米药物可以发生溶酶体逃逸,在细胞内裂解释放出CPT。
实施例8-纳米药物对肺癌细胞的体外抑制效果
通过CCK8实验、流式检测凋亡、Western blot实验测定CPT和其纳米药物以及纳米药物联合PTT对人肺癌A549细胞、小鼠肺腺癌LLC细胞细胞毒性的差异,探究纳米药物的抗肺癌肿瘤细胞效果。如图6-A,6-B所示:纳米药物联合PTT与单纯CPT相比在A549细胞中更能抑制其增殖,促进其凋亡;如图6-C为流式细胞仪检测的凋亡率的统计图,P<0.01,有统计学意义。如图6-D所示:Western blot实验也检测到了人肺癌A549细胞凋亡相关蛋白的表达与流式细胞仪检测凋亡的结果呈一致的趋势。
在LLC细胞中其结果和A549细胞相似,如图7-A、7-B所示:纳米药物及其纳米药物联合PTT与单纯CPT相比在LLC细胞中更能抑制其增殖,促进其凋亡;如图7-C为流式细胞仪检测的凋亡率的统计图,P<0.01,有统计学意义。如图7-D所示Western blot实验检测到了LLC细胞凋亡相关蛋白的表达与流式细胞仪检测凋亡的结果呈一致的趋势。通过上述实验可以看出CPT纳米药物联合PTT组效果优于CPT纳米药物组和CPT组,合成的纳米药物联合PTT有良好的抗肺癌细胞的作用。
实施例9-CPT-PDA-MnO
通过荧光共聚焦等实验来探究纳米药物对人肺癌A549细胞、小鼠肺腺癌LLC细胞促进lipid ROS产生的情况。如图8-A所示:纳米药物中的MnO
实施例10-纳米药物体内核磁成像和光热成像
本实验将裸鼠置于龙华医院实验动物中心无菌环境中,严格按照龙华医院实验动物中心动物保护与使用委员会批准的实验方案进行处理。6周龄Balb/c裸鼠购自上海灵畅生物科技有限公司。
1、纳米药物体内核磁成像荷瘤裸鼠体内核磁成像
皮下瘤裸鼠注射CPT-PDA-MnO
2、纳米药物体内光热成像
比较对照组、PDA纳米材料组、CPT组、CPT纳米药组裸鼠给药12h后808nm激光照射(2W·cm
实施例11-研究喜树碱纳米药物在小鼠的体内分布
将5mL罗丹明染料(1mg/mL)与50mg CPT-PDA-MnO
实施例12-纳米药物体内抗肿瘤效果研究
1、通过比较喜树碱和喜树碱纳米药的体内抗肿瘤效果并阐明其杀伤作用机制:
6周龄Balb/c裸鼠(雄性)在右肩皮下注射2×10
其中
第一组为对照组,注射PBS;
第二组为PBS+激光光照NIR 808laser(2W·cm
第三组PDA纳米材料组(2mg/mL);
第四组PDA纳米材料组(2mg/mL)+激光光照NIR 808laser(2W·cm
第五组CPT组(2mg/kg);
第六组为纳米药物组(2mg/kg CPT and 2mg/mL PDA),
第七组为纳米药物组(2mg/kg CPT and 2mg/mL PDA)+激光光照NIR 808laser(2W·cm
采用腹腔给药的方式,每隔1天给药一次,每次给药100μL,激光照组NIR 808laser(2W·cm
如图12所示:治疗2周后,各组小鼠老鼠体重无明显变化,7组小鼠均处死,取肿瘤进行肿瘤重量、体积和相关实验检测。如图13-A、13-C所示:第四、五、六、七组和对照组相比,都能抑制裸鼠皮下瘤的生长,其中第七组纳米药物(2mg/kg CPT and 2mg/mL PDA)联合激光光照NIR 808laser组,抑瘤效果最好,和CPT组相比有较显著的差异,(**P<0.01)。如图13-B为各组小鼠肿瘤的瘤体图,说明纳米药物有着良好的化疗和光热治疗效果。
2、研究喜树碱纳米药物对体内肺癌细胞的细胞凋亡和铁死亡通路的影响:
在动物实验结束时,收集肺癌肿瘤组织,通过Western blot实验进一步验证喜树碱纳米药物对肺癌的杀伤机制。如图13-D所示:取肿瘤组织通过Western blot实验,检测凋亡的经典蛋白cleaved caspase-3和抑制铁死亡的相关蛋白GPX4的表达,发现cleavedcaspase-3的表达,在第七组纳米药物组(2mg/kg CPT and 2mg/mL PDA)+激光光照NIR808laser组最多,与体外抗肿瘤效果呈一致的趋势。如图13-E所示:抑制铁死亡的相关蛋白GPX4的表达,在纳米药组及其纳米药物联合光照组的组织中呈下降趋势,和体外的实验效果一致,说明纳米药物可以通过促进活性氧的产生来增强铁死亡。
3、评价喜树碱纳米药物的肝肾毒性:
在小鼠牺牲前获得的眼眶血主要用于检测肝细胞和肾的功能。检测了血清中AST(天冬氨酸转氨酶)、ALT(谷氨酰胺-丙酮酸转氨酶)和CRE(肌酐)水平。如图14-A、14-B、14-C所示:发现CPT组的AST、ALT,CRE水平有一定的上升,说明CPT有比较严重的毒副作用。和其他几组相比,纳米药物组的肝肾功能没有明显的变化,显示出纳米药物在动物体内有着良好的安全性,能够减轻喜树碱的毒副作用。
- 一种泡沫镍原位负载SnO2纳米粒子掺杂石墨碳复合材料制备方法和应用
- 聚多巴胺-二氧化锰纳米微球在制备抗菌药物中的应用
- 聚多巴胺-二氧化锰纳米微球在制备抗菌药物中的应用
