一种同时检测多杀性巴氏杆菌和溶血性曼氏杆菌的检测体系和方法
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及生物技术领域,特别是一种同时检测多杀性巴氏杆菌和溶血性曼氏杆菌的检测体系和方法。
背景技术
多杀性巴氏杆菌(Pasteurellamultocida)属于巴氏杆菌科巴氏杆菌属的细菌,巴氏杆菌属细菌已报道有20多种,多杀性巴氏杆菌是本属中最重要的畜禽致病菌。本菌可引起多种畜禽巴氏杆菌病,表现为出血性败血病或传染性肺炎。本菌广泛分布于世界各地,正常存在于多种健康动物的口腔和咽部黏膜,属于条件致病菌。多杀性巴氏杆菌可感染人类和多种动物,引起各种畜禽传染病,如禽霍乱、猪肺疫、牛出血性败血症、兔出血性败血症等,对养殖业造成严重危害。根据Carter分型方法和Heddleston分型方法,分别依据荚膜抗原的不同和脂多糖抗原的不同将多杀性巴氏杆菌分为5种荚膜血清型(A、B、D、E、F)和16种菌体血清型(1-16),由于多杀性巴氏杆菌血清型复杂,各型之间交叉保护性不强,导致疫苗防控难度较大,只有通过病原监测,结合卫生消毒与生物安全等可有效预防本病的发生与流行。
溶血性曼氏杆菌是Mannheimia属的微生物,是引起牛羊等反刍动物呼吸疾病综合征(bovine respiratory disease complex,BRD)的病原之一,当运输、环境等应激或其他病原协同感染导致宿主抵抗力下降时,病原侵袭肺部引起疾病发生,对牛场养殖造成巨大的损失。尽管较多血清型菌株均能引起发病,但从全球感染溶血性曼氏杆菌的动物来看,A1、A2和A6血清型占主导地位,A1和A6血清型主要感染牛,而A2血清型主要感染羊。
近年来,随着家畜养殖业向集约化、规模化方向的发展,呼吸道疾病发病迅速、传染性强,是对养殖业危害最大、最广泛的重要常见疫病之一,极易给养殖业造成巨大的经济损失,严重危害养殖业的健康发展。家畜主要呼吸道病原菌有溶血性曼氏杆菌、多杀性巴氏杆菌、支原体、化脓隐秘杆菌、肺炎克雷伯氏菌等多种,临床上呼吸道疾病常以混合感染的形式出现,其病原学研究越来越趋于专业化、复杂化,给临床诊断造成很大的困难。传统的诊断手段是通过细菌培养的方法,但其耗时长、敏感性低,难以满足临床诊断的需求,因此快速检测家畜呼吸道疾病病原极为重要。目前尚无一种能够适用于任一家禽类、且操作简单、快速、精确的呼吸道病原菌检测方法。
发明内容
本发明的目的是提供一种同时检测多杀性巴氏杆菌和溶血性曼氏杆菌的检测体系和方法,以解决上述现有技术存在的问题。
为实现上述目的,本发明提供了如下方案:
本发明提供一种同时检测多杀性巴氏杆菌和溶血性曼氏杆菌的检测体系,其特征在于,所述检测体系包括:Cas12a蛋白、Cas13a蛋白和crRNA。
优选的是,所述Cas12a蛋白为Cas12a蛋白或具有与Cas12a的旁路单链DNA/RNA切割活性类似的Cas蛋白。
优选的是,所述Cas13a蛋白为Cas13a蛋白或具有与Cas13a的旁路单链DNA/RNA切割活性类似的Cas蛋白。
优选的是,所述crRNA的核苷酸序列如SEQ ID NO.7和SEQ ID NO.19所示。
本发明还提供一种非疾病检测或治疗目的地多杀性巴氏杆菌和溶血性曼氏杆菌的可视化检测方法,利用所述检测体系对待测样本进行酶切反应,根据反应完成后的荧光颜色判断待测样本中是否含有多杀性巴氏杆菌和溶血性曼氏杆菌。
优选的是,所述荧光颜色是在蓝光和紫外激发情况下观察反应完成后的荧光颜色。
优选的是,当液体激发为绿光时,待测样品中存在多杀性巴氏杆菌;当液体激发为红光时,待测样品中存在溶血性曼氏杆菌;当液体激发为黄色或红-绿-黄时,待测样品中同时存在多杀性巴氏杆菌和溶血性曼氏杆菌。
优选的是,所述酶切反应的反应体系为:Kmt1-crRNA-2(0.5μM)、LKT-crRNA-6(0.5μM)、Cas12a(0.25μM)和Cas13a(0.25μM),Kmt1 DNA靶标产物500ng、LKT RNA靶标产物500ng、ssDNA-reporter(JOE-6C-BHQ1,1.5μM)、ssRNA-reporter(ROX-5U-BHQ2,1.5μM)、rCutSmart Buffer 2μL和0.5μL RNA酶抑制剂,DEPC水补齐至20μL;
反应程序为:37℃反应15min,然后98℃2min终止反应。
本发明还提供一种同时检测多杀性巴氏杆菌和溶血性曼氏杆菌的产品,包括所述的检测体系。
优选的是,所述产品包括试剂或试剂盒。
基于上述技术方案,本发明具有以下技术效果:
本发明提供一种同时检测多杀性巴氏杆菌和溶血性曼氏杆菌的检测体系以及检测方法,该方法操作简单,适合现场快速检测多杀性巴氏杆菌和溶血性曼氏杆菌。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
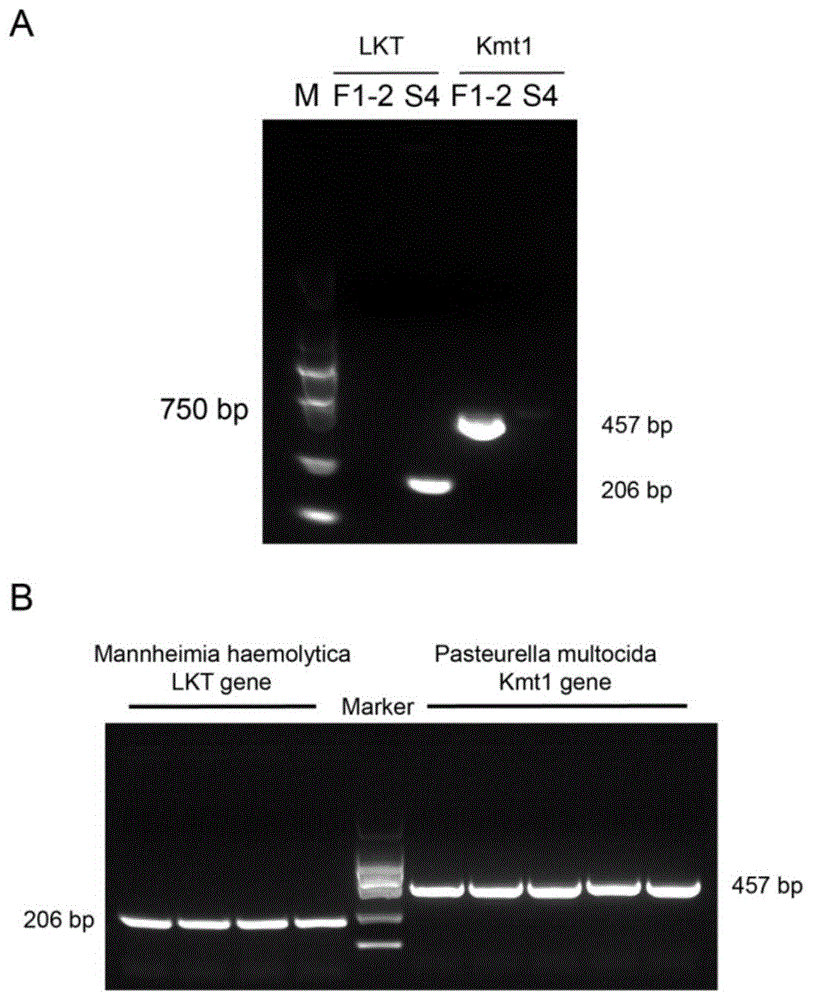
图1中A为溶血性曼氏杆菌和多杀性巴氏杆菌的靶标核酸的PCR检测结果,其中,F1-2为溶血性曼氏杆菌,S4为多杀性巴氏杆菌,图1中B为对检测的LKT和Kmt1进行胶回收,连接pmd19t进行测序;
图2为针对基于CRISPR/Cas12a检测溶血性曼氏杆菌Kmt1高活性的crRNA-2,其中,A为用便携式蓝光仪器进行结果判读,B为通过酶标仪进行图A荧光强度的定量;-:不含识别的Kmt1 DNA靶标;+:包含识别的DNA靶标;误差条代表平均值的标准误差(SEM);n=3;
图3为筛选出针对基于CRISPR/Cas13a检测多杀性巴氏杆菌LKT高活性的crRNA-6,其中,A为用便携式蓝光仪器进行结果判读,B为通过酶标仪进行图A荧光强度的定量;-:不含识别的LKT RNA靶标;+:包含识别的RNA靶标;误差条代表平均值的标准误差(SEM);n=3;
图4为CRISPR/Cas12a/Cas13a同时检测两种细菌的检测结果图,其中,A为用便携式蓝光仪器,分别检测体系中单独存在多杀性巴氏杆菌靶标Kmt1、单独溶血性曼氏杆菌靶标LKT、同时存在多杀性巴氏杆菌靶标Kmt1和溶血性曼氏杆菌靶标LKT时,液体激发分别为绿色、红色、黄色;(红绿灯),B为通过酶标仪进行图A荧光强度的定量;-:不含识别的LKTRNA靶标;+:包含识别的RNA靶标。误差条代表平均值的标准误差(SEM);n=3。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本申请说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
本发明所述技术方案,如未特别说明,均为本领域的常规方案,所用试剂或原料,如未特别说明,均购自商业渠道或是已公开。
实施例1PCR检测多杀性巴氏杆菌Kmt1靶基因和溶血性曼氏杆菌LKT基因
设计PCR引物Kmt1-F、Kmt1-R和LKT-F、LKT-R(见表1)分别扩增多杀性巴氏杆菌Kmt1靶基因和溶血性曼氏杆菌LKT基因,靶标基因片段。
表1.PCR引物模板扩增用引物对
配置50μL PCR反应液,其中Ex taq Mix 25μL,以上述引物的上下游各10pmoL,基因组模板1μL(约100ng)。
PCR反应程序设置为:94℃30s、53℃30s、72℃35s,共进行30个循环,最后72℃延伸5min。将PCR产物在浓度为1.5%的琼脂糖胶上进行电泳跑胶鉴定和回收。
检测结果如图1中A所示,证明设计检测的引物可以分别用于对多杀性巴氏杆菌和溶血性曼氏杆菌的检测,F1-2为溶血性曼氏杆菌,S4为多杀性巴氏杆菌;如图1中B分别对检测的LKT和Kmt1进行胶回收,连接至pmd19t质粒用于后续实验。
实施例2筛选针对基于CRISPR/Cas12a检测Kmt1高活性的crRNA
针对PCR扩增Kmt1基因区域,利用CRISPR-offinder软件(https://sourceforge.net/projects/crispr-offinder-v1-2/)设计6条crRNA,PAM为TTTV:
Kmt1-crRNA1:TTTATGCCACTTGAAATGGGAAAT;
Kmt1-crRNA2:TTTATGGCTCGTTGTGAGTGGGCT;
Kmt1-crRNA3:TTTATTTGGCTTGTGGCAAAGAAA;
Kmt1-crRNA4:TTTGTTGGGCGGAGTTTGGTGTGT;
Kmt1-crRNA5:TTTGCCACAAGCCAAATAAAAGAC;
Kmt1-crRNA6:TTTCCCATTTCAAGTGGCATAAAA。
以sgRNA空载体(pUC57-T7-sgRNA)为模板设计体外转录用引物对(见表2)。利用CRISP-Cas12a检测核酸的实验步骤如下:
表2.Kmt1-crRNA体外转录模板扩增用引物对及探针
(1)PCR扩增靶标基因片段:
配置50μL PCR反应液,其中Ex taq Mix 25μL,以Kmt1-F和Kmt1-R引物各10pmoL,pMD18T-Kmt1质粒模板1μL(约10ng)。
PCR反应程序设置为:94℃30s、53℃30s、72℃35s,共进行30个循环,最后72℃延伸5min。
(2)体外转录crRNA:以含有T7 promoter和crRNA scaffold的质粒(pUC57-T7-crRNA)作为模板,用T7-crRNA-F和不同crRNA-R引物(见表2),利用PCR技术扩增用于sgRNA体外转录用的模板。
实验反应体系为50μL,其中Extaq Mix 25μL,上下游引物各10pmoL,crRNA空载体(pUC57-T7-sgRNA)的模板为1μL(约10ng)。
反应条件为:94℃30s、55℃30s、72℃5s,共进行30个循环,最后72℃延伸5min。
PCR产物用琼脂糖凝胶DNA回收试剂盒进行回收。依据HiScribe
>pUC57-T7-sgRNA(载体部分序列)
T7启动子序列:
CGAGGGGACGGTGATTGGAGATCGGTACTTCGCGAATGCGTCGAGATGGATCCCTAATACG;
sgRNA scaffold:19nt:
ACTCACTATAGGGAATTTCTACTGTTGTAGATAATCGCATTGCCTCCGTAGTGAATTTTTTAAAGGGCCCGTCGACTGCAGAGGCCTGCATGCAAGCTTATCGGATGCCGGGACCGACGAGTGCAGAGGCGTGCAAGCGAGCTTGGCGTAATCATGGTCATAGCTGTTTCCTGTGTGAAATTGTTATCCGCTCACAATTCCACACAACATACGAGCCGGAAGCATAAA。
Cas12a酶切反应:在20μL反应体系中,加入步骤2中纯化的crRNA(0.5μM),Cas12a(0.25μM),步骤1中2μL PCR扩增产物,ssDNA-reporter(JOE-6C-BHQ1,1.5μM),rCutSmartBuffer 2μL,0.5μL RNA酶抑制剂。阴性对照设置为不加检测目标基因模板,即不加Kmt1基因扩增产物。37℃反应15min,然后98℃2min终止反应。
结果检测与判定:直接将含反应液的离心管,置于蓝光切胶仪或紫外凝胶成像仪中检测荧光强度变化。结果如图2所示,可明显检测到荧光信号,表明可用于CRISPR-Cas12a核酸检测实验。以及放入酶标仪中精确读取出荧光强度
结果:
比较针对多杀性巴氏杆菌Kmt1基因的6条crRNA,在将Kmt1基因作为靶基因的模板条件下,发现6条crRNA都有明显的荧光(图2中A),通过酶标测定荧光数值发现,Kmt1-crRNA-2的荧光信号最强(图2中B),表明此条crRNA的检测活性最高。用于后续多重检测实验。
实施例3筛选针对基于CRISPR/Cas13a检测LKT高活性的crRNA
针对PCR扩增LKT基因区域,利用CRISPR-offinder软件(https://sourceforge.net/projects/crispr-offinder-v1-2/)设计6条crRNA:
LKT-crRNA1:GCTATGGTTATCTAACTGGTCGAATTAA;
LKT-crRNA2:ATCTAACTGGTCGAATTAAACATATTAG;
LKT-crRNA3:GCCCGGATGCGATTGAACAACCTAATGT;
LKT-crRNA4:GCAACTATAGCTATAGATAGGAAGAATC;
LKT-crRNA5:AACCTAATGTAGGCTTAGTTTTTAATGC;
LKT-crRNA6:AACAACCTAATGTAGGCTTAGTTTTTAA。
设计crRNA设计体外转录用引物对(表3)。利用CRISP-Cas13a检测核酸的实验步骤如下:
(1)PCR扩增靶标基因片段:
配置50μLPCR反应液,其中Ex taq Mix 25μL,以13a-LKT-F和LKT-R引物各10pmoL(表3),pMD18T-LKT质粒模板1μL(约10ng)。
表3.LKT-crRNA体外转录模板扩增用引物对及探针
PCR反应程序设置为:94℃30s、53℃30s、72℃35s,共进行30个循环,最后72℃延伸5min。
PCR产物用琼脂糖凝胶DNA回收试剂盒进行回收。
(2)体外转录crRNA和LKT靶标:以含有13a-crRNA-F和不同LKT-crRNA-R引物(表3),利用PCR技术扩增用于crRNA体外转录用的模板和步骤(1)纯化得到靶标。
实验反应体系为50μL,其中Extaq Mix 25μL,上下游引物为模板各2μL。
反应条件为:94℃30s、55℃30s、72℃5s,共进行30个循环,最后72℃延伸5min。
PCR产物用琼脂糖凝胶DNA回收试剂盒进行回收。依据HiScribe
(3)Cas13a酶切反应:在20μL反应体系中,加入步骤2中纯化的crRNA(0.5μM),Cas13a(0.25μM),步骤2中纯化出来的靶标产物500ng,ssRNA-reporter(ROX-5U-BHQ
(4)结果检测与判定:直接将含反应液的离心管,置于蓝光切胶仪或紫外凝胶成像仪中检测荧光强度变化。以及放入酶标仪中精确读取出荧光强度,结果如图3所示,可明显检测到荧光信号,表明可用于CRISPR-Cas13a核酸检测实验。
结果:
比较针对溶血性曼氏杆菌LKT基因的6条crRNA,在将LKT RNA基因作为靶基因的模板条件下,发现6条crRNA都有明显的荧光(图3中A),通过酶标测定荧光数值发现,LKT-crRNA-6的荧光信号最强(图3中B),表明此条crRNA的检测活性最高,用于后续多重检测实验。
实施例4:建立一管CRISPR/Cas12a/Cas13a同时检测多杀性巴氏杆菌Kmt1靶基因和溶血性曼氏杆菌LKT基因的方法
为了建立一管CRISPR/Cas12a/Cas13a同时可视化检测检测多杀性巴氏杆菌和溶血性曼氏杆菌的方法,将上述分别筛选出来的Kmt1-crRNA-2和LKT-crRNA-6。
用于一管核酸检测中。实验流程如下:
(1)Cas12a/Cas13a一管酶切反应:在20μL反应体系中,加入实施案例2、3中纯化的Kmt1-crRNA-2(0.5μM)、LKT-crRNA-6(0.5μM)、Cas12a(0.25μM)、Cas13a(0.25μM)和实施案例2、3中纯化出来的Kmt1 DNA靶标产物500ng,LKT RNA靶标产物500ng,以及ssDNA-reporter(JOE-6C-BHQ1,1.5μM)、ssRNA-reporter(ROX-5U-BHQ2,1.5μM)、rCutSmartBuffer 2μL和0.5μL RNA酶抑制剂。剩下的用DEPC水补齐,分别设置不同的对照组,阴性对照设置为不加其中一样或者几样。37℃反应15min,然后98℃2min终止反应。
(2)结果检测与判定:直接将含反应液的离心管,置于蓝光切胶仪或紫外凝胶成像仪中检测荧光强度变化,以及放入酶标仪中精确读取出荧光强度。结果如图4所示。
结果:
如图4中A中管7所示,当检测体系中存在多杀性巴氏杆菌靶标Kmt1时,在蓝光和紫外激发情况下,液体激发为绿光;如管8所示,当检测体系种存在溶血性曼氏杆菌靶标LKT时,在蓝光和紫外激发情况下,液体激发为红光;如管9所示,当检测体系中同时存在多杀性巴氏杆菌靶标Kmt1和溶血性曼氏杆菌靶标LKT时,液体激发为黄色;红-绿-黄(红绿灯);
如图4中B所示,用酶标仪进行荧光的定量,当激发光分别为520和548nM,在JOE探针激发光范围情况下,管2、5、7、9能激发为绿光;当激发光分别为576和601nM,在ROX探针激发光范围情况下,管3、6、8、9能激发为绿光;和A结果对应;因此,本发明成功建立了一管CRISPR/Cas12a/Cas13a同时检测两种细菌的方法。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 物联网终端、系统和用于物联网终端的唤醒方法
- 抗干扰测试系统、监控设备、抗干扰测试方法及终端设备
- 用于展品设备监控的可嵌入式物联网方法、系统及终端
- 用于物联网监控的终端设备及物联网监控系统
