一种基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器及其应用
文献发布时间:2024-04-18 19:53:33
技术领域
本发明涉及传感器领域,更具体地涉及一种基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器及其应用。
背景技术
葡萄糖是活细胞和人体维持系统功能的关键代谢产物和主要能量来源,能够为生理过程提供能量。糖尿病长期以来被误认为是对世界健康影响不大的疾病,然而现在正成为21世纪人类健康的主要威胁之一,检测血糖水平及其变化对糖尿病的防治具有重要意义。
过氧化氢是在线粒体中氧的异常代谢所产生的超氧化物之一。过氧化氢极易渗透进入细胞,诱导细胞凋亡或者坏死。作为世界卫生组织公布的致癌物,过氧化氢的检测在肿瘤发展和抗癌治疗中具有重要作用。
电化学分析法是一种在溶液中对物质进行定量和定性测量的便捷方法。与荧光法、光谱和色谱等其他检测方法相比,电化学传感具有成本低、准确、方便和可重复的优点。目前,常见的生物传感器通常可以分为两种类型:基于酶促反应的有酶传感器和无需额外酶辅助的无酶传感器。有酶传感器一般是基于酶促反应,例如葡萄糖脱氢酶和超氧化物歧化酶,被应用在许多领域中。然而,对酶活性的依赖限制了它们的长期稳定性和在实际环境中的应用。为了解决这些问题,无酶电化学生物传感器应运而生,因其具有优异的长期稳定性、高电催化活性和易于操作的特点,引起了人们的广泛关注。最初的无酶生物电化学传感器通常基于金属纳米颗粒如PtNPs、PdNPs和AuNPs或金属氧化物如NiO、CuO和Co
发明内容
本发明的目的是提供一种基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器及其应用,从而解决现有技术中缺乏高灵敏、高选择性且检测结果可靠的生物传感器的问题,同时为基于多金属纳米颗粒和碳的复合纳米材料的高性能电化学生物传感器提供一种普适性的方法。
为了解决上述问题,本发明采用以下技术方案:
根据本发明的第一方面,提供一种基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器,包括工作电极、参比电极和对电极,所述工作电极采用以下制备工艺:S1:复合纳米材料的制备:在超声处理下将AuCuNPs和多壁碳纳米管分散在四氢呋喃中,获得复合纳米材料AuCuNPs-MWCNTs的均匀溶液;S2:Au电极的预处理:Au电极在麂皮上依次用粒径1.0μm、0.1μm和0.05μm的氧化铝粉末抛光后,分别在乙醇和超纯水下进行超声清洗,经氮气吹干后备用;S3:AuCu@MWCNTs/Au电极的制备:将步骤S1中制备得到的均匀溶液滴在步骤S2预处理后的Au电极上形成电极的传导层,最后在室温下干燥,获得AuCu@MWCNTs/Au电极;其中,所述无酶生物传感器同时利用AuCuNPs的电催化性能和MWCNTs的快速转移电子性能可实现对葡萄糖和过氧化氢的高灵敏度检测。
根据本发明的一个优选方案,步骤S1中复合纳米材料AuCuNPs-MWCNTs的制备包括以下步骤:A1:合成Au纳米颗粒并分散在己烷中:将HAuCl
步骤A2中,为了保证AuCuNPs的正确合成,加入的Cu/Au原子比为1:1。
所述参比电极采用甘汞电极,所述对电极采用铂丝电极,电解液采用pH12,0.1M的碱性溶液,所述碱性溶液选自:NaOH溶液,KOH溶液。
根据本发明的第二方面,提供一种基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器在葡萄糖检测中的应用,包括:提供一种如上面所述的基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器,将不同浓度的葡萄糖溶液连续添加到检测体系中,采用计时安培法,根据电流响应绘制电流-时间响应曲线,并获得电流随葡萄糖浓度变化的标准曲线,当加入含有葡萄糖的待测溶液时,通过检测电信号并将其代入所述标准曲线中,即可获得待测溶液中的葡萄糖浓度,实现所述无酶生物传感器在无酶体系中的葡萄糖浓度检测。
优选地,测量电压选定为0.40V。
在所述应用中,所述无酶生物传感器对葡萄糖的灵敏度为3.62×10
根据本发明的第三方面,提供一种基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器在过氧化氢检测中的应用,包括:提供一种如上面所述的基于复合纳米材料AuCuNPs-MWCNTs的无酶生物传感器,将不同浓度的H
优选地,测量电压选定为-0.40V。
在所述应用中,所述无酶H
在所述应用中,在50ml,约5×10
根据本发明人的前期研究发现,Au和Cu的结合可以提高催化性能,同时降低Au的高成本和Cu的不稳定性。随着对葡萄糖和过氧化物检测的要求越来越高,越来越多的新型复合纳米材料被开发并应用于生物传感器。例如,耦合在碳材料表面的贵金属纳米颗粒由于其协同作用而受到越来越多的关注。
基于此,发明人设想AuCuNPs与MWCNTs的耦合材料有可能是用于葡萄糖和H
本发明利用X射线衍射(XRD)和透射电子显微镜(TEM)表征所制备材料的结构和形貌。通过循环伏安法(CV)和电化学阻抗谱(EIS)比较了AuCuNPs、MWCNTs和AuCu@MWCNTs的电化学性能。此外,通过CV和计时安培法(CA)评估了基于AuCu@MWCNTs的电极对葡萄糖和过氧化氢的检测性能。由AuCuNPs和MWCNTs的耦合所产生的协同效应使传感器具有良好的传感性能。这种简单、可持续且可扩展的合成策略可用于设计其他高性能纳米复合材料,以此扩展纳米材料在电化学中的应用。
本发明的关键发明点在于,使用有序AuCu纳米粒子和MWCNTs的纳米复合材料制备了一种性能优异的新型无酶生物传感器。最重要的是,由于本发明合成的是晶格有序的AuCu纳米颗粒,其比表面积大,离子-电子转移速度快,所以才能得到目前为止最灵敏的葡萄糖和过氧化氢传感器。与单独的AuCuNPs和MWCNTs相比,AuCuNPs和MWCNTs的耦合使材料具有更快的电子传输能力和更高的电容。循环伏安结果表明基于AuCu@MWCNTs的无酶葡萄糖传感器具有优异的灵敏度和选择性。同时使用安培法检测了电极定量分析葡萄糖的能力,响应曲线表明,该电极具有响应时间短(<5s),灵敏度高(362.3μA·mM
综上所述,本发明首次开发了一种基于AuCuNPs与MWCNTs的复合纳米材料的新型无酶生物传感器,电极本身具有电催化葡萄糖的能力,无需葡萄糖氧化或还原酶就可以进行葡萄糖的检测。AuCu@MWCNTs电极的电化学性能通过电化学阻抗谱(EIS)进行了分析,其在电极表面显示出低的电荷转移阻抗,表明电极具有快速转移电子的性能,这是进行高灵敏检测的关键。利用循环伏安法(CV)和计时安培法(CA)对电极的催化机理和检测性能进行了研究。本发明所构建的无酶传感器在葡萄糖检测过程中和H
附图说明
图1示出了金铜双金属纳米颗粒的(A)透射电镜分析(标尺50nm),(B)粒径统计分析和(C)XRD衍射分析;
图2示出了AuCu@MWCNTs在透射电镜下的形态;
图3示出了(A)AuCu@MWCNTs/Au电极在含有5mM K
图4分别示出了AuCu@MWCNTs/Au电极、MWCNTs/Au电极和裸金电极在1mM葡萄糖存在的0.1M NaOH溶液中的CV图(扫描速率:75mV·s
图5示出了AuCu@MWCNTs/Au电极和MWCNTs/Au电极的奈奎斯特图(频率范围:0.01Hz-100kHz,初始电压:0.4V,电压变化幅度:10mV);
图6示出了不同工作电位(0.35、0.40、0.45和0.50V)下AuCu@MWCNTs/Au电极对连续加入的0.2mM葡萄糖(0.1M NaOH)的电流响应;
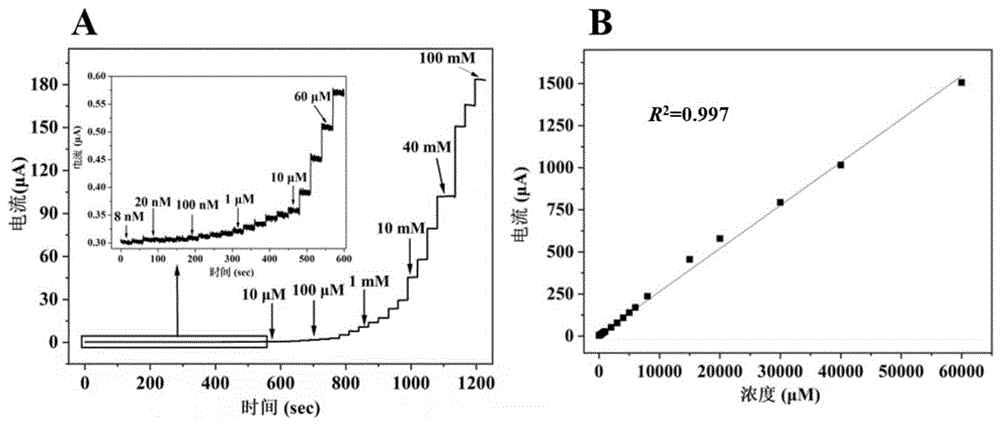
图7分别示出了AuCu@MWCNTs/Au电极(A)在不同浓度葡萄糖下的电流强度变化(0.1M NaOH);(B)电流强度与8nM至60mM的葡萄糖浓度的线性关系(电压:0.40V);
图8示出了AuCu@MWCNTs/Au在0.1M NaOH中(电压:0.40V)对不同物质(葡萄糖、尿素、蔗糖、果糖、尿酸和葡萄糖)的电流响应;
图9示出了不同工作电位(-0.35、-0.40、-0.45和-0.50V)下AuCu@MWCNTs/Au电极对连续加入的0.2mM H
图10分别示出了AuCu@MWCNTs/Au电极(A)在不同浓度H
图11示出了AuCu@MWCNTs/Au在0.1M PB(pH=7)中(电压:-0.40V)对HepG2细胞、0.3μM的CHAPS蛋白质裂解液、加入0.3μM CHAPS蛋白质裂解液的HepG2细胞以及连续加入5nM H
具体实施方式
实验材料
乙酸铜一水合物(98%),油胺(70%),硼烷叔丁胺络合物(TBAB,97%),尿素(C3H8N2O2),铁氰化钾(K
实施例1AuCuNPs的合成及表征
已有报道称,通过提高内部结构的有序程度能够提高AuCuNPs的催化活性,因此在本实验中所使用的AuCuNPs均为有序晶格。
1.1AuCuNPs的合成
AuCuNPs的合成分为两步,包括:预合成AuNPs;使新产生的Cu原子扩散到AuNPs中。
1)预合成AuNPs:将200mg HAuCl
2)将新生成的Cu原子扩散到AuNPs中并通过高温使其有序排列:将86mg乙酸铜一水合物、0.5mL油酸和2.25mL三辛胺在50mL三颈烧瓶中混合,得到澄清溶液,并在80℃下反应30分钟后注入步骤1)所制备的AuNPs中。在80℃下加热搅拌,等待己烷完全挥发后,溶液变为深紫色。将得到的溶液在氩气保护下,120℃搅拌反应20分钟后,在冷却至室温前将溶液倒入反应釜中并快速加热至250℃,并持续1小时。获得的黑色溶液利用无水乙醇溶解,并通过离心(10000rpm,10分钟)来收集AuCuNPs。利用无水乙醇洗涤产物三次后将其放入50℃真空干燥箱干燥备用。
根据该方法,首先合成了金纳米颗粒AuNPs作为种子,然后将新生成的Cu原子加入AuNPs溶液中,Cu会分散至AuNPs种子中形成AuCuNPs。为了保证AuCuNPs的正确合成,加入的Cu/Au原子比为1:1。在后续的加热过程中,还原反应和铜扩散反应在金表面同时进行,长时间的高温环境也为形成有序化晶格提供了足够的热能。在高温反应后生成了黑色粘稠液体,利用乙醇溶解、离心后得到的黑色粉末即为AuCuNPs。
1.2AuCuNPs的表征
本实施例利用透射电镜观察了所合成的AuCuNPs的形貌特征,如图1中的A所示,AuCuNPs呈球形,平均粒径约为7nm。此外,粒度分布图如图1中的B所示,AuCuNPs的粒径主要集中在6~10nm范围内。较小的粒径提供了较大的比表面积,从而提升纳米颗粒的催化活性。
为了表征AuCuNPs,本实施例还进行了XRD分析。结果如图1中的C所示,合成的纳米颗粒111衍射的峰值位置(2θ值)在41.34°处,位于纯Au的38.26°和纯Cu的43.29°之间,并且200衍射的峰值位置为48.46°位于纯Au的44.6°和纯Cu的50.43°之间,这证实了双金属体系的成功形成。纯面心立方Au(JCPDS 04-0784)和纯面心立方Cu(JCPDS 04-0836)的数据来自粉末衍射标准联合委员会(JCPDS)。并且,在201(56.12°)处出现了超晶格峰,这在无序面心立方结构中是不存在的;此外,在200(48.46°)和220(79.26°)处有明显的分裂峰,这都表明AuCuNPs的结构已经向有序面心正方结构转变。
以上结果均证明本实施例成功完成了有序AuCuNPs的合成。
实施例2电极的制备
金电极(内径1.6mm,外径6.35mm)在麂皮上依次用粒径1.0μm、0.1μm和0.05μm的氧化铝粉末抛光后,分别在乙醇和超纯水下超声清洗各10分钟。用氮气吹扫Au电极表面以去除表面残留的水分和灰尘。然后将获得的干净的金电极放入干燥皿中过夜,以供后续实验。
通过溶剂浇筑的方法分别制备AuCu@MWCNTs/Au电极和MWCNTs/Au电极。为了获得AuCuNPs和MWCNTs的复合纳米材料AuCu@MWCNTs,将1mg AuCuNPs和0.95mg MWCNTs在超声处理下分散在1.2mL四氢呋喃中获得均匀溶液,直至观察到体系中没有明显颗粒。然后,将100μL的均匀溶液滴在干净的裸金电极上作为电极的传导层,最后在室温下干燥过夜,获得AuCu@MWCNTs/Au电极。为了进行比较,也制备了MWCNTs/Au电极,将0.95mg MWCNTs在超声处理下分散在1.2mL四氢呋喃中以获得传导层,将100μL传导层滴在干净的裸金电极上,经室温干燥过夜,获得MWCNTs/Au电极。
应当理解的是,本实施例与在先专利(CN201811589008.0)中电极的制备方法比较类似,但仍然存在明显不同之处。不同点之一在于,本发明复合纳米材料AuCu@MWCNTs的制备相比在先专利未使用Pluronic F127,因为经过本发明的研究发现,加了Pluronic F127以后,传感器的响应性能将明显变差,而去掉Pluronic F127以后才能获得优异的电化学传感性能,其原因可能是亲水性的物质不适合作为电极的传感涂层,因此,根据在先专利制备的电极并不具有本发明同等的传感效果;其次,在先专利在电极上套了一小段塑料PVC管,并且将复合纳米材料层进一步用离子选择性电极传感膜ISM覆盖;再次,二者在反应机理上存在不同,本发明利用的是该复合纳米材料中的AuCuNPs的电催化性能检测葡萄糖及H
实施例3AuCuNPs和AuCu@MWCNTs的表征
使用JEOL 2100F(日本)200kV的透射电子显微镜(TEM)观察AuCuNPs和AuCu@MWCNTs的形态特征,并利用ImageJ软件对AuCuNPs的粒径进行了统计分析。AuCuNPs的X射线衍射(XRD)图谱是使用RINT2000垂直测角仪(Rigaku,Japan)在CuKα辐照下获得的(λ=0.15418nm)。
将AuCuNPs和MWCNTs在超声处理下分散在1.2mL四氢呋喃中获得AuCu@MWCNTs,并通过透射电镜观察其形貌特征。如图2所示,AuCuNPs成功与MWCNTs耦合在一起,且分散和附着效果较好。
实施例4生物电化学传感器表征
所有电化学测量均在CHI 760D电化学工作站(上海,华辰)上进行。所有电化学测量均使用三电极系统,其中铂丝作为辅助电极,甘汞电极(内参比为饱和氯化钾溶液)作为参比电极,制备的电极作为工作电极。
分别使用实施例2制备得到的AuCu@MWCNTs/Au电极或MWCNTs/Au电极作为工作电极,在0.1M CaCl
4.1扫描速率分析
在加入了5mM K
4.2循环伏安分析
为了检测AuCu@MWCNTs复合纳米材料在无酶环境中对葡萄糖的电催化活性,进行循环伏安(CV)分析。在实验过程中电位扫描在向一个方向扫描结束时立即向另一方向回扫,扫描过程可以是单圈或多圈,这种方法被称为循环伏安法,是最常用的电分析方法之一。通过分析循环伏安曲线有无氧化还原峰以及其形状和位置等,能够研究体系中可能发生的氧化还原反应。
无酶体系的反应背景是pH=12的碱性溶液,比如0.1M NaOH或者KOH溶液,其在加入葡萄糖后能够直接进行电化学表征,将不同浓度的葡萄糖标准溶液依次加入测量体系后,即可立即测量电信号。
为了比较AuCu@MWCNTs和MWCNTs两种材料的电催化性能,本实施例在1mM葡萄糖存在下分别研究了AuCu@MWCNTs/Au电极、MWCNTs/Au电极和裸金电极在0.1M NaOH背景溶液中的循环伏安。使用相似的方法制备了三种电极,因此可以认为电流峰值的变化仅与电化学活性表面有关,从而直接推断出AuCu@MWCNTs和MWCNTs这两种材料之间的电催化性能差异。AuCu@MWCNTs/Au电极、MWCNTs/Au电极和裸金电极的CVs以75mV·s
4.3电化学阻抗分析
本实施例分别研究了以AuCu@MWCNTs和MWCNTs作为传感层的金电极的阻抗谱。AuCu@MWCNTs/Au电极和MWCNTs/Au电极的奈奎斯特图在0.01Hz至100kHz频率范围内的开路电压下用交流电记录。
图5展示了两种电极在0.1M NaCl中电压变化幅度为5mV时的阻抗谱,相应的拟合等效电路如图5所示。电路由溶液电阻(R
4.4无酶生物传感器对葡萄糖的响应性能评价
前面的循环伏安(CV)分析实验证明了AuCu@MWCNTs/Au在碱性溶液中具有优异的电催化能力。已有报道称,相比于循环伏安法,计时安培法在流体动力学条件下具有更高的灵敏度和选择性,因此本实例使用了计时安培法,采用AuCu@MWCNTs/Au电极测定无酶体系中的葡萄糖浓度。首先检测了电极在不同电压下对相同浓度葡萄糖的响应情况,以选择最佳电压进行后续实验。在搅拌条件下连续加入0.2mM葡萄糖,并记录相应的电流响应。
图6展示了AuCu@MWCNTs/Au电极在0.1M NaOH中连续加入0.2mM葡萄糖和不同工作电位(0.35、0.40、0.45和0.50V)下的电流响应。电流响应在电位0.40至0.50V的范围内下降,在0.35至0.40V的范围内增加,在0.40V时的电流响应最好,因此使用0.40V的恒定电位作为后续无酶体系葡萄糖定量实验的最佳电位。
图7中的A显示了AuCu@MWCNTs/Au电极在连续搅拌下连续加入0.1M NaOH中不同浓度的葡萄糖溶液的电流-时间曲线,选定的测量电压为0.40V。如图7中的A所示,即使在只存在1.3nM葡萄糖的情况下,所制备电极也能在5秒内实现稳定的电流响应。在8nM到100mM的浓度范围内,电流强度随葡萄糖浓度的升高而升高。并且在8nM到60mM的大范围内,电极的电流强度与体系中葡萄糖的浓度线性相关(R
4.5选择性、重现性分析
为了研究AuCu@MWCNTs/Au电极的选择性,本实施例在背景溶液中加入葡萄糖(1mM)、尿素(1mM)、蔗糖(1mM)、果糖(1mM)和尿酸(0.1mM)后检测电极的电信号变化。
能否将目标物质与干扰物质区分开,是判断传感器好坏的一个关键要素。因此,本实施例在0.1M NaOH和0.1M PB溶液中分别进行了AuCu@MWCNTs/Au电极的选择性测试。首先测试了电极在无酶体系中的抗干扰能力,将下列几种物质,葡萄糖、尿素、蔗糖、果糖、尿酸和葡萄糖依次添加到0.1M NaOH的背景溶液中,结果如图8所示。在加入葡萄糖后观察到电流强度明显增加。而在加入尿素、蔗糖、果糖和尿酸后没有观察到电流强度的变化。这些结果证明AuCu@MWCNTs/Au电极具有出色的选择性,这是电极能进行实际样品分析的一个重要前提。
单个电极的重现性通过记录同一电极在背景溶液中对1mM葡萄糖的连续5次电流响应计算得到。在无酶体系中同一电极的相对标准偏差(RSD)分别为2.9%和2.5%。制备了五个平行电极来评估AuCu@MWCNTs/Au电极的电极间重现性,用于在0.1M NaOH或0.1M PB溶液下测定1mM葡萄糖。五根不同的AuCu@MWCNTs/Au电极在相同的条件下进行测量,并记录电流相应情况,计算得到的RSD分别为2.2%和2.3%。这些结果证明基于AuCu@MWCNTs/Au的无酶葡萄糖传感器具有良好的单电极重现性和电极间的重现性。
4.6血清样品分析
在实际样品分析中,使用了标准加入法。首先,将0.5mL山羊血清加入50mL NaOH溶液(0.1M)中。然后在上述体系中连续加入不同浓度的葡萄糖标准溶液,得到血清样品中葡萄糖浓度的电流响应。回收率根据无酶系体系中的标准曲线计算。原山羊血清的葡萄糖浓度采用葡萄糖浓度检测试剂盒(Applygen,China)检测。
为了验证本实验发明的无酶生物传感器在实际样品分析中的可行性,以山羊血清稀释液为反应背景,使用标准加样法连续加入葡萄糖并记录电极的响应情况。首先将0.5mL山羊血清注入50mL 0.1M NaOH中,并使用AuCu@MWCNTs/Au作为工作电极进行电化学检测。在加入0.5mL山羊血清后,电极的电流变化不明显,说明山羊血清中的葡萄糖含量极低,这与使用葡萄糖检测试剂盒获得的结果相符。然后在检测系统中分别添加不同体积的浓度为1M的葡萄糖溶液,使得溶液中葡萄糖的终浓度为1mM,1.5mM和2.5mM,并记录电流强度数值。将电流强度代入之前所作的标准曲线,获得目标分析物的回收率分别为103.8%、95.7%和97.2%。结果证明,即使在复杂背景的真实样品中,AuCu@MWCNTs/Au也具有良好的葡萄糖检测能力。
表2AuCu@MWCNTs/Au电极在真实样品中测定葡萄糖的回收率(n=3)
4.7无酶生物传感器对H
前面使用了计时安培法表征AuCu@MWCNTs/Au电极在无酶体系中对不同浓度葡萄糖的响应。为了说明该无酶体系设计的通用性,本实例还使用计时安培法,采用AuCu@MWCNTs/Au电极测定无酶体系中的H
图9展示了AuCu@MWCNTs/Au电极在0.1M PB中连续加入0.2mM H
图10中的A显示了AuCu@MWCNTs/Au电极在连续搅拌下连续加入0.1M PB中不同浓度的H
4.8细胞样品分析
在实际样品分析中,使用了标准加入法。首先,将约5×10
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
