一种小麦穗长相关分子标记及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于分子育种技术领域,具体一种小麦穗长相关分子标记及其应用。
背景技术
小麦(Triticum aestivum L.)是世界主要粮食作物之一,在人口快速增长、耕地面积不断减少的国际形势下,小麦产量的提高尤为重要。由于小麦穗是重要的生殖器官,一些研究表明,穗形性状与产量成分显著相关(Gao等,2015;Hu等,2020)。因此,了解小麦穗长性状的遗传特征对产量育种具有重要价值。小麦穗长是一种复杂的数量性状,受Q、Tasg-D1和AGO1d等多个基因/QTL控制(Chen等,2020;Xu等,2022)。QTL定位是揭示这些复杂数量性状遗传基础的有效途径。(JI等,2021)利用BSE-Seq分析方法对极端混池进行基因分型,在5A染色体上初步定位到了QSl.cib-5A,贡献7.88%–26.60%的表型变异。(Zhou等,2017)基于小麦90K SNP芯片检测到9个穗长QTL,最高解释23.60%的贡献率。(Li等,2021)利用小麦55K SNP芯片鉴定和验证了2个控制穗长且对株高、千粒重和粒长具有多效性效应的主效QTL。相关研究表明,穗长QTL不仅在千粒重和粒长等产量相关性状上表现出多效效应(Li等,2021),也与小麦赤霉病有一定联系(陆成彬等,2013)。Rht1和Rht2基因对内源性赤霉素(GA)不敏感,产生更短的植株和更小的细胞(Keyes等,1989;Rebetzke等,2004;Botwright等,2005),而Rht5、Rht8、Rht22、Rht24和Rht25对GA具有响应性,除降低株高外,对穗密度和穗长均表现出多效性(Peng等,1999;Chen等,2014)。因此,除了探索新的主效穗长QTL外,了解它们对其他相关性状的多效性效应也很重要。扬麦12和偃展1号是分别在中国长江中下游和黄淮流域发布的两个优良小麦品种。扬麦12的穗长为长穗,中抗赤霉病。因此,利用扬麦12/偃展1号RIL(Recombinant inbred lines)群体可以挖掘扬麦12的穗长位点,为小麦高产育种提供基因资源。
KASP技术基于引物末端碱基的特异匹配和通用荧光探针对SNP进行分型检测,荧光定量PCR仪或普通PCR仪结合酶标仪即可完成分型。KASP技术与TaqMan(检测寡核苷酸的荧光探针法)类似,都是基于终端荧光信号的读取判断,每孔反应都是采用双色荧光检测一个SNP位点的两种基因型,不同的SNP对应着不同的荧光信号。但它不需要每个SNP位点都合成特异的荧光引物,所有的位点检测最终都可以使用通用荧光引物进行扩增,这就降低了KASP技术的试剂成本,使其更具实用性。现代小麦中很多农艺性状或者抗病抗逆的相关基因/位点被挖掘或者精细定位后,研究者都会根据位点两侧的紧密连锁标记侧翼序列开发成KASP标记,方便育种家利用(Su等,2018;Zhang等,2020;胡文静等,2022)。KASP技术具有高通量、检测方便等优势(Rasheed等,2019)。用SNP芯片进行基因分型,通过QTL定位或GWAS分析获得的与目标性状连锁的SNP,可被转化成KASP标记组,以方便应用于育种。(Rasheed等,2019)开发了70个小麦功能基因KASP标记组,已得到广泛应用。
发明内容
为了克服现有技术中存在的缺陷,本发明提供一种可供分子标记辅助选择增加穗长基因型的小麦育种使用的连锁分子标记。利用Wheat 55K SNP小麦高通量基因芯片获取基因型数据,检测到来源于小麦品种扬麦12的与穗长显著相关的QTL区域QSl.yaas-5B,进一步通过筛选附近SNP序列的有效性、可靠性,在此QTL峰值附近开发了KASP标记引物组,用以对增加穗长的基因型的小麦种质进行高效筛选。
本发明目的之一在于提供一种小麦穗长相关的KASP分子标记,所述分子标记位于小麦基因组中染色体5B上如SEQ ID NO.4所示。
本发明目的之二在于提供一种用于检测所述分子标记的KASP引物组,所述KASP引物组为用于检测小麦基因组中染色体5B上SEQ ID NO.4所示的分子标记的第36位脱氧核糖核苷酸是CC、还是TT、还是C和T的成套引物X1的组合,所述成套引物X1中含有两条上游引物和一条下游引物;
其中,所述上游引物根据所述小麦基因组中染色体5B上SEQ ID NO.4所示序列的第36位脱氧核糖核苷酸及其上游序列进行设计,且一条所述上游引物的3’末端脱氧核糖核苷酸为C,另一条所述上游引物的3’末端脱氧核糖核苷酸为T;
所述下游引物根据所述小麦基因组中染色体5B上SEQ ID NO.4所示序列的第36位脱氧核糖核苷酸的下游序列进行设计。
进一步地,所述成套引物X1由如SEQ ID NO.1、SEQ ID NO.2所示的上游引物,以及如SEQ ID NO.3所示的下游引物组成。
本发明目的之三在于提供所述分子标记或所述KASP引物组在如下任一中的应用:
(A)鉴定或辅助鉴定小麦穗长性状;
(B)预测或比较待测小麦穗长性状;
(C)选育或筛选小麦穗长性状的小麦单株或株系或品系或品种;
(D)制备用于鉴定或辅助鉴定小麦穗长性状的产品;
(E)制备用于选育或筛选小麦穗长性状的小麦单株或株系或品系或品种的产品。
本发明目的之四在于提供如下任一方法:
方法A:一种比较待测小麦穗长性状的方法,包括如下步骤(A1)或(A2):
(A1)检测小麦基因组中染色体5B上SEQ ID NO.4所示分子标记的第36位基因型是CC还是TT还是CT;
(A2)按照如下确定所述待测小麦穗长:基因组中染色体5B上SEQ ID NO.4所示分子标记的第36位脱氧核糖核苷酸是CC,所述待测小麦具有增加穗长的等位变异;
方法B:一种选育或筛选小麦穗长性状的小麦单株或株系或品系或品种的方法,包括如下步骤:
(B1)检测小麦基因组中染色体5B上SEQ ID NO.4所示分子标记的第36位基因型是CC还是TT还是CT;
(B2)选择基因组中染色体5B上SEQ ID NO.4所示的分子标记的第36位脱氧核糖核苷酸是C的纯合体的待测小麦作为亲本进行选育,并在育种各世代选择基因组中染色体5B上SEQ ID NO.4所示的分子标记的第36位脱氧核糖核苷酸是C的纯合体的小麦,最终获得小麦穗长相对较长的小麦单株或株系或品系或品种;
(B3)选择基因组中染色体5B上SEQ ID NO.4所示的分子标记的第36位脱氧核糖核苷酸是T的纯合体的待测小麦作为亲本进行选育,并在育种各世代选择基因组中染色体5B上SEQ ID NO.4所示的分子标记的第36位脱氧核糖核苷酸是T的纯合体的小麦,最终获得穗长相对较短的小麦单株或株系或品系或品种。
进一步地,所述步骤(A1)或步骤(B1)的具体操作为:
采用上述引物组对待测小麦基因组DNA进行PCR扩增,将所扩增的产物进行荧光信号扫描,对扫描数据进行分析,然后按照如下确定所述待测小麦基因中染色体5B上SEQ IDNO.4所示的第36位脱氧核糖核苷酸种类:
若所述待测小麦的扩增产物的荧光信号数据显示为红色,则所述待测小麦基因组中染色体5B上SEQ ID NO.4所示的分子标记的第36位脱氧核糖核苷酸是C的纯合体;
若所述待测小麦的扩增产物的荧光信号数据显示为蓝色,则所述待测小麦基因组中染色体5B上SEQ ID NO.4所示的分子标记的第36位脱氧核糖核苷酸是T的纯合体。
本发明相对于现有技术而言,利用Wheat 55KSNP小麦高通量基因芯片获取基因型数据,检测到来源于小麦品种扬麦12的与小麦穗长显著相关的QTL区域QSl.yaas-5B,进一步通过筛选附近SNP序列的有效性、可靠性,在此QTL峰值附近开发了1个KASP标记引物组,用以对增加小麦穗长的基因型的小麦种质进行高效筛选。本发明为小麦穗长位点QSl.yaas-5B在高产育种中的有效利用提供了良好工具,这个KASP标记可快速对小麦穗长性状进行筛选,为筛选携带增加穗长的优异等位变异的小麦材料提供便捷,提高小麦育种效率。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
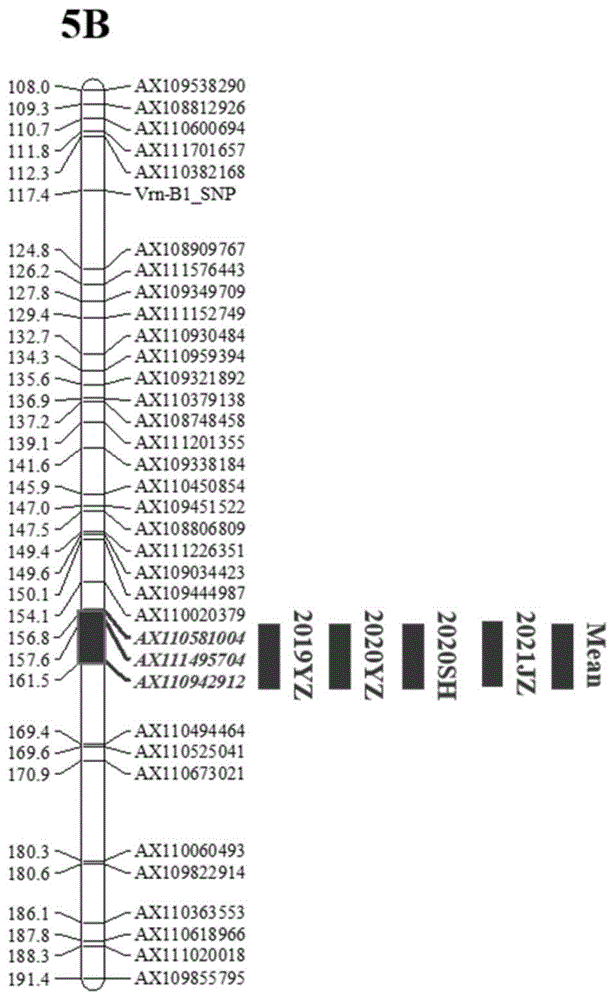
图1为实施例1中5B染色体的部分遗传连锁图谱及QSl.yaas-5B定位示意图。
图2为实施例3中QSl.yaas-5B的KASP引物组KASP_Q.5B在180份自然群体中的分型结果。
具体实施方式
下面将结合附图对本发明技术方案的实施例进行详细的描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只是作为示例,而不能以此来限制本发明的保护范围。需要注意的是,除非另有说明,本申请使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。作为专业性农业研究机构,申请人长期保存有相关种质材料,而且相关小麦品种均是可以市场或者现有种质库中公开获得的。
除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1筛选稳定与小麦穗长显著相关的位点
本实施例以205份来源于“扬麦12×偃展1号”的重组自交系(F
用CTAB法从新鲜叶片组织中提取基因组DNA(Jiang等,2020),利用凝胶电泳检测DNA完整性和数量。
利用中玉金标记(北京)生物技术有限公司提供的含有53063个SNP的小麦55K单核苷酸多态性(SNP)阵列对亲本和重组自交系群体进行基因分型。然后,选取Vrn-B1、Rht-B1、Rht-D1、Rht8等12个与已知基因相关的KASP标记或者SSR标记对亲本及RIL群体进行基因分型,加密遗传图谱(Rasheed等,2016;Zhang等,2019;Xu等,2020;Zhu等,2021)。将所有多态SNP侧翼序列与国际小麦基因组测序联盟(IWGSC)Ensembl Plants数据库(http://plants.ensembl.org)中国春参考基因组v2.1(Ref v2.1)进行比对,得到其物理位置,并以1E
首先对小麦55K SNP芯片结果进行初步质量控制,利用IciMapping v4.1软件(http://www.isbreeding.net)对原始基因型数据进行过滤和去冗余(利用“BIN”功能可以同时删除缺失率大于20%、最小等位基因频率小于5%的和偏分离(χ2≥33.3%)的SNPs,删除冗余SNPs。),并利用“MAP”功能对过滤后的标记进行分群(Li等,2007;2008;Meng等,2015),将标记侧翼序列放在国际小麦基因组测序联盟数据库v2.1(International WheatGenome Sequencing Consortium,IWGSC)比对物理位置(Ma等,2021)(WheatOmics 1.0,http://202.194.139.32/blast/blast.html)。在JoinMap 4.0软件中使用Kosambi映射函数计算每个群体的遗传距离(Kosambi等,1944;Van等,2006)。利用IciMapping v4.1的“BIP”功能进行完备区间作图法(ICIM)算法进行穗长QTL检测,LOD域值被设置为3.0(Li等,2021)。使用MapChart v2.32(Voorrips,2002)绘制覆盖QTL区域的遗传图谱。位于重叠置信区间内的QTL被认为是相同的。将QTL侧翼标记的物理位置与此前报道的基因/QTL进行比较(http://202.194.139.32/blast/blast.html和http://wheatomics.sdau.edu.cn/genes/)。
扬麦12/偃展1号群体中检测到在4个不同环境下和Mean值中稳定存在的穗长位点QSl.yaas-5B,扬麦12为其提供了增加穗长的效应,该位点为表型提供9.01–12.85%的贡献率,加性效应4.02–9.47(附图1,表1),经过与以往研究比对,这是一个新的小麦穗长位点。
表1扬麦12/偃展1号的穗长QTL定位结果
注释:
实施例2明确穗长QTL与穗长、千粒重和赤霉病抗性的关系
利用QSl.yaas-5B侧翼标记(AX110581004)与穗长、千粒重、土表接种平均病小穗数(PIS)和喷孢子液接种平均病小穗数(PSS)的Mean值(江苏里下河地区万福试验基地2020年和2021年的数据的均值)分析此穗长QTL对穗长、千粒重和赤霉病抗性的影响,结果表明QSl.yaas-5B显著增加穗长的同时还显著增加千粒重并降低PIS值和PSS值,是利用价值较高的穗长位点(表2)。
表2QSl.yaas-5B对千粒重和赤霉病抗性的效应分析(Mean值)
注释:Mean代表的是平均值。PIS:代表土表接种法鉴定平均病小穗率;PSS:代表喷孢子液鉴定平均病小穗率。‘*’、‘**’分别代表P<0.05、P<0.01。
实施例3开发与QSl.yaas-5B连锁的KASP标记
上述研究结果表明QSl.yaas-5B的增加穗长的等位变异对千粒重和赤霉病抗性有显著的增效效应。我们利用小麦参考基因组信息将此位点峰值区间的侧翼SNP标记AX110581004转化为KASP标记KASP_Q.5B。KASP_Q.5B的引物序列如表3。
表3KASP_Q.5B的引物序列
注释:F1和F2是正向引物,R是反向引物。竞争性引物中有下划线。
KASP引物的制备和PCR反应
利用小麦参考基因组信息将有育种价值的穗长位点峰值区间的侧翼SNP转化为KASP标记,引物的设计利用在线软件Primer 3.0。根据KASP设计原理每个标记设计2条特异性引物(F1/F2)和一条通用引物(R),F1尾部添加与FAM荧光结合的特异性序列,F2尾部添加与HEX荧光结合的特异性序列。引物由北京嘉程生物科技有限公司合成。
KASP反应总体系为6μL,包含2×KASP Master Mix 3.5μL、KASP引物混合工作液0.1μL、浓度为20ng μL
KASP反应程序第一步为94℃,15min;第二步为94℃,25s,61–55℃,1min,每个循环降低0.6℃,共进行10个循环;第三步为94℃,20s,55℃,45s,共进行29个循环。利用KASP荧光分析仪(LGC公司,PHERAstar plus)分析KASP分型结果。
RIL群体连同亲本按照如上方法进行KASP_Q.5B扩增。KASP_Q.5B扩增产物的荧光信号数据经Kluster Caller软件分析聚集在分型结果荧光信号坐标系中靠近Y轴的位置(红色),与扬麦12相同,即证明这些小麦在QSl.yaas-5B位点侧翼核苷酸序列(如SEQ IDNO.4)的第36位碱基(SNP位点)的基因型为C;而扩增产物的荧光信号数据经KlusterCaller软件分析聚集在坐标系中靠近X轴的位置(蓝色),与扬麦12分型不同,则证明这些小麦在QSl.yaas-5B位点的基因型为T。材料分型良好,KASP引物组设计成功。
表4携带不同基因型的RIL家系的t测验结果
注释:
表4所示利用Excel 2019的双样本t测验,可以看出,KASP_Q.5B基因型是CC的家系比TT的家系显著增加穗长5.14%(P<0.01)(统计方法为本领域常规方法,具体也可以参见文献“盖钧镒,《试验统计方法》,中国农业出版社,2000年9月”中公开的内容)。
上述KASP的引物组及基因型检测体系各自单独应用或者同时应用于小麦穗长性状的材料选择中,QSl.yaas-5B的效应显著,说明KASP标记开发成功,可进一步用于育种材料检测。
实施例4KASP引物组育种应用
田间试验:本实施例以180份来源于全国各地的小麦材料为研究对象,2020年和2021年连续2个生长季将180份小麦材料种植于江苏里下河地区万福试验基地产量评价苗圃。采用随机区组设计,每个系种植2行,每行25粒,行长1.5m,行距0.30m,两次重复,田间管理按照当地的高产栽培管理。小麦灌浆后期随机选取各RIL生长状态相近的20株代表性植株,在6个环境下测量主穗的穗长,测量方法:从麦穗轴基部到顶生小穗尖端测量,不包括芒(基部不育小穗不算在内)。
利用实施例1获得的KASP引物组对180份小麦品种(系)进行基因分型。分型结果如图2所示。
KASP_Q.5B扩增产物的荧光信号数据经Kluster Caller软件分析聚集在分型结果荧光信号坐标系中靠近Y轴的位置(红色),与扬麦12相同,即证明这些小麦在分子标记KASP_Q.5B侧翼核苷酸序列(如SEQ ID NO.4)的第36位碱基(SNP位点)的基因型为C,扩增产物的荧光信号数据经Kluster Caller软件分析聚集在坐标系中靠近X轴的位置(蓝色),与扬麦12分型不同,则证明这些小麦在该SNP位点的基因型为T。
表5携带不同基因型的供试品种(系)的t测验结果
注释:数字后面的*表示相对于“TT”在P<0.05具有显著差异。
表5利用Excel 2019的双样本t测验,结果表明180份小麦品种(系)中QSl.yaas-5B位点上携有扬麦12等位变异(CC)时显著增加穗长3.61%(P<0.05),与RIL群体的检测结果一致。上述KASP的引物组及基因型检测体系各自单独应用或者同时应用于验证群体小麦穗长性状的材料选择中,QSl.yaas-5B的效应显著,说明KASP标记开发成功,可进一步用于育种材料检测。
由上述实验结果不难得出:利用本发明的KASP引物组对小麦基因组DNA进行PCR扩增,通过KASP分型判断是否携带扬麦12的增加穗长的基因型,检测方法操作简单,结果直观且有效,利用此KASP引物组可以大大提高增加穗长的小麦的分子标记辅助选择育种工作效率。
以上具体实施方式详细描述了本发明的实施,但是,本发明并不限于上述实施方式中的具体细节。在本发明的权利要求书和技术构思范围内,可以对本发明的技术方案进行多种简单改型和改变,这些简单变型均属于本发明的保护范围。
- 一种与小麦穗长主效QTL位点紧密连锁的KASP分子标记及其应用
- 一种与小麦穗发芽抗性相关的SNP分子标记及其应用
