通过混合模式色谱纯化抗体
文献发布时间:2024-04-18 19:58:21
本发明处于抗体纯化的领域。特别地,本发明涉及用于生产或纯化亲水性抗体的方法,其中使用具有离子交换和疏水相互作用功能的混合模式(即多模式)色谱材料以流通模式处理抗体。特别地,该方法涉及在施加至混合模式色谱材料的溶液中使用抗离液盐。
先前技术
单株抗体已被证明是一类非常成功的治疗产品。为了使这些重组生物医药蛋白能够被施用人类患者,重要的是从最终的生物产物中去除制造和纯化过程中产生的杂质以及与产物相关的杂质。工艺成分包括培养基蛋白、免疫球蛋白亲和配体、病毒、内毒素、DNA和宿主细胞蛋白(HCP)。与产物相关的其他杂质包括低分子量(LMW)杂质,如不完全组装的抗体或片段。此外,高分子量(HMW)杂质如二聚体、三聚体、多聚体或一般聚集体也可能出现在医药抗体的生产中。
蛋白聚集现象是一个常见问题,它影响抗体的质量、安全性和功效,并且可能发生在制造过程的不同步骤中。在评估分子的质量属性时,原料药和最终药物产物中的聚集位准是一个关键因素,因为聚集可能影响生物医药的生物活性。与单体蛋白的活性相比,聚集体的生物活性的差异可显著削弱基于蛋白的药物的效力。
在纯化期间,色谱通常为主要有助于去除聚集体或HMW的步骤。应在与整个工艺纯化系列的适合性和兼容性以及生产率、产量和产品质量的适当平衡的指导下选择特定色谱材料和操作模式。蛋白A亲和色谱通常用作制造治疗抗体的第一个纯化步骤。该纯化步骤通常不能或几乎不能去除聚集体,因为产物聚集体可能与色谱配体以及单体形式的产物相结合。已证明使用离子(阴离子和阳离子)交换色谱在生产规模上可用于从二聚体和LMW物质中分离抗体单体。WO 99/62936报导了通过使用离子交换色谱从聚集体中分离单体。可以通过疏水相互作用色谱(HIC)基于疏水性的差异来从聚集体中分离抗体单体,该HIC主要用于去除聚集体和杂质两者,诸如HCP(Lu,Y.等人,2009,Curr Pharm Biotechnol 10(4):427-433)。抗体的疏水性随着聚集而增加,这一事实具有重要的理论和实践意义(Suda,E.J.等人,2009,J Chromatogr A 1216(27):5256-5264)。此外,混合模式或多模式色谱已广泛用于抗体纯化和聚集体去除。例如Gagnon等人(2009,Curr Pharm Biotechnol 10(4):434-439)报告了通过带电疏水性混合模式色谱去除聚集体。还有Gao等人(2013,Journal ofChromatography A,129470-75)描述了使用混合模式色谱从相关联聚集体中分离抗体单体。
除了减少与产物相关的杂质(如HMW或聚集体)之外,还需要在纯化期间去除与工艺相关的杂质,如HCP或病毒颗粒。病毒污染是使用源自哺乳动物细胞系的生物技术产物的潜在风险。因此,为了保证这些产物在潜在病毒污染方面的安全性,监管机构要求进行病毒清除研究,以评估纯化工艺清除内源性病毒和外源性病毒的能力。为了去除病毒污染,通常使用病毒过滤器和低pH灭活,但也可以使用色谱工艺,如阴离子交换色谱(Ajayi等人,2022,Current Research in Biotechnology 4:190–202)。
尽管总体上并且特别是从HMW杂质中纯化抗体单体以及通过不同的色谱材料去除病毒方面取得了这些进展,为实现更高纯度和质量的抗体,仍有针对提高纯化设置的需要和空间。
发明内容
本文报导了一种在抗离液盐的存在下使用包含离子交换官能团和疏水相互作用官能团的混合模式/多模式色谱材料来纯化或生产亲水性抗体的方法。
本发明至少部分基于出人意料的发现,即当在至少一种抗离液盐的存在下,以流通液(FT)模式通过包含离子交换官能团和疏水相互作用官能团的混合模式色谱材料(MMHIC/IEX)来纯化包含亲水性抗体和HMW的装载溶液时,可以成功减少抗体相关的高分子量杂质(HMW)。在本发明的一个优选实施例中,抗离液盐存在于用于平衡色谱材料、装载溶液和任选的冲洗/漂洗溶液的平衡液(缓冲液)中。已经发现,可以在抗离液盐的存在下对亲水性抗体进行生产和/或纯化,即HMW的减少,但是对于疏水性抗体或在离液盐的存在下未能实现该效果。
此外,本发明至少部分基于出人意料的发现,即当在至少一种抗离液盐的存在下,以流通液(FT)模式通过包含离子交换官能团和疏水相互作用官能团的混合模式色谱材料(MM HIC/IEX)来纯化包含亲水性抗体和病毒杂质的装载溶液时,也可以成功减少病毒或病毒样颗粒(例如RVLP)的污染(即病毒杂质含量)。在本发明的一个优选实施例中,抗离液盐存在于用于平衡色谱材料、装载溶液和任选的冲洗/漂洗溶液的平衡液(缓冲液)中。已经发现,可以在抗离液盐的存在下对亲水性抗体进行生产和/或纯化,即病毒杂质含量的减少,但是针对疏水性抗体,不存在该效果。
因此,本发明的一个方面是一种使用(/利用)包含以流通模式操作的离子交换官能团和疏水相互作用官能团的混合模式/多模式色谱材料(MM HIC/IEX)来生产抗体的方法,其中
a)抗体为亲水性抗体,且
b)在包含抗体和抗离液盐的溶液中将抗体施加到MM HIC/IEX。
在上述方面的某些实施例和其他实施例中,该方法进一步包括以下步骤:
c)任选地施加冲洗液,
d)在b)的流通液中或任选地在b)和c)的流通液中回收抗体,从而使用在流通模式下操作的MM HIC/IEX生产抗体。
本发明的另一个方面是一种使用(利用)包含以流通模式操作的离子交换官能团和疏水相互作用官能团的混合模式/多模式色谱材料(MM HIC/IEX)来纯化抗体的方法,其中
a)该抗体为亲水性抗体,且
b)在包含抗体和抗离液盐的溶液中将抗体施加到MM HIC/IEX,从而纯化抗体。
在上述方面的某些实施例和其他实施例中,MM HIC/IEX已用包含(相同)抗离液盐的缓冲液来调整/平衡。在一个优选实施例中,用于调适/平衡MM HIC/IEX的缓冲液也是步骤b)的溶液的缓冲液。
在上述方面的某些实施例和其他实施例中
-该方法用于生产具有降低的抗体相关高分子量(HMW)杂质含量和/或具有降低的病毒杂质含量的抗体组合物,
-将抗体施加到包含抗体、至少一种抗体相关HMW杂质和/或至少一种病毒杂质以及抗离液盐的溶液中的MM HIC/IEX,
-从流通液中回收具有降低的抗体相关HMW杂质含量和/或具有降低的病毒杂质含量的抗体组合物,并且
-从而产生具有降低的抗体相关HMW杂质含量和/或具有降低的病毒杂质含量的抗体组合物。
在上述方面的某些实施例和其他实施例中
-该方法用于生产具有降低的抗体相关高分子量(HMW)杂质含量和具有降低的病毒杂质含量的抗体组合物,
-将抗体施加到包含抗体、至少一种抗体相关HMW杂质和至少一种病毒杂质以及抗离液盐的溶液中的MM HIC/IEX,
-从流通液中回收具有降低的抗体相关HMW杂质含量和具有降低的病毒杂质含量的抗体组合物,并且
-从而产生具有降低的抗体相关HMW杂质含量和具有降低的病毒杂质含量的抗体组合物。
在上述方面的某些实施例和其他实施例中
-该方法用于生产具有降低的抗体相关高分子量(HMW)杂质含量的抗体组合物,
-将抗体施加到包含抗体、至少一种抗体相关HMW杂质和抗离液盐的溶液中的MMHIC/IEX,
-从流通液中回收具有降低的抗体相关HMW杂质含量的抗体组合物,并且
-从而产生具有降低的抗体相关HMW杂质含量的抗体组合物。
在上述方面的某些实施例和其他实施例中,与在步骤b)中被施加到MM HIC/IEX的溶液相比,抗体相关(HMW)杂质含量降低。
在上述方面的某些实施例和其他实施例中,与基本上不含抗离液盐的溶液相比和/或与包含疏水性抗体的溶液相比,抗体相关(HMW)杂质含量降低。
在上述方面的某些实施例和其他实施例中
-该方法用于生产具有降低的病毒杂质含量的抗体组合物,
-将抗体施加到包含抗体、至少一种病毒杂质和抗离液盐的溶液中的MM HIC/IEX,
-从流通液中回收具有降低的病毒杂质含量的抗体组合物,并且
-从而产生具有降低的病毒杂质含量的抗体组合物。
在上述方面的某些实施例和其他实施例中,与在步骤b)中被施加到MM HIC/IEX的溶液相比,抗体病毒杂质含量降低。
在上述方面的某些实施例和其他实施例中,与基本上不含抗离液盐的溶液相比和/或与包含疏水性抗体的溶液相比,病毒杂质含量降低。
在上述方面的某些实施例和其他实施例中,亲水性抗体为在疏水相互作用色谱(HIC)材料上的滞留时间等于或小于利妥昔单抗(rituximab)(在相同操作条件下在相同的HIC材料上)的滞留时间的抗体。
在上述方面的某些实施例和其他实施例中,疏水相互作用色谱(HIC)材料含有聚醚基团(乙醚基团)作为配体。
在上述方面的某些实施例和其他实施例中,疏水相互作用色谱(HIC)材料含有具有以下结构(-(OCH
在上述方面的某些实施例和其他实施例中,疏水相互作用色谱(HIC)材料含有聚甲基丙烯酸酯基材/基质。
在上述方面的某些实施例和其他实施例中,疏水相互作用色谱(HIC)材料含有聚醚基团(乙醚基团)作为配体,具有100nm的平均孔径和10μm的粒径。
在上述方面的某些实施例和其他实施例中,疏水相互作用色谱(HIC)材料为
在上述方面的某些实施例和其他实施例中,使用(任一个其他实施例的)HIC色谱材料,在75mm的柱长度、7.5mm的内径和流速为8.8ml/min的洗脱缓冲液梯度下,对在HIC色谱材料上的滞留时间进行测定,并且其中将抗体以1mg/ml的浓度施加到色谱材料。
在上述方面的某些实施例和其他实施例中,抗离液盐具有范围在1.285至4.183x10E3 dyn*g*cm
在上述方面的某些实施例和其他实施例中,抗离液盐选自由以下项组成的组:氯化物、硫酸盐、柠檬酸盐、碳酸盐、磷酸盐、乙酸盐或氟化物。
在上述方面的某些实施例和其他实施例中,抗离液盐为钙盐、钠盐、铵盐或钾盐。
在上述方面的某些实施例和其他实施例中,抗离液盐为钠盐、铵盐或钾盐。
在上述方面的某些实施例和其他实施例中,抗离液盐选自由以下项组成的组:(NH
在上述方面的某些实施例和其他实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有(并且包括)0.5至120mS/cm的导电率。
在上述方面的某些实施例和其他实施例中,在包含抗体和抗离液盐的溶液中,该抗离液盐具有(并且包括)10mM至900mM的浓度。
在上述方面的某些实施例和其他实施例中,到MM HIC/IEX的装载量为每升色谱材料10g蛋白(10g/L)或更高。
在上述方面的某些实施例和其他实施例中,到MM HIC/IEX的装载量为(并且包括)每升色谱材料10g蛋白(10g/L)至每升色谱材料650g蛋白(650g/L)。
在上述方面的某些实施例和其他实施例中,到MM HIC/IEX的装载量为(并且包括)每升色谱材料15g蛋白(15g/L)至每升色谱材料350g蛋白(350g/L)。
在上述方面的某些实施例和其他实施例中,包含抗体和抗离液盐的溶液具有(并且包括)4.0至9.0的pH值。
在上述方面的某些实施例和其他实施例中,HMW杂质为具有285kDa或更大的分子量的杂质。
在上述方面的某些实施例和其他实施例中,HMW杂质为至少为抗体的二聚体、或三聚体或任何多聚体的杂质。
在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含阴离子交换官能团或阳离子交换官能团。
在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含强阴离子交换官能团。
在上述方面的某些实施例和其他实施例中,MM HIC/IEX为Capto
在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含弱阳离子交换官能团。
在上述方面的某些实施例和其他实施例中,MM HIC/IEX为Capto
具体实施方式
本文报导了一种利用包含离子交换官能团和疏水相互作用官能团的混合模式/多模式色谱材料并使用装载溶液(本文中也表示为“装载”)中的抗离液盐来纯化或生产亲水性抗体的方法。
本发明至少部分基于出人意料的发现,即当以流通液(FT)模式通过包含离子交换官能团和疏水相互作用官能团的混合模式色谱材料(MM HIC/IEX)来纯化包含亲水性抗体和高分子量杂质(HMW)的装载并且在色谱开始之前装载溶液中存在至少一种抗离液盐时,可以成功减少抗体相关HMW。
更详细且令人惊讶地发现,当想要纯化的抗体为亲水性抗体且存在抗离液盐时,HMW的含量可显著降低更多。相反,当纯化疏水性抗体时,未观察到添加抗离液盐对于HMW减少的显著影响。
本发明进一步至少部分基于以下发现,即该影响不能归因于盐摩尔浓度本身的增加。再者,随着抗离液盐的盐摩尔浓度的增加,可以观察到针对亲水性抗体的积极效果,而针对疏水性抗体则无法观察到该效果。
本发明进一步至少部分基于以下发现,即对于离液盐无法显示改善的HMW减少。
在第一组实验(第I部分)中,显示了在恒定导电率下抗体疏水性对HMW杂质减少的影响。
流通液(FT)运行是在机器人系统上利用Capto
对于多种亲水性抗体,已发现与在相同导电率下不含抗离液盐的Tris/乙酸盐缓冲液中的装载溶液相比,当将抗离液盐添加到装载溶液中时,HMW减少值得到增加(参见图1至4;黑色实心圆)。已发现装载中抗离液盐的存在引起针对MM HIC/IEX上的亲水性mab,HMW减少有所改善。
与此相反,对于含有抗离液盐的装载和不含抗离液盐的装载,疏水性抗体的HMW减少值未增加(参见图5至7)。
为了计算池的HMW去除率,引入了趋势线。针对示例性亲水性mab(图8A;mab2)和示例性疏水性mab(图8B;mab7)示出了FT池的HMW去除率。针对mab2,当将硫酸铵添加到装载时,总载量为150g/L下的池HMW去除值从35%增加到89%(参见图9A)。对于550g/L的总载量,利用在装载中添加(NH
在不同的pH值(实例1:pH 8;实例2:pH 6)下可以看到相同的效果。已发现,当将抗离液盐添加到装载溶液中时,亲水性mab的HMW减少值显著增加(参见图10至13)。与此相反,对于含有抗离液盐的装载和不含抗离液盐的装载,疏水性mab的HMW减少值是相当的(参见图14至16)。
在不同的导电率(实例1/2:20mS/cm;实例3:10mS/cm)下,可以看到相同的效果,参见图17(A和B)以及18(A和B)。已发现,针对亲水性mab的抗离液盐的存在增加了FT分数中HMW的减少值。对于疏水性mab,当将抗离液盐添加到装载中时,未观察到HMW减少值的增加。已发现,通过向装载中添加抗离液盐来改善亲水性mab的HMW减少的效果随着pH值的增加而更加显著。
在第二组实验中,已显示了抗离液盐摩尔浓度对HMW去除率的影响。
进行了RC实验和Kp(分配系数)筛选以示出不同摩尔浓度的抗离液盐对HMW减少的影响。已使用摩尔浓度高达500mM的盐。在pH 8.0下,测试了不同的盐(Na
进一步地,Kp筛选示出了宽范围的pH值和盐摩尔浓度下,盐摩尔浓度对HMW减少的影响(参见使用Capto
进一步地,在pH 4至9的pH范围和高达约900mM的盐摩尔浓度下进行了Kp筛选(参见实例6)。在这些Kp筛选中,比较了两组缓冲液:一种缓冲液含有抗离液盐Na
更详细地,利用亲水性mab对五种抗离液盐在pH 8下测试了增加盐摩尔浓度(和导电率)的效果(实例4;mab2)。抗离液盐为硫酸钠(结果参见图19)、氯化钠(结果参见图20)、硫酸铵(结果参见图21)、氯化钾(结果参见图22)和硫酸钾(结果参见图23)。相对于增加的总装载量,对每个FT分数的所获得的HMW去除值绘图。一般而言,观察到了HMW去除值随总装载量的增加而增加。已发现,通过向亲水性mab添加抗离液盐,可以实现FT分数的HMW位准的降低。对于所有测试的抗离液盐,发现HMW减少值有所增加。
此外,使用Kp筛选在5.5至8.0的pH范围和高达800mM的盐摩尔浓度下,针对三种(亲水性和疏水性)mab和四种盐((NH
根据mab的疏水性,看出了HMW减少率的差异。已发现,对于亲水性mab(mab2;A和mab4;B),添加抗离液盐(硫酸铵,图24A和图24B,以及KCl,图25A和图25B)实现了高达70%至80%的HMW减少值。对于疏水性mab(mab6;C),在硫酸铵存在下HMW的减少值几乎不受摩尔浓度的影响。利用KCl,疏水性mab6的HMW减少值甚至随着KCl摩尔浓度的增加而降低。图24C和图25C示出:对于疏水性mab6,HMW去除率未通过增加抗离液盐的摩尔浓度而得到提高。
Gua/HCl(参见图26)和尿素(参见图27)被用于测定离液盐对HMW减少值的影响。对于亲水性和疏水性mab,随着盐摩尔浓度的增加,未观察到HMW减少值的增加。
总的来说,已发现当将抗离液盐添加到装载溶液中时,亲水性mab的HMW减少值得到增加。对于疏水性mab,未观察到通过添加抗离液盐而增加的HMW减少值。此外,在添加离液盐的情况下未能获得增加的HMW减少值。
实例6的结果表明添加抗离液盐提高了亲水性mab(mab2)的FT分数中HMW的减少率。增加的Na
在第三组实验(第三部分)中,使用了不同的色谱树脂。
在实例7中,研究了在5.5至8.0的pH范围和10至800mM的盐摩尔浓度下包含亲水性mab(mab2)的装载中HMW的减少值。使用了三种不同的混合模式阴离子交换(MMAEX)树脂:Capto
实例8总结了利用亲水性和疏水性mab对MMAEX树脂、阴离子交换(AEX)树脂、HIC树脂和混合模式阳离子交换(MMCEX)树脂进行的Kp筛选。使用的pH范围为pH 4.0至9.0并且使用的盐浓度为5至850mM。已发现,对于两种离子混合模式树脂(MMAEX和MMCEX),亲水性mab的流通液样品示出随着盐摩尔浓度的增加而增加的HMW减少值。与此相反,对于疏水性mab,MMAEX树脂上的HMW减少与盐摩尔浓度无关。对于MMCEX树脂,疏水性mab的HMW减少值并未通过将盐摩尔浓度增加到500mM Na
更详细地,mab2在实例7中与不同的混合模式树脂一起使用。使用了三种具有阴离子交换和疏水相互作用的混合模式树脂。图29A至图32A(A系列)中示出了Capto
一般而言,已发现对于所有盐,Capto
总的来说,利用不同的MMAEX树脂可以实现增加的HMW减少值。
在实例8中,一种亲水性mab(mab2)和一种疏水性mab(mab6)与不同的树脂类型组合使用:混合模式阴离子交换树脂(Capto
对于AEX树脂Q Sepharose FF,未观察到抗离液盐对HMW减少的影响(参见图34)。对于树脂Phenyl Sepharose 6FF(high sub),亲水性和疏水性mab都示出了随着Na
与此相反,对于混合模式树脂,亲水性和疏水性mab的HMW减少值是不同的。当将抗离液盐添加到装载中时,MMAEX树脂针对亲水性mab2(参见图33A)示出了提高的HMW去除率。对于疏水性mab6,HMW去除率在测试的pH和摩尔浓度范围内几乎是恒定的(参见图33B)。因此,已发现仅对于亲水性mab,HMW减少值已通过增加混合模式阴离子交换树脂上的盐摩尔浓度来增加。图36示出了针对Capto
不受该理论的束缚,实例8示出通过添加抗离液盐而增加的亲水性mab的HMW减少值可归因于离子和疏水相互作用的组合(但不仅针对疏水相互作用)。对于两种离子混合模式树脂,Capto
该方法还可以自由扩展(第IV部分;参见实例9和10)。
扩展结果证实了在第II部分和第III部分中使用较小体积系统所实现的结果。
更详细地,在实例9中,制备了具有相同导电率(9mS/cm)但具有不同摩尔浓度的Na
实例10示出了Na
在第五组实验中,已显示了抗离液盐摩尔浓度对病毒去除/RVLP去除的影响。
进行了Kp(分配系数)筛选以示出不同摩尔浓度的抗离液盐对病毒污染物减少的影响。在pH 5.0至8.0的pH范围内,利用两种亲水性和两种疏水性mab示出了mab疏水性和抗离液盐的存在的影响。在实例11中,研究了盐摩尔浓度高达400mM的抗离液盐,硫酸钠。在实例12中,使用了具有增加的Tris摩尔浓度和增加的导电率但缺少抗离液盐的Tris/乙酸盐缓冲液。
根据mab的疏水性和抗离液盐的存在,测量了不同的RNA减少值(表示RVLP减少,这又是病毒污染物减少的替代测量)。
总的来说,已发现当将抗离液盐添加到装载溶液中时,亲水性mab的病毒污染物减少值得到增加。对于疏水性mab,未观察到通过添加抗离液盐而增加的病毒污染物减少值。
因此,本发明至少部分基于出人意料的发现,即当以流过(FT)模式通过包含离子交换官能团和疏水相互作用官能团的混合模式色谱材料(MM HIC/IEX)来纯化包含亲水性抗体和高分子量杂质(HMW)的装载溶液并且在色谱开始之前装载溶液中存在至少一种抗离液盐时,可以成功减少抗体相关HMW。
此外,本发明至少部分基于出人意料的发现,即当以流通液(FT)模式通过包含离子交换官能团和疏水相互作用官能团的混合模式色谱材料(MM HIC/IEX)来纯化包含亲水性抗体和病毒污染物的装载并且在色谱开始之前装载溶液中存在至少一种抗离液盐时,可以成功减少病毒污染物。
更详细且令人惊讶地发现,当想要纯化的抗体为亲水性抗体且存在抗离液盐时,病毒污染物的含量可显著降低更多。相反,当纯化疏水性抗体时,没有观察到添加抗离液盐对减少病毒污染物的显著影响。
本发明进一步至少部分基于以下发现,即该影响不能归因于盐摩尔浓度本身的增加。同样,对于亲水性抗体可以观察到抗离液盐的某些盐摩尔浓度的积极作用,而针对疏水性抗体则不能观察到该作用。
因此,根据本发明的一个方面为一种使用(/以)混合模式/多模式色谱材料生产抗体的方法,该混合模式/多模式色谱材料(MM HIC/IEX)包含以流通模式操作的离子交换官能团和疏水相互作用官能团,其中
a)该抗体为亲水性抗体,且
b)在包含抗体和抗离液盐的溶液中将抗体施加到MM HIC/IEX色谱材料。
在上述方面的某些实施例和其他实施例中,该方法进一步包括以下步骤:
c)任选地施加冲洗液,
d)在b)的流通液中或任选地在b)和c)的流通液中回收抗体,
从而使用在流通模式下操作的MM HIC/IEX生产该抗体。
本发明的另一个方面是一种使用(利用)包含以流通模式操作的离子交换官能团和疏水相互作用官能团的混合模式/多模式色谱材料(MM HIC/IEX)来纯化抗体的方法,其中
a)该抗体为亲水性抗体,且
b)在包含抗体和抗离液盐的溶液中将抗体施加到MM HIC/IEX色谱材料,
从而纯化抗体。
定义和实施例
本文中的术语“抗体”以最广义使用并且具体涵盖单株抗体、多株抗体、由至少两种完整抗体形成的多特异性抗体(例如双特异性抗体)。只要抗体片段以及融合多肽确实具有Fc区,即包含在该定义的范围内。术语“免疫球蛋白”(Ig)在本文中与抗体可互换使用。
抗体为天然存在的免疫球蛋白分子,其具有不同的结构,均基于免疫球蛋白折迭。例如,IgG抗体具有两条“重”链和两条“轻”链,它们通过双硫键结合以形成功能性抗体。每条重链和轻链本身都包含一个“恒定”(C)区和一个“可变”(V)区。V区决定抗体的抗原结合特异性,而C区提供结构支持并在与免疫效应子的非抗原特异性交互作用中起作用。抗体或抗体的抗原结合片段的抗原结合特异性为抗体与特定抗原特异性结合的能力。
抗体的抗原结合特异性由V区的结构特性决定。可变性并非在可变结构域的110个氨基酸的范围内均匀分布。相反地,V区由15~30个氨基酸的相对不变的链段组成(称为骨架区(Fr)),这些链段被称为“高度可变区”的极度变异的较短区隔开,每个区各自长9~12个氨基酸。天然重链和轻链的可变结构域各自包含四个FR,主要采用β-折迭构造,通过三个高度可变区连接,其形成连接β-折迭结构的环并在一些情况下形成β-折迭结构的一部分。各链中的高度可变区通过FR紧密地结合在一起,且与另一链的高度可变区一起,有助于形成抗体的抗原结合位点(参见Kabat等人,Sequences of Proteins of ImmunologicalInterest,第五版,Public Health Service,National Institutes of Health,Bethesda,Md.(1991))。恒定结构域不直接参与抗体与抗原的结合,而是呈现多种效应子功能,例如抗体参与抗体依赖性细胞毒性作用(ADCC)。
每个V区通常包含三个互补决定区(“CDR”,每个互补决定区都含有“高度可变环”)和四个骨架区。抗体结合位点(即以显著亲和力结合期望的抗原所需的最小结构单元)因此通常包括三个CDR以及至少三个(优选的是四个)散布在它们之间的骨架区,从而以适当的构形保持和呈现CDR。典型的四链抗体具有由VH结构域和VL结构域共同定义的抗原结合位点。某些抗体(诸如骆驼抗体和鲨鱼抗体,缺乏轻链,且仅依赖于重链形成的结合位点。
术语“可变”是指如下事实:可变结构域的某些部分在抗体当中在序列方面广泛地不同,且用于各特定抗体对于其特定抗原的结合和特异性。然而,可变性并非均匀分布于抗体的整个可变结构域中。其集中在轻链和重链可变结构域中的三个称作高度可变区的片段中。可变结构域中保守性较高的部分称为骨架区(FR)。天然重链和轻链的可变结构域各自包含四个FR,主要采用β-折迭构造,通过三个高度可变区连接,其形成连接β-折迭结构的环并在一些情况下形成β-折迭结构的一部分。各链中的高度可变区通过FR紧密地结合在一起,且与另一链的高度可变区一起,有助于形成抗体的抗原结合位点(参见Kabat等人,Sequences of Proteins of Immunological Interest,第五版,Public Health Service,National Institutes of Health,Bethesda,MD.(1991))。恒定结构域不直接参与抗体与抗原的结合,而是呈现多种效应子功能,例如抗体参与抗体依赖性细胞毒性作用(ADCC)。
本文所用的术语“高度可变区”是指抗体中负责抗原结合的氨基酸残基。高度可变区包含来自“互补决定区”或“CDR”的氨基酸残基(例如约为VL中的残基24-34(L1)、50-56(L2)和89-97(L3)以及约为VH的31-35B(H1)、50-65(H2)和95-102(H3);Kabat等人,Sequences of Proteins ofImmunological Interest,第5版,Public Health Service,国立卫生研究院,Bethesda,Md.(1991))和/或来自“高度可变环”的那些残基(例如VL中的残基26-32(L1)、50-52(L2)和91-96(L3)以及VH中的26-32(H1)、52A-55(H2)和96-101(H3);Chothia和Lesk J.Mol.Biol.196:901-917(1987))。
“骨架”或“FR”残基是除如本文所定义高度可变区残基外的那些可变结构域残基。
抗体或半抗体上下文中的“铰链区”通常定义为从人IgG1的Glu216延伸到Pro230(Burton,Molec.Immunol.22:161-206(1985))。通过将形成重链间S-S键的第一个和最后一个半胱胺酸残基放置在相同位置,可以将其他IgG同型的铰链区与IgG1序列对齐。
Fc区的“下部铰链区”通常定义为紧接在铰链区C末端的残基延伸,即,Fc区的残基233至239。在本申请之前,FcγR结合通常归因于IgG Fc区的下部铰链区中的氨基酸残基。
人IgG Fc区的“CH2结构域”通常从IgG的约231位残基延伸至约340位。CH2结构域的独特之处在于其没有与另一结构域紧密配对。而是,两个N-连接的分支碳水化合物链插入完整的天然IgG分子的两个CH2结构域之间。经推测,碳水化合物可提供该结构域-结构域配对的替代物,并有助于稳定CH2结构域。Burton,Molec.Immunol.22:161-206(1985)。
“CH3结构域”包含Fc区中CH2结构域的C末端残基的延伸(即从IgG的约氨基酸残基341到约氨基酸残基447)。
木瓜蛋白酶消化的抗体产生两个相同的抗原结合片段,称为“Fab”片段,和一个残留的“Fc”片段,该名称反映了容易结晶的能力。Fab片段由完整的L链以及H链的可变区结构域(VH)和一个重链的第一恒定结构域(CH1)组成。胃蛋白酶对抗体的处理产生单一大的F(ab')2片段,该片段大致对应于两个具有二价抗原结合活性并且仍能够交联抗原的双硫键连接的Fab片段。Fab'片段与Fab片段的不同之处在于,在CH1结构域的羧基末端具有额外的少数残基,其包括来自抗体铰链区的一个或多个半胱胺酸。Fab'-SH是指恒定结构域的半胱胺酸残基带有一个游离硫醇基的Fab'。F(ab')2抗体片段最初以其间具有铰链半胱胺酸的Fab’片段对形式产生。抗体片段的其他化学耦联也是已知的。
“Fv”为包含完整抗原识别与抗原结合位点的最小抗体片段。该区由一个重链和一个轻链可变结构域的二聚体紧密、非共价缔合而成。在此构造中,各可变结构域的三个N末端高度可变区交互作用以界定VH-VL二聚体表面上的抗原结合位点。六个高度可变区共同地赋予抗体以抗原结合特异性。然而,即使单个可变结构域(或仅包含对抗原具有特异性的三个N末端高度可变区的Fv的一半)也具有识别和结合抗原的能力,尽管其亲和力低于整个结合位点。
Fab片段也含有轻链的恒定结构域和重链的第一恒定结构域(CH1)。Fab'片段与Fab片段不同之处在于,在重链CH1结构域的羧基端添加几个残基,包括来自抗体枢纽区的一个或多个半胱胺酸。Fab'-SH是指恒定结构域的半胱胺酸残基带有至少一个游离硫醇基的Fab'。F(ab')2抗体片段最初作为成对Fab'片段产生,其具有铰链半胱胺酸。抗体片段的其他化学耦联也是已知的。
来自任何脊椎动物物种的抗体(免疫球蛋白)的“轻链”可基于其恒定结构域的氨基酸序列而分配至称为kappa(κ)和lambda(λ)的两种明显不同类型中的一者。
取决于重链恒定结构域的氨基酸序列,抗体可归类为不同种类。存在以下五大类完整抗体:IgA、IgD、IgE、IgG和IgM,且这些种类中的若干者可进一步分成子类(同型),例如IgG1、IgG2、IgG3、IgG4、IgA和IgA2。对应于不同种类的抗体的重链恒定结构域分别称为α、δ、ε、γ和μ。不同种类的免疫球蛋白的亚单元结构和三维构造已众所周知。
如本文所用的术语“半抗体”是指单价抗原结合多肽。在某些实施例中,半抗体包含VH/VL单元和任选地选用的至少一部分免疫球蛋白恒定结构域。在某些实施例中,半抗体包含与一个免疫球蛋白轻链缔合的一个免疫球蛋白重链,或其抗原结合片段。在某些实施例中,半抗体为单特异性的,即结合单个抗原或抗原决定基。本领域技术人员将容易理解,半抗体可具有由单个可变结构域(例如,源自骆驼科)组成的抗原结合结构域。
术语“VH/VL单元”是指抗体的抗原结合区,其包含至少一个VH HVR和至少一个VLHVR。在某些实施例中,VH/VL单元包含至少一个、至少两个或所有三个VH HVR以及至少一个、至少两个或所有三个VL HVR。在某些实施例中,VH/VL单元进一步包含至少一部分骨架区(FR)。在一些实施例中,VH/VL单元包含三个VH HVR和三个VL HVR。在一些此类实施例中,VH/VL单元包含至少一个、至少两个、至少三个或所有四个VH FR以及至少一个、至少两个、至少三个或所有四个VL FR。
术语“多特异性抗体”用于最广泛的意义并且具体涵盖包含具有多抗原决定基特异性的抗原结合结构域的抗体(即,能够与一种生物分子上的两个或更多个不同抗原决定基特异性结合或能够与两种或更多种不同生物分子上的抗原决定基特异性结合)。在一些实施例中,多特异性抗体(诸如双特异性抗体)的抗原结合结构域包含两个VH/VL单元,其中第一VH/VL单元与第一抗原决定基特异性结合,且第二VH/VL单元与第二抗原决定基特异性结合,其中每个VH/VL单元包含重链可变结构域(VH)和轻链可变结构域(VL)。此类多特异性抗体包括但不限于全长抗体、具有两个或更多个VL和VH结构域的抗体。进一步包含重链恒定区的至少一部分和/或轻链恒定区的至少一部分的VH/VL单元也可称为“半抗体”。在一些实施例中,半抗体包含单个重链可变区的至少一部分和单个轻链可变区的至少一部分。在一些此类实施例中,包含两个半抗体并结合两个抗原的双特异性抗体包含结合第一抗原或第一抗原决定基但不结合第二抗原或第二抗原决定基的第一半抗体以及结合第二抗原或第二抗原决定基但不结合第一抗原或第一抗原决定基的第二半抗体。在一些实施例中,半抗体包含足够部分的重链可变区以允许与第二半抗体形成分子内双硫键。在一些实施例中,半抗体包含杵突变或臼突变,例如以允许与包含互补臼突变或杵突变的第二半抗体发生异二聚化。杵突变和臼突变如下文所进一步讨论。
“双特异性抗体”为包含能够特异性地结合一种生物分子上的两个不同抗原决定基或能够特异性地结合两种不同生物分子上的抗原决定基的抗原结合结构域的多特异性抗体。双特异性抗体在本文中也可称为具有“双重特异性”或为“双特异性的”。除非另有说明,双特异性抗体所结合的抗原在双特异性抗体名称中的排列次序为任意的。在一些实施例中,双特异性抗体包含两个半抗体,其中每个半抗体包含单个重链可变区和单个轻链可变区,并且其中第一半抗体结合第一抗原而不结合第二抗原,并且第二半抗体结合第二抗原而不是第一抗原。
如本文中所使用之术语“杵臼(knob-into-hole)”或“KiH”技术是指通过将突起(杵(knob))导入一个多肽并将腔体(臼(hole))在其交互作用的界面处引入其他多肽,在体外或体内指导两个多肽的配对在一起的技术。例如,KiH已被导入抗体的Fc:Fc结合界面、CL:CH1界面或VH/VL界面中(例如,参见,US2011/0287009、US2007/0178552、WO 96/027011、WO 98/050431和Zhu等人,1997,Protein Science 6:781-788)。在一些实施例中,在多特异性抗体的制造中,KiH驱动两个不同重链配对在一起。例如,在其Fc区中具有KiH的多特异性抗体可进一步包含与各Fc区连接的单个可变结构域,或进一步包含与相似或不同轻链可变结构域配对的不同重链可变结构域。KiH技术也可用于将两个不同的受体胞外结构域或包含不同目标识别序列的任何其他多肽序列(例如,包括亲和体、肽体、和其他Fc融合体)配对在一起。
如本文所使用的术语“杵突变”是指在多肽与另一多肽交互作用的界面处将突起(杵)引入该多肽的突变。在一些实施例中,另一多肽具有臼突变(参见,例如,US 5,731,168、US 5,807,706、US 5,821,333、US 7,695,936、US 8,216,805,其各自通过引用整体并入本文)。
如本文所使用的术语“臼突变”是指在多肽与另一多肽交互作用的界面处将腔体(臼)引入该多肽的突变。在一些实施例中,另一多肽具有杵突变(参见,例如,US 5,731,168、US 5,807,706、US 5,821,333、US 7,695,936、US 8,216,805,其各自通过引用整体并入本文)。
如本文所用的术语“单株抗体”是指获自基本上同源抗体的群体的抗体,即,该群体中所包含的个别抗体为相同的和/或结合同一抗原决定基,但不包括可产生于单株抗体至产生期间的可能的变异体,此类变异体一般以少量存在。与通常包括针对不同决定体(抗原决定基)的不同抗体的多株抗体制剂相反,每个单株抗体是针对于抗原上的单一决定体。除特异性以外,单株抗体的优势在于它们不受其他免疫球蛋白污染。修饰词“单株”表示抗体的特征获自基本上同源的抗体群体,并且不应解释为需要通过任何特定方法生产该抗体。例如,根据本文所提供的方法使用的单株抗体可通过Kohler等人率先在Nature,256:495(1975)所描述的杂交瘤方法来制备,或可通过重组DNA方法(参见例如,美国专利号4,816,567)来制备。也可使用(例如)以下文献中所述的技术从噬菌体抗体文库中分离“单株抗体”:Clackson等人Nature 352:624-628(1991)和Marks等人J.Mol.Biol.222:581-597(1991)。
本文的单株抗体具体包括“嵌合”抗体(免疫球蛋白),其中,重链和/或轻链的一部分与源自特定物种或属于特定抗体类别或亚型的抗体中的对应序列相同或同源,而链的其余部分与源自另一物种或属于另一抗体类别或亚型的抗体以及此类抗体的片段中的对应序列相同或同源,只要它们展现出期望的生物学活性即可(美国专利号4,816,567;Morrison等人,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984))。本文的目标嵌合抗体包括“灵长类化”抗体,这些抗体包含衍生自非人灵长类动物(例如,旧大陆猴,诸如狒狒、猕猴或食蟹猴)的可变结构域抗原结合序列和人恒定区序列(美国专利号5,693,780)。
非人类(例如鼠类)抗体的“人类化”形式为含有衍生自非人类免疫球蛋白的最小序列的嵌合抗体。大部分人类化抗体为人类免疫球蛋白(接受者抗体),其中来自接受者的超变区的残基由非人类物种(提供者抗体)(例如小鼠、大鼠、兔或非人类灵长类动物)的超变区中具有期望特异性、亲和力和能力的残基代替。在一些情况下,人类免疫球蛋白的骨架区(FR)残基被相应的非人类残基取代。此外,人源化抗体可包含不存在于受体抗体或供体抗体中的残基。这些修饰是进行以进一步改善抗体效能。通常,人源化抗体将包括基本上所有至少一个(且通常两个)可变结构域,其中,所有或基本上所有高度变异环对应于非人类免疫球蛋白的高度变异环,并且所有或基本上所有FR是人免疫球蛋白序列的FR,除如上所述的FR取代基外。人源化抗体也任选地将包含免疫球蛋白恒定区的至少一部分,通常是人类免疫球蛋白的恒定区。关于其他细节,参见Jones等人,Nature 321:522-525,1986;Riechmann等人,Nature332:323-329,1988;和Presta,Curr.Op.Struct.Biol.2:593-596,1992。
在某些实施例中,双特异性抗体选自由以下项组成的双特异性抗体的组:
结构域交换1+1双特异性抗体(CrossMab)
(包含一对第一轻链和第一重链以及一对第二轻链和第二重链的双特异性全长IgG抗体,该一对第一轻链和第一重链包含第一Fab片段,该一对第二轻链和第二重链包含第二Fab片段,其中在第一Fab片段中
a)仅CH1和CL结构域被彼此替换(即,第一Fab片段的轻链包含VL和CH1结构域,并且第一Fab片段的重链包含VH和CL结构域);b)仅VH和VL结构域被彼此替换(即,第一Fab片段的轻链包含VH和CL结构域,并且第一Fab片段的重链包含VL和CH1结构域);或
c)CH1和CL结构域以及VH和VL结构域被彼此替换(即,第一Fab片段的轻链包含VH和CH1结构域,并且第一Fab片段的重链包含VL和CL结构域);
其中,第二Fab片段包含包含VL和CL结构域的轻链,以及包含VH和CH1结构域的重链;
其中第一重链和第二重链都包含CH3结构域,其中两个CH3结构域通过各自的氨基酸取代基以互补方式工程化,以支持第一重链和第二重链的异二聚化,(在一个优选的实施例中,一个CH3结构域包含杵突变,并且相应的另一个CH3结构域包含臼突变);
C末端融合2+1双特异性抗体(2+1C格式)
(双特异性全长IgG抗体,其包含
a)一种全长抗体,其包含两对,每一对包含一全长抗体轻链和一全长抗体重链,其中每一对全长重链和全长轻链所形成的结合位点与第一抗原特异性结合;以及
b)一种另外的结合结构域,例如受体配体,其中另外的结合结构域与全长抗体的一条重链的C末端融合;
N末端Fab结构域插入2+1双特异性抗体(2+1N格式;TCB)
(双特异性全长抗体,其具有另外的重链N末端结合位点和结构域交换,其包含
-第一和第二Fab片段,其中第一和第二Fab片段的每个结合位点都与第一抗原特异性结合,
-第三Fab片段,其中第三Fab片段的结合位点与第一抗原特异性结合,并且其中第三Fab片段包含结构域交叉,使得可变轻链结构域(VL)与可变重链结构域(VH)彼此替换,以及
-Fc区包含第一Fc区结构域多肽和第二Fc区结构域多肽,
其中,第一和第二Fab片段各自包含重链片段和全长轻链,
其中,第一Fab片段的重链片段的C末端与第一Fc区结构域多肽的N末端融合,
其中第二Fab片段的重链片段的C末端与第三Fab片段的可变轻链结构域的N末端融合,并且第三Fab片段的CH1的C末端与第二Fc区结构域多肽的N末端融合)。
如本文所用,术语“结构域交叉”表示,在一对抗体重链VH-CH1片段及其相应同源抗体轻链中,即,在抗体Fab(抗原结合片段)中,该结构域序列衍生自天然抗体中的序列,其中至少一个重链结构域被其相应轻链结构域取代,反之亦然。存在三种一般类型的结构域交叉,(i)CH1结构域与CL结构域的交叉,其通过轻链中的结构域交叉引起VL-CH1结构域序列且通过重链片段中的结构域交叉引起VH-CL结构域序列(或具有VH-CL-铰链-CH2-CH3结构域序列的全长抗体重链),(ii)VH结构域与VL结构域的交叉,其通过轻链中的结构域交叉引起VH-CL结构域序列且通过重链片段中的结构域交叉引起VL-CH1结构域序列,以及(iii)完全轻链(VL-CL)与完全VH-CH1重链片段的结构域交叉(“Fab交叉”),其通过结构域交叉引起具有VH-CH1结构域序列的轻链且通过结构域交叉引起具有VL-CL结构域序列的重链片段(全部前述结构域序列都以N末端至C末端方向指示)。
如本文所用,关于相应重链结构域与轻链结构域的术语“彼此替换”是指前述的结构域交叉。因此,当CH1结构域和CL结构域“彼此替换”时,其是指项(i)下提及的结构域交叉以及所得重链和轻链结构域序列。据此,当VH和VL结构域“彼此替换”时,其是指项(ii)下提及的结构域交叉;而当CH1结构域和CL结构域“彼此替换”且VH结构域和VL结构域“彼此替换”时,其是指项(iii)下提及的结构域交叉。
在某些实施例中,含有Fc区的多肽或抗体是双特异性抗体或Fc融合蛋白。
在根据本发明的方法中,已示出,仅对于亲水性mab(滞留时间
根据本发明的术语“亲水性抗体”表示在疏水相互作用色谱(HIC)柱上的滞留时间等于或小于利妥昔单抗在相同HIC柱上和相同色谱条件下的HIC滞留时间的抗体。同样,根据本发明的“疏水性抗体”表示在疏水相互作用色谱(HIC)柱上的滞留时间大于利妥昔单抗在相同HIC柱上和相同色谱条件下的HIC滞留时间的抗体。换言之,滞留时间≤滞留时间
材料与方法部分的第10点描述了测定滞留时间的方法。通过该方法所测定的mab的滞留时间在19分钟至41分钟的范围内。表MM-1中提供了mab滞留时间的概述。已发现,利妥昔单抗的滞留时间是定义亲水性和疏水性mab的分界点。
在上述方面的某些实施例和其他实施例中,亲水性抗体为在疏水相互作用色谱(HIC)材料上的滞留时间等于或小于利妥昔单抗(rituximab)(在相同操作条件下在相同的HIC材料上)的滞留时间的抗体。
在上述方面的某些实施例和其他实施例中,疏水相互作用色谱(HIC)材料含有聚醚基团(乙醚基团)作为配体。在上述方面的某些实施例和其他实施例中,疏水相互作用色谱(HIC)材料含有具有以下结构(-(OCH
技术人员了解如何测定用于洗脱给定抗体的缓冲液梯度。在本文的材料与方法部分的第10点(滞留时间和疏水性的测定)中,特别是第10.8点中,描述了合适的洗脱缓冲液梯度。
在本文中可互换使用的术语“装载(loading)密度”或“装载(loading)容量”或“装载(load)密度”或“装载(load)容量”或“装载量”是指与一定体积(例如升)的色谱材料接触的抗体或蛋白质的量(例如克)。在一些实例中,装载密度以g/L表示。
在上述方面的优选实施例和其他实施例中,MM HIC/IEX色谱材料(即包含离子交换和疏水相互作用官能团的混合模式色谱材料)的装载量为10g/L或更高,即,每升色谱材料10g蛋白(10g/L)或更高。在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料的装载量为15g/L或更高。在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料的装载量为20g/L或更高。在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料的装载量为30g/L或更高。在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料的装载量为40g/L或更高。在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料的装载量为50g/L或更高。
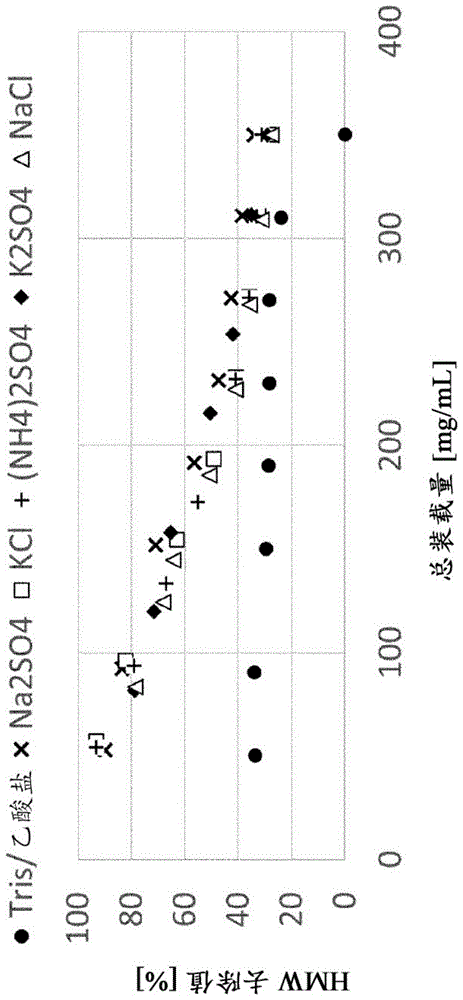
在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料(即包含离子交换和疏水相互作用官能团的混合模式色谱材料)的装载量为(且包括)10g/L至650g/L,即,每升色谱材料10g蛋白(10g/L)至每升色谱材料650g蛋白(650g/L)。在上述方面的某些实施例和上述方面的其他实施例以及其他实施例中,MM HIC/IEX色谱材料的装载量为(且包括)30g/L至600g/L。在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料的装载量为(且包括)50g/L至500g/L。在上述方面的某些实施例和其他实施例中,MM HIC/IEX色谱材料的装载量为(且包括)50g/L至400g/L。在上述方面的优选实施例和其他实施例中,MMHIC/IEX色谱材料的装载量为(且包括)15g/L至350g/L。
还必须注意,除非上下文另有明确规定,否则如本文中和所附权利要求中所使用,单数形式“一”、“一种”和“该”包括多种提及物。因此,例如,提及“一种盐”包括多种此类盐,例如一种到三种,或一种到两种。同样,术语“一”(或“一种”)、“一个或多个”和“至少一个”在本文中可互换使用。
术语“约”表示其后的值不是精确值,而是值的+/-10%、或值的+/-5%、或值的+/-2%、或值的+/-1%的范围的中心点。如果该值是以百分比给出的相对值,则术语“约”也表示其后的值不是精确值,而是值的+/-10%、或值的+/-5%、或值的+/-2%、或值的+/-1%的范围的中心点,其中范围的上限不能够超过值100%。
术语“细胞”或“宿主细胞”是指核酸(编码异源多肽)能够被转染或被转染到其中的细胞。术语“细胞”包括原核细胞和真核细胞两者,该原核细胞用于表达核酸和产生编码的多肽,包括增殖质粒,并且该真核细胞用于表达核酸和产生编码的多肽。在一个实施例中,该真核细胞是哺乳动物细胞。在一个实施例中,哺乳动物细胞是CHO细胞,任选地选用的CHO K1细胞(ATCC CCL-61或DSMACC 110)、或CHO DG44细胞(也称为CHO-DHFR[-],DSMACC126)、或CHO XL99细胞(CHO-T细胞(参见例如Morgan,D.等人,Biochemistry 26(1987)2959-2963))、或CHO-S细胞、或Super-CHO细胞(Pak、S.C.O.,等人Cytotechnology 22(1996)139-146)。如果这些细胞不适应在无血清培养基或悬浮液中生长,则将在用于当前方法中之前进行适应。如本文所用,表述“细胞”包括受试者细胞及其后代。因此,词语“转化子”和“转化的细胞”包括原代受试者细胞和从其衍生的培养物,而不考虑转移或继代培养的次数。还应理解的是,由于蓄意的突变或无意的突变,所有子代的DNA含量可能并不完全相同。包括与在最初转化的细胞中筛选出具有相同功能或生物活性的变异体子代。
术语“Fc区”表示免疫球蛋白的不直接参与与免疫球蛋白的结合配偶体的结合,但表现出各种效应子功能的一部分。根据重链恒定区的氨基酸序列,免疫球蛋白分为以下类别:IgA、IgD、IgE、IgG和IgM。其中一些类别进一步分为亚类(同种),即IgG1、IgG2、IgG3和IgG4中的IgG,或IgA1和IgA2中的IgA。依据免疫球蛋白所属的类别,免疫球蛋白的重链恒定区分别称为α(IgA)、δ(IgD)、ε(IgE)、γ(IgG)和μ(IgM)。
本文中所用的术语“Fc区”,用于定义包含至少一部分恒定区的免疫球蛋白重链的C末端区片段。该术语包括天然序列Fc区和变异Fc区。在一个实施例中,人IgG重链Fc区Cys226或Pro230延伸至重链的羧基端。然而,Fc区的C末端赖氨酸(Lys447)或甘氨酸-赖氨酸二肽(Gly446-Lys447)分别可能存在也可能不存在。依据Kabat欧盟指数进行编号。
免疫球蛋白的“Fc区”是技术人员众所周知的术语,且由全长免疫球蛋白的木瓜酶切割为基础来定义。
本文所述的抗体总是含有Fc区,因此本文报导的抗体是含有Fc区的多肽或抗体。
术语“(抗体的)恒定区”在本文中用于定义免疫球蛋白重链中不包括可变结构域的部分。
术语“抗体相关高分子量(HMW)杂质”指具有约二聚体(正被生产或纯化的相同期望抗体/靶分子单体的)分子量或更高分子量的杂质。
在上述方面的某些实施例和其他实施例中,抗体相关高分子量(HMW)杂质具有约250kDa或更大的分子量。在上述方面的优选实施例和其他实施例中,抗体相关高分子量(HMW)杂质具有约285kDa或更大的分子量。在某些实施例中,抗体相关高分子量(HMW)杂质具有约300kDa或更大的分子量。在优选实施例中,抗体相关高分子量(HMW)杂质至少为期望抗体/靶分子的二聚体、三聚体或任何多聚体。因此,在某些实施例中,抗体相关高分子量(HMW)杂质是具有约相同抗体的二聚体的分子量或更高分子量的杂质。进一步地,其也可以包括期望抗体/靶分子的片段(如半抗体)。例如,抗体相关高分子量(HMW)杂质为二聚体或三聚体加上靶抗体的片段。
测量HMW杂质的方法在本领域中为已知的并且在例如WO 2011/150110中进行描述。此类方法包括,例如,尺寸排阻色谱、毛细管电泳-十二烷基硫酸钠(CE-SDS)和液相色谱-质谱法(LC-MS)。
HMW杂质可以如实例部分中所述来测定。
术语“病毒杂质”或“病毒杂质含量”是指病毒或病毒颗粒的杂质。出于实际和安全原因,病毒杂质污染利用逆转录病毒样颗粒(RVLP)作为实际病毒/病毒杂质的替代物而进行分析。反过来,RVLP可以通过测定RNA含量(例如,通过定量逆转录酶(RT)PCR)来测定。
在上述方面的优选实施例和其他实施例中
-该方法用于生产抗体组合物,该抗体组合物具有降低的抗体相关高分子量(HMW)杂质含量和/或具有降低的病毒杂质含量,
-将抗体施加到包含抗体、至少一种抗体相关HMW杂质和/或至少一种病毒杂质以及抗离液盐的溶液中的MM HIC/IEX,
-从流通液中回收具有降低的抗体相关HMW杂质含量和/或具有降低的病毒杂质含量的抗体组合物,并且
-从而产生具有降低的抗体相关HMW杂质含量和/或具有降低的病毒杂质含量的抗体组合物。
在上述方面的优选实施例和其他实施例中
-该方法用于生产具有降低的抗体相关高分子量(HMW)杂质含量和具有降低的病毒杂质含量的抗体组合物,
-将抗体施加到包含抗体、至少一种抗体相关HMW杂质和至少一种病毒杂质以及抗离液盐的溶液中的MM HIC/IEX,
-从流通液中回收具有降低的抗体相关HMW杂质含量和具有降低的病毒杂质含量的抗体组合物,并且
-从而产生具有降低的抗体相关HMW杂质含量和具有降低的病毒杂质含量的抗体组合物。
在各方面的优选实施例和其他实施例中
-该方法用于生产具有降低的抗体相关高分子量(HMW)杂质含量的抗体组合物,
-将抗体施加到包含抗体、至少一种抗体相关HMW杂质和抗离液盐的溶液中的MMHIC/IEX,
-从流通液中回收具有降低的抗体相关HMW杂质含量的抗体组合物,并且
-从而产生具有降低的抗体相关HMW杂质含量的抗体组合物。
在各方面的某些实施例和其他实施例中,与在步骤b)中被施加到MM HIC/IEX的溶液相比,抗体相关(HMW)杂质含量降低。在上述方面的优选实施例和其他实施例中,与基本上不含抗离液盐的溶液相比和/或与包含疏水性抗体的溶液相比,抗体相关(HMW)杂质含量降低。
在上述方面的优选实施例和其他实施例中
-该方法用于生产具有降低的病毒杂质含量/病毒杂质的抗体组合物,
-将抗体施加到包含抗体、至少一种病毒杂质和抗离液盐的溶液中的MM HIC/IEX,
-从流通液中回收具有降低的病毒杂质含量/病毒杂质的抗体组合物,并且
-从而产生具有降低的病毒杂质含量/病毒杂质的抗体组合物。
在上述方面的某些实施例和其他实施例中,与在步骤b)中被施加到MM HIC/IEX的溶液相比,抗体病毒杂质含量/病毒杂质降低。
在上述方面的某些实施例和其他实施例中,与基本上不含抗离液盐的溶液相比和/或与包含疏水性抗体的溶液相比,病毒杂质含量/病毒杂质降低。
如本文所用,术语“混合模式色谱”或“混合模式色谱材料”或“MM HIC/IEX”指包含疏水相互作用(HIC)功能/部分和离子交换(IEX)功能/部分的混合模式或多模式(MM)色谱材料(术语“混合模式”和“多模式”可互换使用)。换言之,混合模式色谱材料包含离子交换官能团和疏水相互作用官能团。因此,其在一种色谱材料中结合至少两种功能。MMIEX色谱材料另外可以包括其他功能,例如氢结合交互作用。
在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含阴离子交换官能团或阳离子交换官能团(作为离子交换官能团);除了疏水相互作用官能团之外。在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含阴离子交换官能团(作为离子交换官能团)。然后该材料主要结合阴离子交换(AEX)和疏水相互作用功能(HIC)。在上述方面的优选实施例和其他实施例中,MM HIC/IEX包含强阴离子交换官能团(作为离子交换官能团)(即,其是多峰强阴离子交换色谱材料)。在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含带电氮原子和环结构(作为官能团)。在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含季胺(作为离子交换官能团)。在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含季胺(作为离子交换官能团)和高度交联的琼脂糖(作为基质)。在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含N-芐基-N-甲基乙醇胺(作为官能团)和高度交联的琼脂糖(作为基质)。在上述方面的某些实施例和其他实施例中,MM HIC/IEX为Capto
在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含阳离子交换官能团(作为离子交换官能团)。该材料主要结合阳离子交换(CEX)和疏水相互作用(HIC)功能。在上述方面的优选实施例和其他实施例中,MM HIC/IEX包含弱阳离子交换官能团(作为离子交换官能团)(即,其是多峰弱阳离子交换色谱材料)。在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含弱阳离子交换官能团(作为离子交换官能团)和高度交联的琼脂糖(作为基质)。在上述方面的某些实施例和其他实施例中,MM HIC/IEX包含N-苯甲酰基高半胱(作为离子交换官能团)和高度交联的琼脂糖(作为基质)。在上述方面的一个优选实施例和其他实施例中,MM HIC/IEX为Capto
术语“抗离液盐”(或亲液盐)是指能够使蛋白质构形较不溶于水的化合物。抗离液剂通过干扰由有助于水-水交互作用的稳定性和结构的非共价力介导的分子内交互作用来降低系统的熵。抗离液盐通常会引起水分子有利地交互作用,这也稳定了大分子中的分子间交互作用。抗离液盐可以为离子的和/或非离子的。此类抗离液剂的实例包括但不限于Na
在上述方面的某些实施例和本文报道的其他实施例中,抗离液盐选自由以下项组成的组:氯化物、硫酸盐、柠檬酸盐、碳酸盐、磷酸盐、乙酸盐或氟化物。在一个实施例中,抗离液盐选自由以下项组成的组:氯化物、硫酸盐、柠檬酸盐、磷酸盐或乙酸盐。在一个实施例中,抗离液盐选自由以下项组成的组:氯化物或硫酸盐。在一个实施例中,抗离液盐选自由以下项组成的组:氯化物、硫酸盐、柠檬酸盐、碳酸盐、磷酸盐、乙酸盐或氟化物,其包含钙(Ca)、钠(Na)、铵(NH4)或钾(K)。在上述方面的某些实施例和其他实施例中,抗离液盐为钙盐、钠盐、铵盐或钾盐。
在一个优选实施例中,抗离液盐为钠盐、铵盐或钾盐。在一个实施例中,抗离液盐选自由以下项组成的组:氯化物、硫酸盐、柠檬酸盐、磷酸盐或乙酸盐,其包含钙(Ca)、钠(Na)、铵(NH4)或钾(K)。在一个实施例中,抗离液盐为钙盐、钠盐、铵盐或钾盐。在一个优选实施例中,抗离液盐为钠盐、铵盐或钾盐。在一个实施例中,抗离液盐选自由以下项组成的组:氯化物或硫酸盐,其包含钙(Ca)、钠(Na)、铵(NH4)或钾(K)。在一个实施例中,抗离液盐为钙盐、钠盐、铵盐或钾盐。在一个优选实施例中,抗离液盐为钠盐、铵盐或钾盐。在一个实施例中,抗离液盐选自由以下项组成的组:氯化物或硫酸盐,其包含钠(Na)、铵(NH4)或钾(K)。在一个优选实施例中,抗离液盐为钠盐、铵盐或钾盐。在一个实施例中,抗离液盐选自由以下项组成的组:(NH
在上述方面的某些实施例和其他实施例中,抗离液盐具有范围在1.285至4.183x10E3 dyn*g*cm
本领域技术人员了解如何测定摩尔表面张力增量。可以在如下找到这方面的信息,例如Laurel M.Pegram和M.Thomas Record,Jr.,J.Phys.Chem.B 2007,111,5411-5417以及Jan-Christer Janson;疏水相互作用色谱,第170页,表6.2
术语“流通液”、“流通模式”、“以流通模式操作”或类似表述指进行或操作色谱的方式,使得色谱的条件(例如pH、缓冲液含量和浓度、导电率等)的选择的方式为目标蛋白或抗体不会显著结合色谱材料。相反,目标蛋白或抗体会流过色谱材料。由于基本上不发生结合,因此也不必进行洗脱以从色谱材料中释放目标蛋白或抗体(在结合和洗脱操作模式中也这样)。可能有益的是,在利用包含目标蛋白质或抗体的溶液完全装载(即施加目标蛋白)色谱材料之后,(例如,用平衡缓冲液或类似溶液)进行冲洗色谱材料的附加步骤来回收仍在色谱柱中的残留目标蛋白或抗体。因此,如果色谱材料“以流通模式操作”,则这包括以下步骤:施加待纯化或生产的包含目标抗体/蛋白质的溶液的步骤;使目标抗体/蛋白质流过色谱材料(从而通过将目标抗体/蛋白质与杂质分离来纯化目标抗体/蛋白质);以及在流通液(分数)中回收目标抗体/蛋白质。任选地可以进行冲洗步骤。
技术人员了解必须如何选择色谱条件才能在流通模式下操作。例如,为了实现流通液条件,技术人员理解必须以如下方式选择pH:根据分子的pI(等电点),目标分子不会显著结合色谱材料。如果pH低于分子的pI,则分子带正电并且不会显著结合具有阴离子交换官能团的混合模式色谱材料。另一方面,如果pH值高于分子的pI,则该分子带负电并且不会显著结合具有阳离子交换官能团的混合模式色谱材料。
技术人员了解色谱条件会受到pH值的影响。如上所述,pH值的选择很大程度上取决于分子的pI和要实现的条件。
在所有方面的一个实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有4.0或更高的pH值。在一个实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有4.5或更高的pH值。在一个实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有5.0或更高的pH值。在一个实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有5.5或更高的pH值。在一个优选实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有6.0或更高的pH值。在一个实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有7.0或更高的pH值。
在上述方面的某些实施例和其他实施例中,包含抗体和(步骤b的)抗离液盐之溶液具有3.5至9.5的pH值。在一个优选实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有4.0至9.0的pH值。在一个实施例中,包含抗体和(步骤b的)抗离液盐之溶液具有5.0至8.5的pH值。在一个优选实施例中,包含抗体和(步骤b的)抗离液盐的溶液具有5.5至8.5的pH值。在一个实施例中,包含抗体和(步骤b的)抗离液盐之溶液具有5.5至8.0的pH值。在一个实施例中,包含抗体和(步骤b的)抗离液盐之溶液具有5.0至8.0的pH值。
技术人员了解色谱条件会受到导电率条件的影响。
在上述方面的某些实施例和其他实施例中,包含抗体和抗离液盐的溶液具有0.5mS/cm或更高的导电率。在一个优选实施例中,包含抗体和抗离液盐的溶液具有(并且包括)0.5至120mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)0.5至100mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)0.5至80mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)0.5至60mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)0.5至50mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)0.5至30mS/cm的导电率。在一个优选实施例中,包含抗体和抗离液盐的溶液具有(并且包括)4至25mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)10至20mS/cm的导电率。特别关于病毒杂质的去除,在一个优选实施例中,包含抗体和抗离液盐的溶液具有(并且包括)5至25mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)8至22mS/cm的导电率。在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)10至20mS/cm的导电率。
在上述方面的某些实施例和其他实施例中,在包含抗体和抗离液盐的溶液中,该抗离液盐具有5mM或更高的抗离液盐摩尔浓度。在一个优选实施例中,在包含抗体和抗离液盐的溶液中,该抗离液盐具有10mM或更高的抗离液盐摩尔浓度。在一个实施例中,在包含抗体和抗离液盐的溶液中,该抗离液盐具有20mM或更高的抗离液盐摩尔浓度。在一个实施例中,在包含抗体和抗离液盐的溶液中,该抗离液盐的抗离液盐摩尔浓度为(并且包括)5mM至1000mM。在一个优选实施例中,在包含抗体和抗离液盐的溶液中,抗离液盐的抗离液盐摩尔浓度为(并且包括)10mM至900mM。在一个实施例中,在包含抗体和抗离液盐的溶液中,该抗离液盐具有15mM至850mM的抗离液盐摩尔浓度。特别关于病毒杂质的去除,在一个实施例中,包含抗体和抗离液盐的溶液具有(并且包括)50mM至400mM的抗离液盐摩尔浓度。在一个实施例中,包含抗体和抗离液盐的溶液的抗离液盐摩尔浓度为(并且包括)50mM至300mM。在一个实施例中,包含抗体和抗离液盐的溶液的抗离液盐摩尔浓度为(并且包括)50mM至250mM。
应当理解,抗离液盐可以添加到装载到MM HIC/IEX上的溶液中并且/或者其可以存在于来自在MM HIC/IEX之前进行的方法步骤的装载到MM HIC/IEX上的溶液中。例如,抗离液盐可能在早期色谱步骤中已存在于溶液中。
提供以下实例和图式以帮助理解本发明,但本发明的真实范围在所附权利要求中阐明。应当理解的是,在不脱离本发明的精神的前提下,可以对所提出的步骤进行修改。
附图说明
图1与含有抗离液盐Na
图2与含有抗离液盐Na
图3与含有抗离液盐Na
图4与含有抗离液盐Na
图5与含有抗离液盐Na
图6与含有抗离液盐Na
图7与含有抗离液盐Na
图8A对于1.5M Tris/乙酸盐、pH为8、导电率为20mS/cm的装载条件,以及70mMTris/乙酸盐、100mM(NH
图8B对于1.5M Tris/乙酸盐、pH为8、导电率为20mS/cm的装载条件,以及70mMTris/乙酸盐、100mM(NH
图9A对于1.5M Tris/乙酸盐、pH为8、导电率为20mS/cm的装载条件,以及70mMTris/乙酸盐、100mM(NH
图9B对于1.5M Tris/乙酸盐、pH为8、导电率为20mS/cm的装载条件,以及70mMTris/乙酸盐、100mM(NH
图10与含有抗离液盐Na
图11与含有抗离液盐Na
图12与含有抗离液盐Na
图13与含有抗离液盐Na
图14与含有抗离液盐Na
图15与含有抗离液盐Na
图16与含有抗离液盐Na
图17A与含有抗离液盐Na
图17B与含有抗离液盐Na
图18A与含有抗离液盐Na
图18B与含有抗离液盐Na
图19在包含70mM Tris/乙酸盐、pH 8、不同摩尔浓度的抗离液盐Na
图20在包含70mM Tris/乙酸盐、pH 8、不同摩尔浓度的抗离液盐NaCl的装载条件下,在MMAEX Capto
图21在包含70mM Tris/乙酸盐、pH 8、不同摩尔浓度的抗离液盐(NH
图22在包含70mM Tris/乙酸盐、pH 8、不同摩尔浓度的抗离液盐KCl的装载条件下,在MMAEX Capto
图23在包含70mM Tris/乙酸盐、pH 8、不同摩尔浓度的抗离液盐K
图24A在pH 5.5至pH 8.0以及150g
图24B在pH 5.5至pH 8.0以及150g
图24C在pH 5.5至pH 8.0以及150g
图25A在pH 5.5至pH 8.0以及150g
图25B在pH 5.5至pH 8.0以及150g
图25C在pH 5.5至pH 8.0以及150g
图26A在pH 5.5至pH 8.0以及150g
图26B在pH 5.5至pH 8.0以及150g
图26C在pH 5.5至pH 8.0以及150g
图27A在pH 5.5至pH 8.0以及150g
图27B在pH 5.5至pH 8.0以及150g
图27C在pH 5.5至pH 8.0以及150g
图28A在pH 4.0至pH 9.0以及150g
图28B在pH 4.0至pH 9.0以及150g
图29A在pH 5.5至pH 8.0以及150g
图29B在pH 5.5至pH 8.0以及150g
图29C在pH 5.5至pH 8.0以及150g
图30A在pH 5.5至pH 8.0以及150g
图30B在pH 5.5至pH 8.0以及150g
图30C在pH 5.5至pH 8.0以及150g
图31A在pH 5.5至pH 8.0以及150g
图31B在pH 5.5至pH 8.0以及150g
图31C在pH 5.5至pH 8.0以及150g
图32A在pH 5.5至pH 8.0以及150g
图32B在pH 5.5至pH 8.0以及150g
图32C在pH 5.5至pH 8.0以及150g
图33A在pH 5.5至pH 8.0以及150g
图33B在pH 5.5至pH 8.0以及150g
图34A在pH 4.0至pH 9.0以及150g
图34B在pH 4.0至pH 9.0以及150g
图35A在pH 4.0至pH 9.0以及150g
图35B在pH 4.0至pH 9.0以及150g
图36A在pH 4.0至pH 9.0以及75g
图36B在pH 4.0至pH 9.0以及75g
图37在pH 8和9mS/cm的导电率下,在两种装载含有不同摩尔浓度的Na
图38在包含70mM Tris/乙酸盐、pH 8、不同摩尔浓度的抗离液盐Na
图39在包含70mM Tris/乙酸盐、pH 7、不同摩尔浓度的抗离液盐Na
图40在包含70mM Tris/乙酸盐、pH 8、不同摩尔浓度的抗离液盐Na
图41A在pH 5.0至pH 8.0以及150g
图41B在pH 5.0至pH 8.0以及150g
图41C在pH 5.0至pH 8.0以及150g
图41D在pH 5.0至pH 8.0以及150g
图42A在pH 5.0至pH 8.0以及150g
图42B在pH 5.0至pH 8.0以及150g
图42C在pH 5.0至pH 8.0以及150g
图42D在pH 5.0至pH 8.0以及150g
图43A在pH 5.0至pH 8.0以及150g
图43B在pH 5.0至pH 8.0以及150g
图43C在pH 5.0至pH 8.0以及150g
图43D在pH 5.0至pH 8.0以及150g
图44A在pH 5.0至pH 8.0以及150g
图44B在pH 5.0至pH 8.0以及150g
图44C在pH 5.0至pH 8.0以及150g
图44D在pH 5.0至pH 8.0以及150g
实验部分
材料与方法
1.蛋白质
本文使用的分子是在中国仓鼠卵巢细胞中产生的人源化IgG1单株抗体(mab)。用于装载混合模式色谱柱的起始材料是亲和色谱柱洗脱液(表示为“亲和柱池”)。这些分子涵盖标准的IgG样mab和复杂抗体形式,例如双特异性CrossMab形式、含有结合配体的mab(2+1C形式)和T细胞结合mab(2+1N形式;TCB)。分子的pI在8.0至9.4的范围内。
对于RVLP去除研究,用于装载混合模式色谱柱的起始材料是第二柱色谱洗脱液(即亲和色谱和随后的第二次色谱运行后的洗脱液;表示为“第二柱池”)。例如,可以在阳离子交换色谱材料(对于mab9也是如此)、阴离子交换色谱材料或混合模式色谱材料(诸如混合模式阴离子交换色谱材料,对于mab1、mab2或mab7也是如此)上进行第二次色谱运行。
测定滞留时间的方法在下文材料与方法项10中进行了描述。以该方法所测定的mab的滞留时间在19分钟至41分钟的范围内。表1中提供了mab滞留时间的概述。已发现,利妥昔单抗的滞留时间是定义亲水性和疏水性mab的分界点。滞留时间≤滞留时间
表MM-1:Mab和滞留时间
2.化学品
以下化学品是从下面列出的制造商购买的,并依制造商所提供的方式使用:K
默克公司:K
安格斯化学有限公司:三(羟甲基)-氨基甲烷
西格玛奥德里奇公司和默克公司:硫酸铵
赛默飞世尔公司:硫酸钾
3.Robocolumns(RC)
Robocolumns
-Capto
4.色谱树脂
本文使用了以下色谱树脂:
-Capto
-Capto
-Nuvia aPrime 4A(美国伯乐生命医学产品公司)
-Q Sepharose FF(思拓凡公司(前身为GE Healthcare))
-Phenyl Sepharose 6FF(high sub)(思拓凡公司(前身为GE Healthcare))
-Capto
5.机器人实验室器皿
-滤板:PALL;AcroPrep Advance 96Well,1mL,0.45μm,REF 8184
-MTP紫外线板:紫外微量滴定板,赛默飞世尔公司
6.装载制备材料
-离心机:Heraeus Multifige 3S-R;Rotor:75006445
-Amicon Ultra离心式过滤器(Merck Millipore,Ultracel–30K)
-Slide-A-Lyzer透析盒(赛默飞世尔公司,20 000-30 000MWCO)
-Minisart注射器过滤器(赛多利斯公司Minisart High Flow,0.22μm)
7.机器人系统
7.1.Tecan Freedom EVO 150
Tecan Freedom EVO 150(德国克莱尔斯海姆的Tecan Deutschland GmbH)液体处理系统(LHS)用于进行RC运行。EVO 150配备了一个液体处理臂(LiHa)和一个偏心夹持器、用于RC的环礁桥和Infinite M200 NanoQuant读板器(德国克莱尔斯海姆的TecanDeutschland GmbH)。LHS通过软件Freedom EVOware(德国克莱尔斯海姆的TecanDeutschland GmbH)控制。用于控制读板器的软件为Magellan(德国克莱尔斯海姆的TecanDeutschland GmbH)。该平台另外配备了用于存储96孔收集板(微量滴定板)的Te-Stack
7.2.Hamilton Microlab STARlet
Hamilton Microlab STARlet机器人用于制备本文所用的滤板。该机器人配备了8个1000μL移液通道和振荡器。制备50%水中树脂浆(v/v),并将其放置在振荡器上的玻璃小瓶中。LiHa配备了1000μL大口径吸头(切割开)以用于将树脂从振荡器转移到滤板。制备了每孔含有50μL树脂的滤板。储存溶液为水。
7.3.Tecan Freedom EVO 200
Tecan Freedom EVO 200(德国克莱尔斯海姆的Tecan Deutschland GmbH)液体处理系统用于制备本文所用的装载板和缓冲板并进行运行。Tecan Freedom EVO 200配备了一个液体处理臂(LiHa)、一个偏心夹持器、Te-Shake
8.蛋白纯度测定
使用HPLC系统(Thermo Fisher)通过尺寸排阻高效液相色谱(SE-HPLC)来测定单体含量和高分子量物质方面的蛋白纯度。在TSK-Gel G3000SWXL(7.8x 300mm;5μm)色谱柱(TOSOH Bioscience,P/N 08541)上使用0.2MK
使用以下条件:
波长:280nm
等度的:30分钟
柱温度:25℃
样品温度:10℃
施加量:150μg蛋白质
9.蛋白浓度测定
9.1.使用比色皿进行测定
使用Spectramax Plus(德国慕尼黑的Molecular Devices)通过紫外光谱法来测定蛋白浓度。在比色皿中进行测量。在水中稀释蛋白样品。依据源自朗伯-比尔定律(Lambert-Beer law)的以下等式1确定浓度:
(A
吸光度、蛋白浓度[mg/ml]、ε消光系数[ml/(mg*cm)]、路径长度[cm]。
9.2.使用微孔板进行测定
使用Infinite读板器(德国克莱尔斯海姆的Tecan Deutschland GmbH)通过紫外光谱法来测定蛋白浓度。在微孔板中进行测量。在水中稀释蛋白样品。依据等式(1)确定浓度。
使用以下公式2计算路径长度d:
A
10.滞留时间和疏水性的测定
10.1.设备
-具有集成数据采集系统的HPLC装置;Dionex(现在为Thermo FisherScientific)
-0.2μm膜过滤器;例如Pall Life Sciences
-Tosoh Bioscience,
10.2.工作溶液:
-洗脱液A:包含1.5M(NH
-洗脱液B:25mM磷酸钠缓冲液,pH调整至7.0
10.3.疏水相互作用色谱(HIC)标准品
对于标准品制备,利妥昔单抗用合适的稀释缓冲液稀释至1mg/ml。注入20μl(=20μg)的HIC标准品。利妥昔单抗的尖峰将在接近32分钟的运行时间出现,即具有接近32分钟的滞留时间。
10.4.样品
将样品稀释至1mg/ml的浓度。如果样品的浓度已达到1mg/ml,则无需稀释。注入20μl(=20μg)的1mg/ml溶液。
10.5.空白试样
注入20μl的稀释缓冲液。
10.6.新柱的调适化
在超纯水中提供柱。在第一次运行之前,按如下方式准备新柱:
1)在环境温度下将柱转移至洗脱液B:在最少40分钟内,流速从0.0ml/min缓慢增加到0.8ml/min;之后用洗脱液B以0.8ml/min的速度洗涤柱,直到达到稳定的基线(通常在60分钟后)。
2)梯度运行:以20分钟内从0%洗脱液A到100%洗脱液A的线性梯度运行。之后,用洗脱液A洗涤柱,直到达到稳定的基线(通常在60分钟后)。
3)饱和度:以10.8.所述注入和处理可用的标准品多次,直到三个连续的色谱图在尖峰形、高度和面积方面相同;此后使用该柱。
10.7.使用过的柱的调适化
安装后,在环境温度下用超纯水洗涤柱。在最少40分钟内,流速从0.0ml/min缓慢增加到0.8ml/min。此后,用洗脱液A以0.8ml/min的流速洗涤柱,直到达到稳定的基线。此后使用该柱。
10.8.工作条件和顺序规划
在任何顺序1x之前,注入洗脱液A,然后注入20μl的0.1M NaOH,再注入洗脱液A。
使用以下工作条件:
流速:0.8ml/min
梯度:
最大压力:22bar
波长:214nm(另外记录220nm和280nm)
注入蛋白:20μg
柱温度:40℃±2℃
自动进样器中的温度:10℃±4℃
HIC标准品和样品按以下顺序测量:
1. 洗脱液A
2. 20μl的0.1M NaOH
3. 洗脱液A
4. HIC/对照
5. 空白(稀释缓冲液)
6. 样品1至n
7+N空白(稀释缓冲液)
在最大尖峰值处确定滞留时间。
与利妥昔单抗同时或在其之前洗脱的mab(滞留时间较短)被发现是亲水性的(滞留时间
11.RNA浓度测定
为了测定RVLP的去除,将样品中的RNA浓度确定为代表性测量结果值。
经由FLOW PCR设置系统(罗氏公司)进行自动化RNA分析。该系统由3个模块组成:FLOW PCR SETUP仪器(罗氏公司,订单号07101996001)、MagNA Pure 96仪器(罗氏公司,订单号06541089001)和
实例概述
实例部分可以细分为四个部分:
第I部分:mab疏水性对恒定导电率下高分子量(HMW)杂质减少的影响流通液(FT)运行是在机器人系统(Tecan Freedom 150)上通过Capto
表MM-2总结了第I部分的实例。
表MM-2:第I部分-实例
第II部分:抗离液盐摩尔浓度对HMW去除的影响
在第2实验部分中,进行了RC实验和Kp(分配系数)筛选以研究不同摩尔浓度的抗离液盐对HMW减少的影响。在实例4中,将亲水性mab装载到Capto
除了这些RC运行之外,还使用Capto
在实例6中,通过mab2和pH 4至9的筛选范围以及高达约900mM的摩尔浓度来进行Kp筛选。在这些Kp筛选中,比较了两组缓冲液:一种缓冲液含有抗离液盐Na
表MM-3总结了第II部分的实例。
表MM-3:第II部分-实例
第III部分:HMW去除与其他树脂的比较
第3部分由两个实例组成
实例8总结了利用一种亲水性mab和一种疏水性mab对MMAEX、阴离子交换(AEX)树脂、HIC树脂和混合模式阳离子交换(MMCEX)树脂进行的Kp筛选。研究的pH范围是pH 4.0至9.0和5至850mM的盐。对于两种离子混合模式树脂(MMAEX和MMCEX),亲水性mab的流通液样品指示了随着盐摩尔浓度的增加而改善的HMW减少。与此相反,对于疏水性mab,MMAEX树脂上的HMW减少在所研究的盐摩尔浓度范围内是恒定的。对于MMCEX树脂,疏水性mab的HMW减少值并未通过将盐摩尔浓度增加到500mM Na
表MM-4示出了第III部分的实例。
表MM-4:第III部分-实例
第IV部分:扩大
对于第4部分,利用Na
表MM-5示出了第IV部分的实例。
表MM-5:第IV部分-实例
第V部分:去除RVLP(反转录病毒样颗粒)
除了去除产品相关杂质(如HMW)外,还研究了在MM色谱树脂上纯化抗体时使用抗离液盐是否确实也具有去除反转录病毒样颗粒(RVLP)的效果。
在这方面,进行了两次Kp筛选(实例11和实例12)。
Kp筛选:抗离液盐和mab疏水性对RVLP去除的影响
进行了Kp(分配系数)筛选以研究抗离液盐和mab疏水性对RVLP减少的影响。通过定量RT PCR对RNA浓度的量化来测量了(含RNA)RVLP的浓度。在这些Kp筛选中,比较了两组缓冲液:一种缓冲液含有抗离液盐Na
对于实例11,所研究的pH范围为pH 5.0至8.0,摩尔浓度范围为25至400mM Na
仅对照/缓冲液:不包括任何抗离液盐,但具有相同的导电率
装载:独立于成分而装载的溶液
LF:RC的装载分数
总装载体积:施加350g
总装载量:在所有施加的相应装载分数中所施加的抗体量的总和
装载量:用于通过最佳拟合线来计算HMW去除率
HMW值:经过分析确定的流通液分数中的HMW含量
HMW去除值:针对单个装载分数而计算出的HMW去除率
HMW去除率:基于最佳拟合线计算出的HMW去除率
池HMW去除值:针对施加于单个分数中的总装载量而获得的计算出的HMW去除率
单个池装载量:在相应计算出的池HMW去除值的单个分数中装载的理论抗体量
FT:流通液分数
RC:Robocolumn
RC运行:Robocolumn
CV:柱体积
实例
第I部分:mab疏水性对恒定导电率下高分子量(HMW)杂质减少的影响
实例1
通过在pH 8和20mS/cm下的装载进行的Robocolumn
在pH 8和20mS/cm的导电率下,利用4种亲水性和3种疏水性mab进行机器人运行。在运行间,通过添加以下抗离液盐来改变缓冲条件:氯化钠、硫酸钠、硫酸铵、氯化钾和硫酸钾。对于每次运行,平行研究了所有7种mab。
缓冲液
各个平衡缓冲液的pH值和导电率总结在下表X-1.1a中。通过添加缓冲液的相应酸(乙酸)分别调整pH值。将溶液的所有组分混合后测定导电率。缓冲液1.5M Tris/乙酸盐(pH8)系“对照”条件,即不包括任何抗离液盐但具有相同的导电率(“仅缓冲液”)。
表X-1.1a:RC运行的缓冲液条件为pH 8和20mS/cm。
起始材料的浓缩和抗体溶液的缓冲液交换
将抗体溶液(mab)调整至与相应缓冲液相当的pH值和导电率。为了实现这一点,将各个亲和柱洗脱池进行缓冲液交换至相应缓冲液(例如,70mM Tris/乙酸盐,125mM Na
装载
装载的pH值、导电率和抗体浓度总结在下表X-1.1b中。
表X-1.1b:在pH 8和20mS/cm下RC运行的装载pH、导电率和浓度。范围基于包含不同抗体的装载。
对于实例1的所有实验,装载的pH范围在pH 8.0±0.2的范围内。装载的导电率与平衡缓冲液的导电率相差±2.0mS/cm。装载的蛋白浓度在14.5与25.5g/L之间。
在下文中,提供了对示例性RC运行的描述。所有RC运行都进行了类似的操作,除了用于制备装载的缓冲液不同之外(参见上面的表X-1.1a和X-1.1b)。例如,对于使用缓冲液(70mM Tris/乙酸盐,125mM Na
下表X-1.2示出了流通模式下70mM Tris/乙酸盐、125mM Na
表X-1.2:实例1-70mM Tris/乙酸盐、125mM Na
这些装载单独地施加于不同的Capto adhere ImpRes RC。
色谱
在Tecan Freedom Evo 150上进行RC运行。首先用10CV的不含抗体的缓冲液(例如,pH 8下的70mM Tris/乙酸盐、125mM Na
所有RC运行的流速为18CV/hr,其对应停留时间3.3分钟。洗涤之后是RC的再生和储存。
表X-1.3:实例1–示例性色谱步骤。
下表X-1.4总结了装载浓度和体积。
表X-1.4:实例1–在使用表X-1.3的方案的RC运行中使用的装载浓度和体积。
通过Tecan Freedom Evo 150对装载分数的移液以同时完成一次联合RC运行的所有装载的模式进行。因此,施加装载的起点因装载中的抗体浓度而变化。具有较高浓度的装载,例如mab5,引起所需的总装载体积较低(从而进行装载步骤),并引起装载步骤开始较晚。对于每个装载步骤,收集相应的流过分数(FT)。因此,对于每次运行,分别施加、收集和分析不同数量的200μL分数(对于mab8,最多20个分数)。
下表X-1.5示出了在每个装载步骤后增加的总装载量[g/L]。在最多20个连续装载步骤后,每个RC上已施加总装载量350g
表X-1.5a:实例1–使用表X-1.3和X-1.4的方案的运行的基于装载步骤的总装载量[g/L]。
分析
表X-1.5b:所选FT分数的SE-HPLC分析。
表X-1.5c:HMW去除值。
HMW去除值通过以下公式1计算:
HMW去除值%=100–HMW
HMW
HMW
在装载步骤10中计算mab2的HMW去除值的实例:
在装载步骤10中,相应FT分数的测定HMW值为1.66%。装载的HMW值为9.97%。将此应用于公式1
HMW去除值=100–1.66/9.97x 100%=83.35%
得到:mab2的装载分数10的HMW去除值为83.35%。
分析
相对于抗体的总装载量,对HMW值或主尖峰值或HMW去除值绘图。
图1至图7示出了在pH 8.0和导电率为20mS/cm时,用不同的抗离液盐针对所研究的mab的FT分数确定的HMW去除值。x轴对应于总装载量,y轴对应于针对相应的FT分数所确定的HMW去除值。
表X-1.5c中的HMV去除值示出了在相应装载步骤中达成的实际HMW去除,即针对相应的装载分数。然而,池HMW去除值更接近地反映了实际的大规模过程。该池HMW去除值是在单个分数中施加时针对总装载量获得的HMW去除。基于表X-1.5c中数据的对数最佳拟合线,针对单个池装载量150g/L、250g/L、350g/L、450g/L和550g/L计算了池HMW去除值。
下面针对mab2示例性地说明该程序:
图2示出了mab2的每个FT分数的HMW去除值。针对表X-1.1的不同缓冲液所获得的结果显示在该图中。为了计算mab2的单个池装载量的池HMW去除值,首先,确定每种缓冲液的HMW去除的对数最佳拟合线。mab2的这些最佳拟合趋势线的添加如图8A所示。其次,使用两个最佳拟合趋势线方程式,对于5g/L并且在25至550g/L范围内以25g/L为增量的装载量,计算了HMW去除率。
例如,为了计算单个池装载量(例如150g/L)的池HMW去除值,基于装载量≤150g/L时每个计算出的HMW去除值的HMW去除率来计算平均值。对于小装载量(5至50g/L),HMW去除率设定为100%,因为计算结果显示非逻辑HMW去除率>100%。表X-1.6示出了所计算的HMW去除率。
表X-1.6:实例1-HMW去除率和池HMW去除值的计算。
/>
另外,这些计算是针对一种疏水性mab(mab7)进行的。图8B示出了mab7的各个最佳拟合线和方程式。
在图9A和9B中,针对mab2(图9A)和mab7(图9B)示出了单个池装载量的HMW去除率。
实例1总结:
对于亲水性mab(mab1、mab2、mab4、mab5),与在相同导电率下没有抗离液盐的装载相比,当向装载添加抗离液盐时,HMW值减少得更多。这在图1至图4中进行了说明。装载的导电率相当(都约为20mS/cm)。装载中抗离液盐的存在增强了亲水性mab的HMW减少,而装载导电率未改变。
与此相反,对于疏水性mab(mab6、mab7、mab8),含有抗离液盐的装载和不含抗离液盐的装载(参见图5至图7)的HMW值减小相似。对于疏水性mab,与不含抗离液盐的装载相比,添加抗离液盐没有显示出在HMW值减小方面的有利效果。
为了计算FT池的HMW去除率,引入了趋势线。在图8A和8B中,针对mab2(图8A)和mab7(图8B)示出了FT池的HMW去除率。例如,对于mab2,可以看出当装载中存在硫酸铵时,装载量为150g/L的HMW减少从35%增加到89%(参见图9A)。对于550g/L的装载量,在(NH
实例2
通过在pH 6和20mS/cm下的装载进行的Robocolumn
在不存在和存在两种抗离液盐,即Na
图10至图16示出了在pH 6.0和导电率为20mS/cm的情形下,对于含有Na
实例2总结:
对于亲水性mab,当向装载中添加抗离液盐时,与在相同导电率下不含抗离液盐的相同缓冲液中的装载相比,HMW减少显著改善(参见图10至图13)。与此相反,令人惊讶的是,对于含有抗离液盐的装载和不含抗离液盐的装载,疏水性mab的HMW减少是相当的(参见图14至图16)。
实例3
通过在pH 6或8和10mS/cm下的装载进行的Robocolumn
在抗离液盐存在和不存在(即不含)于缓冲液中的情形下,用一种亲水性和一种疏水性mab进行RC运行。在这两种情形下,装载的导电率相同(10mS/cm)。在pH 6以及在pH 8下进行这些实验。RC上装载了高达350g
图17A和图17B示出了对于亲水性mab2(图17A)和对于疏水性mab7(图17B),在pH 6和10mS/cm的导电率时FT分数的HMW去除值。图18示出了在pH 8和导电率为10mS/cm时FT分数的HMW去除值。图18A示出了亲水性mab2的结果,图18B示出了疏水性mab7的结果。
实例3总结:
图17和图18分别示出了在pH 6和pH 8在导电率为10mS/cm时每个FT分数的HMW去除值与mab2和mab7的总装载量相关。可以看出,与不含抗离液盐的对照运行相比,在存在抗离液盐的情形下,包含亲水性mab的装载中的HMW减少在FT分数中增加。对于疏水性mab,在抗离液盐的存在下未观察到HMW减少的增加。
第II部分:抗离液盐摩尔浓度对HMW减少的影响
实例4
通过在pH 8下的mab2进行的Robocolumn
通过含有在pH 8下以及抗离液盐浓度范围为0至500mM的装载的mab2进行RC运行。所使用的RC运行的程序已在示例1中详细概述。使用以下盐:Na
图19至图23示出了对于不同抗离液盐,在pH 8下的mab2的FT分数的HMW值。
实例4总结:
在实例4中,针对具有亲水性mab2的在pH 8下的五种抗离液盐研究了增加的抗离液盐摩尔浓度(和导电率)的影响。使用了以下抗离液盐:硫酸钠(参见图19)、氯化钠(参见图20)、硫酸铵(参见图21)、氯化钾(参见图22)和硫酸钾(参见图23)。相对于总装载量,对每个FT分数的HMW值[%]绘图。通过向包含亲水性mab的装载添加抗离液盐,实现了FT分数中降低的HMW值。对于所有研究的抗离液盐,发现HMW减少有所增加。
对于三种mab(亲水性和疏水性)和四种盐(NH
实例5
Kp筛选(pH 5.5至8.0)
该实例中详细描述了Kp筛选的方法。
Mab溶液的制备
通过Amicon Ultra离心式过滤器浓缩含有抗体的溶液,并通过Slide-A-Lyzer透析盒将进行缓冲液交换至10mM Tris/乙酸盐(pH 6.5)。蛋白浓度范围为67g/L至89g/L。Kp筛选的总装载量为150g/L。装载在0.2μm下过滤并测定蛋白含量(OD 280至320)。
滤板的制备
通过离心机在试管中制备50% Capto
缓冲液的制备
为了制备缓冲板和装载板,使用了以下材料:
-高盐缓冲液;
-低盐缓冲液;
-10mM Tris/乙酸盐,pH 6.5(0.6mS/cm);
-适当浓度的10mM Tris/乙酸盐(pH 6.5)中的蛋白储备溶液;
-剥离缓冲液。
对于Kp筛选,缓冲板和装载板由机器人系统(Tecan Freedom EVO 200)使用高盐缓冲液和低盐缓冲液来制备。通过称入Tris和所需量的盐来制备高盐和低盐储备溶液。然通过乙酸调整pH。
表X-2.1和X-2.2总结了用于制备平衡板和装载板的低盐和高盐缓冲液。
表X-2.1:实例5-Kp筛选的低盐缓冲液
表X-2.2:实例5-Kp筛选的高盐缓冲液
如表X-2.3所示,由机器人对装载板和平衡板进行移液。四种盐的摩尔浓度在10mM至约800mM的范围内。
表X-2.3:实例5-Kp筛选的板布置
浓缩的蛋白储备溶液由机器人移液到装载板中。为了忽略每个孔条件的pH值和导电率的变化,蛋白储备溶液可以在10mM Tris/乙酸盐(pH 6.5)中,并处于高蛋白浓度,以最大限度地减小移液体积。
Kp筛选的执行
Kp筛选的总装载量设定为150g/L,并分为两个装载步骤,每个装载步骤75g/L。
Kp筛选法包括以下步骤:
-去除储存缓冲液;
-平衡1+2:转移300μL平衡缓冲液,在摇床(1100rpm)上孵育5分钟,并离心以去除平衡缓冲液(2,500rpm,600sec);
-装载1+2:转移300μL装载,在摇床(1100rpm)上孵育60分钟,
并离心以在FT板上收集FT(2,500rpm,600sec);
-剥离1+2:转移300μL剥离缓冲液,在摇床(1100rpm)上孵育5分钟,并离心以去除剥离缓冲液(2,500rpm,600sec)。
对FT板进行SE-HPLC分析。
HMW去除率计算如下:
HMW去除率%=100–HMW
HMW
使用Infinite M200读板器测定装载板和FT板的蛋白浓度。
图24至图27示出了FT样品针对三种mab和两种抗离液盐(NH
图24中示出了(NH
实例5总结:
使用pH范围为pH 5.5至8.0和盐摩尔浓度高达800mM的两种亲水性和一种疏水性mab示出了四种盐(两种抗离液盐和两种离液盐)的效果。选择了离液盐(Gua/HCl和尿素)以在疏水相互作用减弱时测定HMW减少。
根据mab的疏水性,看出了HMW减少的差异。对于亲水性mab(mab2和mab4),添加抗离液盐(硫酸铵,图24以及KCl,图25)使HMW减少值提高到70-80%。对于疏水性mab6,在硫酸铵的存在下的HMW减少在70-80%的范围内,并且几乎不受硫酸铵摩尔浓度的影响。利用KCl,疏水性mab6的HMW减少随着KCl摩尔浓度的增加而降低。图24C和图25C示出了:对于疏水性mab6,HMW减少未通过增加抗离液盐的摩尔浓度而得到改善。
Gua/HCl(图26)和尿素(图27)示出了,对于亲水性或疏水性mab两者,没有观察到随着盐摩尔浓度的增加而提高的HMW去除率。
总的来说,在抗离液盐的存在下,亲水性mab的HMW减小得到改善。对于疏水性mab,在抗离液盐的存在下可观察到HMW减少的改善。此外,在离液盐的存在下没有获得改善的HMW减少。
实例6
通过mab2(pH 4-9)进行Kp筛选
对于具有一种亲水性mab(mab2)和两种缓冲系统i)包含(10至850)mM Na
表X-2.4:实例6–Kp筛选的低盐和高盐缓冲液
/>
总装载量为150g/L并且分为两个装载步骤。
缓冲条件:研究了2个缓冲系统,如表X-2.5所示:
-25mM Tris/乙酸盐+(10至850)mM Na
-25至975mM Tris/乙酸盐(pH 4.0至9.0),Tris摩尔浓度:25、100、175、250、350、500、750、975mM
表X-2.5:实例6–Kp筛选的板布置
图28示出了在Na
实例6总结:
实例6示出了在抗离液盐的存在下,含有mab2的装载的HMW减少增加。增加的Na
第III部分:HMW去除与其他树脂/色谱材料的比较
实例7
通过混合模式AEX树脂进行Kp筛选
测定了包含亲水性mab(mab2)和以下混合模式AEX树脂的装载的HMW减少值:Capto
对应实例5执行Kp筛选。
图29至图32示出了三种混合模式树脂和四种盐(两种抗离液,两种离液)的等值线图。
实例7总结:
在该示例中,比较了三种混合模式树脂上的HMW减少值以及阴离子交换和疏水相互作用。生成Capto
一般而言,对于所有盐,Capto
实例8
通过MMAEX、AEX、HIC、MMCEX树脂进行Kp筛选
一种亲水性mab和一种疏水性mab的等值线图是用以下树脂确定:
-混合模式阴离子交换树脂(Capto
-阴离子交换树脂(Q Sepharose FF)(AEX);
-疏水性树脂(Phenyl Sepharose 6FF(high sub))(HIC);
-混合模式阳离子交换树脂(Capto
树脂的总装载量为150g/L,但Capto
对应实例5执行Kp筛选。
对于Q Sepharose FF、Phenyl Sepharose 6FF(high sub)和Capto
表X-3.1:实例8-低盐和高盐缓冲液
研究了以下含Na
-25mM Tris/乙酸盐+(5至850)mM Na
表X-3.2:实例8–Kp筛选的板布置
图33至图36示出了四种树脂的亲水性mab 2(图“A”)和疏水性mab 6(图“B”)的等值线图。图33和图36示出了混合模式树脂Capto
实例8总结:
通过一种亲水性mab(mab2)和一种疏水性mab(mab6)测定了以下树脂的流通液中的HMW减少值:混合模式阴离子交换树脂(Capto
对于AEX树脂Q Sepharose FF,针对两种mab,均未观察到抗离液盐对HMW减少值的影响(图34)。在图35中,示出了树脂Phenyl Sepharose 6FF(high sub)的等值线图。随着Na
与此相反,对于混合模式树脂,亲水性和疏水性mab的HMW减少值不同。在抗离液盐的存在下,MMAEX树脂示出了mab2的增加的HMW减少值(图33A)。对于mab6,HMW减少值在所研究的pH和摩尔浓度范围内相当恒定(图33B)。仅对于亲水性mab,HMW减少根据混合模式阴离子交换树脂上的盐摩尔浓度而增加。图36示出了在Capto
已表明,通过添加抗离液盐,亲水性mab的HMW减少值的增加可归因于离子和疏水相互作用的组合。对于两种离子混合模式树脂,Capto
第IV部分:
实例9
在相同导电率和不同Na
制备了具有导电率相同但Na
装载1和装载2使用mab2的相同亲和色谱池(柱1池)来制备。
装载1:通过1.5M Tris碱基将mab2的柱1池调整至pH 8.0,进行深度过滤,然后使用1M Na
装载2:通过1.5M Tris碱基将mab2的柱1池调整至pH 8.0,进行深度过滤,然后通过乙酸将pH调整至pH 5.6,然后通过1.5MTris将pH重新调整至8.0。此后,通过1M Na
表X-4.1总结了装载调整。
表X-4.1:实例9–装载调整
实例9中使用的缓冲液列于表X-4.2中:
表X-4.2:实例9–缓冲液
Capto
图37示出了Na
实例9总结:
制备了具有相同导电率(9mS/cm)但具有不同摩尔浓度的Na
实例10
在不同Na
通过mab2测定增加盐摩尔浓度(和导电率)的影响。在pH 7和pH 8以及不同Na
色谱条件示出于表X-4.3中:
表X-4.3:实例10-色谱步骤
表X-4.4:实例10-缓冲液
通过1.5 M Tris和1 M Na
表X-4.5:实例10–装载条件
图38示出了在pH 8下每个分数的主尖峰值以及增进的总装载量。随着Na
图39示出了在pH 7下每个分数的主尖峰值以及增进的总装载量。在pH7下的曲线表明,即使Na
池按以下方式进行计算:
使用分数的平均主尖峰值计算池的主尖峰值。洗涤分数(在装载步骤之后)未包括在FT池中。表X-4.6总结了运行条件和主尖峰值。
表X-4.6:实例10–FT池的运行条件和主尖峰值
图40示出了FT池的计算出的主尖峰。通过向装载中添加60mM Na
实例10总结:
已示出了Na
实例11和12
Kp筛选:抗离液盐和mab疏水性对RVLP去除的影响
Kp筛选(pH 5.0至8.0)
该实例中结合RVLP去除率详细描述了Kp筛选的方法。
Mab溶液的制备
通过Amicon Ultra离心式过滤器浓缩含有抗体的溶液(柱2池)并进行缓冲液交换至10mM Tris/乙酸盐(pH 6.5),然后通过Amicon Ultra离心式过滤器进行浓缩。蛋白浓度范围为61g/L至72g/L。Kp筛选的总装载量为150g/L。装载在0.2μm下过滤并测定蛋白含量(OD 280至320)。
滤板的制备
通过离心机在试管中制备50% Capto
缓冲液的制备
为了制备缓冲板和装载板,使用了以下材料:
-高盐缓冲液;
-低盐缓冲液;
-10mM Tris/乙酸盐,pH 6.5(0.6mS/cm);
-适当浓度的10mM Tris/乙酸盐(pH 6.5)中的蛋白储备溶液;-剥离缓冲液。
对于Kp筛选,缓冲板和装载板由机器人系统(Tecan Freedom EVO 200)使用高盐缓冲液和低盐缓冲液来制备。通过称入Tris和所需量的盐来制备高盐和低盐储备溶液。然通过乙酸调整pH。
表X-5.1和X-5.2总结了用于制备实例11的平衡板和装载板的低盐和高盐缓冲液。
表X-5.1:实例11-Kp筛选的低盐缓冲液
表X-5.2:实例11-Kp筛选的高盐缓冲液
表X-5.3和X-5.4总结了用于制备实例12的平衡板和装载板的低盐和高盐缓冲液。
表X-5.3:实例12-Kp筛选的低盐缓冲液
表X-5.4:实例12-Kp筛选的高盐缓冲液
在移取高盐和低盐缓冲液之前,实例11和12的机器人将10μl RVLP储备溶液移到装载板的每个孔中。如表X-5.5所示,由机器人对装载板和平衡板进行移液。对于实例11,硫酸钠的摩尔浓度在25mM至400mM的范围内。
表X-5.5:实例11-Kp筛选的板布置
对于实例12,如表X-5.6所示,由机器人对装载板和平衡板进行移液。对于实例12,Tris的摩尔浓度在25mM至1100mM的范围内。
表X-5.6:实例12-Kp筛选的板布置
对于实例11和12,浓缩的蛋白储备溶液由机器人移液到装载板中。为了忽略每个孔条件的pH值和导电率的变化,蛋白储备溶液可以在10mM Tris/乙酸盐(pH 6.5)中,并处于高蛋白浓度,以最大限度地减小移液体积。
Kp筛选的执行
Kp筛选的总装载量设定为150g/L,并分为两个装载步骤,每个装载步骤75g/L。
Kp筛选法包括以下步骤:
-去除储存缓冲液;
-平衡1+2:转移300μL平衡缓冲液,在摇床(1100rpm)上孵育5分钟,并离心以去除平衡缓冲液(2,500rpm,600sec);
-装载1+2:转移300μL装载,在摇床(1100rpm)上孵育60分钟,并离心以在FT板上收集FT(2,500rpm,600sec);
-剥离1+2:转移300μL剥离缓冲液,在摇床(1100rpm)上孵育5分钟,并离心以去除剥离缓冲液(2,500rpm,600sec)。
对FT板进行RNA分析。
通过RNA浓度对RVLP去除率(RNA对数减少值)进行以下计算:
RNA对数减少值=对数(RNA浓度
RNA浓度
RNA浓度
图41A至图41D示出了四种mab的FT样品的RNA对数减少值以及具有增加的硫酸钠摩尔浓度的抗离液盐Na
图42A至图42D示出了四种mab的FT样品的RNA对数减少值以及具有增加的导电率的抗离液盐Na
图43A至图43D示出了随着Tris摩尔浓度的增加,在不含抗离液盐的Tris/乙酸盐缓冲液中四种mab的FT样品的RNA对数减少值。图43A和图43B示出了亲水性mab1(图43A)和mab2(图43B)的RNA对数减少值。图43C和图43D示出了疏水性mab7(图43C)和mab9(图43D)的RNA对数减少值。
图44A至图44D示出了随着导电率的增加,在不含抗离液盐的Tris/乙酸盐缓冲液中四种mab的FT样品的RNA对数减少值。图44A和图44B示出了亲水性mab1(图44A)和mab2(图44B)的RNA对数减少值。图44C和图44D示出了疏水性mab7(图44C)和mab9(图44D)的RNA对数减少值。
实例11和12总结:
在pH 5.0至8.0的pH范围内,利用两种亲水性和两种疏水性mab示出了mab疏水性和抗离液盐的存在的影响。在实例11(图41和图42)中,研究了盐摩尔浓度高达400mM的抗离液盐,硫酸钠。在实例12(图43和图44)中,使用了具有增加的Tris摩尔浓度和增加的导电率但缺少抗离液盐的Tris/乙酸盐缓冲液。
根据mab的疏水性和抗离液盐的存在,测量了不同的RNA减少值。
对于实例12(不含抗离液盐),所研究的mab仅针对<100mM的低Tris/乙酸盐摩尔浓度(对应于<3mS/cm的导电率)显示出4至5的RNA对数减少值范围,而与mab疏水性无关(亲水性和疏水性mab之间没有显著差异)。对于亲水性mab1和mab2,仅针对<25mM的盐摩尔浓度(导电率<1.5mS/cm)测得对数减少值4至5。
与实例12相反,在Na
- 一种用于抗体纯化的混合模式蛋白吸附膜及制备方法
- 一种利用混合模式层析介质连续分离纯化抗体的方法
