单一分子量聚乙二醇配体化合物、磁性纳米颗粒及其制备方法与应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及化学材料领域,尤其涉及一种单一分子量聚乙二醇配体化合物、磁性纳米颗粒及其制备方法与应用。
技术背景
功能化的纳米材料越来越被认为是有前途和强大的生物医学工具或设备,用于成像、药物输送和癌症治疗等方面,但是很少有纳米材料在临床试验中进行了实验。实验室中的发现与临床应用之间的巨大差距主要是由于我们对纳米材料生物学特性的认识有限,当纳米颗粒被注入在到人体中时,纳米颗粒不可避免地与体液发生相互作用,从而吸附很多生物分子,形成蛋白冠。纳米材料表面形成的“蛋白冠”,赋予了纳米粒子新的生物学特性,它决定了纳米颗粒在生物体内的细胞摄取、免疫反应、生物分布、清除和毒性等生物特性。因此,深入了解纳米颗粒蛋白冠可以有效地促进纳米药物的临床转化。
关于纳米颗粒蛋白冠的研究方法包括体内与体外共孵育的方法。体外共孵育是大多数人采取的方法,但是其与动物体内的真实的动态环境差异较大。体内共孵育后的提取纳米颗粒的方法包括离心法、柱洗脱法、磁分离法,其中离心法会有剪切力的存在改变纳米颗粒蛋白冠的成分,柱洗脱法会因为淋洗剂的冲洗改变蛋白冠的成分,磁分离法可以原位提取纳米颗粒最大程度的保留蛋白冠的原始组成。不同功能化的磁性纳米粒子表面结合的蛋白质会影响纳米药物的生物分布,这是涉及其医疗应用的一个关键问题。各研究表明纳米颗粒的理化特性对血液蛋白的吸附行为至关重要。然而关于蛋白冠对纳米颗粒生物分布的影响,目前还没有明确的共识。因此,还需要开发新的蛋白冠试剂,以便为更好地理解纳米颗粒与蛋白冠的关系,以及提高纳米颗粒靶向目标器官或组织的特异性和效率,提供更精确的指导。
发明内容
有鉴于此,本发明的主要目的在于提供一种单一分子量聚乙二醇配体化合物、磁性纳米颗粒及其制备方法与应用,以期至少部分地解决上述提及的技术问题中的至少之一。
为实现上述目的,本发明的技术方案如下:
根据本发明一个方面的实施例,提供了一种单一分子量聚乙二醇配体化合物,具有如下式(I)~式(III)任一所示的结构:
其中,n为2~400;X为
其中,k为1~50;L
根据本发明另一个方面的实施例,提供了一种磁性纳米颗粒的制备方法,包括:将疏水性的四氧化三铁纳米颗粒分散于有机溶剂中,得到分散液;将如上所述的单一分子量聚乙二醇配体化合物加入所述分散液中,对所述四氧化三铁纳米颗粒进行改性,得到改性后的四氧化三铁纳米颗粒;对所述改性后的四氧化三铁纳米颗粒至少重复一次地进行所述分散和所述改性的操作,得到能够分散于水中的所述磁性纳米颗粒。
根据本发明再一个方面的实施例,提供了一种利用如上所述的制备方法制备得到的磁性纳米颗粒,包括:四氧化三铁纳米粒子,以及包覆于所述四氧化三铁纳米粒子表面的单一分子量聚乙二醇配体化合物。
根据本发明又一个方面的实施例,提供了一种磁性纳米颗粒蛋白冠的原位提取方法,包括:对来自于生物活体的血液样本进行处理,得到血清或血浆的混合液,其中,所述生物活体被注射有如上所述的磁性纳米颗粒,使得所述磁性纳米颗粒与所述血液样本在体内共孵育;对所述混合液进行稀释后,使用磁性细胞分选(Magnet-Activated Cell Sorting,简称MACS)仪器对得到的稀释液中的磁性纳米颗粒进行磁分选,得到结合有蛋白冠的磁性纳米颗粒。
根据本发明的还一个方面的实施例,提供了一种如上所述的磁性纳米颗粒在制备用于提取蛋白冠的试剂盒中的应用。
根据本发明的实施例,本发明的单一分子量聚乙二醇配体化合物通过其上磷酸或苯酚结构可以稳定地结合至四氧化三铁纳米颗粒,单一分子量聚乙二醇片段结构相较于多分散聚乙二醇更有利于实现四氧化三铁纳米颗粒在水中稳定分散,同时,配体化合物末端的功能性基团可实现四氧化三铁纳米颗粒形成不同的蛋白冠,为蛋白冠研究提供更精确的指导。
根据本发明的实施例,本发明在制备磁性纳米颗粒过程中,采用将单一分子量聚乙二醇配体化合物分批加入的方式,来对疏水性的四氧化三铁纳米颗粒进行改性,可以提高配体化合物在四氧化三铁纳米颗粒表面的结合效率,使得制得的磁性纳米颗粒可以均匀分散于水中,形成的磁性纳米颗粒粒径分布也更为均匀,有利于制备成适用于直接注射入生物活体内,从而实现原位蛋白冠提取的试剂。
根据本发明的实施例,本发明制得的磁性纳米颗粒可以注射入生物活体内,进行磁性纳米颗粒与血液样本的体内共孵育,通过对来自于该生物活体的血液样本进行处理,得到血清或血浆的混合液,进而使用MACS仪器回收混合液中的磁性纳米颗粒,实现了活体原位提取蛋白冠,提取的蛋白冠能够在较大程度上接近生物活体的生理状态。基于单一分子量聚乙二醇配体化合物的精准结构为研究纳米颗粒与蛋白冠的关系,以及纳米颗粒靶向目标器官的特异性和效率,提供更精确的指导。
附图说明
图1是本发明实施例1的聚合度为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与甲氧基的单一分子量聚乙二醇配体化合物(P-OEG
图2是本发明实施例2的聚合度为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与马来酰亚胺基团的单一分子量聚乙二醇配体化合物(P-OEG
图3是本发明实施例3的聚合度为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与邻苯二醛基团的单一分子量聚乙二醇配体化合物(P-OEG
图4是本发明实施例4的聚合度为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与邻醛基硼酸基团的单一分子量聚乙二醇配体化合物(P-OEG
图5是本发明实施例5的聚合度为4的三臂聚乙二醇,三端功能化的官能团分别为单磷酸、甲氧基、邻苯二醛基团(P-3OEG
图6是本发明实施例5的聚合度为8的三臂聚乙二醇,三端功能化的官能团分别为单磷酸、甲氧基、邻苯二醛基团(P-3OEG
图7是本发明对比例1的聚合度为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与甲氧基的多分散聚乙二醇配体化合物(P-OEG750-OMe)的质谱图。
图8是本发明实施例6的使用MeO-OEG
图9是本发明实施例6的使用聚合物为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与甲氧基配体稳定四氧化三铁纳米颗粒DLS测试图。
图10是本发明实施例6和对比例2所制备的磁性纳米颗粒粒径DLS表征图。
图11是本发明实施例6和对比例3分别使用P-OEG
图12是本发明实施例7的使用P-OEG
图13是本发明实施例8的使用P-OEG
图14是本发明实施例9的使用P-OEG
图15是本发明实施例10的使用P-OEG
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
在实现本发明的过程中发现,不同功能化的磁性纳米粒子表面结合的蛋白质会影响纳米颗粒的生物分布,并且磁性纳米粒子的理化性质与表面吸附蛋白质从而形成蛋白冠也紧密相关,如何能够在较大程度上保留蛋白冠的原始组成,更接近实际生物活体的生理状态是原位蛋白冠提取的难点。本发明设计了系列单一分子量聚乙二醇配体化合物,具有精确的聚乙二醇分子量和整体结构,可以稳定、高效地结合至四氧化三铁纳米颗粒的表面,形成粒径分布更为均一的磁性纳米粒子,该磁性纳米粒子表面的功能化基团适用于调控蛋白冠的形成,为研究纳米颗粒与蛋白冠的关系,以及纳米颗粒靶向目标器官的特异性和效率,提供更精确的指导。
具体地,根据本发明的一些实施例,提供了一种单一分子量聚乙二醇配体化合物,具有如下式(I)~式(III)任一所示的结构:
其中,n为2~400;
R
其中,k为1~50;L
根据本发明的实施例,单一分子量聚乙二醇配体化合物的X基团为磷酸或苯酚时,有利于与四氧化三铁纳米颗粒进行稳定结合,形成以纳米颗粒为核心,包覆配体化合物的磁性纳米颗粒稳定结构,纳米颗粒表面的单一分子量聚乙二醇拓扑结构适用于形成粒径更为均一的磁性纳米颗粒,并对四氧化三铁纳米进行良好分散的同时,引入不同功能化基团来作用与蛋白质相互作用,使得磁性纳米颗粒吸附形成蛋白冠,这种精确的分子量和结构有利于为研究纳米颗粒和蛋白冠形成的关系,以及纳米颗粒靶向生物器官或组织的特异性和效率提供更精确的依据。
需要说明的是,在本发明的通式化合物中,波浪线表示连接位点。单键的含义为直接键连;卤素例如可以是氟、氯、溴或碘。C
根据本发明的实施例,上述式(I)~(III)化合物中,n可以是4、8、16、24、32、40、45、64、128、192等。进一步地,n优选为4~100,更优选为4~50。基于合适的n的范围,在便于配体化合物制备的同时,更有利于提高四氧化三铁在水中的溶解性和稳定性。
根据本发明的实施例,为了考察或研究蛋白冠的形成作用机理,R
根据本发明的实施例,单一分子量聚乙二醇配体化合物具有下述结构中的一种:
根据本发明的实施例,还提供了上述单一分子量聚乙二醇配体化合物的制备方法,包括:
以如式s1~s3任一所示的单一分子量聚乙二醇为原料,将该单一分子量聚乙二醇的一个羟基由X基团取代,将该单一分子量聚乙二醇的剩余羟基由R
根据本发明的实施例,直接以单一分子量聚乙二醇为起始原料,无需复杂的纯化操作来形成单一分子量聚乙二醇配体化合物。进一步地,根据X基团和R
根据本发明的实施例,为了合成上述直链或支链型的单一分子量聚乙二醇,上述制备方法还包括操作S201~操作S204:
在操作S201,将直链寡聚乙二醇A的一端进行疏水性封端,得到一端被疏水性封端的直链寡聚乙二醇B,如下式所示,其中TG表示疏水性封端基团。
在操作S202,将一端被疏水性封端的直链寡聚乙二醇B与多元醇进行缩合反应,使得多元醇键连直链寡聚乙二醇,其中多元醇具有式g1~g3任一所示结构,j为1~16,例如可以是2、4、8、16。:
在操作S203,对键连有直链寡聚乙二醇的多元醇进行水解反应,以去除疏水性封端基团,得到单一分子量聚乙二醇,其中单一分子量聚乙二醇具有式g4~g6任一所示结构。
在操作S204,将单一分子量聚乙二醇迭代为新的多元醇,重复缩合反应和水解反应的操作,直至得到的单一分子量聚乙二醇具有目标分子量,即达到式(I)~(III)所示的聚乙二醇链段的聚合度为n。
根据本发明的实施例,在聚乙二醇末端使用疏水性封端基团可以改变聚乙二醇的溶解性与极性,使得制备得到的带疏水性封端基团的化合物便于纯化分离,进而得到单一分子量精确聚乙二醇,聚合度可以达到40~200,适于进行大量制备,且分子量可控。
根据本发明的实施例,直链寡聚乙二醇(oligo ethylene glycon,简称OEG)是具有重复亚乙基氧结构单元的聚醚化合物,其中i可以为1~8,出于降低成本的考虑,i更优选为1~3。
根据本发明的实施例,操作S204还包括:将直链型的单一分子量聚乙二醇迭代为新的直链寡聚乙二醇,并重复疏水性封端的操作,得到新的一端被疏水性封端的直链寡聚乙二醇B。
根据本发明的实施例,疏水性封端基团TG选自以下结构中的任意一种:
其中,
根据本发明的实施例,C
根据本发明的实施例,C
根据本发明的实施例,进一步可选的,操作S202中的缩合反应包括:将一端被疏水性封端的直链寡聚乙二醇B使用对甲苯磺酰基(Ts)保护,将得到的化合物C与多元醇进行缩合反应,使得多元醇键连直链寡聚乙二醇。该反应条件温和,效率较高,适于工业化生产且分子量可控。
根据本发明的实施例,为便于对其中的操作S201~操作S203进一步说明,以疏水性封端基团为
根据本发明的一些实施例,还提供了一种磁性纳米颗粒的制备方法,包括操作S301~操作S303。
在操作S301,将疏水性的四氧化三铁纳米颗粒分散于有机溶剂中,得到分散液;
在操作S302,将如上所述的单一分子量聚乙二醇配体化合物加入分散液中,对四氧化三铁纳米颗粒进行改性,得到改性后的四氧化三铁纳米颗粒;
在操作S303,对改性后的四氧化三铁纳米颗粒至少重复一次地进行上述分散和上述改性的操作,得到能够分散于水中的所述磁性纳米颗粒。
根据本发明的实施例,通过试验发现通过分批加入配体化合物的方式,可更高效地将疏水性的四氧化三铁纳米颗粒进行改性,使得四氧化三铁纳米颗粒表面更多地与单一分子量聚乙二醇配体化合物相结合,使得得到的磁性纳米颗粒在较大程度上呈单分散状态,粒径分布更为均一,在水中的溶解性和分散性得到较为显著的改善。
根据本发明的实施例,疏水性的四氧化三铁纳米颗粒市售可得,可以是由油酸等含羧基疏水性化合物对四氧化三铁改性得到。对四氧化三铁纳米颗粒进行分散的有机溶剂例如可以是四氢呋喃(THF)等。
根据本发明的实施例,单一分子量聚乙二醇配体化合物的总用量与所述疏水性的四氧化三铁纳米颗粒的质量比为1:1~100:1,例如可以是1:1、10:1、20:1、40:1、60:1、80:1、100:1等,若单一分子量聚乙二醇配体化合物的用量过高导致成本过高,用量过低则改性效果不好。
根据本发明的实施例,进一步可选的,可以将单一分子量聚乙二醇配体化合物分成两批以上来对四氧化三铁纳米颗粒进行改性,更优选地,为兼顾操作便利性和改性效果,可以分成三批来对四氧化三铁纳米颗粒进行改性,即在操作S303中的重复次数为2次。
根据本发明的实施例,操作S302和操作S303中的改性操作包括:向分散液加入单一分子量聚乙二醇配体化合物后,在10~80℃(例如可以是10℃、20℃、40℃、60℃、80℃等)下搅拌0~96小时(例如可以是6小时、12小时、24小时、48小时、96小时等),通过磁吸附回收改性后的四氧化三铁纳米颗粒。
根据本发明的一些实施例,还提供了一种利用如上所述的制备方法制备得到的磁性纳米颗粒,包括:四氧化三铁纳米粒子,以及包覆于四氧化三铁纳米粒子表面的单一分子量聚乙二醇配体化合物。
根据本发明的实施例,上述制备方法得到的磁性纳米颗粒的粒径能更为均一地分布,呈现单分散状态,磁性纳米颗粒的平均粒径可为1~400nm之间,进一步例如可以是10~30nm之间。
根据本发明的一些实施例,还提供了一种磁性纳米颗粒蛋白冠的原位提取方法,包括操作S401~操作S402。
在操作S401,对来自于生物活体的血液样本进行处理,得到血清或血浆的混合液,其中,所述生物活体被注射有如上所述的磁性纳米颗粒,使得磁性纳米颗粒与血液样本在体内共孵育。在操作S402对混合液进行稀释后,使用MACS仪器对得到的稀释液中的磁性纳米颗粒进行磁分选,得到结合有蛋白冠的磁性纳米颗粒。
根据本发明的实施例,基于本发明所提供的磁性纳米颗粒可以成功地进行磁性纳米颗粒与血液样本在体内共孵育,实现了活体原位提取蛋白冠,提取的蛋白冠能够在较大程度上接近生物活体的生理状态。
根据本发明的实施例,在操作S401,生物活体包括但不限于小鼠、人体等。进一步地,磁性纳米颗粒可以水分散液的方式静脉注射入生物活体内,以使得磁性纳米颗粒与血液样本在体内共孵育,共孵育的时间根据实际需要确定,可以是15min~12小时,例如可以是15min、30min、1小时、2小时、4小时、8小时、12小时等。
根据本发明的实施例,在操作S401,对来自于生物活体的血液样本进行处理,得到血清或血浆的混合液具体包括:将血液样本在不加入抗凝剂的情况下进行静置和离心,得到含磁性纳米颗粒的血清混合液;或者将血液样本在加入抗凝剂例如肝素钠的情况下,进行静置和离心,得到含磁性纳米颗粒的血浆混合液。
根据本发明的实施例,进一步可选的,静置时间例如可以是1~2小时。进一步可选的,离心条件例如可以是4℃,1300g离心15min。
根据本发明的实施例,在操作S402,使用MACS仪器对得到的稀释液中的磁性纳米颗粒进行磁分选具体包括:
将稀释液加入至磁柱中,将磁柱置于磁区,使用PBS缓冲液对磁柱进行第一次淋洗直至没有蛋白流出,然后使磁柱脱离磁区;使用PBS缓冲液对磁柱进行第二次淋洗,对第二次淋洗的淋洗液进行收集和浓缩,即可得到结合有蛋白的磁性纳米颗粒。
根据本发明的一些实施例,还提供了一种磁性纳米颗粒蛋白冠的体外提取方法,包括操作S401’~操作S403’。
在操作S401’,对来自于生物活体的血液样本进行处理,得到血清或血浆的混合液;在操作S402’,将混合液与如上所述的磁性纳米颗粒体外共孵育,得到孵育液;在操作S403’,对孵育液进行稀释后,使用磁性细胞分选仪器对得到的稀释液中的磁性纳米颗粒进行磁分选,得到结合有蛋白冠的磁性纳米颗粒。
根据本发明的实施例,在操作S402’,体外共孵育的条件为0~60℃孵育15min~12小时。为了更贴合生理状态,孵育温度例如可以是37℃。
根据本发明的实施例,操作S401’和操作S403’中血液样本的处理方法和磁分选的方法和前文内容相同,故在此不作赘述。
根据本发明的一些实施例,还提供了一种如上所述的磁性纳米颗粒在制备用于提取蛋白冠的试剂盒中的应用。更进一步地,提供了如上所述的磁性纳米颗粒在制备用于原位或体外提取蛋白冠的试剂盒中的应用。
以下通过具体实施例结合附图对本发明的单一分子量聚乙二醇配体化合物、磁性纳米颗粒及其制备方法与应用做进一步阐述说明。需要注意的是,下述的具体实施例仅是作为举例说明,本发明的保护范围并不限于此。下述实施例中使用的药品或试剂均为市售所得或通过公知的制备方法自制得到。
实施例1:聚合度n为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与甲氧基的单一分子量聚乙二醇配体化合物的制备方法。
将原料E(1.24g,1.28mmol)与碘甲烷(1.82g,12.8mmol)加入到10mL的烧瓶中进行甲苯共沸除水,而后加入5ml的无水THF,再加入NaH(614mg,25.6mmol),室温下反应6h。使用使用EA:PE=5:1进行点板监测,至反应结束。逐滴加入水进行消耗多余的NaH,而后旋去THF,加入DCM,进行萃取三次,最后使用饱和氯化钠洗涤一次,用无水硫酸钠进行干燥,旋除溶剂,得到淡黄色的油状液体F为1.0g。
将瓶中加入原料F(0.98g,1mmol)和36mL甲醇,将TsOH(19mg,0.1mmol)用4mL甲醇溶解,冰浴下缓慢加入体系,室温下反应过夜。旋蒸除去甲醇,加入100mL水,用EA:PE=1:3洗涤水相(30mL*2),再用DCM从水相萃取出产物(100mL*2),将水相加入NaCl制备成饱和食盐水,再用100mL DCM萃取三次,再用饱和食盐水洗涤有机相(100mL),有机相干燥,旋蒸除去有机相,得到无色透明产物G为0.9g.
将原料G(0.8g,1.08mmol)加入到50mL的烧瓶,而后加入20mL的THF,将NaOH(0.26g,6.5mmol)溶于0.2mL的水中,加入到反应体系中去,冰浴搅拌30min,将对甲苯磺酰氯(0.62g,3.25mmol)溶于10mLTHF,滴加到原料C的THF溶液,而后进行在冰浴下搅拌两小时,室温下反应过夜。使用EA:THF=1:1进行点板监测反应。使用旋蒸除去溶剂,而后加入100mL水,使用50mL的PE和5mL的EA进行洗涤两次;再使用100mL的DCM从水相中萃取出产物,重复萃取三次,使用无水硫酸钠进行干燥,再使用旋蒸旋除溶剂,得到微黄色油状液体H为0.8g。
将原料H(0.8g,0.898mmol)与碘化钠(0.86g,4.49mmol)加入到100mL的烧瓶中,而后加入50mL的丙酮,进行回流过夜。使用旋蒸除去溶剂,而后加入100mL的水,加入50mLPE进行洗涤两次,再用DCM进行萃取三次,有机相使用无水硫酸钠进行干燥,旋除溶剂,得到黄色的油状液体I为0.72g。
将原料I(0.72g,0.886mmol)以及亚磷酸三乙酯(5g,30.01mmol)加入到10mL的烧瓶中,使用甲苯共沸除水,而后使用氩气进行保护,加热到160℃,进行回流1h。使用油泵旋干体系,而后使用石油醚进行沉降,得到微黄色油状液体V约0.7g。
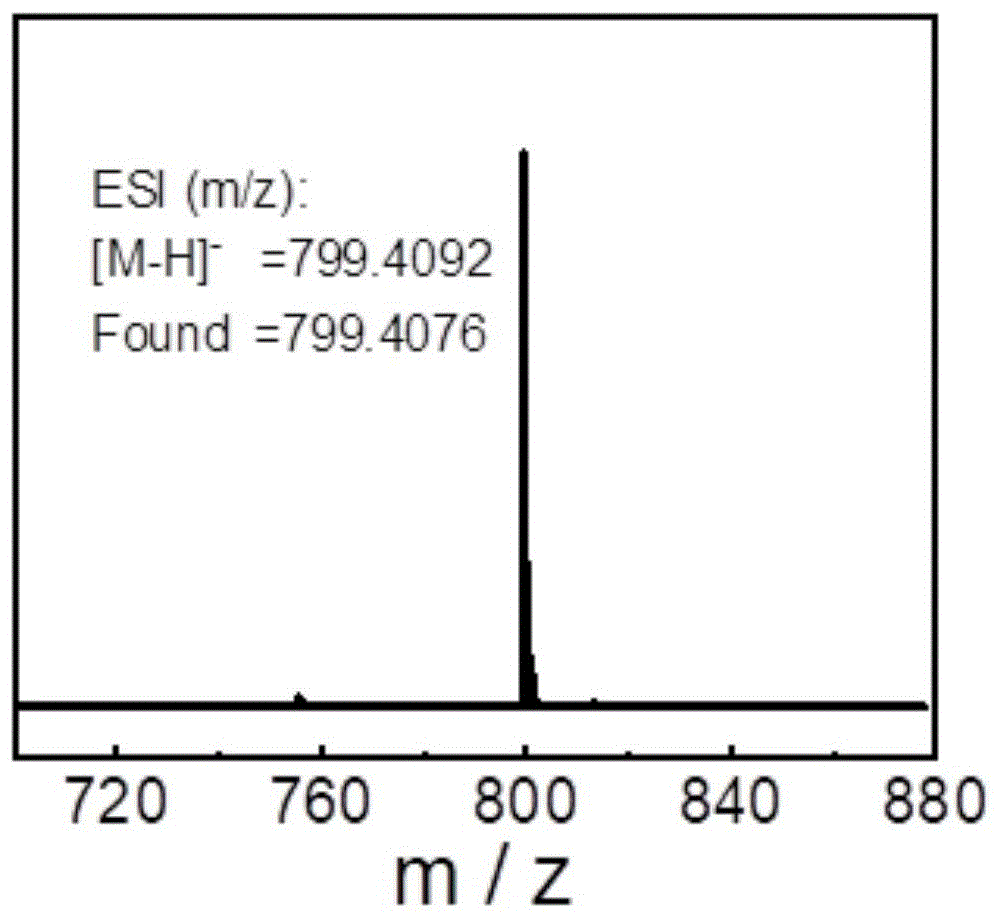
将原料V(700mg,0.817mmol)溶解在无水的二氯甲烷中,在冰浴下冷却至0℃,而后将1mL三甲基溴硅烷(7.425mmol)滴加到反应瓶中。将反应体系在室温下搅拌两天。蒸发溶剂后,将产物在真空下干燥1h。之后,加入4mL甲醇,并将混合物在室温下搅拌20min,除去溶剂,而后使用PE进行沉降,使用油泵抽干溶剂,再使用冻干机进行冻干过夜,得到微黄色油状液体产物P-OEG
实施例2:聚合度n为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与马来酰亚胺基团的单一分子量聚乙二醇配体化合物的制备方法。
原料J的合成方法与实施例1中类似,区别在于将原料E直接和TsCl反应,并且得到的产物经过和NaI、三乙基磷酸酯反应后,增加TsOH脱去Trt保护基的操作。
将原料J(0.4g,0.54mmol)加入到50mL的烧瓶,而后加入20mL的THF,将NaOH(0.13g,3.25mmol)溶于0.2mL的水中,加入到反应体系中去,冰浴搅拌30min,将对甲苯磺酰氯(0.31g,1.62mmol)溶于10mL THF,滴加到原料对甲苯磺酰氯的THF溶液,而后进行在冰浴下搅拌两小时,室温下反应过夜。使用旋蒸除去溶剂,而后加入100mL水,使用100mL的DCM从水相中萃取出产物,重复萃取三次,使用无水硫酸钠进行干燥,再使用旋蒸旋除溶剂,使用乙醚:石油醚=1:4的条件进行沉降,得到微黄色油状液体K为0.4g。
将原料K(0.2g,0.2mmol)、呋喃保护的马来酰亚胺(0.067g,0.4mmol)以及碳酸钾(0.138g,1mmol)加入到10mL的DMF在30℃的条件下搅拌24h。在反应体系中加入100mL二氯甲烷,而后使用100mL的水洗涤三次,使用无水硫酸钠干燥,旋去溶剂,使用DCM溶解,不良溶剂EA:PE=1:4进行沉降,而后进行干燥,得到微黄色油状物L约180mg。
将原料L(0.18g,0.18mmol)溶解在甲苯中,通入氮气,升温至110℃,反应三小时,而后使用油泵将溶剂旋干,再将产物M溶解在10mL无水二氯甲烷中,在冰浴下冷却至0℃,并在30min分钟内将三甲基溴硅烷(260.25mg,10eq)滴入其中。将反应体系在室温下搅拌两天。蒸发溶剂后,将产物在真空下干燥1h。之后,加入4mL甲醇,并将混合物在室温下搅拌20min,除去溶剂,而后使用PE进行沉降,使用油泵抽干溶剂,再使用冻干机进行冻干过夜,得到微黄色油状液体P-OEG
实施例3:聚合度n为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与邻苯二醛基团的单一分子量聚乙二醇配体化合物的制备方法。
将原料J(0.3g,0.36mmol)、M(0.11g,0.43mmol)、DBTL(0.05g,0.07mmol)进行甲苯共沸除水三次,最后一次留10mL的甲苯溶液,而后在85℃的条件下,进行反应4h。点板监测反应。使用油泵旋干甲苯,而后加入少量DCM进行溶解,使用正己烷:二氯甲烷=1:1进行沉降,反复三次,使用真空干燥箱进行干燥,得到微黄色油状物N为200mg。
产物N(0.2g,0.19mmol)溶解在6mL无水二氯甲烷中,在冰浴下冷却至0℃,并在30min分钟内将三甲基溴硅烷(0.29mg,1.9mmol)滴入其中。将反应体系在室温下搅拌两天。蒸发溶剂后,将产物在真空下干燥1h。之后,加入4mL甲醇,并将混合物在室温下搅拌20min,除去溶剂,而后使用PE进行沉降三次,使用油泵抽干溶剂,再使用冻干机进行冻干过夜,得到微黄色油状液体O约180mg。
将原料O(0.18g,0.19mmol)溶解在4mL DCM中,而后加入1mL TFA(1g,8.77mmol),在室温下搅拌1h,使用油泵旋干产物。而后使用水溶解产物,使用PE:EA=10:1洗涤三次,再使用DCM从水中萃取出目标产物,使用无水硫酸钠进行干燥,旋除溶剂,使用真空干燥箱干燥过夜,得到油状产物P-OEG
实施例4:聚合度n为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与邻醛基硼酸基团的单一分子量聚乙二醇配体化合物的制备方法。
将邻醛基苯硼酸酰基叠氮P(50mg,0.166mmol)、DBTL以及原料J(140mg,0.166mmol)加入到100mL的烧瓶中进行甲苯共沸除水两次,而后在甲苯中,将烧瓶升温到85℃,通入氮气保护,反应四个小时,而后自然恢复至室温。旋除溶剂,而后使用DCM溶解产物,使用PE反复沉降三次,得到微黄色油状液体Q 170mg。
将原料Q(170mg,0.152mmol)溶解在无水的二氯甲烷中,在冰浴下冷却至0℃,并在30min分钟内滴加到三甲基溴硅烷中(232mg,1.52mmol),将反应体系在室温下搅拌两天。蒸发溶剂后,将产物在真空下干燥1h。之后,加入10mL甲醇,并将混合物在室温下搅拌20min,除去溶剂,而后使用PE进行沉降,使用油泵抽干溶剂,再使用冻干机进行冻干过夜,得到微黄色油状液体R 120mg。
将原料R(120mg,0.113mmol)加入到25mL的圆底烧瓶,再加入8mL THF中搅拌充分溶解;而后将二乙醇胺(71.39mg,)溶入3mL THF,再滴入体系;于室温下反应12h。加入10mL的1M HCl,旋除THF,冻干,再使用乙醚进行沉降,之后进行干燥,得到约100mg的微黄色油状产物P-OEG
实施例5:聚合度n为4、8的三臂聚乙二醇,三端功能化的官能团分别为单磷酸、甲氧基、邻苯二醛基团的单一分子量聚乙二醇配体化合物的制备方法。
采用和实施例1和3类似的操作,区别在于将化合物J替换为如下J’所示化合物:
式J’,其中n为3或7。
如图5和6,通过核磁氢谱法验证成功制备了P-3OEG
对比例1:聚合度n为16的直链聚乙二醇,两端功能化的官能团分别为单磷酸与甲氧基的多分散聚乙二醇配体化合物的制备方法。
将原料MeO-OEG750-OH(5g,6.67mmol)加入到100mL的烧瓶,而后加入30ml的THF,将NaOH(1.6g,40mmol)加入到反应体系中去,冰浴搅拌30min,将对甲苯磺酰氯溶于10mlTHF,滴加到原料A的THF溶液,而后进行在冰浴下搅拌两小时,室温下反应过夜。使用EA:THF=5:1进行点板监测反应。使用旋蒸除去溶剂,先使用纯EA进行过柱子,待最前沿点点除去后,而后使用EA:THF=5:1进行过柱子,得到无色油状液体产物S4g。
将原料S(4g,4.49mmol)与碘化钠(4.28g,22.47mmol)加入到100ml的烧瓶中,而后加入50ml的丙酮,进行回流过夜。使用旋蒸除去溶剂,而后加入100ml的水,加入100ml的DCM,进行萃取三次,有机相使用无水硫酸钠进行干燥,旋除溶剂,得到淡黄色的油状液体T3.5g。
将原料T(3.5g,4.13mmol)以及亚磷酸三乙酯(6.88g,41.3mmol)加入到50mL的烧瓶中,使用甲苯共沸除水,而后使用氩气进行保护,加热到160℃,进行回流1h。使用油泵旋干体系,而后使用哇哈哈水溶解,再加入PE洗涤,最后使用DCM进行萃取,得到微黄色油状液体U约3.0g。
将原料U(3g,3.5mmol)溶解在无水的二氯甲烷中,在冰浴下冷却至0℃,并在30min分钟内滴加到三甲基溴硅烷中(5.36g,35mmol)。将反应体系在室温下搅拌两天。蒸发溶剂后,将产物在真空下干燥1h。之后,加入20mL甲醇,并将混合物在室温下搅拌20min,除去溶剂,而后使用PE进行沉降,使用冻干机进行冻干过夜,得到微黄色黏稠液体P-OEG750-OMe2g。如图7所示,通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)验证成功制备了P-OEG750-OMe配体化合物。
实施例6:磁性纳米颗粒的制备方法
每10mg油酸稳定的四氧化三铁纳米颗粒,加入40mg实施例1制得的聚乙二醇配体化合物(以下简称P-OEG
如图8和图9所示,本实施例所制得的磁性纳米颗粒的粒径分布较为均一,且相较于油酸稳定的四氧化三铁纳米颗粒,粒径有所增加,推测是由于在四氧化三铁纳米颗粒表面包覆了分子量较大的P-OEG
对比例2:磁性纳米颗粒的制备方法
每10mg油酸稳定的四氧化三铁纳米颗粒,加入120mg实施例1制得的单一分子量聚乙二醇配体化合物(以下简称磷酸配体)在25℃下搅拌12h,而后通过磁吸附回收稳定后的四氧化三铁纳米颗粒,分散在水中。
如图10所示,本对比例所制得的磁性纳米颗粒的粒径较大,聚集体较多。
对比例3:多分散配体磁性纳米颗粒的制备方法
每10mg油酸稳定的四氧化三铁纳米颗粒,加入40mg对比例1制得的多分散聚乙二醇配体化合物(以下简称P-OEG750-OMe配体)在25℃下搅拌12h,而后通过磁吸附回收,再次将回收的纳米颗粒使用THF分散,加入40mg的P-OEG750-OMe配体在25℃下搅拌12h,而后通过磁吸附回收,再次重复一次上述步骤,最后磁吸附回收得到磁性纳米颗粒,分散在水中。
如图11所示,本对比例所制得的磁性纳米颗粒的稳定性较单一分子量的配体稳定的纳米颗粒要差,更不稳定。
实施例7:磁性纳米颗粒与血清在体外共孵育的蛋白冠研究
取6只6周大的balb/c小鼠,将每只小鼠通过摘除眼球取全血,置于不含抗凝剂的离心管中,静置1h,而后使用4℃,1300g,15min进行离心,取上层液体,得到200μL的血清。将200μL的血清与200μL使用实施例7制得的磁性纳米颗粒(3g/L)在37℃的摇床里进行共孵育15min(磁性纳米颗粒使用的剂量与注入每只小鼠的剂量一致,血浆的使用量为能取到的每只小鼠的总血浆量,孵育时间与后面活体实验中磁性纳米颗粒在活体内保留时间一致)。而后将混合液使用PBS进行稀释至3mL,使用MACS进行磁分选,在后期淋洗时,当柱子位于磁区时,每次加入300μL的PBS进行冲洗柱子,一共冲洗十次,至不再有蛋白流出,得到样品1到样品10,而后使磁柱脱离磁区,每次使用1mL的PBS进行冲洗柱子,一共冲洗四次,直至柱内磁性纳米颗粒冲洗干净,将四次收集液放置于一块得到样品11。将得到的样品进行冻干浓缩蛋白,而后使用SDS-PAGE表征,结果如图12所示。
实施例8:磁性纳米颗粒与血浆在体外共孵育的蛋白冠研究
所述方法包括:取6只6周大的balb/c小鼠,将每只小鼠通过摘除眼球取全血,置于含有肝素钠的离心管中,轻轻摇晃均匀,静置1h,而后使用4℃,1300g,15min进行离心,取上层液体,得到200μL的血浆。将200μL的血浆与200μL使用实施例7制得的磁性纳米颗粒(3g/L)在37℃的摇床里进行共孵育15min(磁性纳米颗粒使用的剂量与注入每只小鼠的剂量一致,血浆的使用量为能取到的每只小鼠的总血浆量,孵育时间与后面活体实验中磁性纳米颗粒在活体内保留时间一致)。而后将混合液使用PBS进行稀释至3mL,使用MACS进行磁分选,在后期淋洗时,当柱子位于磁区时,每次加入300μL的PBS进行冲洗柱子,一共冲洗十次,至不再有蛋白流出,得到样品1到样品10,而后使磁柱脱离磁区,每次使用1mL的PBS进行冲洗柱子,一共冲洗四次,直至柱内磁性纳米颗粒冲洗干净,将四次收集液放置于一块得到样品11.将得到的样品进行冻干浓缩蛋白,用于SDS-PAGE表征,结果如图13所示。
实施例9:磁性纳米颗粒与血清在体内共孵育的蛋白冠研究
所述方法包括:取6只6周大的balb/c小鼠,而后通过尾静脉给每只小鼠注入200μL使用实施例7制得的磁性纳米颗粒(3g/L),15min后将每只小鼠通过摘除眼球取全血,置于不含抗凝剂的离心管中,静置1h,而后使用4℃,1300g,15min进行离心,取上层液体,即得到磁性纳米颗粒与血清的混合液。而后将混合液使用PBS进行稀释至3mL,使用MACS进行磁分选,在后期淋洗时,当柱子位于磁区时,每次加入300μL的PBS进行冲洗柱子,一共冲洗十次,至不再有蛋白流出,得到样品1到样品10,而后使磁柱脱离磁区,每次使用1mL的PBS进行冲洗柱子,一共冲洗四次,直至柱内磁性纳米颗粒冲洗干净,将四次收集液放置于一块得到样品11。将得到的样品进行冻干浓缩蛋白,用于SDS-PAGE表征,结果如图14所示。
实施例10:磁性纳米颗粒与血浆在体内共孵育的蛋白冠研究
取6只6周大的balb/c小鼠,而后通过尾静脉给每只小鼠注入200μL使用P-OEG
如图12至15所示,采用同样配体稳定的磁性纳米颗粒在体内、外共孵育后,提取的蛋白冠的种类、数量均有差异,体内共孵育的蛋白冠更接近生理状态。在末端功能性基团调整的情况下,同样采用体内共孵育的方式,提取的蛋白冠的种类、数量均有差异,表明本发明所设计的配体化合物在末端的功能性基团能够调控蛋白冠的形成。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 配体化合物、包含该配体化合物的烯烃铜配位聚合物及其制备方法和应用
- 一种用于组氨酸标签蛋白纯化的螯合金属磁性纳米颗粒的制备方法及应用
- 一种具有pH响应性的木质素磁性纳米颗粒及其制备方法和在纤维素酶回收中的应用
- 一种核酸适配体修饰的磁性纳米颗粒及其制备方法和应用
- 配体修饰的磁性纳米颗粒及其制备方法与应用
