含有1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸的口服制剂
文献发布时间:2024-04-18 19:58:21
技术领域
本申请要求基于2021年4月16日提交的韩国专利申请第10-2021-0049613号的优先权利益,所述申请的全部内容作为本说明书的一部分并入本文。
本发明涉及一种用于口服给药的复合制剂,其具有优异的物理性质,并同时以高含量包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸。
背景技术
黄嘌呤氧化酶是一种将次黄嘌呤转化成黄嘌呤并且也将形成的黄嘌呤转化成尿酸的酶,抑制黄嘌呤氧化酶活性的物质可以有效地治疗与尿酸积累相关的疾病,例如高尿酸血症、痛风、心力衰竭和心血管疾病。
另一方面,关于抑制黄嘌呤氧化酶活性的物质,韩国专利第10-1751325号(专利文献1)提供了1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸(下面的式1)和制备所述化合物的方法;韩国专利第10-1424013号(专利文献2)提供了使用各种溶剂获得的各种类型的晶型及其制备方法。
[式1]
然而,尚无关于包含上述式1的1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为活性药物成分(API)的用于口服给药的复合制剂的报道,并且特别是尚无关于以高含量包含所述API的用于口服给药的复合制剂的报道。
包含高含量API的复合制剂通常不能被称为具有优异的基本物理性质例如硬度和压片性质,因此为了克服这些缺点,通常使用湿法成粒或干法成粒,或使用增加赋形剂的量以降低API比率的方法。
然而存在的问题在于,不仅通过进行成粒过程以改善高含量复合制剂的流动性可能增加制造时间和生产成本,而且通过增加赋形剂的量并因此增加复合制剂的总重量和体积,生产成本增加并且患者的可接受性降低。
此外,在用于口服给药的复合制剂中,当考虑到给药的容易性、生产成本等将它以口服片剂形式提供时,生物可利用度非常重要。影响生物可利用度的重要因素是药物在体内的溶出过程,这可以通过实验室中的溶出试验由溶出度间接证实。
然而,由于与低含量复合制剂相比高含量复合制剂别无选择,只能具有较低含量的赋形剂,因此物理性质通常降低。
因此,需要开发一种用于口服给药的复合制剂,其具有优异的物理性质和优异的溶出度,同时包含高含量的1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API。
[现有技术文献]
[专利文献]
(专利文献1)1.韩国专利第10-1751325号(2017年6月21日),题为“有效作为黄嘌呤氧化酶抑制剂的新型化合物、制备所述化合物的方法以及含有所述化合物的药物组合物”(novel compounds effective as xanthine oxidase inhibitors,method forpreparing the same,and pharmaceutical composition containing the same)
(专利文献2)2.韩国专利第10-1424013号(2014年7月22日),题为“1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸结晶形式及其生产方法”(1-(3-cyano-1-isopropyl-indol-5-yl)pyrazol-4-Carboxylic acid crystalline form and the producingmethod thereof)
发明内容
技术问题
本发明的目的是获得一种用于口服给药的复合制剂,其具有优异的物理性质和优异的溶出度,同时包含过量的1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API。
技术解决方案
本发明涉及一种用于口服给药的复合制剂,其通过包含选自1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐的API,特别是具有一定粒径范围的API而具有优异的物理性质,并涉及一种制备所述用于口服给药的复合制剂的方法。
包含在本发明的用于口服给药的复合制剂中的API具有80μm以上且300μm以下、或120μm以上且270μm以下的对应于累积粒径分布中最大粒径的90%的颗粒的粒径(D(0.9))。
本发明的用于口服给药的复合制剂使用900ml pH 6.8的缓冲液作为溶出介质,并且当使用旋转速度为50rpm的桨时,在15分钟时的溶出度为70%以上,在30分钟时的溶出度为85%以上,并且在60分钟时的溶出度为89%以上。
包含在本发明的用于口服给药的复合制剂中的API具有以所述复合制剂的总重量计30至50重量%的含量。
本发明的用于口服给药的复合制剂中的API具有95至105%的含量。
本发明的用于口服给药的复合制剂被用于治疗或预防选自高尿酸血症、痛风、心力衰竭、心血管疾病、高血压、糖尿病、肾脏疾病、炎症和关节疾病以及炎症性肠病的黄嘌呤氧化酶相关疾病。
有利效果
根据本发明的包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API的用于口服给药的复合制剂,通过将API的粒径调节到一定范围,由于优异的物理性质可以防止在制造过程中可能发生的问题,即使包含高的API含量。
此外,由于根据本发明的用于口服给药的复合制剂包含高含量的1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API,因此它是经济的,并且由于高溶出度,也可以预期生物可利用度提高。
附图说明
图1是分析未包衣片剂的脆性(%)随着API的粒径分布而变的结果。
图2是分析未包衣片剂的溶出度(%)随着API的粒径分布而变的结果。
具体实施方式
在下文中,将更详细描述本发明。
除非另有定义,否则本发明中使用的所有技术术语均具有与本发明相关领域中的普通技术人员通常理解的相同的含义。此外,在本说明书中描述了优选的方法或样品,但相似或等效的方法或样品也包括在本发明的范围之内。在本说明书中通过引用描述的所有出版物的内容均整体通过引用并入本说明书。
作为以各种方式不断研究以在包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API的用于口服给药的复合制剂中增加API含量并维持或提高物理性质的结果,本发明人开发了一种用于口服给药的复合制剂,当将API的粒径调整到一定范围时,所述复合制剂具有优异的物理性质和优异的溶出度。
在这种情况下,当API的粒径被调整到一定范围时,诸如流动性的物理性质得以维持,并且当配制成片剂(未包衣片剂)时,它具有优异的物理性质例如硬度和脆性,因此它是经济的,并且即使包含高含量API,也不需要增加单独的赋形剂的含量来提高物理性质,并且所述片剂具有优异的含量和均匀性以及具有高溶出度的优点。
因此,本发明通过将选自1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐的API的粒径调整到一定范围,提供了一种具有优异的物理性质和高溶出度的用于口服给药的复合制剂。
在本发明中,“药学上可接受的盐”是指化合物的不会对所述化合物给药到的生物体造成严重刺激并且不会损害所述化合物的生物活性和物理性质的盐形式。1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸这种包含在本发明的用于口服给药的复合制剂中的API,可以通过常规方法转化成其盐。
在用于口服给药的复合制剂例如片剂或颗粒胶囊中,通常尝试将每单位剂型的大小最小化以便于吞服,即使包含高含量的API,但本领域普通技术人员的常识是当以高含量包含API时,物理性质例如流动性和压片性能通常受损,并且由溶出度代表的生物可利用度也可能受到影响。
事实上,对于包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸作为API的用于口服给药的复合制剂来说,在用于口服给药的复合制剂(特别是片剂)中具有药学上可接受的物理性质的API的可接受的含量仅为约30%,并且当含量高于所述值时,存在物理性质例如压片性能快速恶化的问题。
在本发明中,对具有优异或良好的由物理稳定性和溶出度代表的生物可利用度,同时以高含量包含选自1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐的API的用于口服给药的复合制剂,进行了各种研究。
API的粒径分布是影响压片过程中可压缩性的一个因素,并且已知是制造过程中的重要特征之一。此外,API的粒径分布是影响溶解性的一个因素并且是影响最终产品的溶出的一个重要特征,并且为了确保最终产品中的所需溶出模式,在本发明中调整了API的粒径分布。
因此,通过调整API的粒径分布,已经开发出即使包含高含量的API也具有优异的物理稳定性以及优异的溶出度的用于口服给药的复合制剂。
本发明的一个方面提供了一种用于口服给药的复合制剂,i)其包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API,并且ii)其中所述API具有80μm以上且300μm以下的粒径(D(0.9))。
在本发明中,所述API可以具有80μm以上且300μm以下、90μm以上且300μm以下、100μm以上且300μm以下、110μm以上且300μm以下、120μm以上且300μm以下、130μm以上且300μm以下、140μm以上且300μm以下、150μm以上且300μm以下、80μm以上且270μm以下、90μm以上且270μm以下、100μm以上且270μm以下、110μm以上且270μm以下、120μm以上且270μm以下、130μm以上且270μm以下、140μm以上且270μm以下、150μm以上且270μm以下、80μm以上且250μm以下、90μm以上且250μm以下、100μm以上且250μm以下、110μm以上且250μm以下、120μm以上且250μm以下、130μm以上且250μm以下、140μm以上且250μm以下、150μm以上且250μm以下、80μm以上且230μm以下、90μm以上且230μm以下、100μm以上且230μm以下、110μm以上且230μm以下、120μm以上且230μm以下、130μm以上且230μm以下、140μm以上且230μm以下或150μm以上且230μm以下的对应于累积粒径分布中最大粒径的90%的颗粒的粒径(D(0.9))。
此外,所述API可以具有30μm以上且150μm以下、40μm以上且150μm以下、50μm以上且150μm以下、60μm以上且150μm以下、70μm以上且150μm以下、80μm以上且150μm以下、30μm以上且140μm以下、40μm以上且140μm以下、50μm以上且140μm以下、60μm以上且140μm以下、70μm以上且140μm以下、80μm以上且140μm以下、30μm以上且130μm以下、40μm以上且130μm以下、50μm以上且130μm以下、60μm以上且130μm以下、70μm以上且130μm以下或80μm以上且130μm以下的对应于累积粒径分布中最大粒径的50%的颗粒的粒径(D(0.5))。
此外,所述API可以具有10μm以上且90μm以下、20μm以上且90μm以下、30μm以上且90μm以下、40μm以上且90μm以下、50μm以上且90μm以下、10μm以上且80μm以下、20μm以上且80μm以下、30μm以上且80μm以下、40μm以上且80μm以下或50μm以上且80μm以下的对应于累积粒径分布中最大粒径的10%的颗粒的粒径(D(0.1))。
由于API具有80μm以上且300μm以下的D(0.9),因此本发明的用于口服给药的复合制剂具有优异的硬度和低脆性。结果,在制造本发明的包含粒径调整的API的用于口服给药的复合制剂(片剂)中,存在着可以通过在未包衣片剂的处理和包衣过程中降低破碎和损失的可能性来提高用于口服给药的复合制剂的生产率的优势。
本发明的用于口服给药的复合制剂具有优异的含量和95%以上的均匀性,并且也具有优异的崩解时间。
本发明的用于口服给药的复合制剂使用900ml pH 6.8缓冲液作为溶出介质,并且当使用旋转速度为50rpm的桨时,在15分钟时的溶出度为70%以上,在30分钟时的溶出度为85%以上,在60分钟时的溶出度为89%以上,从而与包含具有325μm以上的D(0.9)的API的用于口服给药的复合制剂相比显示出优异的溶出度。
此外,本发明的用于口服给药的复合制剂使用900ml pH 6.8缓冲液作为溶出介质,并且当使用旋转速度为50rpm的桨时,在60分钟时的溶出度为89%以上。
因此,由于本发明的用于口服给药的复合制剂具有优异的溶出度,可以预期通过反映出这一点,生物可利用度也会是优异的。
本发明中的用于口服给药的复合制剂进一步包含选自药学上可接受的稀释剂、崩解剂、助流剂、润滑剂等的一种或多种赋形剂作为赋形剂。
作为赋形剂例如稀释剂、崩解剂、助流剂和润滑剂,可以使用已知在本领域中常用的任何这些赋形剂。以所述用于口服给药的复合制剂的总重量计,稀释剂可以以30至50重量%、40至50重量%或45至50重量%的量使用。以所述用于口服给药的复合制剂的总重量计,崩解剂可以以1至10重量%或1至5重量%范围内的量使用。以所述用于口服给药的复合制剂的总重量计,助流剂可以以0.1至5重量%、0.2至3重量%或0.3至2重量%范围内的量使用。以所述用于口服给药的复合制剂的总重量计,润滑剂可以以0.1至10重量%、0.3至5重量%或0.5至4重量%范围内的量使用。
例如,所述稀释剂可以选自但不限于微晶纤维素(MCC)、乳糖单水合物、乳糖酸酐、乳糖、淀粉、甘露糖醇、羧甲基纤维素、山梨糖醇及其组合。所述崩解剂可以选自但不限于低取代羟丙基纤维素、交聚维酮、交联羧甲基纤维素钠、羧甲基淀粉钠、F-熔体及其组合。所述助流剂可以选自但不限于滑石、二氧化硅及其混合物。所述润滑剂可以选自但不限于硬脂酸镁、二氧化硅、滑石、轻质无水硅酸、硬脂酰富马酸钠及其组合。
所述用于口服给药的复合制剂可以每天一次给药,并且可以每天服用。
以所述用于口服给药的复合制剂的总重量计,包含在所述用于口服给药的复合制剂中的API的含量为30至50重量%、35至50重量%、40至50重量%、45至50重量%、30至45重量%、35至45重量%、40至45重量%、30至40重量%或35至40重量%。
所述API可以以每单位剂型50至500mg、50至400mg、50至300mg、50至200mg、50至100mg、100至500mg、100至400mg、100至300mg、100至200mg、200至500mg、200至400mg、200至300mg、300至500mg或300至400mg的量被包含。
所述API可以以例如每单位剂型50mg、100mg、150mg、200mg、300mg、400mg或455mg的量被包含。
包含在本发明的复合制剂中的API的含量可以是95%至105%、96%至105%、97%至105%、98%至105%、99%至105%、100%至105%、95%至100%、96%至100%、97%至100%、98%至100%或99%至100%。此外,API含量可以是95%以上、96%以上、97%以上、98%以上或99%以上,并且可以是105%以下、104%以下、103%以下、102%以下、101%以下或100%以下。
本发明的用于口服给药的复合制剂可以通过本领域中已知的任何方法,通过使用具有上述D(0.9)粒径分布的选自1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐的活性药物成分(API)来制备。
本发明提供了一种用于治疗或预防人类黄嘌呤氧化酶相关疾病的药物组合物,其使用包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API以及助流剂的用于口服给药的复合制剂。
本发明提供了一种用于治疗或预防人类黄嘌呤氧化酶相关疾病的方法,所述方法使用包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API以及助流剂的用于口服给药的复合制剂。
本发明提供了用于制备药物组合物的用途,所述药物组合物用于治疗或预防人类黄嘌呤氧化酶相关疾病,并包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸或其药学上可接受的盐作为API。
本发明的“人类黄嘌呤氧化酶相关疾病”是指可以通过抑制人类黄嘌呤氧化酶治疗或预防的疾病,并包括例如高尿酸血症、痛风、心力衰竭、心血管疾病、高血压、糖尿病、糖尿病相关并发症、肾脏疾病、关节疾病、炎症性肠病等,但不限于上述疾病。糖尿病相关并发症的实例包括高脂血症、动脉硬化、肥胖症、高血压、视网膜病变、肾衰竭等。
“治疗”意味着当在显示出症状发作的受试者中使用时停止或延迟疾病的进展,而“预防”意味着当在未显示出症状发作但具有其高风险的受试者中使用时停止或延迟症状的发作。
除非另有说明,否则本说明书和权利要求书中使用的所有数字不论是否列举,均应被理解为在所有情况下可以被术语“约”修饰。还应该理解,在本说明书和权利要求书中使用的精确数字形成了本公开的附加实施方式。已经努力确保实施例中公开的数值的准确性。然而,所有测量值可能固有地含有由其相应的测量技术中测量的标准偏差产生的某些误差值。
实施例和比较例中的各种评估如下进行。
[粒径分析]
实施例和比较例中使用的API的粒径分布使用激光衍射粒径分析仪,通过干法来测量。在这种情况下,D(0.1)、D(0.5)和D(0.9)是指当将测量的粒子以从粒子直径小的粒子到粒子直径大的粒子的顺序排列时,分别对应于粒子总数的10%、50%和90%的粒子的粒子直径。
[硬度和脆性分析]
硬度和脆性被用作指标,可以预测在压片后片剂(未包衣片剂)的处理和包衣固定中破碎和损失的片剂等。
对于脆性测试来说,取接近约5g的量的片剂,除去附着到片剂上的粉末,精确测量质量,然后将片剂放置在脆性测试仪的滚筒中。将滚筒旋转100次后,取出片剂,像开始时一样除去附着到药片上的粉末,然后精确测量质量。
脆性(%)=(测试前的质量-测试后的质量)/(测试前的质量)X 100
在硬度测试的情况下,将1个片剂置于片剂硬度测试仪中并测量硬度,并在以这种方式重复10个片剂后,使用其平均硬度。
[崩解时间分析]
崩解时间是影响复合制剂摄入后在体内的溶出和吸收的指标。
在用纯化水充分填充崩解测试仪后,将温度调节至37±2℃。在崩解测试仪的每个玻璃管中放置4个片剂,以规定的方式进行操作,测量片剂完全崩解和消失的时间,并使用其平均值。
[含量分析]
进行含量测试以评估配制的复合制剂的含量。含量是最终产品的重要品质特征,并测量未包衣片剂的平均API含量。
<分析条件>
流动相的制备:乙腈(500ml)+纯化水(500ml)+TFA(1ml)
稀释剂的制备:甲醇(900ml)+纯化水(100ml)
标准溶液和测试溶液的制备:在将标准品和样品完全溶解在稀释剂中之后,按照下述UPLC分析方法进行分析。
柱:Waters CSH C18(2.1mm I.D.X 100mm L,粒径1.7μm)
柱温:40℃
流动相:乙腈/H
流速:0.35ml/min
检测:258nm uv
样品量:1μl
分析时间:6分钟
[溶出度分析]
根据韩国药典(第10版)的溶出测试方法测试下述实施例和比较例的未包衣片剂的溶出。所述溶出方法施用桨法进行,搅拌速度为50rpm,溶出温度为37±0.5℃。溶出介质是900ml pH 6.8的磷酸盐缓冲液。
分析条件:将在溶出测试中得到的溶液通过0.45μm膜滤器过滤,并使用UPLC方法分析作为API的1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸的浓度。
<分析条件>
分析条件与含量分析方法中相同。
[实施例和比较例]
使用如下表1中所示的相应含量的组分,将实施例和比较例的片剂制备成复合制剂(未包衣片剂)。
将具有每种粒径分布的1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸(API)与助流剂混合,然后研磨以制备第一混合物。然后,将未包括在第一混合物中的组分稀释剂、崩解剂和润滑剂混合,然后研磨以制备第二混合物。
在将所述第一混合物和第二混合物混合后,使用旋转压片机(Modul P,GEA,Belgium)在预压力(5.0kN)和主压力(14至15kN)条件下进行压片,以制备未包衣片剂。
用作润滑剂的
[表1]
实验例1.根据粒径分布的复合制剂的表征分析
在包含1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸作为API的用于口服给药的复合制剂中,通过上文描述的分析方法分析根据API的粒径分布的物理性质。
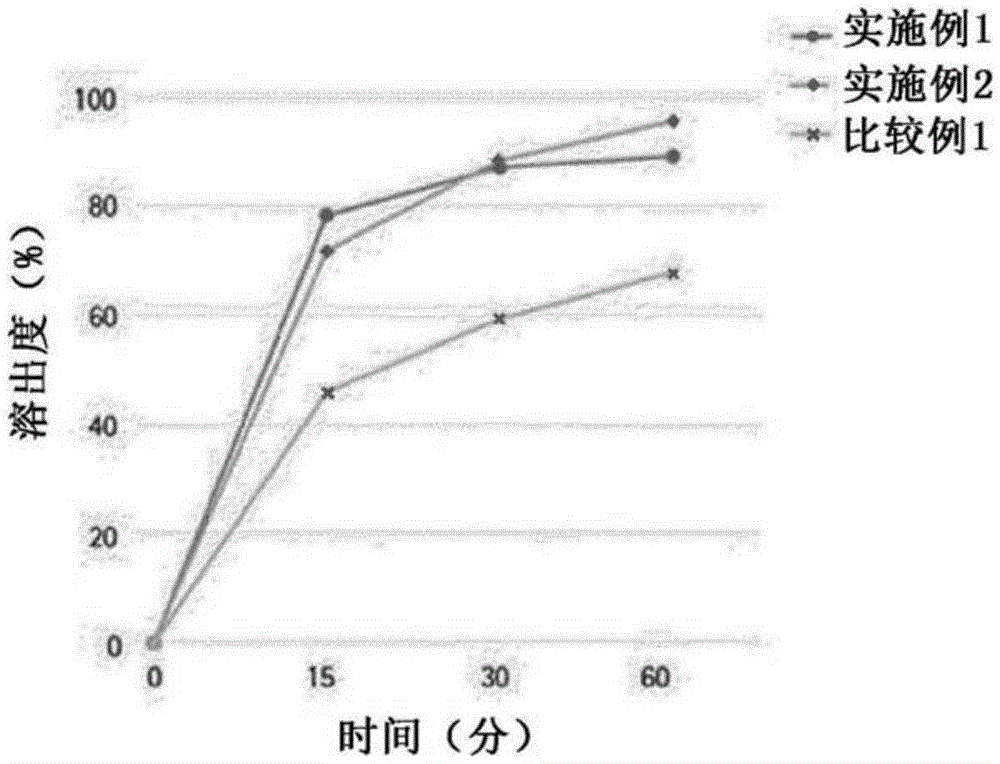
具体来说,分析了使用表1中所示的相应含量的组分制备的复合制剂(未包衣片剂)的物理性质(硬度、脆性、崩解时间、含量和溶出度),并将结果总结如下面的表2和图1和2中所示。
所述未包衣片剂的硬度随着其粒径的减小而提高,而相反,脆性随着其粒径的增大而降低。因此,当D(0.9)为325μm以上(比较例1)时,考虑到未包衣片剂的硬度和脆性,它不适合配制成片剂(图1)。
根据粒子分布,平均含量没有差异。然而,在溶出度的情况下,比较例1的片剂显示在15分钟、30分钟和60分钟时的平均溶出度(46.1%、59.4%、67.8%)都低于实施例1和2的平均溶出度。
此外,尽管实施例1和2两者都显示出相对良好的溶出度,但实施例1和2在每个时间段显示出轻微差异:在15分钟时的平均溶出度的情况下,实施例1中为78.5%,实施例2中为71.8%,因此具有小粒子的实施例1的片剂显示出相当高的平均溶出度,但在30分钟和60分钟时的平均溶出度的情况下,实施例2显示出更高的平均溶出度。
[表2]
到目前为止,已经参考优选实施方式描述了本发明。然而,本领域技术人员将会理解,在不脱离本发明的精神或范围的情况下,可以对本发明进行各种改变和修改。因此,所公开的实施方式应当被认为是示例性的而非限制性的。本发明的范围在权利要求书而不是详细描述中定义,并且在等效范围内的所有差异应被解释为包括在本发明中。
- 1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸晶型及其生产方法
- 1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸晶型及其生产方法
