共再生顽拗性植物
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及分子植物生物学领域,特别涉及植物再生领域。本发明涉及用于改善植物的再生能力和/或效率的方法。
背景技术
植物生物技术中的许多工作流程需要从单细胞再生为整个植物。由于一般植物细胞的再生能力有限,因此再生步骤通常是此类工作流程的主要瓶颈。再生潜力高度依赖于植物种类、植物品种和植物组织来源。即使采用既定方案,成功再生为植物的细胞比例通常也相当低(Srinivasan等人,Planta[植物学]2007,225:341-351)。再生失败或再生效率差的植物物种或品种被认为是顽拗的。
再生是瓶颈的工作流程的非限制性实例是(克隆繁殖的)植物材料的一般增殖,特别是在单倍体植物材料或遗传复杂(例如高度倍性和杂合)F1群体的情况下,还有更高级的植物生物技术工作流程,例如但不限于靶向植物基因组编辑、(稳定或瞬时)转化体的生产和双单倍体诱导。
通过CRISPR/Cas9或相关技术进行的基因组编辑(GE)是农业生物技术的少数重大突破之一,它有潜力通过在植物中进行快速有效的定向遗传突变,轻松地将改良的性状转化为作物。预计该技术将在未来十年内蓬勃发展,并对作物改良和育种的研发产生重大影响。为了获得携带可遗传突变的植物,可以将突变引入植物原生质体中,然后将原生质体再生为植物。该技术的一个主要障碍是许多作物物种不能从单个编辑细胞再生完整植物和/或依赖于基因型从单个编辑细胞再生完整植物。后者是关键的未解决因素,对于应用的GE来说也是如此,因为它正在向无DNA系统发展(Zhang等人2021Plant Communications[植物通讯]2(100168)p1-p13),该系统主要依赖于向原生质体的传递。
一种可替代方法是用诱导可遗传突变的载体(例如病毒载体)接种植物。这种方法的主要限制是,在许多系统中,病毒被主动排除在茎尖分生组织(SAM)之外,并被强大的转录后基因沉默机制所沉默。因此,只能获得通常不能直接传递给后代的体细胞编辑,因为生殖组织是从分生组织发育而来的。因此,该过程也受益于改进的再生方案。
因此,本领域强烈需要提高植物的再生效率,优选提高顽拗性植物的再生效率。特别地,强烈需要提高携带可遗传突变的植物的再生效率。
发明内容
本发明可以概括为以下实施例:
实施例1.一种产生和选择植物的芽的方法,其中该方法包括以下步骤:
(a)将顽拗性植物的细胞与再生性植物的细胞接触,其中在允许芽再生的条件下,该再生性植物的细胞表现出比该顽拗性植物的细胞更高的再生效率;
(b)使步骤(a)的经接触细胞在允许一个或多个芽再生的条件下形成芽;
(c)选择步骤(b)中形成的芽,其中所述芽的至少部分由该顽拗性植物的细胞组成;以及任选地
(d)从步骤(c)中选择的芽生长植物。
实施例2.如实施例1所述的方法,其中在步骤(c)中,所选择的芽的由该顽拗性植物的细胞组成的部分是包含种系祖细胞的组织,并且其中任选地,该方法进一步包括步骤(d)和通过有性繁殖,任选通过自交或回交获得步骤(d)中生长的植物的种子或植物后代的步骤。
实施例3.如实施例1或2所述的方法,其中在步骤(c)中,所选择的芽由该顽拗性植物的细胞组成,并且其中任选地,该方法进一步包括步骤(d)和通过营养繁殖获得步骤(d)中生长的植物的后代的步骤。
实施例4.如实施例1至3所述的方法,其中步骤(a)的该顽拗性植物的细胞和该再生性植物的细胞是分离的细胞,优选原生质体。
实施例5.如实施例4所述的方法,其中将步骤a)中的分离的细胞暴露于促进这些细胞的细胞膜聚集的化合物,优选地通过使用植物细胞和/或原生质体连接剂,并且其中优选地该连接剂是Yariv试剂。
实施例6.如实施例1至3所述的方法,其中步骤(a)的该顽拗性植物的细胞和该再生性植物的细胞包含在组织中。
实施例7.如实施例6所述的方法,其中步骤(a)是通过砧木-接穗嫁接并使嫁接连接处愈合来进行。
实施例8.如实施例7所述的方法,其中步骤(b)包括以下步骤:
-在该嫁接连接处或附近产生伤口;
-使愈伤组织在受伤的嫁接连接处形成;以及
-使芽从所述愈伤组织生长。
实施例9.如前述实施例中任一项所述的方法,其中该方法进一步包括以下步骤:在步骤(a)的该顽拗性植物的细胞中或步骤(b)中形成的芽中源自该顽拗性植物的细胞的细胞中引入:
(i)转基因;或
(ii)目的序列中的突变。
实施例10.如实施例9所述的方法,其中引入该转基因或该突变的步骤在步骤(b)之前,并且任选地在步骤(a)之前。
实施例11.如实施例9或10所述的方法,其中该转基因或该突变包含在以下至少一项中:
-种系祖细胞和/或衍生自其的种系细胞;以及
-步骤(d)中生长的植物的用于步骤(b)中形成的芽的营养繁殖的植物部分。
实施例12.如实施例9-11中任一项所述的方法,其中该突变通过编程的基因组编辑引入,优选地使用位点特异性核酸内切酶,优选地CRISPR核酸内切酶。
实施例13.一种由如实施例9-12中任一项的方法可获得的植物,其中所述植物包含以下中至少一种
i)该顽拗性植物的种系祖细胞和/或衍生自其的种系细胞;以及
ii)用于该顽拗性植物的克隆繁殖的植物部分,
其中该种系祖细胞、种系细胞和/或植物部分包含该转基因或该目的序列中的突变。
实施例14.如实施例13所述的植物,其中所述植物包含该顽拗性植物的细胞和该再生性植物的细胞。
实施例15.将顽拗性植物细胞的细胞膜与再生性植物细胞连接的药剂用于再生所述顽拗性植物细胞的用途,其中优选地所述试剂是Yariv试剂。
定义
与本发明的方法、组合物、用途和其他方面相关的各种术语在整个说明书和权利要求书中使用。除非另有说明,这些术语应具有本发明所属领域中的普通含义。其他具体定义的术语将以与本文提供的定义一致的方式解释。
对于本领域技术人员来说清楚的是,与本文描述的那些相似或等同的任何方法和材料都可以用于实践本发明。
实施本发明方法中使用的常规技术的方法对于技术人员来说是显而易见的。分子生物学、生物化学、计算化学、细胞培养、重组DNA、生物信息学、基因组学、测序和相关领域中的常规技术的实践是本领域技术人员众所周知的,并且在例如以下文献中进行了讨论参考:Sambrook等人Molecular Cloning.ALaboratory Manual[分子克隆:实验室手册],第2版,Cold Spring Harbor Laboratory Press[冷泉港出版社],冷泉港,纽约,1989;Ausubel等人.Current Protocols in Molecular Biology[分子生物学最新方案],John Wiley&Sons[约翰·威利父子公司],纽约,1987并定期更新;以及Methods in Enzymology[酶学方法],Academic Press[学术出版社],圣地亚哥系列。
单数形式“一个/种(a/an)”和“该(the)”包括复数个指示物,除非上下文中另外明确指明。因此,例如,提到“一个/种细胞”包括两个/种或更多个/种细胞的组合等。因此,不定冠词“一个/种”(“a”或“an”)通常意指“至少一个/一种”。
术语“和/或”是指如下情形,其中所陈述情况中的一个或多个可能单独发生或与所陈述情况中的至少一个组合地发生,多至与所有所陈述情况组合地发生。
如本文所用的,术语“约”用于描述和解释小的变化。例如,该术语可以指小于或等于±(+或-)10%,例如小于或等于±5%、小于或等于±4%、小于或等于±3%、小于或等于±2%、小于或等于±1%、小于或等于±0.5%、小于或等于±0.1%、或小于或等于±0.05%。另外,量、比率和其他数值有时以范围形式呈现在本文中。应当理解,这种范围形式是为了方便和简洁而使用的,并且应当被灵活地理解为包括明确指定为范围界限的数值,而且还包括该范围内涵盖的所有单独的数值或子范围,就好像每个数值和子范围都被明确指定。例如,约1至约200范围内的比率应理解为包括明确列举的约1和约200的限制,而且还包括单独的比率,例如约2、约3和约4,以及诸如约10至约50、约20至约100等子范围。
术语“包含”被解释为包容性和开放式的,而不是排他性的。特定地,该术语及其变体意味着包括指定的特征、步骤或组分。这些术语不应被解释为排除其他特征、步骤或组分的存在。
术语“蛋白”或“多肽”可互换使用并且是指由氨基酸链组成的分子,而不涉及特定的作用模式、大小、3维结构或来源。因此,蛋白的“片段”或“部分”仍可称为“蛋白”。“分离的蛋白”用于指蛋白,该蛋白不再在它的自然环境中,例如在体外或在一个重组细菌或植物宿主细胞中。
“植物”是指整个植物或可从植物获得的植物组织或器官的部分(例如花粉、种子、根、叶、花、花芽、花药、果实等),以及任何这些的衍生物和通过自交或杂交或无融合生殖繁殖从这种植物衍生的后代。植物的非限制性实例包括作物植物和栽培植物,例如非洲茄子、葱属植物、朝鲜蓟、芦笋、大麦、甜菜、甜椒、苦瓜、膀胱樱桃、葫芦、卷心菜、卡诺拉油菜、胡萝卜、木薯、花椰菜、芹菜、菊苣、菜豆、玉米沙拉、棉花、黄瓜、茄子、苦苣、茴香、小黄瓜、葡萄、辣椒、生菜、玉蜀黍、甜瓜、油菜、秋葵、欧芹、防风草、茄瓜、胡椒、马铃薯、南瓜、萝卜、水稻、丝瓜(ridge gourd)、芝麻菜、黑麦、蛇瓜、高粱、菠菜、丝瓜(sponge gourd)、南瓜、甜菜、甘蔗、向日葵、粘果酸浆、番茄、番茄砧木、蔬菜芸苔、西瓜、冬瓜、小麦和西葫芦。
“一个或多个植物细胞”包括来自植物源的原生质体、配子、悬浮培养物、小孢子、花粉粒等,其可以是分离的,也可以是在组织、器官或生物体中的。植物细胞可以,例如是多细胞结构的一部分,例如愈伤组织、分生组织、植物器官或外植体。植物细胞可以是分生细胞、体细胞和/或生殖细胞。
培养植物/植物细胞的“相似条件”除其他外意指使用相似的温度、湿度、营养和光照条件,以及相似的灌溉和光/暗节律。
术语“同源性”、“序列同一性”等在本文中可互换使用。“序列同一性”在本文中定义为两个或更多个氨基酸(多肽或蛋白)序列或两个或更多个核苷酸(多核苷酸)序列之间的关系,如通过比较序列所确定的。在本领域中,“同一性”还意指氨基酸或核酸序列之间的序列相关性程度,视情况而定,由此类序列的串之间的匹配确定。两个氨基酸序列之间的“相似性”通过将一个多肽的氨基酸序列及其保守氨基酸取代物与第二多肽的序列进行比较来确定。“同一性”和“相似性”可以通过已知的方法容易地计算。可以在序列的全长上确定序列同一性/相似性百分比。
如本文所用的,“序列同一性”是指两个最佳比对的多核苷酸或肽序列在组分(例如核苷酸或氨基酸)的整个比对窗口中不变的程度。用于测试序列和参考序列的比对片段的“同一性分数”是由两个比对序列共有的相同组分的数量除以参考序列片段(即整个参考序列或参考序列的较小定义部分)中的组分总数。“同一性百分比”是同一性分数乘以100。
“序列同一性”和“序列相似性”可以通过使用全局或局部比对算法对两个肽或两个核苷酸序列进行比对来确定,这取决于两个序列的长度。相似长度的序列优选使用全局比对算法(例如尼德曼-翁施(Needleman-Wunsch))进行比对,该算法在整个长度上最优化地进行序列比对,而长度区别非常大的序列优选使用局部比对算法进行比对(例如史密斯-沃特曼(Smith-Waterman))。当序列(当通过例如程序GAP或BESTFIT使用默认参数进行最佳比对时)共享至少某个最小百分比的序列同一性(如本文所定义)时,它们可以被称为“基本相同”或“基本相似”。序列同一性的百分比优选使用序列分析软件包(Sequence AnalysisSoftware Package
用于确定序列同一性的有用方法还披露于Guide to Huge Computers[大型计算机指南],Martin J.Bishop编辑,Academic Press[学术出版社],San Diego,1994,和Carillo,H.,和Lipton,D.,Applied Math[应用数学](1988)48:1073。更特别地,用于确定序列同一性的优选计算机程序包括基本局部比对搜索工具(BLAST)程序,该程序可从美国国立卫生研究院(National Institute of Health)(贝塞达斯(Bethesda),马里兰州(Md.)20894)的国立医学图书馆(National Library of Medicine)的国家中心生物技术信息(National Center Biotechnology Information,NCBI)公开获得;参见BLAST Manual[BLAST手册],Altschul等人,NCBI,NLM,NIH;Altschul等人,J.Mol.Biol.[分子生物学杂志]215:403-410(1990);BLAST程序的2.0版本或更高版本允许在比对中引入缺口(缺失和插入);对于肽序列,BLASTX可用于确定序列同一性;并且,对于多核苷酸序列,BLASTN可用于确定序列同一性。
可替代地,百分比相似性或同一性可以通过使用诸如FASTA、BLAST等算法搜索公共数据库来确定。因此,本文所述的核酸和蛋白序列可进一步用作“查询序列”来对公共数据库进行搜索,以例如鉴定其他家族成员或相关序列。可以使用Altschul等人(1990)J.Mol.Biol.[分子生物学杂志]215:403—10的BLASTn和BLASTx程序(版本2.0)来执行这样的检索。可以用BLAST程序(分值=100,字长=12)进行NBLAST核苷酸检索,以获得与本文描述的核酸分子同源的核苷酸序列。可以用BLASTx程序,得分=50,字长=3执行BLAST蛋白检索,以获得与本文描述的蛋白分子同源的氨基酸序列。为了获得用于比较目标的有缺口的比对,可以利用如在Altschul等人,(1997)Nucleic Acids Res.[核酸研究]25(17):3389-3402中所述的Gapped BLAST。当使用BLAST和缺口BLAST程序时,可以使用各程序(例如,BLASTx和BLASTn)的默认参数。请参阅美国国家生物技术信息中心的主页
如本文所用的,“核酸”或“多核苷酸”可包括嘧啶和嘌呤碱基(分别优选胞嘧啶、胸腺嘧啶和尿嘧啶,以及腺嘌呤和鸟嘌呤)的任何聚合物或寡聚物(参见AlbertL.Lehninger,Principles of Biochemistry[生物化学原理],在793-800(沃茨出版社[Worth Pub.]1982),出于所有目的通过引用以其全文并入本文)。涵盖任何脱氧核糖核苷酸、核糖核苷酸或核酸组分,及其任何化学变体,例如这些碱基的甲基化、羟甲基化或糖基化形式等。聚合物或寡聚物的组成可以是异质的或同质的,并且可以从天然存在的来源中分离或者可以是人工或合成产生的。另外,核酸可以是DNA(任选地cDNA)或RNA、或其混合物,并且可以以单链或双链形式永久或暂时存在,包括同源双链体、异源双链体和杂交状态。
“分离的核酸”用于指不再处于其天然环境中的核酸,例如体外或重组细菌或植物细胞中的。核酸和/或蛋白可以是重组的、合成的或人工的核酸和/或蛋白中的至少一种。
术语“核酸构建体”、“核酸载体”、“载体”和“表达构建体”在本文中可互换使用,并且在本文中定义为通过使用重组DNA技术产生的人造核酸分子。因此,术语“核酸构建体”和“核酸载体”不包括天然存在的核酸分子,尽管核酸构建体可以包含天然存在的核酸分子(的一部分)。
载体骨架可以例如是二元或超二元载体(参见例如美国专利号5,591,616、US2002138879和WO 95/06722)、共整合载体或T-DNA载体,如本领域已知的并且如如本文别处所述,其中整合了嵌合基因,或者如果已经存在合适的转录调节序列,则仅将所期望的核酸序列(例如编码序列、反义序列或反向重复序列)整合到转录调节序列的下游。载体可以包含另外的遗传元件以促进其在分子克隆中的使用,例如选择标记、多克隆位点等。
术语“基因”是指包含在细胞中被转录成RNA分子(例如mRNA)的可操作地连接到合适的调节区域(例如启动子)的区域(转录的区域)的DNA片段。基因通常包含几个可操作地连接的片段,例如启动子、5'前导序列、编码区和包含聚腺苷酸化位点的3'非翻译序列(3'末端)。
“基因的表达”是指这样的过程,其中与适当的调节区,特别是启动子可操作地连接的DNA区被转录成具有生物活性的RNA,例如能够被翻译成具有生物活性的蛋白或肽的RNA,或例如调节性非编码RNA。
术语“可操作地连接”是指处于功能关系中的多核苷酸元件的连接。当核酸被放置成与另一个核酸序列具有功能关系时,该核酸与另一个核酸序列“可操作地连接”。例如,如果启动子或转录调节序列影响编码序列的转录,则其可操作地连接至编码序列。可操作地连接可以意味着被连接的DNA序列是连续的。
“启动子”是指具有控制一个或多个核酸转录的功能的核酸片段。启动子片段优选位于基因转录起始位点的转录方向的上游(5'),并且结构特征为存在DNA依赖性RNA聚合酶的结合位点、转录起始位点并且可以进一步包含任何其他DNA序列,包括但不限于转录因子结合位点、阻遏蛋白和激活物蛋白结合位点以及本领域技术人员已知的直接或间接发挥作用以调节启动子的转录量的任何其他核苷酸序列。
“组成型”启动子是在大多数生理和发育条件下在大多数组织中具有活性的启动子。“诱导型”启动子是生理学上(例如通过外部应用某些化合物)或发育上调节的启动子。“组织特异性”启动子仅在特定类型的组织或细胞中具有活性。
任选地,术语“启动子”还可以包括5’UTR区(5'非翻译区)(例如,启动子在本文中可以包括转录区的翻译起始密码子上游的一个或多个部分,因为该区可能在调节转录和/或翻译中发挥作用)。
“3’UTR”或“3'非翻译序列”(也常称为3'非翻译区或3’末端)是指在基因编码序列下游发现的核酸序列,其包含例如转录终止位点和(在大多数但不是所有真核mRNA中)聚腺苷酸化信号(例如AAUAAA或其变体)。转录终止后,mRNA转录物可能会在聚腺苷酸化信号下游被切割,并且可能会添加聚(A)尾,这参与了mRNA向细胞质(翻译发生的地方)的运输。
术语“cDNA”是指互补DNA。互补DNA是通过将RNA逆转录成互补DNA序列而制成的。因此,cDNA序列对应于基因表达的RNA序列。由于从基因组表达的RNA序列在细胞质中翻译成蛋白之前可以经历剪接,即内含子从前mRNA剪接出来并且外显子连接在一起,因此可以理解,cDNA的表达意味着编码该cDNA的mRNA的表达。因此,cDNA序列可能与其对应的基因组DNA序列不相同,因为cDNA可能仅编码蛋白的完整开放阅读框(其由连接的外显子组成),而基因组DNA序列可以包含由内含子序列穿插的外显子序列。因此,对编码蛋白的基因进行遗传修饰可能不仅涉及修饰编码蛋白的序列,而且还可能涉及突变基因组DNA的内含子序列和/或该基因的其他基因调节序列。
术语“再生”在本文中定义为从单个植物细胞、一组细胞、愈伤组织、外植体、组织或器官形成新组织和/或新器官。再生可以包括从单个植物细胞或从例如愈伤组织、外植体、组织或器官形成新植物。用于再生的植物细胞可以是未分化的植物细胞。优选的植物细胞是原生质体。再生过程可以直接从亲本组织发生,也可以间接发生,例如通过愈伤组织的形成。再生途径可以是体细胞胚发生或器官发生。体细胞胚发生在本文中理解为体细胞胚的形成,体细胞胚可以长成完整植物。器官发生在本文中被理解为从(未分化的)细胞形成新器官。器官发生可以是分生组织形成、不定枝形成、花序形成、根形成、不定枝伸长和(随后)完整植物的形成中的至少一种。优选地,再生是芽再生、(异位)顶端分生组织形成和根再生中的至少一种。本文定义的芽再生是从头芽形成。例如,再生可以是从(伸长的)下胚轴外植体再生(花序)芽。
术语“正常生长条件”在本文中理解为植物生长的环境。这些条件至少包括合适的温度(即在0℃-60℃之间)、营养、光/暗节律和灌溉。
术语“允许再生的条件”在本文中理解为其中植物细胞或组织可以再生的环境,优选地包括正常生长条件。
“芽器官发生”是细胞,优选愈伤组织或外植体细胞从头形成芽顶端分生组织的再生途径,该芽顶端分生组织发育成具有叶原基和叶的芽。由于只有一个顶端分生组织,这是一种单极结构,在此阶段还没有形成根。芽的维管系统通常与母体组织相连。只有在芽完全形成和伸长,并从例如愈伤组织或外植体上取下后,才能在不同的培养基上在单独的根诱导步骤中诱导根的形成(Thorpe,TA(1993)In vitro Organogenesis and SomaticEmbryogenesis:Physiological and Biochemical Aspects.[体外器官发生和体细胞胚发生:生理和生化方面]在:Roubelakis-Angelakis K.A.,Van Thanh K.T.(编辑)Morphogenesis in Plants[植物的形态发生].NATO ASI系列(A系列:生命科学),第253卷.Springer[施普林格],波士顿,马萨诸塞州)。
芽器官发生可以自发发生,即无需外部添加任何植物生长调节剂(PGR)。芽器官发生可以由植物生长调节剂诱导,通常是不同浓度的单独细胞分裂素或与生长素组合,其中优选细胞分裂素保留为培养基的成分,直到新芽顶端分生组织和芽已形成并充分伸长,例如将它们从初级外植体或愈伤组织上取下。优选地,为了诱导芽形成,细胞分裂素的浓度超过生长素的浓度。
“体细胞胚发生”导致类似于合子胚的双极结构的形成,合子胚包含具有封闭的独立维管系统的根-茎轴。换句话说,根和芽原基同时形成,并且与下面的组织没有维管连接(Dodds,JH和Roberts,LW(1985)Experiments in plant tissue culture.[植物组织培养实验]Cambridge University Press[剑桥大学出版社],英国剑桥)。体细胞胚发生可以例如从愈伤组织或细胞悬浮液间接诱导,或者它们可以在外植体的细胞上直接诱导(Thorpe,同上)。体细胞胚的形成经历了许多不同的阶段,从球状阶段(小的等径细胞簇),经过心状阶段(双边对称结构)到鱼雷阶段(伸长)。球状到心状的转变以两个子叶的生长和胚根发育的开始为标志(Zimmerman,JL(1993)Somatic Embryogenesis:A Model for EarlyDevelopment in Higher Plants.[体细胞胚发生:高等植物早期发育的模式]The PlantCell[植物细胞]5:1411-1423;Von Arnold等人(2002)Developmental pathways ofsomatic embryogenesis.[体细胞胚发生的发育途径]Plant Cell,Tissue and OrganCulture[植物细胞、组织和器官培养]69:233–249)。最后,鱼雷阶段体细胞胚可以发育成含有绿色子叶、伸长的下胚轴和具有明显分化的根毛的发育胚根的小植株(Zimmerman,同上),这一过程被称为“萌发”(类似于合子胚)或“转化”或“成熟”(Von Arnold等人,同上)。在直接或间接诱导体细胞胚发生中,优选在初始阶段使用生长素来诱导愈伤组织中的胚发生状态,但在培养物传代至不含或含有降低的生长素水平的培养基后形成胚。用于体细胞胚诱导的生长素是例如1-萘乙酸(NAA)、2,4-二氯苯氧基乙酸(2,4-D)、毒莠定和麦草畏。
本发明上下文中与蛋白或核酸组合使用的术语“内源”是指所述蛋白或核酸仍然包含在植物内,即存在于其天然环境中。通常,内源基因会以其正常的遗传背景存在于植物中。
“植物激素”、“植物生长激素”、“植物生长调节剂”或“植激素”是影响植物细胞和组织的生长和/或发育的化学物质。植物生长调节剂由来自以下五组的化学品组成:生长素、细胞分裂素、赤霉素、脱落酸(ABA)和乙烯。除了五组主要化学品外,另外两类化学品通常被视为植物生长调节剂:油菜素内酯和多胺。
“
术语“目的序列”包括但不限于优选存在于细胞内的任何遗传序列,例如基因、基因的一部分、或基因内或邻近基因的非编码序列。目的序列可以存在于染色体、附加体、细胞器基因组(例如线粒体或叶绿体基因组)或可以独立于遗传物质主体存在的遗传物质(例如感染性病毒基因组、质粒、附加体、转座子)中。目的序列可以位于基因的编码序列内、转录的非编码序列(例如前导序列、尾随序列或内含子)内。所述目的序列可以存在于双链或单链核酸分子中。核酸序列优选存在于双链核酸分子中。目的序列可以是核酸内的任何序列,例如基因、基因复合物、基因座、假基因、调控区、高度重复区、多态性区或其部分。目的序列还可以是包含指示表型或疾病的遗传或表观遗传变异的区域。优选地,目的序列是双链体DNA的一小段或更长段的连续核苷酸序列(即多核苷酸),其中所述双链体DNA还包含与所述双链体DNA互补链中的目的序列互补的序列。目的序列可以是目的基因(优选内源目的基因),或者可以是目的基因的一部分。
具体实施方式
发明人发现,任选地携带可遗传突变或转基因的顽拗性植物的一个或多个细胞和/或组织在与再生性植物的一个或多个细胞和/或组织接触时可以直接再生。因此,本发明涉及顽拗性植物的再生和克隆繁殖和/或营养繁殖。另外,本发明涉及用于产生优选至少在克隆繁殖的组织或植物部分中和/或在用于有性生殖的种系祖细胞中携带可遗传突变或转基因的植物、优选顽拗性植物的方法。因此,一方面,本发明提供了增加或诱导顽拗性植物的细胞的再生能力和/或效率的方法,其中所述方法包括使所述细胞与再生性植物的细胞接触的步骤。
发明人发现,使用这样的方法可以容易地产生包含顽拗性植物的细胞或组织或由顽拗性植物的细胞或组织组成的芽,其中“顽拗性植物的”在本文中应理解为从在本发明的方法中与再生性植物的细胞接触的顽拗性植物的细胞再生。
因此,在一个方面,本发明提供了一种产生和选择植物的芽的方法,其中该方法包括以下步骤:
(a)将顽拗性植物的细胞与再生性植物的细胞接触;
(b)使步骤(a)中接触的细胞形成一个或多个芽;并且
(c)选择步骤(b)中形成的芽,其中所述芽的至少部分由该顽拗性植物的细胞组成。
步骤(b)优选包括形成多个芽,即多于一个芽。因此,本发明方法的步骤(c)可以包括从步骤(b)中形成的多个芽中选择芽的步骤,其中所述选择的芽的至少部分由顽拗性植物的细胞组成。
优选地,顽拗性植物或其细胞是在正常生长条件下不能再生或表现出差的再生效率的植物或细胞。任选地,顽拗性植物或其细胞在本领域已知的对于再生最佳的条件下不能再生或表现出较差的再生效率,所述条件例如但不限于允许在外部提供的生长调节剂存在下再生的条件。尽管在物种内可能存在顽抗性和再生性栽培品种、变种和/或种质,但一般来说,胡椒、大豆和甜菜是顽拗性植物的非限制性实例,并且其细胞是顽拗性植物细胞的非限制性实例。然而,本发明的方法可应用于在某些情况下受益于再生效率增加的所有植物或植物细胞。因此,本发明方法的步骤(a)的顽拗性植物或植物细胞特别是显示出比本发明方法的步骤(a)的再生性植物或植物细胞更低的再生效率的植物或植物细胞。在优选的实施例中,在合适的条件下,本发明方法的步骤(a)的顽拗性植物或植物细胞显示出比本发明方法的步骤(a)的再生性植物或植物细胞在对于再生性植物或植物细胞再生的适合的,优选最佳的条件下更低的再生效率。这种合适的和/或最佳的条件至少包括合适的营养物供应,任选地补充有激素。这样的条件还可以包括合适的和/或最佳的温度和/或光/暗状态。优选地,在本发明方法的步骤(b)中应用此类合适的和/或最佳的条件。优选地,步骤(a)的顽拗性植物或植物细胞是当暴露于本发明方法的步骤(b)中应用的类似条件(除了所述顽拗性植物或植物细胞不与所述再生性植物或植物细胞接触)时,与步骤(a)的再生性植物或植物细胞相比显示出较低再生效率和/或能力的植物或植物细胞。换言之,步骤(a)的顽拗性植物或植物细胞是当顽拗细胞和再生性细胞暴露于如本发明方法的步骤(b)中所应用的类似条件时,优选在不存在如本文所定义的接触步骤(a)的情况下,与步骤(a)的再生性植物或植物细胞相比,表现出较低的再生效率和/或能力的植物或植物细胞。这些条件优选是适合再生性植物或其细胞再生的条件。技术人员知道适合再生性植物细胞再生的条件。这样的条件可以是顽拗性植物细胞正常情况下(即,当不与再生性细胞接触时)不显示、几乎不显示再生的条件。
优选地,本发明方法的步骤(b)在适合再生性植物或其细胞再生的条件下进行。任选地,本发明方法的步骤(b)可以在这样的条件下进行,在该条件下,与再生性植物的细胞不同,顽拗性植物的细胞当不与所述再生性植物细胞接触时不显示或几乎不显示任何再生。
优选地,本发明方法的步骤(a)的顽拗性植物细胞和再生性植物细胞是体细胞。任选地,顽拗性植物或植物细胞被修饰以包含正选择标志物。本领域已知的顽拗性植物的典型非限制性实例是辣椒(辣椒(Capsicum annuum))、糖用甜菜(甜菜(Beta vulgaris),更特别是甜菜亚种vulgaris)、大豆(黄豆(Gycine max))、太阳花(向日葵(Helianthusannuus))、棉花(陆地棉(Gossipium hirsutum))、大麻或大麻属(大麻(Cannabissativa))、草莓(草莓(Fragaria×ananassa))、啤酒花(蛇麻(Humulus lupulus))、甜瓜(香瓜(Cucumis melo))和胡瓜(黄瓜(Cucumis sativus))。顽拗性植物可以是不显示或几乎不显示任何再生的植物,但也可以是可以(进一步)改善再生的植物。因此,并且如本文所示例的,顽拗性植物可以是但不限于辣椒(Capsicum annuum)、马铃薯(Solanum tuberosum)或短角蒲公英(Taraxacum brevicorniculatum)。同样,顽拗性植物的细胞可以是但不限于辣椒、马铃薯或短角蒲公英的细胞。
优选地,本发明方法的步骤(a)的再生性植物(或其细胞)能够在正常生长条件下再生,优选在没有外部提供的生长调节剂如生长素和/或细胞分裂素的情况下允许植物(或其细胞)再生的条件。优选地,在这样的条件下,再生性植物可以在多细胞组织上从头形成芽。再生优选是器官发生和体细胞胚发生中的至少一种。优选地,再生性植物能够在体内断头(即除去所有预先形成的芽顶端分生组织)后再生芽。尽管在物种内可能存在顽拗品种和再生性栽培品种、变种和/或种质,但一般来说,番茄和烟草、小米辣椒、茄子、马铃薯的幼苗下胚轴是本领域已知的再生性外植体的实例。
再生性植物或植物细胞可以是天然存在的再生性植物或植物细胞,即具有天然再生能力的植物或植物细胞。可替代地,可以对植物或植物细胞进行遗传修饰以增加再生潜力。此类植物或植物细胞的实例包括但不限于WO 2019/211296和WO 2019/193143(将其通过引用并入本文)中披露的植物和植物细胞。作为非限制性实例,再生性植物或植物细胞可以是经修饰以诱导或增加优选如WO 2019/193143中所述选自由CHK4、CHK2和CHK3组成的组氨酸激酶的表达的植物或植物细胞。另外地或可替代地,再生性植物或植物细胞是经修饰以优选瞬时地诱导或增加以下与再生相关的转录因子的表达的植物或植物细胞:优选地
WUSCHEL相关同源盒蛋白(优选地WOX5,任选地SEQ ID NO:16的AtWox5)、PLETHORA蛋白(优选地PLT1,任选地SEQ ID NO:17的AtPLT1)和伤口诱导的去分化1蛋白(WIND1,任选地SEQ ID NO:18的AtWIND1)中的至少一种,优选WOX5和PLT1两者,甚至更优选WOX5、PLT1和WIND1,如WO 2019/211296中所述。优选地,所述转录因子处于诱导型启动子的控制下,并且通过将细胞暴露于导致诱导所述诱导型启动子的药剂来诱导再生。任选地,再生性植物或植物细胞是由如WO 2019/211296中所述的芽再生-2载体或芽再生载体转染的植物或植物细胞。所述载体可以通过瞬时或稳定转染引入,并且可以通过将接触的细胞暴露于地塞米松和雌二醇中的至少一种、优选地塞米松和雌二醇两者来诱导再生,因为与再生相关的所示转录因子受可通过施用这些化合物来诱导的启动子的控制(在这方面参考WO 2019/211296)。另外地或可替代地,再生性植物可以是在内源基因中具有导致再生能力和/或效率增加的突变的植物。非限制性实例是本领域已知的,例如Duclerq等人描述的ATHB15突变体(Plant biology[植物生物学],2011,13,p317-324),Shang等人描述的KCS1突变体(PNAS[美国国家科学院院刊]2016,113,5101-5106),Buechel等人描述的ARR突变体(EuropeanJournal of Cell Biology[欧洲细胞生物学杂志]2010,89:279–284)和Lee等人描述的ATRXR2突变体(2021)Cell Reports[细胞报道]37,1-13。
任选地,再生性植物或植物细胞经修饰以包含负选择标志物。再生性植物或植物细胞可以是但不限于小米辣椒(Capsicum baccatum)、番茄(Solanum lycopersicum)和菊苣。具体地,本发明方法的步骤(a)的再生性植物或植物细胞是与本发明方法的步骤(a)的顽拗性植物或植物细胞相比显示出更高再生效率的植物或植物细胞。优选地,本发明方法的步骤(a)的再生性植物或植物细胞是与本发明方法的步骤(a)的顽拗性植物或植物细胞相比,在对于再生性植物或植物细胞再生适合的,优选最佳的条件下表现出更高再生效率的植物。这种合适的和/或最佳的条件至少包括合适的营养物供应,任选地补充有激素。这样的条件还可以包括合适的和/或最佳的温度和/或光/暗状态。
优选地,本发明方法的步骤(a)的顽拗性植物或植物细胞具有与本发明方法的步骤(a)的再生性植物或植物细胞不同的基因型。本发明方法的步骤(a)的顽拗性植物或植物细胞和再生性植物或植物细胞可以属于不同属或相同属。优选地,本发明方法的步骤(a)的顽拗性植物或植物细胞和再生性植物或植物细胞属于相同属。任选地,本发明方法的步骤(a)的顽拗性植物细胞和再生性植物细胞属于不同物种。优选地,本发明方法的步骤(a)的再生性植物或植物细胞是能够通过传统育种方法与本发明方法的步骤(a)的顽拗性植物或植物细胞交换遗传物质的植物或植物细胞。优选地,顽拗性植物的细胞可以与再生性植物的细胞杂交。
作为非限制性实例,顽拗性植物细胞和再生性植物细胞均可属于茄属或辣椒属。例如,顽拗性植物或其细胞可以是辣椒并且再生性植物或其细胞可以是小米辣椒。类似地,顽拗性植物或其细胞可以是马铃薯并且再生性植物或其细胞可以是番茄。此外,顽拗性植物或其细胞可以是短角蒲公英并且再生性植物或其细胞可以是菊苣。
在优选的实施例中,与本发明方法的步骤(a)的再生性植物或植物细胞相比,本发明方法的步骤(a)的顽拗性植物或植物细胞是在允许再生但彼此不接触的相同或相似条件下显示较低再生能力和/或效率的植物。所述条件优选是适合再生性和顽拗性植物或其植物细胞的正常生长条件。更优选地,所述条件是允许再生的条件,甚至更优选地,所述条件是允许在不存在外部供应的生长调节剂(例如通过人为干扰添加化学品)的情况下再生的条件。在优选的实施例中,所述条件至少是再生性植物或植物细胞的再生所需的最低条件。任选地,所述条件至少是用于再生性植物或植物细胞再生的合适条件和任选地最佳条件。
一方面,本发明涉及产生和选择植物的芽的方法,其中所选择的芽包含顽拗性植物的种系祖细胞,即从本发明方法的步骤(a)的顽拗性植物细胞再生的种系祖细胞。因此,任选地,本发明的方法包括以下步骤:
(a)使顽拗性植物的细胞与再生性植物的细胞接触;
(b)使步骤(a)中接触的细胞形成一个或多个芽;并且
(c)选择步骤(b)中形成的芽,其中所述芽包含顽拗性植物的种系祖细胞。
另外地或可替代地,本发明涉及产生和选择植物的芽的方法,其中芽包含产生顽拗性植物的克隆繁殖组织和/或植物部分(即由本发明方法的步骤(a)的顽拗性植物细胞再生的克隆繁殖的组织和/或植物部分)的细胞。因此,任选地,本发明的方法包括以下步骤:
(a)使顽拗性植物的细胞与再生性植物的细胞接触;
(b)使步骤(a)中接触的细胞形成一个或多个芽;并且
(c)选择步骤(b)中形成的芽,其中所述芽包含产生顽拗性植物的克隆繁殖的组织和/或植物部分的细胞。
任选地,顽拗性植物的经接触细胞在步骤(b)中形成愈伤组织,并且从愈伤组织生长出芽。因此,在实施例中,本发明的方法是产生并任选地选择包含顽拗性植物的种系祖细胞的植物的芽的方法,其中该方法包括以下步骤:
(a)使顽拗性植物的细胞与再生性植物的细胞接触;
(b)允许步骤(a)的顽拗性植物的经接触细胞形成愈伤组织并允许从愈伤组织生长出芽;并且
(c)选择在步骤(b)中获得的包含顽拗性植物的种系祖细胞的芽。
因此,优选地,本发明的方法包括选择芽的步骤(c),其中所述芽的至少一部分由顽拗性植物的细胞组成(即由步骤(a)的顽拗性植物细胞再生),并且其中所述部分是以下至少之一:
i)包含种系祖细胞的组织;以及
ii)包含产生克隆繁殖的组织和/或克隆繁殖的植物部分的细胞的组织。
克隆繁殖的组织和/或植物部分在本文中理解为可用于克隆繁殖至后代即后续世代的植物的组织和/或植物部分。此类组织和/或植物部分可以是但不限于块茎、鳞茎、球茎、小球茎、吸盘、插条、冠、珠芽、根茎、茎的顶端部分、芽或根切条、基节或短截茎,匍匐茎、块茎切条或芽眼、(克隆繁殖的)种子等。因此,克隆繁殖的植物部分或组织(产生克隆繁殖的植物部分或组织的细胞)的基因型决定了克隆繁殖的植物的后代的基因型,并且在该组织或部分(产生该组织或部分的细胞)中进行的任何基因组修饰可以延续到一个或多个后续世代。因此,在克隆繁殖的植物部分(产生克隆繁殖的植物部分的细胞)中产生的转基因或突变是可遗传的转基因或突变。
种系祖细胞在本文中被理解为最终分化成配子的那些细胞或其克隆后代。因此,种系祖细胞的基因型决定了配子的基因型,并且在种系祖细胞中进行的任何基因组修饰将被延续到一个或多个后续世代。因此,引入种系祖细胞中的转基因或突变是可遗传的,即可遗传的转基因或可遗传的突变。L2芽分生组织层可以决定配子的基因型(参见例如Filippis等人Using a periclinal chimera to unravel layer-specific geneexpression in plants[利用周缘嵌合体揭示植物中层特异性基因表达],The PlantJournal[植物杂志],2013,75:1039-1049)。优选地,在步骤(c)中,所选择的芽的由顽拗性植物的细胞组成的部分是包含种系祖细胞的组织。因此,优选地,本发明方法的种系祖细胞源自顽拗性植物的L2芽分生组织层(即,从本发明方法的步骤(a)的顽拗性植物细胞再生的L2分生组织层)。本发明方法的步骤(c)中选择的芽还可包含顽拗性植物的L1和L3芽分生组织层中的至少一个。任选地,所述芽包含顽拗性植物的L1、L2和L3芽分生组织层。可替代地,本发明方法的步骤(c)中选择的芽可包含从步骤(a)的顽拗性植物细胞再生的L2芽分生组织层和从步骤(a)的再生性植物细胞再生的L1和L3芽分生组织层中的至少一个。在本发明方法的步骤(b)中生长并在步骤(c)中选择的芽或至少一个芽可以是不定芽或至少一个不定芽。
在本发明方法的步骤(a)中,使顽拗性植物的细胞与再生性植物的细胞接触。任选地,在本发明方法的步骤(a)中,使顽拗性植物的一个或多个细胞与再生性植物的一个或多个细胞接触。接触步骤(a)可以使用本领域技术人员已知的任何常规方法进行。接触步骤优选地要求顽拗性植物的细胞与再生性植物的细胞物理接触。细胞的物理接触在本文中应理解为细胞通过细胞-细胞接触、任选地通过聚集细胞的试剂或接头的稳定关联或聚集。优选地,胞间连丝形成于具有物理接触的细胞之间。优选地,细胞-细胞接触使得形成共享细胞壁。因此,优选地,顽拗性植物的细胞与再生性植物的细胞之间的接触导致例如共享细胞壁和/或胞间连丝。
作为非限制性实例,该接触步骤可以包括本领域已知的任何体外技术,例如用于产生周缘嵌合体的常规技术:这些技术可以包括以下中至少一项:
(1)细胞共培养,其中将来自再生性植物和顽拗性植物的邻接茎切片一起培养成愈伤组织,并从这些愈伤组织再生不定芽,优选在补充激素的体外生长培养基上。
(2)混合的愈伤组织培养物,其中将再生性植物和顽拗性植物的细胞悬浮液混合,混合物生长成愈伤组织,并从这些愈伤组织再生不定芽,优选在补充激素的体外生长培养基上。
(3)原生质体共培养,其中将再生性植物和顽拗性植物的原生质体悬浮液包埋在任选的琼脂糖中,并以非常高的细胞密度生长,然后再生芽,优选在补充激素的体外生长培养基上。
(4)体外嫁接培养,其中再生性植物和顽拗性植物沿着它们的下胚轴或节间嫁接,优选在无菌条件下。其中一种植物是“接穗”,另一种是“砧木”。培养嫁接连接处的横截面以诱导不定愈伤组织和芽。此类技术属于组织培养的共同点,并且由多种不同的方案组成,这些方案特定针对单个植物品系或物种。技术人员将知道如何将两种不同植物的细胞放在组织培养中以再生芽。有关植物嵌合体的详细评论,请参阅Richard A.E.Tilney-Bassett所著的“Plant Chimeras[植物嵌合体]”(剑桥大学出版社,1991年)。任选地,在本发明的方法中,任选地如本文进一步指定,实施上述技术中的任何一种,从而产生包含从顽拗性植物细胞再生的组织或由其组成的至少一个(不定)芽,优选地所述组织包含种系祖细胞,和/或产生克隆繁殖的组织和/或克隆繁殖的植物部分。
任选地,本发明方法的步骤(a)中的顽拗性植物的细胞和再生性植物的细胞包含在组织和/或植物部分中。本发明方法的接触步骤(a)可以通过嫁接顽拗性植物和再生性植物来进行,其中一种作为砧木,另一种作为接穗。优选地,砧木是再生性植物并且接穗是顽拗性植物。因此,优选地,步骤(a)的接触通过将顽拗性植物的接穗嫁接到再生性植物的砧木上来进行。可替代地,砧木可以是顽拗性植物,接穗可以是再生性植物,并且步骤(a)的接触通过将再生性植物的接穗嫁接到顽拗性植物的砧木上来进行。嫁接通常包括允许接穗和砧木以维管组织生长在一起以形成嫁接连接部的方式连接在一起的步骤。
优选地,从砧木植物移除的芽包含顶芽,从而形成“断头”植物。芽断头优选在下胚轴或上胚轴或节间。优选地,将子叶节嫁接到断头的下胚轴砧木上。在嫁接连接处可能会形成薄愈伤组织条。
嫁接可以是将接穗嫁接到砧木上,本文也称为砧木-接穗嫁接。然而,本领域技术人员理解,变化是可能的并且这些变化被包括在本发明的方法中。作为非限制性实例,可再生性植物的一部分或“切片”可以相互嫁接在砧木和顽拗性植物的接穗之间。优选地,幼小植物材料用于嫁接,其中所述幼小植物材料是播种后1-4周或1-3周之间的幼苗材料,优选使用播种后约2周的材料。优选地,用于嫁接的幼小植物材料是0.1至1mm、0.1至0.75mm、0.1至0.5mm、或0.1至0.25mm的幼苗材料。优选地,在第一片真叶刚刚发育之后使用幼苗材料。优选地,在所述嫁接过程中,使用(微小)钢销、优选无菌钢销来对准和固定所述幼苗材料。所述钢销可以插入砧木和接穗的中心,如本文所例示的(例如参见图1)。另外地或可替代地,可以在两个嫁接配偶体周围使用系带、胶带、带子和/或夹子以将它们固定在一起,并且任选地可以在嫁接连接处的边缘使用粘合剂(胶水、蜡或浆糊)进行固定。
在嫁接连接处,砧木和接穗的维管组织相互连接,使养分和水分从砧木转移到接穗。应当理解,本发明的该实施例中的顽拗性植物和再生性植物,即在本发明方法的接触步骤(a)中利用嫁接的植物,是天然能够形成嫁接连接的植物。优选地,顽拗性植物和再生性植物都是双子叶植物。任选地,顽拗性植物和再生性植物都是单子叶植物。任选地,使用幼小植物材料进行嫁接,例如从体外微繁殖获得的幼小植物材料、幼苗材料或种子。例如在WO2020/099878和WO 2020/099879(其通过引用并入本文)中提供了用于嫁接单子叶植物的这种方法。
嫁接联合体愈合后,可随后被切断或“受伤”,导致愈伤组织和不定芽的产生。在这些不定芽中,包含顽拗性植物细胞或由顽拗性植物细胞组成(例如包含顽拗性植物的种系祖细胞和/或顽拗性植物的克隆繁殖的植物组织和/或植物部分)的芽可以自发出现。
优选在嫁接联合体的顽拗性植物和再生性植物之间的交叉处进行切割。优选地,切割使得接穗细胞的薄层留在顶部。优选地,这些接穗细胞是来自顽拗性植物的细胞。优选地,切口正好在嫁接连接愈合处。因此,优选地步骤(b)可包括在嫁接连接处或附近产生伤口并允许在受伤的嫁接连接处形成愈伤组织的步骤。
伤口可以是完全切割,例如横向切割,将嫁接物分成两个植物部分。任选地,伤口不将嫁接联合体完全分离成两个植物部分,但足以引发和/或刺激愈伤组织的产生。任选地,通过从嫁接连接处取出组织切片并随后培养该切片以允许愈伤组织形成来进行形伤口。优选地,芽由所述愈伤组织生长,其中所述芽可包含由顽拗性植物细胞再生的组织或由其组成。换言之,优选地从所述愈伤组织生长出芽,其中所述芽的至少一部分由顽拗性植物的细胞组成。这种特殊的方法是在生长室或温室的环境条件下实施的。
因此,任选地,步骤(a)的接触通过将顽拗性植物的接穗嫁接在再生性植物的砧木上并允许嫁接连接处愈合来进行。任选地,所述方法还包括在步骤(b)中仅在嫁接连接处或附近产生伤口、允许在(受伤的)嫁接连接处形成愈伤组织并且允许芽从所述愈伤组织生长的步骤,并且其中所述芽的至少一部分由顽拗性植物的细胞组成。
在优选的实施例中,本发明的方法是生成和选择芽的方法,包括以下步骤:
(a)通过将顽拗性植物和再生性植物之一的接穗嫁接到顽拗性植物和再生性植物中另一个的砧木上使顽拗性植物的细胞与再生性植物的细胞接触,并允许在接穗和砧木之间形成嫁接连接以获得嫁接联合体;
(b)通过在嫁接连接处或附近产生伤口,允许步骤(a)的顽拗性植物的经接触细胞形成愈伤组织,并允许一个或多个芽从愈伤组织生长;并且
(c)选择步骤(b)中生长的芽,其中所述芽的至少部分由该顽拗性植物的细胞组成。
任选地,步骤(c)中所选择的芽内的顽拗性植物的一个或多个细胞是种系祖细胞。任选地,步骤(c)中所选择的芽内的顽拗性植物的细胞产生克隆繁殖的组织和/或植物部分。
优选地,在步骤(a)中,再生性植物和顽拗性植物是幼苗或幼小营养体(任选体外)克隆植物,优选如本文所定义,并且嫁接可以通过在所述接穗和砧木的中心插入钢销来对准和固定而便利进行。如上所述,可使用替代方法来使不同植物的细胞接触。
在可替代的实施例中,本发明方法的接触步骤(a)可以通过将顽拗性植物的一个或多个分离的细胞与再生性植物的一个或多个分离的细胞接触来进行。因此,步骤(a)的顽拗性植物的细胞和再生性植物的细胞可以是分离的细胞,优选原生质体。这样的分离的细胞可以是单细胞。优选地,接触步骤(a)通过使顽拗性植物的原生质体与再生性植物的原生质体接触来进行。优选地,用促进细胞的细胞膜聚集的化合物处理本发明方法的步骤(a)中的分离的细胞。
优选地,在该方法中,顽拗性植物和再生性植物的一个或多个分离的细胞是原生质体。在优选的实施例中,使用本领域已知的促进这些原生质体膜粘附的方法,例如但不限于由以下中的至少一个介导的聚集,来使顽拗性植物和再生性植物的原生质体接触:聚乙二醇(PEG)、Yariv抗原或试剂(1,3,5-三(4-β-D-吡喃葡萄糖氧基苯基偶氮)-2,4,6-三羟基苯)、生物素-链霉亲和素和抗体(例如参见Yariv等人(1962)Biochem.J.[生物化学杂志]85,383–388;Hartmann等人Planta[植物学](Berl.)1973,112;45-56;Larkin,J.Cell Sci.[细胞科学杂志]1978,30;283-282;Kesteren和Tempelaar,Plant Science[植物科学]1993,93;131-141)。这种方法可以包括促进原生质体彼此紧密接近的处理,例如通过用PEG处理,优选使用包含约15% PEG的溶液,其中所述PEG优选是PEG 3350MW。优选地,所述PEG溶液是如下文实例中示例的PEG溶液。可替代地或另外地,此类方法可以包括中和正常表面电荷的处理,使得凝集的原生质体可以紧密接触,例如用高Ca
(a1)再生性植物的原生质体和顽拗性植物的原生质体的分离;
(a2)将分离的顽拗性植物的原生质体与分离的再生性植物的原生质体混合;
(a3)用PEG处理混合物;以及
(a4)用中和性溶液处理混合物。
任选地,在步骤(a2)之前和步骤(a1)之后,用抑制有丝分裂的药剂处理再生性植物的原生质体。
另外地或可替代地,这样的方法可以包括通过将植物细胞的细胞膜和/或原生质体连接在一起来促进原生质体的粘附或凝集的步骤。换句话说,优选地,可以在本发明方法的步骤a)中使用将植物细胞的细胞膜连接在一起的连接试剂。
优选地,连接试剂结合、优选选择性结合植物细胞上存在的半乳聚糖和/或阿拉伯半乳聚糖蛋白(AGP),从而将植物细胞连接在一起。
优选的连接试剂是Yariv。Yariv(1,3,5-三(对糖基氧基苯偶氮)-2,4,6-三羟基苯)是一种能够连接原生质体的化合物。优选地,在本发明的方法中,使用包含选自由以下组成的组的糖基的Yariv,该组由以下组成:葡萄糖、半乳糖或甘露糖、麦芽糖、木糖、乳糖和纤维素。优选地,Yariv包含三个β-D糖基基团。因此,在进一步优选的实施例中,本发明方法的步骤(a)包括以下(子)步骤:
(a-i)再生性植物的原生质体和顽拗性植物的原生质体的分离;
(a-ii)将再生性植物的原生质体与顽拗性植物的原生质体混合;
(a-iii)用原生质体连接试剂处理混合物;以及
(a-iv)回收连接的原生质体。
在步骤(a-iv)中,优选充分洗涤(连接的)原生质体,优选使用原生质体培养基,例如但不限于9M(9%(w/v)甘露醇、140mg/L CaCl
本发明还提供了连接植物细胞膜的药剂用于再生如本文定义的顽拗性植物细胞的用途。优选地,所述连接剂是β-D-半乳糖基Yariv。
优选地,在接触和/或连接之前,将再生性植物的原生质体和顽拗性植物的原生质体以约1:1、1:2、1:3、1:4、1:5等的比例混合,这取决于细胞类型和/或物种。顽拗性植物细胞的丰度超过再生性植物细胞的丰度可能是优选的,以防止再生性植物细胞可能胜过顽拗性植物细胞。优选地,步骤(a)中的接触是通过以下来进行的:将混合的原生质体(优选约10至约100个原生质体)强迫在一起从而进一步增加它们之间的接触,优选在用如本文所示的连接剂处理原生质体混合物之后或期间(即在步骤(a-iii)期间或之后)。这可以使用本文示例的网来实现,使得多个原生质体在网的孔中彼此物理接触。在优选的方法中,在本发明方法的步骤(a)中用连接剂处理原生质体期间,多个原生质体彼此接触。连接,优选使用Yariv试剂连接,优选进行约15至约30分钟。
步骤(b)在允许再生性植物或植物细胞再生的条件,优选适合芽形成的条件下进行。这些条件在本文中被理解为至少是再生性植物或植物细胞再生的最低要求,其通常至少包括所述植物或植物细胞的正常生长条件。优选地,步骤(b)在适合于步骤(a)的再生性植物或再生性植物细胞再生的条件下进行。优选地,步骤(b)包括在芽形成之前形成愈伤组织。因此,步骤(b)可包括子步骤(b1),允许至少顽拗性植物的经接触细胞形成愈伤组织;以及(b2)允许芽从所述愈伤组织生长,其中任选地(b1)和(b2)的培养条件不同。更具体地,步骤(b1)可以在适合至少再生性植物的细胞形成愈伤组织的条件下进行;以及步骤(b2)可以在适合再生性植物愈伤组织形成芽的条件下进行。技术人员知道适合再生性植物的愈伤组织和/或芽再生的条件。优选地,在步骤(b)中,除了顽拗性植物细胞之外,再生性细胞也再生形成芽。任选地,除了顽拗性植物细胞之外,步骤(b1)中的再生细胞也再生形成愈伤组织,并且任选地,所述愈伤组织也在步骤(b2)中再生形成芽。因此,任选地,在步骤(b)、(b1)和/或(b2)中,再生性细胞和顽拗性细胞共同再生。
愈伤组织可以在步骤(b)的再生过程期间通过(芽)器官发生或体细胞胚发生形成。形成的愈伤组织的量可能取决于,例如本发明方法中使用的植物物种和/或使用的允许芽形成的条件。所述愈伤组织的形成,例如在体外和/或嫁接和创伤后,可以自发发生,即在没有一种或多种外部提供的植物激素的情况下。类似地,步骤(b)中芽的形成,例如在任选的愈伤组织形成之后,可以因此在没有一种或多种外部提供的植物激素的情况下自发发生。可替代地,所述愈伤组织的形成可以在一种或多种植物激素的存在下被诱导和/或增强。可替代地或另外地,步骤(b)中芽的形成可在一种或多种植物激素存在下诱导和/或增强。
在特定实施例中,在本发明方法的步骤(a)中的细胞接触和步骤(b)中的芽形成之间,愈伤组织的形成最少。这是特别优选的,以避免再生性植物的细胞胜过顽拗性植物的细胞。因此,最小愈伤组织阶段可以增加包含顽拗性植物的细胞或由顽拗性植物的细胞组成的芽生长的机会。
为了诱导植物组织中的芽再生,可以使用一种或多种细胞分裂素和一种或多种生长素的组合。
可用于本发明方法的细胞分裂素可以是腺嘌呤型细胞分裂素或苯脲型细胞分裂素。类似地,细胞分裂素可以是天然产生的植物激素或可以是合成的化合物。腺嘌呤型细胞分裂素可以是在根、种子和果实中的至少一种中合成的植物激素。此外,形成层和其他活跃分裂的组织也可以合成细胞分裂素。天然存在的腺嘌呤型细胞分裂素的非限制性实例是玉米素及其代谢前体2iP。合成的腺嘌呤型细胞分裂素的非限制性实例是激动素和6-苄氨基嘌呤(BAP)。经取代的脲化合物,例如噻苯隆和CPPU不存在于植物中,但可以在组织培养中充当细胞分裂素。腺嘌呤型细胞分裂素可以选自由以下组成的组:激动素、玉米素、反式玉米素、顺式玉米素、二氢玉米素、6-苄基氨基嘌呤和2iP及其组合。苯脲型细胞分裂素可以是二苯脲或噻苯隆。本领域已知添加的细胞分裂素的类型取决于植物细胞的类型,并且如果需要,技术人员可以直接选择合适的一种或多种细胞分裂素。
可替代地或另外地,植物激素可以是生长素。生长素可以是内源合成的生长素。内源合成的生长素可以选自由以下组成的组:吲哚-3-乙酸(IAA)、4-氯吲哚-3-乙酸、苯乙酸、吲哚-3-丁酸和吲哚-3-丙酸。生长素可以是合成的生长素,例如生长素类似物。合成的生长素可以是1-萘乙酸、2,4-二氯苯氧基乙酸(2,4-D)、α-萘乙酸(α-NAA)、2-甲氧基-3,6-二氯苯甲酸(麦草畏)、4-氨基-3,5,6-三氯吡啶甲酸(毒莠定或氨氯吡啶酸)、1-萘乙酸(NAA)、吲哚-3-丁酸(IBA)和2,4,5-三氯苯氧基乙酸(2,4,5-T)中的至少一种。生长素可以是1-萘乙酸(NAA)。
对于通过细胞分裂素和生长素的组合进行的芽器官发生,优选地,细胞分裂素与生长素的比率应当优选>1(Dodds,JH和Roberts,LW(1985)Experiments in plant tissueculture.[植物组织培养实验]Cambridge University Press[剑桥大学出版社],英国剑桥)。
任选地,在步骤(b)中,首先刺激愈伤组织形成(步骤b1),随后刺激芽形成(步骤b2)。步骤(b1)可以使用允许再生性植物愈伤组织形成的条件来进行。任选地,使用允许再生性植物愈伤组织形成的最低条件进行步骤(b1)。在优选的实施例中,使用再生性植物愈伤组织形成的最佳条件进行步骤(b1)。步骤(b2)可以使用允许再生性植物芽形成的条件来进行。任选地,使用允许再生性植物芽形成的最低条件进行步骤(b2)。在优选的实施例中,使用再生性植物芽形成的最佳条件进行步骤(b2)。
本发明的方法还可包括从步骤(c)中选择的芽生长植物的步骤(d)。
任选地,在本发明方法的步骤(c)中,选择包含顽拗性植物的种系祖细胞的芽。这样的芽可以产生包含衍生自步骤(a)中使用的顽拗性植物细胞的种系祖细胞和/或种系细胞(例如配子、卵细胞、精子细胞)的植物。生殖细胞可以形成有性生殖的配子。此类植物随后可用于产生种子,其中所述种子包含胚,并且其中胚的至少部分基因型衍生自本发明方法的步骤(a)的顽拗性植物细胞,任选地,种子通过自交或回交获得。
任选地,在本发明方法的步骤(c)中,选择包含可产生顽拗性植物的克隆繁殖的组织或植物部分(即,可产生从本发明方法的步骤(a)的顽拗性植物细胞再生的克隆繁殖的组织和/或植物部分)的细胞的芽。这样的芽可以产生包含衍生自顽拗性植物细胞的可以用于克隆繁殖的植物部分的植物。这样的植物部分具有与本发明方法的步骤(a)的顽拗性植物细胞相同或基本上相同的基因型。
所选择的芽可以基本上不含再生性植物的细胞。这样的芽可以由顽拗性植物的细胞(即从顽拗性植物细胞再生的细胞)组成,并且可以用于通过所述芽的(营养)繁殖,即通过从所述芽生长出完整的植物来产生顽拗性植物。选择芽的步骤可以使用本领域技术人员已知的任何常规方法来进行。
选择可以包括确定表型特征和/或分子标志物的步骤,该表型特征和/或分子标志物存在于顽拗性植物的细胞中和/或存在于顽拗性植物的芽分生组织层中,但不存在于再生性植物的细胞中和/或不存在于再生性植物的芽分生组织层中。可替代地或另外地,选择可以包括确定表型特征和/或分子标志物的步骤,该表型特征和/或分子标志物不存在于顽拗性植物的细胞中和/或不存在于顽拗性植物的芽分生组织层中,但存在于再生性植物的细胞中和/或存在于再生性植物的芽分生组织层中。优选地,选择可以包括确定表型特征和/或分子标志物的步骤,该表型特征和/或分子标志物存在于顽拗性植物的种系祖细胞和/或克隆繁殖的植物部分中,但不存在于再生性植物的种系祖细胞和/或克隆繁殖的组织和/或植物部分中。可替代地或另外地,选择可以包括确定表型特征和/或分子标志物的步骤,该表型特征和/或分子标志物不存在于顽拗性植物的种系祖细胞和/或克隆繁殖的组织和/或植物部分中,但存在于再生性植物的种系祖细胞和/或克隆繁殖的组织和/或植物部分中。分子标志物优选是存在于顽拗性植物或再生性植物中的基因组序列。
可替代地或另外地,步骤(c)和/或(d)可包括使(再生的)芽与对表达负选择标志物的(植物)细胞有毒的化合物接触的步骤。在该实施例中,负选择标志物在再生性植物的细胞中表达,优选负选择标志物至少在再生性植物的种系祖细胞和/或克隆繁殖的组织和/或植物部分中表达。任选地,毒性选择标志物由再生性细胞(的基因组)编码,任选地在诱导型启动子的控制下。通过将此类细胞暴露于激活诱导型启动子的物质,毒性选择标志物被表达并且优选地再生性细胞死亡。任选地,毒性选择标志物的前体由再生性细胞(的基因组)编码。通过将此类细胞暴露于激活前体向有毒成分的转化的物质,优选地由此杀死再生细胞。
可替代地或另外地,步骤(c)和/或(d)可包括使(再生的)芽与对(植物)细胞有毒但可通过正选择标志物的表达转化为无毒化合物的化合物接触的步骤。在该实施例中,正选择标志物在顽拗性植物的芽分生组织层中表达,优选地,正选择标记至少在顽拗性植物的种系祖细胞和/或克隆繁殖的组织和/或植物部分中表达。
在优选的实施例中,在本发明方法的步骤(c)中选择的产生的芽的至少一个或多个种系祖细胞和/或克隆繁殖的组织和/或植物部分包含转基因或目的序列中的突变。优选地,所产生的芽的L1-、L2-和/或L3-芽分生组织层中的至少一个包含转基因或目的序列中的突变。优选地,所产生的芽的至少L2芽分生组织层包含转基因或目的序列中的突变。
转基因或突变可以存在于本发明方法的步骤(a)的顽拗性植物的细胞中,并且任选地存在于本发明方法的步骤(a)的再生性植物的细胞中。优选地,转基因或突变存在于本发明方法的步骤(a)的顽拗性植物的细胞中。优选地,转基因或突变至少存在于本发明方法的步骤(c)中选择的产生的芽的顽拗性植物的种系祖细胞和/或克隆繁殖的组织和/或植物部分中。任选地,转基因或突变存在于步骤(c)中选择的所产生芽的所有或基本上所有细胞中,其中所述细胞是从本发明方法的步骤(a)的顽拗性植物细胞再生的细胞。优选地,所产生的芽的至少L2芽分生组织层包含转基因或目的序列中的突变,并且其中至少L2芽分生组织层属于顽拗性植物,或者换言之,从步骤(a)中提供的顽拗性植物细胞再生。由这样的芽产生的后续种子可以包含所述转基因或突变,优选地在所述种子的胚内。
因此,优选地,本发明的方法包括在步骤(a)的顽拗性植物的细胞中引入转基因或目的序列中的突变的步骤。可替代地或另外地,本发明的方法(进一步)包括在源自步骤(a)的顽拗性植物并存在于步骤(b)中形成的芽中,任选地存在于步骤(b)中形成的愈伤组织中的细胞中引入转基因或目的序列中的突变的步骤。
在步骤(a)中,在将一个或多个细胞与再生性植物的细胞(任选地一个或多个细胞)接触之前,可以将转基因或突变引入顽拗性植物的细胞(任选地一个或多个细胞)中。作为非限制性实例,可以将转基因或突变引入顽拗性植物的一个或多个细胞中,随后将这些细胞与再生性植物的一个或多个细胞共培养。顽拗性植物和/或再生性植物的这些细胞可以任选地是原生质体、或愈伤组织的一部分或茎切片(或连接切片)。类似地,可以将转基因或突变引入顽拗性植物的一个或多个细胞中,并且可以将携带转基因或突变的顽拗性植物的细胞嫁接到任选地非转化或非突变的再生性植物的细胞上。
可替代地或另外地,可在将顽拗性植物的一个或多个细胞与再生性植物的一个或多个细胞接触之后,将转基因或突变引入顽拗性植物的一个或多个细胞中。优选在芽形成之前引入转基因或突变。因此,优选地,引入突变的步骤在如本文所定义的方法的步骤(b2)之前,但可以在步骤(a)或(b1)期间或之后。
作为非限制性实例,顽拗性植物的一个或多个细胞可以与再生性植物的一个或多个细胞在体外接触或共培养,随后将转基因或突变引入顽拗性植物的一个或多个细胞。任选地,在将转基因或突变引入顽拗性植物的至少一个或多个细胞之前,首先允许接触的或“共培养的”细胞形成愈伤组织。还可以将转基因或突变引入再生性植物的一个或多个细胞中。
类似地,可以将顽拗性植物的一个或多个细胞嫁接到再生性植物的一个或多个细胞上,随后在顽拗性植物的一个或多个细胞中引入转基因或目的序列中的突变。还可以将转基因或突变引入再生性植物的一个或多个细胞中。任选地,在将转基因或突变引入顽拗性植物的至少一个或多个细胞之前,首先使嫁接部分愈合。任选地,在将转基因或突变引入顽拗性植物的至少一个或多个细胞之前,首先切割或“创伤”嫁接联合体。任选地,在将转基因或突变引入顽拗性植物的至少一个或多个细胞之前,首先允许接触的细胞形成愈伤组织。
优选地,本发明方法的步骤(c)中选择的芽包含从本发明方法的步骤(a)的顽拗性植物的细胞再生的细胞中的转基因或目的序列中的突变。优选地,芽在由本发明方法的步骤(a)的顽拗性细胞再生的L1-、L2-和L3-芽分生组织层中的至少一个中包含转基因或突变。优选地,至少所选择的芽的种系祖细胞和/或克隆繁殖的组织和/或植物部分从本发明方法的步骤(a)的顽拗性细胞再生,并且在目的基因中包含转基因或突变。因此,本发明的优选方法是产生和选择植物的芽的方法,其中该芽包含种系祖细胞和/或包含产生顽拗性植物的克隆繁殖的组织和/或植物部分的细胞并且其中这些种系祖细胞和/或克隆繁殖的植物组织和/或植物部分中的一个或多个包含转基因或目的序列中的突变。优选地,所有或基本上所有种系祖细胞和/或克隆增殖的组织和/或植物部分包含转基因或目的序列中的突变。
转基因或突变可以至少存在于L2芽分生组织层中。因此,本发明的优选方法是产生和选择植物的芽的方法,其中该芽包含顽拗性植物的L2芽分生组织层,并且其中该L2芽分生组织层的一个或多个细胞包含转基因或目的序列中的突变。优选地,至少L2芽分生组织层的所有或基本上所有细胞包含转基因或目的序列中的突变。任选地,转基因或突变存在于步骤(c)中选择的所产生芽的所有或基本上所有细胞中,其中所述细胞是从本发明方法的步骤(a)的顽拗性植物细胞再生的细胞。
在本发明的方法中,在目的序列中引入转基因或突变优选导致一种或多种改善的表型特性,例如但不限于增加的产量、抗病性、农艺性状、非生物性状、蛋白组成、油组成、淀粉组成、抗虫性、肥力、青贮和形态性状。
可以使用本领域技术人员已知的任何方法通过稳定或转基因转染以转染植物、植物部分、愈伤组织、植物细胞或原生质体来导入转基因。
突变在本文中应理解为遗传密码的核苷酸序列改变(一个或多个核苷酸的插入、缺失或取代)或表观遗传改变例如甲基化的改变。突变可以通过随机诱变或靶向诱变来引入,后者也称为程序化基因组编辑。随机诱变可以是但不限于化学诱变和γ辐射。化学诱变的非限制性实例包括但不限于EMS(甲磺酸乙酯)、MMS(甲磺酸甲酯)、NaN3(叠氮化钠)D)、ENU(N-乙基-N-亚硝基脲)、AzaC(氮杂胞苷)和NQO(4-硝基喹啉1-氧化物)。任选地,诱变系统例如TILLING(Targeting Induced Local Lesions IN Genomics[基因组学中靶向诱导的局部损伤];McCallum等人,2000,Nat Biotech[自然生物技术]18:455,和McCallum等人2000,Plant Physiol.[植物生理学]123,439-442(均通过引用并入本文))可用于在顽拗性植物的细胞中产生突变。TILLING使用传统的化学诱变(例如EMS诱变),然后进行高通量突变筛选。因此,包含具有一个或多个所期望突变的基因的植物、种子和组织可以使用TILLING获得。优选地,包含具有一个或多个所期望突变的基因的植物、种子和组织可以使用如WO 2007/037678(其通过引用并入本文)中描述的
定向诱变或程序化基因组编辑是可设计用于改变特定核苷酸或核酸序列的诱变,例如但不限于寡核苷酸定向诱变、RNA指导型核酸内切酶(例如CRISPR技术)、TALEN、大范围核酸酶或锌指技术。
优选地,通过位点特异性蛋白、优选位点特异性核酸内切酶引入靶向诱变。位点特异性核酸内切酶优选是与指导RNA复合的CRISPR蛋白、TALEN、锌指蛋白、大范围核酸酶和Argonaute复合物中的至少一种。优选地,位点特异性核酸内切酶是与指导RNA复合的CRISPR蛋白。
作为用于本发明的方法的CRISPR蛋白复合物的一部分的CRISPR蛋白优选地是CRISPR核酸内切酶、CRISPR切口酶和CRISPR-脱氨酶中的至少一种。优选地,CRISPR蛋白是CRISPR核酸内切酶。
CRISPR蛋白可以是本领域已知的任何合适的CRISPR蛋白。任选地,CRISPR蛋白包含核定位信号(NLS)以将CRISPR蛋白引导至植物细胞的细胞核。任何已知的核定位信号都适用于本发明。优选的核定位信号包括但不限于SV40大T抗原的NLS(MEDPTMAPKKKRKV(SEQID NO:1))和核质蛋白的NLS(KRPAATKKAGQAKKKK(SEQ ID NO:2))。
CRISPR核酸内切酶包含核酸酶结构域和至少一个与指导RNA相互作用的结构域。当与指导RNA复合时,CRISPR蛋白复合物被指导RNA引导至特定的核酸序列。指导RNA与CRISPR核酸内切酶以及靶特异性核酸序列相互作用,使得一旦通过指导序列引导至包含靶核酸序列的位点,CRISPR核酸内切酶就能够在靶位点引入双链断裂。
如果CRISPR蛋白是CRISPR核酸内切酶,则核酸酶的两个结构域均具有催化活性,并且该蛋白能够在靶位点引入双链断裂。如果CRISPR蛋白是CRISPR切口酶,则核酸酶的一个结构域具有催化活性,并且一个结构域无催化活性,并且该蛋白能够在靶位点引入单链断裂。
技术人员熟知如何设计指导RNA,使得当其与CRISPR核酸内切酶或CRISPR切口酶组合时,在核酸分子的预定位点引入单链或双链断裂。
CRISPR蛋白通常可分为六种主要类型(I-VI型),并根据核心元件内容和序列进一步细分为亚型(Makarova等人,2011,Nat Rev Microbiol[自然微生物评论]9:467-77和Wright等人,2016,Cell[细胞]164(1-2):29-44)。一般来说,CRISPR蛋白复合物的两个关键元件是CRISPR蛋白和指导RNA。
II型CRISPR蛋白复合物包括标志性Cas9蛋白,这是一种单一蛋白(约160KDa),能够特异性切割双链DNA。Cas9蛋白通常包含两个核酸酶结构域,靠近氨基末端的RuvC样核酸酶结构域和靠近蛋白中部的HNH(或McrA样)核酸酶结构域。Cas9蛋白的每个核酸酶结构域专门用于切割双螺旋的一条链(Jinek等人,2012,Science[科学]337(6096):816-821)。Cas9蛋白是II型CRISPR-CAS蛋白复合物的CAS蛋白的实例,并且当与crRNA和称为反式激活crRNA(tracrRNA)的第二种RNA组合时,会形成核酸内切酶。crRNA和tracrRNA一起充当指导RNA。CRISPR蛋白复合物在基因组中由crRNA定义的位置引入DNA双链断裂(DSB)。Jinek等人(2012,Science[科学]337:816-820)证明,通过融合crRNA和tracrRNA的必需部分产生的单链嵌合指导RNA(本文定义为“sgRNA”或“单指导RNA”)能够与Cas9蛋白结合形成功能性CRISPR-蛋白复合物。
已经描述了V型CRISPR蛋白复合物,即来自普雷沃菌属和弗朗西斯菌属1或CRISPR/Cpf1的成簇规则间隔短回文重复序列。Cpf1基因与CRISPR基因座相关联,并编码使用crRNA靶向DNA的核酸内切酶。Cpf1是比Cas9更小的核酸内切酶,这可能会克服CRISPR-Cas9系统的一些限制。Cpf1是缺乏tracrRNA的单RNA指导的核酸内切酶,它利用富含T的原型间隔子相邻基序。Cpf1通过交错的DNA双链断裂来切割DNA(Zetsche等人(2015)Cell[细胞]163(3):759–771)。V型CRISPR蛋白系统优选地包括Cpf1、C2c1和C2c3中的至少一种。
用于本发明的CRISPR蛋白复合物可以包含如上文所定义的任何CRISPR蛋白。优选地,CRISPR蛋白是II型CRISPR蛋白,优选II型CRISPR核酸内切酶,例如,Cas9(例如由SEQ IDNO:4编码的SEQ ID NO:3的蛋白,或SEQ ID NO:5的蛋白)或V型CRISPR蛋白,优选V型CRISPR核酸内切酶,例如Cpf1(例如,SEQ ID NO:6的蛋白,由SEQ ID NO:7编码)或Mad7(例如SEQID NO:8或9的蛋白),或衍生自其的优选地与所述蛋白在全长上具有至少约70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的蛋白。
优选地,CRISPR蛋白是II型CRISPR核酸内切酶,优选Cas9核酸内切酶。
技术人员知道如何发现和制备用于本发明方法的CRISPR蛋白。在现有技术中,有大量关于其设计和使用的报道。例如,参见Haeussler等人(J Genet Genomics.(2016)43(5):239-50.doi:10.1016/j.jgg.2016.04.008.)关于指导RNA的设计及其与CAS蛋白(最初从化脓性链球菌获得)的组合使用的评论,或Lee等人(Plant Biotechnology Journal[植物生物技术杂志](2016)14(2)448–462)的评论。
一般来说,CRISPR核酸内切酶,例如Cas9,包含两个催化活性核酸酶结构域。例如,Cas9蛋白可包含RuvC样核酸酶结构域和HNH样核酸酶结构域。RuvC和HNH结构域协同工作,均切割单链,从而在DNA中产生双链断裂。(Jinek等人,Science[科学],337:816-821)。
死CRISPR核酸内切酶包含修饰,使得没有核酸酶结构域显示切割活性。CRISPR切口酶可以是CRISPR核酸内切酶的变体,其中核酸酶结构域之一发生突变,使得其不再有功能(即,核酸酶活性不存在)。实例是具有D10A或H840A突变的SpCas9变体。
CRISPR蛋白可包含以下或由以下组成:完整II型或V型CRISPR蛋白或其变体或功能片段。优选地,此类片段结合指导RNA并至少部分地保持核酸内切酶活性。
优选地,用于本发明方法的CRISPR蛋白是Cas9蛋白。Cas9蛋白可以衍生自细菌化脓性链球菌(SpCas9;NCBI参考序列NC_017053.1;UniProtKB-Q99ZW2)、嗜热脱氮芽孢杆菌(Geobacillus thermodenitrificans)(UniProtKB-A0A178TEJ9)、溃疡棒杆菌(Corynebacterium ulcerous)(NCBI参考:NC_015683.1、NC_017317.1);白喉棒杆菌(Corynebacterium diphtheria)(NCBI参考:NC_016782.1、NC_016786.1);食蚜蝇螺原体(Spiroplasma syrphidicola)(NCBI参考:NC_021284.1);中间普雷沃氏菌(Prevotellaintermedia)(NCBI参考:NC_017861.1);台湾螺原体(Spiroplasma taiwanense)(NCBI参考:NC_021846.1);海豚链球菌(Streptococcus iniae)(NCBI参考:NC_021314.1);波罗的海贝利菌(Belliella baltica)(NCBI参考:NC_018010.1);托氏冷色菌(Psychroflexustorquisl)(NCBI参考:NC_018721.1);嗜热链球菌(Streptococcus thermophilus)(NCBI参考:YP_820832.1);无害李斯特菌(Listeria innocua)(NCBI参考:NP_472073.1);空肠弯曲杆菌(Campylobacter jejuni)(NCBI参考:YP_002344900.1);或脑膜炎奈瑟菌(Neisseriameningitidis)(NCBI参考:YP_002342100.1)。包括这些的具有与SpCas9同源的失活HNH或RuvC结构域的Cas9变体,例如SpCas9_D10A或SpCas9_H840A,或在SpCas9蛋白中对应于D10或H840的位置具有等效取代的Cas9,产生切口酶。
用于本发明方法中的CRISPR蛋白可以是或可以衍生自Cpf1,例如来自氨基酸球菌属(Acidaminococcus)物种的Cpf1;UniProtKB-U2UMQ6。该变体可以是具有失活的RuvC或NUC结构域的Cpf1切口酶,其中RuvC或NUC结构域不再具有核酸酶活性。技术人员熟知本领域可用的技术,例如定点诱变、PCR介导的诱变和允许灭活核酸酶例如灭活RuvC或NUC结构域的全基因合成。具有失活NUC结构域的Cpf1切口酶的实例是Cpf1 R1226A(参见Gao等人Cell Research[细胞研究](2016)26:901–913,Yamano等人Cell[细胞](2016)165(4):949–962)。在此变体中,NUC结构域中存在精氨酸到丙氨酸(R1226A)的转换,这使NUC结构域失活。
用于本发明的方法中的CRISPR蛋白可以是或可以衍生自CRISPR-CasΦ,其是大约Cas9大小一半的核酸酶。CRISPR-CasΦ使用单个crRNA来靶向和切割核酸,如例如描述于Pausch等人(CRISPR-CasΦfrom huge phages is a hypercompact genome editor[来自巨大噬菌体的CRISPR-CasΦ是超紧凑基因组编辑器],Science[科学](2020);369(6501):333-337)。
活性、部分失活或死的CRISPR蛋白可用于本发明的方法中,例如将本文详述的融合功能结构域引导至DNA中的由指导RNA确定的特定位点。
因此,CRISPR蛋白可以融合至功能结构域。任选地,此类功能结构域用于表观遗传修饰,例如组蛋白修饰结构域。用于表观遗传修饰的结构域可以选自由甲基转移酶、脱甲基酶、脱乙酰酶、甲基化酶、脱乙酰酶、脱氧酶、糖基化酶和乙酰酶组成的组(Cano-Rodriguez等人,Curr Genet Med Rep[当前遗传医学报告](2016)4:170–179)。甲基转移酶可以选自由G9a、Suv39h1、DNMT3、PRDM9和Dot1L组成的组。脱甲基酶可以是LSD1。脱乙酰酶可以是SIRT6或SIRT3。甲基化酶可以是KYP、TgSET8和NUE中的至少一种。脱乙酰酶可以选自由HDAC8、RPD3、Sir2a和Sin3a组成的组。脱氧酶可以是TET1、TET2和TET3中的至少一种,优选TET1cd(Gallego-BartoloméJ等人,Proc Natl Acad Sci U SA.[美国国家科学院院刊](2018);115(9):E2125-E2134)。糖基化酶可以是TDG。乙酰化酶可以是p300。
任选地,功能结构域是选自下组的脱氨酶或其功能片段,该组由以下组成:载脂蛋白B mRNA编辑复合物(APOBEC)家族脱氨酶、激活诱导的胞嘧啶脱氨酶(AID)、ACF1/ASE脱氨酶、腺嘌呤脱氨酶和ADAT家族脱氨酶。可替代地或另外地,脱氨酶或其功能片段可以是ADAR1或ADAR2或其变体。
胞嘧啶脱氨酶的载脂蛋白B mRNA编辑复合物(APOBEC)家族包含十一种蛋白,这些蛋白用于以受控和有益的方式启动诱变。优选地,APOBEC脱氨酶选自由以下组成的组:APOBEC1、APOBEC2、APOBEC3A、APOBEC3B、APOBEC3C、APOBEC3D、APOBEC3F、APOBEC3G、APOBEC3H、APOBEC4和激活诱导的(胞苷)脱氨酶。优选地,APOBEC家族的胞嘧啶脱氨酶是激活诱导的胞嘧啶(或胞苷)脱氨酶(AID)或载脂蛋白B编辑复合物3(APOBEC3)。优选地,与CRISPR蛋白融合的脱氨酶结构域是APOBEC1家族脱氨酶。
可与CRISPR系统核酸酶融合的另一示例性合适类型的脱氨酶结构域是腺嘌呤或腺苷脱氨酶,例如腺嘌呤脱氨酶的ADAT家族。此外,腺嘌呤脱氨酶可以是TadA或其变体,优选地描述于Gaudelli等人,2017(Gaudelli等人2017Nature[自然]551:464-471)。此外,CRISPR系统核酸酶可以融合至腺嘌呤脱氨酶结构域,例如衍生自ADAR1或ADAR2的腺嘌呤脱氨酶结构域。本发明的脱氨酶结构域可包含以下或由以下组成:完整脱氨酶蛋白或其具有催化活性的片段。优选地,脱氨酶结构域具有脱氨酶活性。任选地,CRISPR蛋白进一步融合至UDG抑制剂(UGI)结构域。
用于本发明方法的CRISPR蛋白与指导RNA分子复合,指导RNA分子将CRISPR蛋白引导至植物细胞基因组中的特定位置以实现靶向基因组修饰。优选地,植物细胞是顽拗性植物的细胞。任选地,植物细胞是种系细胞或种系祖细胞和/或产生顽拗性植物的克隆繁殖的组织和/或植物部分的细胞。
包含CRISPR蛋白和指导RNA的复合物也可以注释为核糖核蛋白复合物。
指导RNA分子将复合物引导至双链核酸分子中的指定靶位点,也称为原型间隔子序列。指导RNA分子包含用于将CRISPR蛋白复合物靶向原型间隔子序列的序列,该原型间隔子序列优选位于植物细胞基因组中目的序列附近、处或内部。指导RNA可以是单指导(sg)RNA或crRNA和tracrRNA的组合(例如对于Cas9)或仅crRNA(例如在Cpf1和CasΦ的情况下)。
因此,用于本发明的方法中的CRISPR蛋白复合物可以包含指导RNA分子,其中指导RNA分子包含crRNA和tracrRNA的组合,并且其中优选地CRISPR蛋白是Cas9。优选将crRNA和tracrRNA组合成sgRNA(单指导RNA)。可替代地,用于本发明方法的CRISPR蛋白复合物可包含指导RNA分子,其中指导RNA分子包含crRNA,并且其中优选地CRISPR蛋白是Cpf1或CasΦ。
用于本发明的方法中的指导RNA分子可以包含可以与目的序列、优选地如本文所定义的目的序列杂交或接近的序列。指导RNA分子可以包含与目的序列中的序列完全互补的核苷酸序列,即目的序列包含原型间隔子序列。可替代地或另外地,用于本发明方法的指导RNA分子可包含可与目的序列的互补序列杂交或接近的序列。
crRNA中与原型间隔子序列互补的部分被设计为与原型间隔子序列具有足够的互补性,以与原型间隔子序列杂交并引导复合的CRISPR蛋白的序列特异性结合。原型间隔子序列优选地与原型间隔子相邻基序(PAM)序列相邻,该PAM序列可以与RNA指导的CRISPR蛋白复合物的CRISPR蛋白相互作用。例如,如果CRISPR蛋白是化脓性链球菌Cas9,则PAM序列优选是5’-NGG-3’,其中N可以是T、G、A或C中的任一种。
技术人员能够工程改造crRNA以靶向任何期望的序列,优选地通过工程改造该序列以与任何期望的原型间隔子序列至少部分互补,以便与其杂交。优选地,当使用合适的比对算法进行最佳比对时,crRNA序列的部分与其对应的原型间隔子序列之间的互补性为至少70%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或100%。crRNA序列中与原型间隔子序列互补的部分可以是至少约5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、75或更多个核苷酸的长度。在一些优选的实施例中,与目的序列互补的序列的长度小于约75、50、45、40、35、30、25、20个核苷酸。优选地,与目的序列互补的序列的长度为至少17个核苷酸。优选地,互补crRNA序列的长度为约10-30个核苷酸、长度为约17-25个核苷酸或长度为约15-21个核苷酸。优选地,与原型间隔子序列互补的crRNA部分的长度是15、16、17、18、19、20、21、22、23、24或25个核苷酸,优选20或21个核苷酸,优选20个核苷酸。
适合作为crRNA和tracrRNA的分子是本领域公知的(参见例如、WO 2013142578和Jinek等人,Science[科学](2012)337,816-821)。指导RNA分子中的crRNA和tracrRNA可以连接在一起形成单指导(sg)RNA。crRNA和tracrRNA可以使用本领域已知的任何常规方法连接,优选共价连接。crRNA和tracrRNA的共价连接是,例如描述于Jinek等人(同上)和WO 13/176772,其通过引用并入本文。crRNA和tracrRNA可以使用例如接头核苷酸或通过crRNA的3’末端和tracrRNA的5'末端直接共价连接。
优选地,在本发明的方法中使用至少一种包含CRISPR-核酸酶和指导RNA的CRISPR蛋白复合物。然而,技术人员直接理解,另外的CRISPR-蛋白复合物可用于本发明的方法中,例如通过使用至少2、3、4、5、6、7、8、9、10或更多不同的指导RNA。这些不同的指导RNA被设计为靶向并结合相同的目的序列。可替代地,不同的指导RNA可以将CRISPR蛋白复合物引导至不同的目的基因。
转基因或目的序列中的突变可以在愈伤组织形成之前、愈伤组织形成期间和/或愈伤组织形成之后引入。优选在芽形成开始之前引入转基因或突变。优选地,转基因或突变至少存在于本发明方法的步骤b)中形成的芽的种系祖细胞和/或克隆繁殖的组织和/或植物部分中。优选地,转基因或突变存在于至少一个种系祖细胞中和/或存在于产生步骤c)中选择的芽的克隆繁殖的组织和/或植物部分的细胞中。优选地,转基因或突变存在于步骤b)中形成的芽的所有种系祖细胞和/或所有克隆繁殖的组织和/或植物部分中。优选地,转基因或突变存在于本发明方法的步骤b)中形成的芽的L2芽分生组织层的至少一个细胞中。优选地,转基因或突变存在于步骤b)中形成的芽的L2芽分生组织层的所有细胞中。转基因或突变也可以存在于其他细胞中,例如L1-和L3-芽分生组织层的细胞。任选地,本发明方法的步骤c)中形成的芽的所有细胞包含转基因或目的序列中的突变。
转基因或目的序列中的突变可以引入顽拗性植物的细胞和/或再生性植物的细胞中。优选地,转基因或目的序列中的突变至少被引入本发明方法的步骤(a)的顽拗性植物的细胞中和/或在本发明方法的步骤(b)中共再生的顽拗性植物的细胞中。
可以通过用位点特异性核酸内切酶、优选CRISPR核酸内切酶转染植物细胞来引入突变。可以通过用目的转基因转染植物细胞来引入转基因。植物细胞的转染可以使用本领域技术人员已知的任何常规方法进行。
“转染”或“转化”在本文中理解为将转基因和/或位点特异性核酸内切酶蛋白或编码转基因和/或位点特异性核酸内切酶的核酸分子递送至植物细胞中。所述核酸分子可以是编码所述转基因和/或位点特异性核酸酶的DNA或RNA。任选地,转基因和/或位点特异性核酸内切酶通过(前)mRNA的转染来引入。转染还可以包括将指导RNA或编码与位点特异性核酸内切酶相关联的指导RNA的核酸分子递送至植物细胞中。任选地,位点特异性核酸内切酶作为包含与指导RNA复合的CRISPR核酸内切酶的CRISPR核酸内切酶复合物来递送。可替代地或另外地,将CRISPR核酸内切酶和指导RNA递送至植物细胞中,并在细胞内形成复合物。可替代地或另外地,CRISPR核酸内切酶从转染的核酸表达并在细胞内与任选表达的指导RNA形成复合物。
优选地,转基因和/或位点特异性核酸内切酶,或编码其的核酸,可以作为蛋白,或在CRISPR核酸内切酶的情况下作为蛋白指导的RNA复合物(也称为核糖核蛋白复合物),使用技术人员已知的任何常规方法引入顽拗性植物的细胞中。转染的非限制性实例包括但不限于病毒感染、缀合、原生质体融合、电穿孔、粒子枪技术、磷酸钙沉淀、直接显微注射、碳化硅晶须技术、农杆菌介导的转化等。方法的选择通常取决于被转化细胞的类型和发生转化的环境(即,体外、离体或体内;蛋白转染或核酸转染)。
基于土壤细菌根癌农杆菌的转染方法对于将核酸分子引入植物细胞可能特别有用。本领域熟知将农杆菌与所培养的植物细胞或创伤组织例如像叶组织、根外植体、下胚轴(hypocotyledon)、茎段或块茎共培养的方法。参见,例如,Glick和Thompson,(编辑),Methods in Plant Molecular Biology and Biotechnology[植物分子生物学和生物技术方法],波卡雷顿(Boca Raton),佛罗里达州:CRC出版社(1993)。微射弹介导的转化也可用于转染植物细胞。这种方法(最初由Klein等人(Nature[自然]327:70-73(1987))进行了描述)依赖于通过与氯化钙、亚精胺或聚乙二醇沉淀而被例如所希望的核酸分子包被的微弹,例如金或钨。使用装置例如生物弹射击(BIOLISTIC)PD-1000(伯乐公司(Biorad);加利福尼亚州赫拉克勒斯(Hercules Calif.)),将微弹颗粒以高速加速引入被子植物组织中。
编码转基因和/或位点特异性核酸内切酶的核酸,和任选的指导RNA(编码指导RNA的核酸),可以例如通过体内或离体方案以核酸能够进入一个或多个植物细胞的方式引入植物。“体内”是指将核酸施用于植物的活体,例如渗透。“离体”是指在植物外修饰细胞或外植体,然后将这些细胞或器官再生为植物的芽。
已经描述了许多适用于植物细胞的转化和/或适用于建立转基因植物的载体,包括在Weissbach和Weissbach,(1989)Methods for Plant Molecular Biology[植物分子生物学方法]Academic Press[学术出版社],和Gelvin等人,(1990)Plant MolecularBiology Manual[植物分子生物学手册],Kluwer Academic Publishers[Kluwer学术出版社]中描述的那些。实例包括根癌农杆菌介导的转化,以及例如以下中披露的那些方法:Herrera-Estrella等人(1983)Nature[自然]303:209,Bevan(1984)Nucl Acid Res.[核酸研究]12:8711-8721,Klee(1985)Bio/Technology[生物技术]3:637-642。用于转化植物细胞的常规方法包括但不限于生物射弹轰击、聚乙二醇转化和显微注射(参见例如Danieli等人Nat.Biotechnol[自然生物技术]16:345-348,1998;Staub等人Nat.Biotechnol[自然生物技术]18:333-338,2000;O'Neill等人Plant J[植物杂志].3:729-738,1993;Knoblauch等人Nat.Biotechnol[自然生物技术]17:906-909;美国专利号5,451,513、5,545,817、5,545,818和5,576,198;国际申请号WO 95/16783;以及Boynton等人,Methods inEnzymology[酶学方法]217:510-536(1993),Svab等人,Proc.Natl.Acad.Sci.USA[美国国家科学院院刊]90:913-917(1993),和McBride等人,Proc.Nati.Acad.Sci.USA[美国国家科学院院刊]91:7301-7305(1994))。
优选地,将转基因引入顽拗性植物的细胞中和/或突变位于顽拗性植物细胞中的目的序列中。顽拗性植物的细胞优选地用转基因、CRISPR核酸内切酶和/单指导RNA中的至少一种转染。优选地,CRISPR核酸内切酶和指导RNA形成被转染到顽拗性植物的细胞中的核糖核蛋白复合物。优选地,所述细胞是原生质体。优选地,使用聚乙二醇转化,用转基因蛋白和/或CRISPR指导的RNA核糖核蛋白复合物转染原生质体,例如WO 2017/222370或WO 2020/089448(其通过引用并入本文)中所述。细胞可以是单细胞悬浮液中的细胞、原生质体、愈伤组织或切片中存在的细胞和/或植物中存在的细胞,优选存在于嫁接联合体中的细胞。
可替代地或另外地,顽拗性植物的细胞可用编码转基因和/或至少一种位点特异性核酸内切酶和/或至少一种指导RNA的核酸分子转染。任选地,所述细胞是原生质体。任选地,使用聚乙二醇转化,用一种或多种编码转基因和/或CRISPR核酸内切酶和指导RNA的质粒转染原生质体,例如WO 2018/115390和WO/2020/011985(其通过引用并入本文)中所述。
优选地,转基因和/或位点特异性核酸内切酶的密码子序列被优化用于在植物细胞中表达。编码至少一种转基因和/或位点特异性核酸内切酶和/或至少一种指导RNA的核酸分子优选包含在核酸载体中。核酸载体优选是用于瞬时表达转基因和/或位点特异性核酸内切酶和/或指导RNA的载体。可替代地,核酸载体是用于稳定表达转基因和/或位点特异性核酸内切酶和/或指导RNA的载体。任选地,本发明方法的步骤a)的顽拗性植物的细胞包含整合在其基因组中的转基因,所述转基因编码目的基因和/或可编程核酸内切酶,优选CRISPR核酸内切酶,其中所述转基因和/或可编程核酸内切酶可以稳定表达,或者其中所述转基因和/或可编程核酸内切酶的表达处于诱导型或组织特异性启动子的控制下。
因此,转基因和/或位点特异性核酸内切酶和任选的至少一种指导RNA可以从包含在载体中的表达盒转录。载体骨架可以是例如表达盒整合到其中的质粒,或者如果已经存在合适的转录调节序列(例如(诱导型)启动子),则仅是期望的核苷酸序列(例如编码转基因和/或位点特异性核酸内切酶的序列)被整合到转录调节序列的下游。
用于本发明方法的载体可以包含另外的遗传元件以促进其在分子克隆中的使用,例如选择标记、多克隆位点等。载体骨架可以例如是二元或超二元载体(参见例如美国专利号5,591,616、US2002138879和WO 95/06722)、共整合载体或T-DNA载体,如本领域已知的。
用于本发明方法的载体优选特别适合于将转基因和/或位点特异性核酸内切酶和任选的一种或多种指导RNA的表达引入植物细胞中,其中植物细胞优选是顽拗性植物细胞。优选的表达载体是裸DNA、DNA复合物或病毒载体。
优选的裸DNA是线性或环状核酸分子,例如质粒。质粒是指可以例如通过标准分子克隆技术插入另外DNA片段的环状双链DNA环。DNA复合物可以是与任何适合将DNA递送到细胞中的载剂偶联的DNA分子。优选的载剂选自由以下组成的组:脂质复合物、脂质体、聚合物囊泡、聚合复合物、PEG、树枝状聚合物、无机纳米颗粒、病毒体和细胞穿透肽。
用于本发明方法的载体优选是病毒表达载体。病毒载体可以是DNA病毒或RNA病毒。病毒载体可以是或可以基于烟草花叶病毒属(Tobamovirus)、烟草脆裂病毒属(Tobravirus)、马铃薯X病毒属(Potexvirus)、双生病毒属(Geminivirus)、紫花苜蓿花叶病毒属(Alfamovirus)、黄瓜花叶病毒属(Cucumovirus)、马铃薯Y病毒属(Potyvirus)、番茄丛矮病毒属(Tombusvirus)、大麦病毒属(Hordeivirus)或核弹状病毒属(Nucleorhabdovirus)。
烟草花叶病毒属病毒载体可以是烟草花叶病毒(TMV)和太阳大麻花叶病毒(SHMV)中的至少一种。烟草脆裂病毒属病毒载体可以是烟草脆裂病毒(TRV)。马铃薯X病毒属病毒载体可以是马铃薯病毒X(PVX)和木瓜花叶病毒(PapMV)中的至少一种。双生病毒属病毒载体可以是豇豆花叶病毒(CPMV)。合适的双生病毒属病毒载体的其它实例可包括卷心菜卷叶病毒、番茄金花叶病毒、豆黄矮病毒、非洲木薯花叶病毒、小麦矮化病毒、芒属条纹玉米线条病毒、烟草黄矮病毒、番茄黄矮化病毒、豆类金花叶病毒、甜菜卷顶病毒、玉米条纹病毒和番茄伪卷顶病毒。紫花苜蓿花叶病毒属可以是苜蓿花叶病毒(AMV)。黄瓜花叶病毒属可以是黄瓜花叶病毒(CMV)。马铃薯Y病毒属可以是李痘病毒(PPV)。番茄丛矮病毒属可以是番茄浓密矮化病毒(TBSV)。大麦病毒属可以是大麦条纹花叶病毒。核弹状病毒可以是桑葚黄网状病毒(SYNV)(参见例如Hefferon K,Plant Virus Expression Vectors:A Powerhouse forGlobal Health[植物病毒表达载体:全局健康的动力源],Biomedicines.[生物医学]2017,5(3):44和Lico等人,Viral vectors for production of recombinant proteins inplants[用于在植物中生产重组蛋白的病毒载体],J Cell Physiol[细胞生理学杂志],2008;216(2):366-77)。
优选地,病毒载体选自由以下组成的组:烟草脆裂病毒(TRV)、烟草花叶病毒(TMV)、桑葚黄网状病毒(SYNV)和马铃薯病毒X(PVX)。优选地,病毒载体是烟草脆裂病毒(TRV)、烟草花叶病毒(TMV)和桑葚黄网状病毒(SYNV)中的至少一种。
用于本发明方法的病毒载体可以包含基因的缺失以增加病毒的包装容量。优选地,病毒缺失编码外壳蛋白(CP)的基因。优选的缺失外壳蛋白的病毒载体是烟草花叶病毒属病毒或烟草脆裂病毒属病毒。优选地,缺失外壳蛋白的病毒载体是烟草花叶病毒属,优选烟草花叶病毒(TMV)。优选的病毒载体是基于TMV RNA的过表达载体(TRBO),例如描述于Lindbo(TRBO:A High-Efficiency Tobacco Mosaic Virus RNA-Based OverexpressionVector[一种高效的基于烟草花叶病毒RNA的过表达载体],Plant Physiol[植物生理学],2007;145(4):1232-40)。病毒载体可以是如例如描述于WO 2018/226972(其通过引用并入本文)的自我复制的RNA。
载体,优选病毒载体,可以包含在农杆菌中以首先将病毒载体引入植物的植物细胞中。感染后,病毒载体由植物细胞中的农杆菌表达。病毒载体可以复制并感染周围的植物细胞。病毒载体可以被修饰,例如通过缺失外壳蛋白来防止病毒的系统性传播。
被转染的顽拗性植物的细胞将优选发育成作为新形成芽的一部分的组织,其中该组织包含一个或多各个种系祖细胞和/或一个或多个产生克隆增殖的组织和/或植物部分的细胞。转染的顽拗性细胞可以是原代转染细胞,或例如二次或随后转染的细胞。作为非限制性实例,再生性植物的细胞可以用表达转基因和/或位点特异性核酸内切酶的载体,例如农杆菌和/或病毒载体转染。这些最初感染的细胞中产生的病毒可能会传播并感染顽拗性植物中的细胞,即二次感染。
例如,再生性植物的一个或多个细胞可以用包含表达转基因和/或位点特异性核酸内切酶的病毒载体的农杆菌感染。在嫁接联合体中,产生的病毒可能转移到顽拗性植物的细胞中。病毒载体的后续感染导致转基因和/或位点特异性核酸内切酶在顽拗性植物的一个或多个细胞中表达。位点特异性核酸内切酶将在顽拗细胞中的目的序列中引入突变,并且在芽形成后,突变将存在于形成的芽中。转基因可以在芽形成后整合到顽拗性植物中并且转基因可以存在于形成的芽中。
如上所述,本发明的方法还可包括从步骤(c)中选择的芽生长植物的步骤(d)。任选地,特别是在根再生很麻烦的情况下,步骤(d)可以包括将所选择的芽嫁接在嫁接相容性砧木上的步骤。步骤(d)中生长的植物优选包含至少一个用于繁殖,即用于产生种子和/或后代植物的花序。
更具体地,本发明提供了产生植物的方法,其中该方法包括如本文所定义的步骤(a)、(b)和(c)并且进一步包括从所述芽产生植物的步骤,其中优选所述植物包含至少一个花序。任选地,所产生的植物不含或基本上不含步骤(a)的再生性植物的细胞。换句话说,任选地,产生的植物是非嵌合植物,其具有与本发明方法的步骤(a)的顽拗性植物相同或基本上相同的基因型。因此,产生的植物也可以是本文定义的顽拗性植物,优选与步骤(a)的顽拗性植物细胞属于相同的物种和品种。在本发明的方法包括引入突变和/或转基因的情况下,优选地,所产生的植物的至少一个细胞、任选地所有细胞也包含所述突变和/或转基因。因此,“基本上相同的基因型”在本文中应理解为相同的基因型,尽管包含可以使用本发明的方法引入的突变和/或转基因。
另外地或可替代地,产生的植物的种系细胞,优选配子可以具有与本发明方法的步骤(a)的顽拗性植物的配子相同或基本上相同的基因型,任选地包含在如本文进一步详述的本发明方法的步骤(a)的顽拗性植物的细胞中引入的突变和/或转基因。任选地,植物可以是进一步包含再生性植物的细胞或组织层的嵌合植物。任选地,在种系祖细胞的无融合生殖基因型的情况下,所述植物用于通过杂交、自交和/或无融合生殖繁殖来产生种子和/或后代(即无融合生殖繁殖)。任选地,对植物进行授粉和/或使用花粉对另一植物或同一植物进行授粉(自交)。任选地,所述植物用于产生用于本文定义的克隆繁殖的组织和/或植物部分,并且任选地,分离所述组织和/或植物部分并用于克隆或营养繁殖。因此,本发明还提供了产生植物或种子的方法,该方法包括如本文所定义的步骤(a)、(b)和(c),并且还包括通过营养繁殖或克隆繁殖从步骤(c)中选择的芽产生植物的步骤,其中优选地所述植物包含至少一个花序;以及任选地通过有性或无融合生殖繁殖产生所产生的植物的种子和/或后代植物。
因此,本发明的方法可以是产生植物或种子的方法,其中所述方法包括以下步骤:
(a)使顽拗性植物的细胞与再生性植物的细胞接触;
(b)使(a)的经接触细胞形成芽;以及
(c)选择步骤(b)中形成的芽,其中所述芽的至少部分由该顽拗性植物的细胞组成,
(d)从步骤(c)中选择的芽生长植物;以及任选地
(e)从步骤(d)的植物产生种子和/或后代。
在本发明的方法包括引入突变和/或转基因的情况下,可以针对具有所述突变和/或转基因来选择所产生的植物的种子和/或后代。产生的种子(或所述种子的胚)可以具有与步骤(a)的顽拗性植物细胞已从中分离出来或者是其一部分的顽拗性植物的后代相同或基本相同的基因型,任选地除了具有引入的突变和/或转基因。
任选地,从步骤(a)中接触的细胞再生芽的步骤(b)包括在芽再生之前形成愈伤组织。因此,本发明的方法可以是用于产生植物的方法,其中该植物包含种系祖细胞和/或用于顽拗性植物的克隆繁殖的组织和/或植物部分,并且其中所述方法包括以下步骤:
(a)使顽拗性植物的一个或多个细胞与再生性植物的一个或多个细胞接触;
(b)使步骤(a)的顽拗性植物的经接触细胞形成愈伤组织,并使步骤(b)中获得的愈伤组织生长出芽;
(c)选择步骤(b)中获得的芽,其包含种系祖细胞和/或产生用于顽拗性植物的克隆繁殖的组织和/或植物部分的细胞;以及
(d)从步骤(c)中选择的芽生长植物。
任选地,产生多个种子和/或后代植物,并且该方法还包括选择至少一个种子和/或后代植物的步骤,优选在基因分型和/或评估可能已经存在的突变和/或在评估了可能已经被引入本文详述的本发明方法的步骤(a)的顽拗性细胞中的突变和/或转基因的存在之后。可以对种子和/或后代植物进行基因分型以评估该植物是否具有与步骤(a)的顽拗性植物的细胞相同或基本相同的基因型。可以使种子发芽并发育成植物。
任选地,本发明方法的步骤(a)的顽拗性植物的细胞是具有异常倍性的细胞,并且可以是单倍体。因此,本发明的方法可以是繁殖单倍体植物材料的方法。所述方法还可包括筛选再生的植物和/或种子的倍性水平的步骤。
任选地,在步骤(b)中的共再生期间,基因组可自发加倍或可化学加倍,从而产生至少一个包含双单倍体细胞或由双单倍体细胞组成的芽。在这种情况下,生成的芽的基因型可能与顽拗性植物细胞不同,因为基因组是双倍的。因此,本发明的方法可以是产生双单倍体植物材料的方法,并且本发明的方法可以包括筛选再生的植物和/或种子的倍性水平的步骤。
在另一个实施例中,步骤(c)的所选择的芽不被分离,而是使其在本发明方法的步骤(b)中发育的植物结构上生长花序,其中所述植物结构任选地包含另外的芽。所述花序可用于有性繁殖或无融合生殖繁殖。所述花序可以被授粉,或者所述花序的花粉用于为另一植物或同一植物授粉(即花序是自交的)。
如本文所示,该方法可以进一步包括以下步骤:在步骤(a)的顽拗性植物的细胞中或在步骤(b)中再生的芽中源自该顽拗性植物的细胞的细胞中引入:
(i)转基因;或
(ii)目的序列中的突变。
优选地,所述目的序列是内源目的序列。在包括引入转基因或突变的方法中,优选地,引入转基因或突变的步骤在步骤(b)之前,甚至更优选在步骤(a)之前。
另外地或可替代地,在所述方法中,至少种系祖细胞和/或产生步骤(b)中再生的芽的克隆繁殖的组织和/或植物部分的细胞包含转基因或突变。任选地,通过编程的基因组编辑引入突变,优选使用位点特异性核酸内切酶,优选CRISPR核酸内切酶。
任选地,本发明方法的步骤(a)中的顽拗性植物的细胞是(高度)异质的,并且本发明的方法是繁殖异质植物材料的方法。任选地,步骤(a)的顽拗性植物的细胞是无菌的,并且本发明的方法是繁殖无菌植物材料的方法。
植物可以使用本领域技术人员已知的任何常规培养条件从本发明方法的步骤(c)中选择的芽生长。这些培养条件可以取决于通过本发明的方法产生的植物,并且技术人员知道如何调整这些条件以产生用于生长通过本发明的方法产生的植物的最佳环境。步骤(d)中生长的植物可包含本文定义的转基因或目的序列中的突变。
本发明的方法还可包括产生或获得步骤(d)中生长的植物的后代的步骤(e)。后代可以例如通过有性繁殖产生,即通过花粉和卵结合产生种子。优选地,花粉和卵中的至少一种源自步骤(d)中产生的植物。如果该方法包括引入本文定义的转基因或目的序列中的突变,优选地,花粉和卵中的至少一种包含转基因或目的序列中的突变。任选地,花粉和卵均衍生自步骤(d)中生长的植物。优选地,花粉和卵包含相同的转基因和/或目的序列中的突变。可替代地,通过步骤(d)中生长的植物的无性(营养)繁殖获得后代。优选地,在这样的实施例中,转基因和/或目的序列中的突变存在于克隆繁殖以形成下一世代的组织和/或植物部分中。
本发明还涉及通过本发明的方法、优选在步骤(d)中通过本发明的方法可获得的植物。该植物可以是嵌合植物,其包含具有与顽拗性植物相同或基本上相同的基因型的细胞和具有与再生性植物相同或基本上相同的基因型的细胞或组织。优选地,植物包含种系或种系祖细胞和/或用于顽拗性植物的克隆繁殖的组织和/或植物部分。优选地,植物包含顽拗性植物的L2芽分生组织层。任选地,植物是包含转基因或目的序列中的突变的周缘嵌合体和/或植物,优选顽拗性植物或周缘嵌合体。因此,植物可以是非天然植物、人造植物、突变植物和/或转化的植物。
因此,在一个方面,本发明涉及从本发明的方法可获得的,优选从如本文定义的步骤(d)可获得的周缘嵌合体。“周缘嵌合体”是其中一个或多个完整细胞(组织)层L1、L2和/或L3在遗传上不同于另一细胞层的嵌合体。在周缘嵌合体的情况下,单个组织层本身是同质的而不是嵌合的。周缘嵌合体是最稳定的嵌合体形式,并产生独特且有价值的植物表型。这些植物产生腋芽,腋芽的顶端结构与产生其的末端分生组织相同。因此,周缘嵌合体可以通过营养繁殖来繁殖并维持其嵌合体层结构。
通过本发明的方法可获得的周缘嵌合植物优选包含顽拗性植物的至少一个芽分生组织层和再生性植物的至少一个芽分生组织层。优选地,L1-、L2-和L3-芽分生组织层中的至少一个来自顽拗性植物。不是来自顽拗性植物的芽分生组织层优选来自再生性植物。优选地,周缘嵌合体的L2芽分生组织层属于顽拗性植物,并且L1芽分生组织层和L3芽分生组织层中的至少一个属于再生性植物。
周缘植物的L2分生组织层以及L1和L3芽分生组织层可以属于相同属或不同属。优选地,周缘植物的L2分生组织层以及L1和L3芽分生组织层属于相同属。作为非限制性实例,L1-、L2-和L3-芽分生组织层可以是茄属或辣椒属。例如,L2芽分生组织层可以来自辣椒植物,并且L1芽分生组织层和L3芽分生组织层中的至少一个可以来自小米辣椒植物。类似地,L2芽分生组织层可以来自马铃薯植物,并且L1芽分生组织层和L3芽分生组织层中的至少一个可以来自番茄植物。
周缘嵌合体还可以包含转基因或目的序列中的突变。突变优选存在于至少种系或种系祖细胞和/或用于顽拗性植物的克隆繁殖的组织和/或植物部分中。优选地,转基因或突变位于周缘嵌合体的L1-、L2-和L3-芽分生组织层中的至少一个的细胞中。优选地,转基因或突变存在于位于周缘嵌合体的至少L2芽分生组织层中的细胞中。
另一方面,本发明涉及从本发明的方法可获得的植物,其中所述植物包含转基因和/或目的序列中的突变。因此,植物可以是转基因植物和/或突变植物。该植物可以是人造植物。优选地,转基因或目的序列中的突变位于种系或种系祖细胞和/或用于顽拗性植物的克隆繁殖的组织和/或植物部分中。因此,优选地,植物至少包含顽拗性植物的种系或种系祖细胞和/或用于顽拗性植物克隆繁殖的组织和/或植物部分,并且优选包含转基因或目的序列中的突变。优选地,本发明的植物不是或不排他地通过基本上生物过程获得。本发明的植物优选至少与天然存在的植物不同,因为它在一个含有至少一个转基因或目的序列中的突变。转基因或目的序列中的突变优选至少位于种系或种系祖细胞和/或用于植物的克隆繁殖的组织和/或植物部分中。转基因或目的序列中的突变优选位于至少L2芽分生组织层中。转基因或目的序列中的突变优选存在于植物的花粉和卵中的至少一种中。
植物优选至少包含种系或种系祖细胞和/或用于顽拗性植物的克隆繁殖的组织和/或植物部分。植物优选至少包含顽拗性植物的L2芽分生组织层。从本发明的方法可获得的植物优选是顽拗性植物,优选包含转基因或目的序列中的突变。
本发明还涉及来自本文定义的植物或周缘嵌合体的后代或种子。后代可以通过有性或无性(营养)繁殖产生。优选地,后代包含在本文定义的转基因或目的序列中的突变。种子的珠被可能具有与胚不同的基因型。优选地,珠被的基因型来自再生性植物并且胚的基因型来自顽拗性植物。
本发明还涉及衍生自通过本发明方法、优选本发明方法的步骤(c)、(d)或(e)获得的植物的植物部分或植物产品。任选地,所述植物部分或植物产品的特征在于它包含源自顽拗性植物和再生性植物的遗传物质。优选地,所述植物部分或植物产品包含衍生自顽拗性植物的细胞或组织或遗传物质。任选地,所述植物部分或植物产品不含或基本上不含衍生自再生性植物的细胞或组织或遗传物质。任选地,所述植物部分或植物产品由细胞或组织或植物材料组成,其特征在于它包含顽拗性植物的基因型。任选地,植物部分或植物产品的特征在于它包含转基因或目的序列中的突变。这样的遗传物质可以是基因组DNA或基因组DNA的片段。这样的遗传物质可以是线粒体DNA或线粒体DNA的片段。这样的遗传物质可以是叶绿体DNA或叶绿体DNA的片段。
植物部分可以是繁殖材料或非繁殖材料。
本说明书中引用的所有专利和参考文献通过引用以其全文特此并入。
任选地,使用组织嫁接方法来接触本发明方法的步骤(a)中的细胞。发明人注意到,如本文所例举的(例如,参见图1),使用钢销(优选无菌钢销)进行固定(即通过将所述钢销插入砧木和接穗的中心)的嫁接方法出人意料地有效。当使用幼苗材料,即幼小植物材料,优选播种后1-4周或1-3周的幼苗材料,优选播种后约2周的幼苗材料,优选0.1-1mm、0.1-0.75mm、0.1-0.5mm、或0.1-0.25mm的幼苗材料时,这种使用钢销的嫁接方法特别有用,优选幼苗材料在第一片真叶发育后立即使用。该嫁接方法可以用于本发明方法的步骤(a)中,而且还可以用于产生周缘嵌合体。在所述周缘嵌合体包含种系或种系祖细胞和/或用于顽拗性植物的克隆繁殖的组织和/或植物部分的情况下,其中使用钢销进行固定的嫁接方法可以是但不限于本文所述的方法。任选地,所述嫁接方法,例如用于产生周缘嵌合体,具有更广泛的应用。这样的方法将包括与生成和选择任选地包含种系或种系祖细胞和/或用于本文定义的顽拗性植物的克隆繁殖的植物部分的植物的芽的方法相同的步骤,尽管在步骤(a)中要嫁接的植物不限于顽拗性和/或再生性植物,而是仅要求两种植物具有不同的基因型,并且在步骤(d)中待选择的所得芽干是周缘嵌合体,不一定包含种系或种系祖细胞和/或用于顽拗性植物克隆繁殖的组织和/或植物部分。任选地,植物由这样的周缘嵌合体生长,其可找到诸如但不限于WO 2018/115395和/或WO 2018/115396中指定的应用。这样的方法和所得的周缘嵌合体可以被认为是本文提供的进一步的发明。
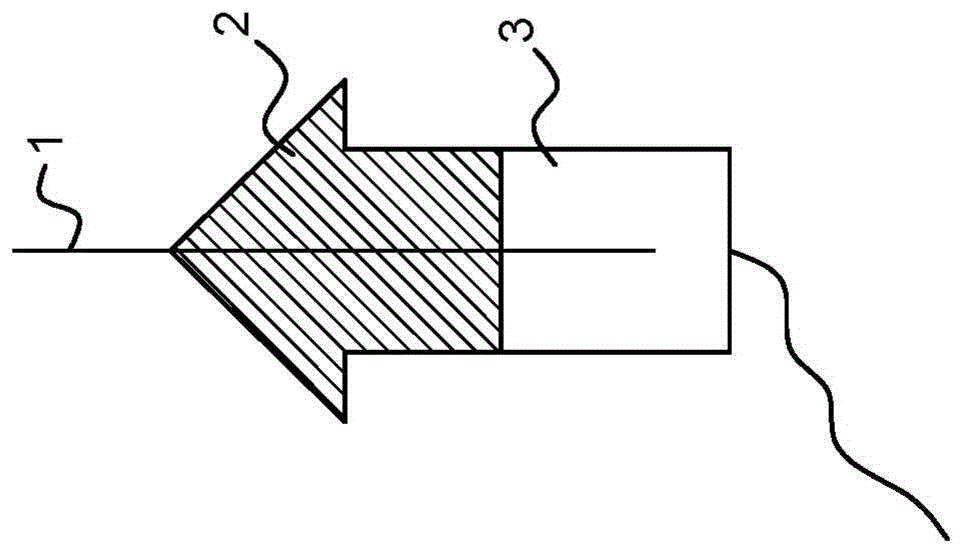
附图说明
图1.本发明的实施例的示例性表示。(A)体外繁殖的Bintje马铃薯作为接穗(2)嫁接到番茄砧木(3)上的示意图,显示了用于固定的任选钢销(1);(B)愈合后,嫁接联合体在嫁接愈合处被断头。标明了切割部位(4);(C)留下断头的嫁接物用于芽的再生(5)。
图2.共再生的植物:纯番茄(A);Bintje和番茄的周缘嵌合体(B);纯Bintje(C)。
图3.菊苣在K1Cg中于28℃黑暗中进行原生质体培养。A)从菊苣叶过夜酶消化获得的原生质体,B)菊苣原生质体在K1Cg培养基中培养4天后观察到的初始分裂,C)培养7天后观察到的微群落,D)培养11天后观察到的微群落。
图4.短角蒲公英在K1Cg培养基中在黑暗中于28℃进行原生质体培养。A)从蒲公英叶过夜酶消化获得的原生质体,B)在K1Cg培养基中培养3天后,空泡化原生质体没有显示分裂迹象,C)和D)显示培养后10天和17天的空泡化原生质体和原生质体碎片。
图5.从菊苣和蒲公英的原生质体混合物中再生小植株。A)和B)显示产生菊苣和蒲公英小植株(虚线圆圈)的混合愈伤组织的两个不同事件,可以通过它们不同的表型清楚地识别菊苣和蒲公英小植株。C)从对照菊苣愈伤组织中再生菊苣小植株,D)从混合原生质体的共培养物中挑选的产生短角蒲公英小植株的黄色愈伤组织。
图6.PCR反应显示蒲公英对照样品(泳道1)、菊苣对照样品(泳道2)和来自具有蒲公英表型(泳道3、5、7和8)或菊苣样表型(泳道4和6)的共再生体的叶材料样品中的两个蒲公英特异性条带(794bp)和菊苣特异性条带(429bp)。
图7.嫁接在辣椒上的毛椒嵌合体的发育。(A);植物1的左侧显示具有辣椒毛状体的小米辣椒表型,而右侧则具有纯小米辣椒表型。(B);2号植物具有类似的分开型表型,左侧具有纯辣椒表型,包括花青素斑块,右侧具有纯小米辣椒表型。(C);7号植物具有辣椒毛状体形态,具有小米辣椒生长特征。
图8.提供了这两个叶样品(第3叶和第4叶)的Caps测定结果。结果表明,植物1、2和7是嵌合体,植物3、4、5和6是纯辣椒。
图9.左:嫁接在170微米Nitex网中的RUBY和vYFP原生质体。右:对网冲洗到9M培养基中后,来自左侧的原生质体嫁接物。细胞团现在自由漂浮在液体培养基中。注意由于添加β-D-半乳糖基Yariv,两种细胞类型聚集在一起。
图10.(A)从野生型番茄下胚轴顶端的愈伤组织再生出丰富的芽。(B)gob突变体下胚轴形成小愈伤组织,偶尔有异常叶,但没有功能性芽分生组织。(C)对从WT-gob嫁接连接处共再生的嫁接杂种植物(chi)进行CAPS标志物分析。
实例1
马铃薯繁殖(马铃薯(Solanum tuberosum)栽培品种Bintje,原产于荷兰)通过在无激素固体MS20培养基Murashige Skoog(包含维生素、20g/L蔗糖、无激素)上使单节插条(带有腋芽的节间)生根进行。原产于荷兰的各种番茄基因型(即番茄(Solanumlycopersicum)栽培品种Money Maker与多毛番茄(Solanum habrochaites)种质LA1392或PI27826、潘那利番茄(Solanum pennellii)种质LA716或番茄(Solanum lycopersicum)种质LA3579)播种在浸有无菌自来水的无菌滤纸上,并在根出现后置于MS20上。嫁接如下进行:使用MS20中的番茄幼苗下胚轴(播种后约两周,其第一片真叶刚发育后)作为砧木,将幼小单节插条的马铃薯节茎尖作为接穗,并使用无菌钢销(0.15mm直径)插入砧木和接穗中心进行固定,如图1a所示。将嫁接物置于无菌组织培养容器中的MS20培养基上,温度为23℃,光照/黑暗时间为16/8小时。
总共251个嫁接物在6-9天内愈合,之后如图1b所示将它们断头,在番茄砧木上留下一层薄薄的马铃薯(约1mm),并使其在MS20中以垂直位置再生芽,如图1c所示,不添加任何激素。
虽然像Bintje这样的四倍体克隆繁殖的马铃薯在没有外部供应的植物激素的情况下不会再生,但番茄在MS20上从切断的下胚轴再生得非常快,6-12天后即可看到芽出现的第一个迹象。通过对形态特征(1)叶形状和(2)毛状体进行评分,在7-14天内从总共251个嫁接物中鉴定出三个含有马铃薯组织的芽。嫁接后1个月内,在具有不同番茄基因型的Bintje的不同嫁接组合中,这一数量增加到总共十个含有芽的马铃薯组织。因此,马铃薯组织再生似乎与所使用的番茄基因型无关。在这10个芽中,3个是纯马铃薯,6个是周缘区分嵌合体,1个是周缘嵌合体。这些芽的再生发生在嫁接的界面(连接处)。因此,发明人得出结论,马铃薯是在嫁接连接处共存的番茄细胞的影响下再生的。
图2显示了纯番茄、周缘嵌合体和Bintje再生体的图片。
实例2
菊苣(Chicoriumintybus L.)(靛蓝菊苣根(chicory Roodlof Indigo),Vreeken'sZaden公司,荷兰)(本文进一步表示为菊苣(chicory))的种子用70%乙醇进行表面灭菌30秒,然后用2%漂白剂(次氯酸钠溶液)灭菌15分钟,用无菌MQ漂洗3次,每次15分钟,并在黑暗中播种于具有MS(Murashige和Skoog,1962)20无激素培养基(pH 5.8)和0.8%琼脂的盆中。
短角蒲公英的种子(由捷克共和国普鲁洪尼斯
菊苣具有高度再生性,短角蒲公英具有顽拗性。
原生质体分离
一旦植物长到4-6周,就如下分别从菊苣和蒲公英植物的叶材料中分离菊苣和蒲公英原生质体。在CPW9M(27mg/L KH
菊苣原生质体失活
将用于共再生的纯化菊苣原生质体重悬于CPW9M中并用10mM碘乙酰胺(IOA,西格玛公司(Sigma))处理30分钟。IOA在有丝分裂前期充当有丝分裂纺锤体组装的不可逆抑制剂,从而阻碍细胞分裂(Varotto等人2001)。IOA处理后,用CPW9M漂洗原生质体两次。
蒲公英原生质体染色
纯化的蒲公英原生质体也重新悬浮于CPW9M中。由于蒲公英原生质体在K1Cg和K5Cg(其是选择的菊苣培养基)中不分裂,因此不需要用IOA处理它们。相反,为了可视化目的,蒲公英原生质体用荧光素二乙酸酯(FDA,Widholm1972)处理5分钟。
PEG处理
将IOA处理的菊苣和FDA处理的蒲公英原生质体以1:1、1:2或1:3的比例混合,原生质体总密度为1x10
方法1
每次实验,将1mL原生质体混合物轻轻移液4滴到6cm培养皿(Greiner 628102,西格玛奥德里奇公司(SigmaAldrich))上。将相同体积的PEG 3350MW溶液轻轻地滴加到原生质体混合物周围。将原生质体混合物和PEG溶液非常仔细地混合并在室温下孵育30分钟。随后,将10mL中和溶液添加至混合物中。然后,将混合物以800rpm离心5分钟,并用9M(9%(w/v)甘露醇、140mg/L CaCl
方法2
每个实验,将200μL原生质体混合物放入培养皿中,并将3体积的上述PEG 3350MW溶液逐滴添加到原生质体混合物中。孵育1分钟后,以1分钟的间隔添加两次700μL上述中和溶液。5分钟后,以5分钟的间隔添加3次2mL CPW9M。室温孵育10-15分钟后,将融合混合物以800rpm离心10分钟,并用9M漂洗两次,然后将其包埋在藻酸盐圆片中,如下文进一步详述。
原生质体培养
通过将9M中的原生质体悬浮液1:1与包含9%(w/v)甘露醇的1.6%海藻酸钠(S1320,Duchefa公司)溶液轻轻混合,将原生质体嵌入藻酸盐圆盘中,以获得最终原生质体密度0.25x10
1周后,除去K1Cg培养基,并更换为4mL K5CgK培养基(600mg/L CaCl
一旦微群落形成,用细镊子手工挑选1-3mm大小(2-3周)的微愈伤组织,并将50个微愈伤组织置于补充有1.43μM IAA(吲哚乙酸,Duchefa公司)和1.11μM BAP的MS10培养基的方形培养皿(Greiner 688102,西格玛奥德里奇公司)上。3周后,将愈伤组织(再生的初始迹象)转移至具有相同激素组合的SH(Schenk&Hildebrandt培养基,Duchefa公司)10培养基中。观察到芽状结构后,将它们转移到含有1.43μM IAA和1.11μM BAP的SH10盆中(OS60盆,Duchefa公司)。然后将发育中的芽转移至装有SH10无激素培养基的方盆(阿特斯塑料公司(Aarts plastics))中,并在25℃、16小时光照和8小时黑暗条件下培养。用菊苣和蒲公英的特异性引物对再生的植物进行基因分型。
结果
共再生
纯菊苣原生质体在分离后3-4天在补充有NAA和BAP的K1Cg培养基中原生质体培养的第一周期间开始初始分裂(图3B),并在4天后形成微群落(图3C)。培养11天后可见菊苣群落(图3D)。
纯蒲公英原生质体在K1Cg培养基中是顽拗性的并且不分裂,如图4B-D所示。培养3天后没有初始分裂的迹象。培养10天和17天后,蒲公英原生质体变成空泡化并且没有表现出存活的迹象。
将菊苣和蒲公英原生质体以1:1和1:2混合共培养后,分离后原生质体培养8-10周后形成淡黄色愈伤组织。这些愈伤组织在表型上与菊苣的带白色的水样愈伤组织明显不同。这些淡黄色愈伤组织出现在使用菊苣和蒲公英原生质体比例为1:1和1:2的原生质体混合物的实验中以及两种PEG处理方案(方法1和方法2)中。一旦这些愈伤组织开始显示出再生迹象,就可以观察到每个愈伤组织内出现两种不同的表型(图5A和B)。
衍生自带白色的菊苣愈伤组织的小植株具有与菊苣相似的较宽的叶,而淡黄色愈伤组织则产生与蒲公英相似的薄叶(图5C和D)。
对再生的小植株的叶进行取样,并分别使用菊苣特异性引物组或蒲公英特异性引物组在57℃的退火温度下对这些叶的DNA样品进行35个循环的PCR。菊苣特异性正向引物具有序列5’-CAGACACAATGGTAGATGATGG-3’(SEQ ID NO:10),并且菊苣特异性反向引物具有序列5’-CTTCATCGCCATGCCCAGAAG-3’(SEQ ID NO:11),从而产生429bp条带。蒲公英引物组的正向引物具有序列5'-TAAGAAACCGAAGCAAACTC-3'(SEQ ID NO:12),并且蒲公英引物的反向引物具有序列5'-GCGCTTTCTACAATCTTACA-3'(SEQ ID NO:13),产生794bp条带。
据观察,来自具有蒲公英样表型的共培养物的小植株仅给出蒲公英特异性条带,而菊苣样表型仅给出菊苣特异性条带(图6)。
这证明了以下概念:使用PEG 3350MW从原生质体共培养物中共再生两个差异很大的物种,即菊苣(高度再生性)和蒲公英(顽拗性)。
实例3
毛椒(Maor pepper)(辣椒;以色列)因是一种顽拗性植物而闻名,在受伤和/或组织培养时没有表现出芽分生组织再生。根据与实例1中所述相同的方法,制备了作为接穗的毛椒子叶节在作为砧木的小米辣椒(栽培品种雨林(rainforest),Vreeken’s Zaden公司,荷兰)幼苗下胚轴上的总共201个嫁接物并将其断头,不同之处在于嫁接物放置在含有1%蔗糖的MS10上,而不是含有2%蔗糖的MS20上。与实例1类似,断头后,使残余部分再生,不添加任何激素。
根据毛状体形态判断,在7-10天内从总共201个嫁接物中鉴定出两个含有毛椒组织的叶(周缘区分嵌合体)和五个具有纯毛椒叶和芽的植物。嵌合体1的左侧显示出整体小米辣椒表型,具有辣椒毛状体,并且可能是周缘嵌合体。右侧显示纯小米辣椒表型。左侧标记为1-1,右侧标记为1-2以供进一步分析(图7A)。嵌合体2具有相似的表型,其中左侧表型表现为纯辣椒,右侧表现为纯小米辣椒(图7B)。转移至温室后,根据毛状体形态被鉴定为纯辣椒的7号植物显示出小米辣椒生长表型,因此被鉴定为可能是周缘嵌合体(图7C)。
通过使用具有序列5’atactaatttccacccaacaacgt 3’(SEQ ID NO:14)的正向引物和具有序列5’tctcaacattaaacatgtcgccac 3’(SEQ ID NO:15)的反向引物的CAPS标志物测定,对这七个植物的样品进行PCR扩增。特别是,使用这些引物,对从叶样品中分离的DNA进行34个循环的PCR扩增,退火温度为55℃。将515bp产物与EcoRV一起孵育1小时。由于辣椒的扩增基因组序列中存在EcoRV识别位点,而毛椒的扩增基因组序列中不存在该位点,因此来自毛椒的扩增子的EcoRV孵育产生了515bp片段,而来自毛椒的扩增子的EcoRV孵育产生348bp和167bp的片段。图8显示从每个植物采集的样品支持表型分析,植物1、2和7是嵌合体,植物3、4、5和6是纯辣椒。
实例4
使用两种转基因烟草细胞系进行烟草(本塞姆氏烟草(Nicotiana benthamiana);Herbalistics公司,澳大利亚)原生质体嫁接和共再生。一种细胞系携带在35S启动子(35S::vYFP)的控制下的金星黄荧光蛋白,第二细胞系携带在35S启动子控制下的细胞质RUBY(He等人Horticulture Research[园艺研究](2020)7:152)(35S::RUBY)。为了制备烟草的嫁接体外芽培养物,使用在不含激素的MS20培养基上在18/8H光周期在25℃和60%-70%相对湿度生长。
从这些芽培养物中分离出烟草原生质体。将烟草植物的新鲜嫩叶倒置收集在含有5mL CPW9M(27mg/L KH
接下来使用以下步骤洗涤原生质体。用CPW9M预先润湿不锈钢50μm筛。在不吸取大碎片的情况下,将原生质体溶液移出并转移到筛上。将25mL KC(2g/L CaCl
为了嫁接原生质体,我们使用了170微米网孔和220微米厚度的无菌2x 2cm精密网片(Nitex#03-177/34),其干燥并保持无菌直至使用。将精密网应用于K8P琼脂平板(600mg/L CaCl
为了形成愈伤组织,孵育5天后用0,5MS+2%蔗糖+6%甘露醇+0,03mg/LNAA+0.1mg/L BAP替换K8p培养基并孵育7天。使用柠檬酸钠(14.7g/L柠檬酸三钠.2H2O、36.4g/L甘露醇,pH 6.5)溶解藻酸盐,并通过160微米无菌网(Nitex公司)选择较大的群落。如上所述将群落包埋在藻酸盐中,并添加新鲜的0,5MS+2%蔗糖+6%甘露醇+0.03mg/L NAA+0.1mg/l BAP。将密封的板在25℃下在黑暗中孵育。5天后,用0,5MS+2%蔗糖+3%甘露醇+0.03mg/L NAA+0.1mg/L BAP更换培养基,并如前所述孵育。用0,5MS+2%蔗糖+0.25mg/L玉米素更换培养基,并在25℃在光下孵育。每3周将其转移到新鲜培养基中直至出现再生。将圆盘或愈伤组织转移至含有0,5MS+2%蔗糖+0.25mg/L玉米素+0.8%微琼脂的培养皿中,并让芽发育以筛选所期望类型的再生体。
在几个独立实验中,嵌合叶由选择和手工挑选的愈伤组织发育而来(96个挑选的愈伤组织中有10个)。这些嵌合愈伤组织因其在全绿色或红色背景中具有红色+绿色器官而脱颖而出。这些嵌合体的一部分发育为周缘区分嵌合体,从其中利用腋芽发育周缘嵌合体。
实例5
还通过将再生性野生型(WT)嫁接到杯状基因(gob;Berger Y.等人(2009)TheNAC-domain transcription factor GOBLET specifies leaflet boundaries incompound tomato leaves.[NAC结构域转录因子GOBLET指定复合番茄叶中的小叶边界]Development[发育]136(5):823–832)的非再生性突变体中测试了在番茄(RZ52201,RijkZwaan公司,荷兰)中的共再生。纯合的gob无效突变体(gob-1,Berger等人2009)由于干细胞的特化/维持缺陷而无法(重新)生成芽(图10A和10B)。通过将gob无效突变接穗嫁接到WT砧木上(n=79个嫁接物)并随后培养这些嫁接连接处的切片,从形成从嫁接连接处再生的芽。除一种稳定的(周缘)嵌合体外,所有嵌合体均为WT,其中gob无效形成功能正常的表皮L1层(图10C)。因此,通过不定芽形成过程中的联合模式形成,即通过共再生,将稳定的干细胞身份赋予gob细胞。
- 顽拗性橡胶种子袋装沙藏冷库储存方法
- 可再循环的工业用共沸清洗剂、物品的清洗方法、工业用共沸清洗剂的再生方法、通过该再生方法再生的工业用共沸清洗剂以及清洗再生装置
