一种来源于中药美洲大蠊的锌离子螯合修饰肽及其应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及生物医学技术领域,特别涉及一种来源于中药美洲大蠊的锌离子螯合修饰肽及其应用。
背景技术
美洲大蠊(拉丁名Periplaneta americana,英文名American cockroach),别名蟑螂,属蜚蠊目蜚蠊科大蠊属昆虫。在我国传统医学中是一味重要的动物类中药,传统医学典籍中对其的记载最早可以追溯至汉代的《神农本草经》:对其的功效表述为“主血瘀,癥坚,寒热,破积聚,喉咽闭,内寒无子。”随着我国传统医学的发展,到了明代,李时珍所著的《本草纲目》中也记载了这一味独特的药物,将其描述为“身似蚕蛾,腹背具赤,两翅能飞。”
虽然美洲大蠊目前尚未被收载入《中国药典》,但湖南省中药材标准(2009年版)中已有记载:本品为蜚蠊科昆虫美洲蜚蠊Periplaneta americana(Linnaeus)的干燥全体。夏季捕捉或人工饲养。用乙醇浸泡杀死或沸水烫死,晒干或60℃烘干。性味与归经:咸,寒,入心、肝、脾、肾经。本品具有健脾消疳,活血通脉,利水消肿,敛疮生肌。用于胁痛,癥瘕,疳积,心悸,气喘,水肿。外用治水火烫伤、各种创伤及溃疡。
现代医学、药学研究表明,美洲大蠊中含有丰富的氨基酸、多糖、细胞色素、各种酶类,还有矿物元素(其中锌、铜、钾的含量较高,分别为96.11、103.25、14.39mg/kg)、维生素、脂肪与脂肪酸等成分。有效的药用成分主要有多肽类、多元醇类、粘糖氨酸等。另外,对于矿物元素,金属锌(Zinc)在美洲大蠊功效的发挥中起着重要的作用,锌离子参与许多和人体健康相关的酶促反应。随着近年来对锌元素研究的深入,已发现锌离子参与300多种酶的酶促催化反应,以及数种转录因子发挥其作用。比如在伤口愈合过程中,对锌离子的需求会大量增加。研究表明,Zn
当前已上市的药物——康复新液,主要成分为美洲大蠊干燥虫体提取物,具有通利血脉,养阴生肌的功效,即可内服,也可外用。内服:用于淤血阻滞,胃痛出血,胃、十二指肠溃疡;以及阴虚肺痨,肺结核的辅助治疗。外用:用于金疮、外伤、溃疡、瘘管、烧伤、烫伤、褥疮之创面。由于其主要成分为虫体提取物,因此患者的实际应用存在一些亟待解决的问题:①提取物成分复杂,容易导致不良反应。监测数据显示,康复新液常见的不良反应主要有:消化系统不良反应,恶心、呕吐、腹胀、腹痛、腹泻等。用药部位不良反应,红肿、疼痛等。皮肤不良反应,如皮疹、瘙痒等。其他不良反应,如头晕、头痛、胸闷、心悸、潮红、呼吸困难、过敏反应等,亦有局部麻木、过敏性休克等个案报告。②药品批次质量稳定性较难控制,中成药的质量(提取物)受药材品质影响,不可控因素较多。尽管目前有实力的制药企业在道地药材原产地自建符合GAP要求的药材原料基地,但实际工作中仍然存在药材质量不稳定的情况。③质量标准难以符合品控的要求。有关研究表明,康复新液中的主要药效成分是多肽,质量标准以总蛋白的含量为指标,并不能很好的反应出药效成分的含量。
因此,针对现有技术的瓶颈与不足:美洲大蠊虫体干燥不彻底而变质;提取物总蛋白含量不稳定;提取物杂质去除不彻底而出现不良反应;制得的中成药按照质量标准虽然合格,但批次间差异较大等问题而影响治疗效果,有必要开发一种新型安全有效、能提高治疗效果以及更好的控制产品质量的皮肤修复产品。
发明内容
本发明目的是提供一种来源于中药美洲大蠊的锌离子螯合修饰肽及其应用,基于来源于中药美洲大蠊的天然多肽SPPFAPRL进行修饰,在其氨基端(N端)引入三个氨基酸残基GHC,甘氨酸G、组氨酸H、半胱氨酸C可通过其富含电子的原子或基团与二价锌离子Zn
为解决上述技术问题,本发明采用如下技术方案:
在本发明的第一方面,提供了一种来源于中药美洲大蠊的锌离子螯合修饰肽,所述来源于中药美洲大蠊的锌离子螯合修饰肽的核苷酸序列SEQ ID NO.1所示,且所述多肽中的氨基酸GHC残基螯合了二价锌离子Zn
在本发明的第二方面,提供了所述的来源于中药美洲大蠊的锌离子螯合修饰肽在制备用于抗氧化的产品中的应用。
在本发明的第三方面,提供了所述的来源于中药美洲大蠊的锌离子螯合修饰肽在制备用于促进细胞迁移或/和增殖的产品中的应用。
在本发明的第四方面,提供了所述的来源于中药美洲大蠊的锌离子螯合修饰肽在制备用于促进伤口修复或/和愈合的产品中的应用。
进一步地,所述产品包括药物、化妆品或日用品中的至少一种。
在本发明的第五方面,提供了一种用于抗氧化或促进伤口修复、愈合的产品,包括所述的来源于中药美洲大蠊的锌离子螯合修饰肽。
进一步地,所述产品还包括在医药或日化品上可接受的盐和/或可接受的辅料。
进一步地,所述产品可以根据常规制剂方法制备成注射剂、注射用无菌粉末、粉剂、膏剂、霜剂、凝胶剂、微针等多种药物剂型或/和日化产品。
进一步地,所述产品可以通过注射、涂抹、敷贴、针刺,以及其他物理或化学介导的方法导入肌肉、内皮、皮下或粘膜组织,或是被其他物质混合或/和包裹后导入肌体。
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
1、本发明提供一种来源于中药美洲大蠊的锌离子螯合修饰肽及其应用,本发明通过在天然多肽序列SPPFAPRL的氨基端前通过酰胺键加入三个氨基酸残基GHC来螯合二价金属锌离子。该修饰肽具有如下优点:
(1)将二价金属锌离子Zn
(2)相较于无机物(如炉甘石中的氧化锌、碳酸锌等),多肽通过配位键螯合锌的离子具有结构稳定,质量可控,易于吸收等优势。
(3)与美洲大蠊天然多肽序列SPPFAPRL的神经激素作用不同,本发明所设计、制备的锌离子螯合修饰肽具有抗氧化、促进细胞迁移或/和增殖、促进伤口愈合等功能。而实验表明天然多肽无促进细胞迁移或/和增殖、无促进伤口愈合作用,仅具有较弱抗氧化作用(且相较于空白对照组差异无统计学意义)
2、本发明提供的来源于传统中药美洲大蠊的锌离子螯合修饰肽的制备方法,其原料价廉且易于获得,制备工艺成熟且简单,能满足现代企业工业化大规模生产的要求。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
图1为固相合成法制备的多肽序列GHCSPPFAPRL的质谱图;
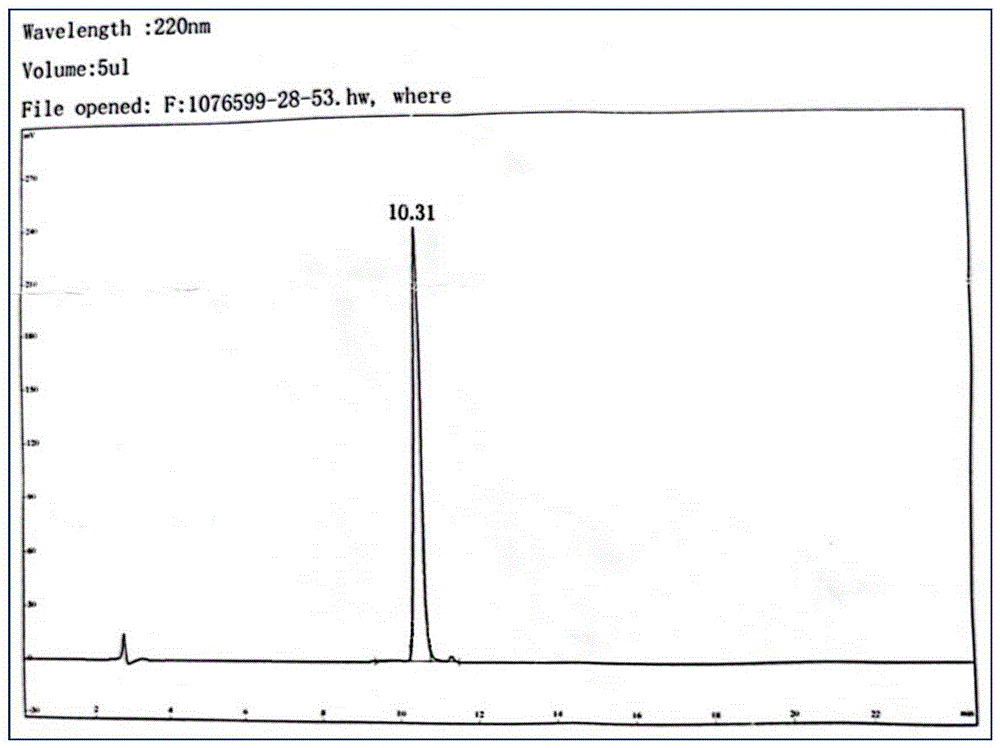
图2为制备的来源于中药美洲大蠊锌离子螯合修饰肽的HPLC图;
图3为计算机模拟的来源于中药美洲大蠊锌离子螯合修饰肽的空间结构图;
图4为来源于中药美洲大蠊锌离子螯合修饰肽的溶血活性结果;
图5为来源于中药美洲大蠊锌离子螯合修饰肽抗H
图6为来源于中药美洲大蠊锌离子螯合修饰肽促进内皮细胞系HUVEC的增殖;
图7为来源于中药美洲大蠊锌离子螯合修饰肽促进成纤维细胞系NIH-3T3迁移;
图8为来源于中药美洲大蠊锌离子螯合修饰肽促进小鼠伤口愈合。
具体实施方式
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买获得或者可通过现有方法获得。
本发明实施例提供的一种来源于中药美洲大蠊的锌离子螯合修饰肽及其应用,其总体思路如下:
本发明所涉及的天然多肽来源于传统中药美洲大蠊Periplaneta americana虫体中分离、鉴定到的天然多肽,该天然多肽由8个氨基端残基所组成,其氨基酸残基的序列为:SPPFAPRL。(参考文献:Predel R,Kellner R,Kaufmann R,Penzlin H,
本发明通过酰胺键链接,在美洲大蠊分离的天然多肽序列SPPFAPRL的氨基端(N端)前引入三个氨基酸残基,即甘氨酸G、组氨酸H以及半胱氨酸C,完整的锌离子螯合修饰肽的序列为GHCSPPFAPRL,其计算模拟的该分子的空间结构及该修饰肽分子的设计思路如下所示:
作为一种具体的实施方式,所述来源于中药美洲大蠊的锌离子螯合修饰肽的制备方法包括:
通过多肽固相合成技术合成多肽GHCSPPFAPRL;接下来通过微波反应使引入的三个氨基酸残基GHC与二价锌离子Zn
通过多肽固相合成技术,制备了该来源于中药美洲大蠊的锌离子螯合修饰肽,其由11个氨基酸残基组成,理论分子量为1181.38Da,理论等电点pI为8.26。
该修饰肽对于鼠源成纤维细胞NIH-3T3具有较强的抗氧化作用,同时亦能促进成纤维细胞系NIH-3T3的迁移以及人源血管内皮细胞系HUVEC的增殖;动物水平实验表明,其具有加速伤口愈合的作用。溶血活性研究表明其对于红细胞亦具有较低的细胞毒性,且制备工艺简便,符合工业化大规模生产的要求。具有较好的开发价值及应用前景,可作为候选药物进行深入研究。
下面将结合实施例及实验数据对本申请的一种来源于中药美洲大蠊的锌离子螯合修饰肽及其应用进行详细说明。
实施例1、来源于中药美洲大蠊的锌离子螯合修饰肽
1、本发明所设计的来源于中药美洲大蠊锌离子螯合修饰肽中间体线性多肽序列GHCSPPFAPRL的制备
在此线性肽肽段的合成中,运用9-芴甲氧羰基(FMOC)作为氨基端的保护基团,选用4-甲基二苯基甲胺树脂(4-methyl-benzhydrylamine resin·HCl,MBHA resin)为多肽合成的固相载体,使用HOBt/DCC为反应的缩合剂,由羧基末端向氨基末端(C端→N端)延长肽链。用90.0%三氟乙酸、4.0%水和6.0%三异丙甲硅烷(TIA)的混合液(质量百分比)将含有11个氨基酸残基的多肽序列GHCSPPFAPRL从MBHA树脂上裂解下来。经乙醚反复几次沉淀后,通过制备型反向高效液相色谱RP-HPLC纯化。
纯化过程:使用C18反相制备柱(250mm×20mm,5μm);流动相:1‰三氟乙酸,0%~65%(体积百分比)乙腈为流动相,1.5mL/min的流速进行梯度洗脱。收集主峰洗脱液,-80℃冻存6小时后放入冻干机冻干,冻干成疏松的固体粉末后置于-20℃冰箱备用。经ESI-Q-TOF-MS鉴定,其分子量与拟制备多肽中间体相应的理论分子量一致,m/z 1182.68[M+H]
2、本发明所述的来源于中药美洲大蠊锌离子螯合修饰肽的制备
将实施例1中所制备的多肽用Milli-Q超纯水配置成浓度为5mg/mL的多肽溶液,按照多肽:二价锌离子Zn
实施例2、本发明所述的来源于中药美洲大蠊锌离子螯合修饰肽的溶血活性
从男性健康自愿者获得新鲜血液,分离人红细胞后制成悬液,以无菌PBS缓冲液为阴性对照、灭菌Milli-Q超纯水为阳性对照,测定该锌离子螯合修饰肽的溶血活性。
具体步骤如下:用肝素抗凝管收集全血,轻轻颠倒使血液充分抗凝,于室温1000rpm离心10min,吸尽上层血浆并保留下层红细胞;加入3~5倍体积的灭菌PBS缓冲液,用移液枪轻柔吹吸,悬浮离心管底部沉淀的红细胞,于室温下1000rpm离心6min,弃去上清保留沉淀下来的红细胞,重复上述操作3~5次,至上清液变为无色即可;用灭菌PBS缓冲液将红细胞制成2%~3%(v/v)浓度的细胞悬液;用灭菌生理盐水将该本发明所述的来源于中药美洲大蠊锌离子螯合修饰肽配置成32μmol/L、16μmol/L、8μmol/L、4μmol/L和2μmol/L浓度的溶液;将100μL该锌离子螯合修饰肽溶液和100μL红细胞悬浮液混合并加入至96孔板中,使多肽的终浓度分别为16μmol/L、8μmol/L、4μmol/L、2μmol/L和1μmol/L;阴性对照组为用灭菌PBS缓冲液悬浮的红细胞,阳性对照使用灭菌Milli-Q超纯水水悬浮红细胞;将样品放入恒温摇床中,(36.5(0.5)℃下80rpm~120rpm孵育40min后;于室温将样品以5000rpm离心5min,每孔中取150μL上清液转移至另一干净的96孔板中;用全波长酶标仪测定490nm波长处的吸光度,并通过以下公式计算溶血百分率,公式中H为490nm波长处的吸光度:溶血率(%)=(H
图4的结果表明,本发明所述的来源于中药美洲大蠊锌离子螯合修饰肽在终浓度为16μmol/L时仍未出现明显的溶血作用(溶血率≤4%)。
实施例3、本发明所述的锌离子螯合修饰肽抗H
选择生长状态良好的NIH-3T3细胞,前一天晚上换成不含血清的培养基,饥饿处理过夜,第二天早上,取出细胞,用胰酶消化处理细胞,经过1000rpm离心5min,取出,弃上清,用DMEM培养基清洗细胞,按照每孔约6×10
不同浓度(≤16μmol/L)的本发明所设计的来源于美洲大蠊的锌离子螯合修饰肽对NIH-3T3细胞均无明显的毒性(图5A)。
加入不同浓度的H
实施例4、本发明所述的锌离子螯合修饰肽促内皮细胞系HUVEC的增殖
从液氮中取出细胞冻存管,立即放入37℃水浴中解冻至管内残留一点冰屑。用75%酒精擦拭冻存管后,轻柔吹吸,并将细胞悬液转移至细胞培养皿中,加入10mL预温至37℃的Gibco M200培养基(含有10%FBS和10%低血清生长因子血管生长因子S00310)。由于HUVEC细胞为有限系,因此传代至第10代后应弃去,重新复苏细胞用于实验。
细胞传代操作为:待HUVEC细胞的融合率约为80%~85%时,弃去培养基,用无菌PBS缓冲液润洗3次后吸净残留液体,加入适量0.25%的胰蛋白酶溶液浸润培养皿底部,置于37℃细胞培养箱中30~45秒,显微镜下见大部分细胞变圆后加入2倍体积的完全培养基终止消化,轻柔吹吸细胞,吸取适量细胞悬液至另一新培养皿中,于37℃、5%CO
采用CCK-8法测定本发明所述的锌离子螯合修饰肽对内皮细胞系HUVEC增殖的影响,具体操作为:
收集对数生长期细胞,稀释细胞悬液至适当浓度,96孔板每孔加入100μl,使细胞密度为6 000cells/well;2、于5%CO
结果如图6所示,表明本发明所述的锌离子螯合修饰肽在终浓度为1~4μM时,对HUVEC细胞无增殖效应(亦无毒性);在浓度为8μM时具有促进细胞增殖的作用(图6),相较于对照组,差异具有统计学意义(P<0.05);浓度增加到16μM时,差异具有显著的统计学意义(P<0.01)。
实施例5、本发明所述的锌离子螯合修饰肽促成纤维细胞系NIH-3T3的迁移
取培养至融合率为70%~80%的小鼠成纤维细胞系NIH-3T3细胞,吸净培养基并弃去,用37℃温育后的无菌PBS缓冲液洗2~3次;加入于适量0.25%胰酶于37℃消化30~45秒,轻轻拍打培养皿或培养瓶使细胞从培养容器底部脱落,加入适量含有10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基轻柔吹打细胞制成单细胞悬液;用培养基稀释细胞,调整细胞浓度约为(3~5)×10
迁移率%=(L
其中L
结果如图7所示,表明:较之于对照组,实验组(含有16μmol/L修饰肽的DMEM完全培养基)细胞迁移速率更高(图7A),差异具有极显著统计学意义P<0.001(图7B)。
实施例6、本发明所述的锌离子螯合修饰肽促进小鼠皮损伤口修复
将成年8周龄体重的20-25g雄性BALB/c小鼠,分为两组(对照组和实验组),每组6只,异氟烷吸入麻醉,待小鼠完成麻醉后,用直径为6mm的活检取样器在小鼠背部中间处人为造成皮损伤口。
对照组伤口处滴加10μL灭菌注射用氯化钠溶液,实验组滴加10μL浓度为16μmol/L的本发明所述的锌离子螯合修饰肽,等待15-30min使液体基本吸收,最后用无菌敷料覆盖伤口并用小块无菌胶布覆盖并固定敷料。每隔一天给药一次,共给药5次,共计10天。
结果如图8所示,表明:与对照组相比,实验组创伤口修复速度明显较快,第1天、第5天及第10天的代表性伤口如图8所示(标尺为5mm)。
实施例7、不同剂型的制备
1、片剂
取本发明所述的来源于中药美洲大蠊的锌离子螯合修饰肽1g、淀粉20g、糊精5g混合,质量浓度为50%的药用级聚乙烯吡咯烷酮(PVP)为粘合剂,制粒,整粒,压片,既得片剂。
2、乳膏剂
取本发明所述的来源于中药美洲大蠊的锌离子螯合修饰肽0.5g、单硬脂酸甘油酯1.0g、硬脂酸2.5g、白凡士林0.2g、液体石蜡1.2g、羊毛脂1.0g、三乙醇胺0.1g、蒸馏水15mL,混匀即得。
3、凝胶剂
取5mL蒸馏水,将适量卡波姆(约0.2g)撒于液面上,45℃温水浴并搅拌使其充分溶胀。加入丙二醇混合均匀,然后边搅拌边加入三乙醇胺使其成为凝胶基质;将本发明所述的来源于中药美洲大蠊的锌离子螯合修饰肽0.2g溶于浓度为0.15M的PBS缓冲液中(pH=7.2),在不断搅拌下将其缓慢加入凝胶基质中。最后加入剩余蒸馏水,制得10.0g该修饰肽凝胶。
4、注射用冻干粉
取本发明所述的来源于中药美洲大蠊的锌离子螯合修饰肽3g、甘露醇15g,置于容器中,加适量PBS缓冲液(0.15M,pH7.4)溶解,加注射用水至250mL,摇匀,加8-10g针用活性炭,室温温和搅拌约60分钟,粗滤,用0.22μm灭菌滤膜过滤除菌,分装,每瓶2.0mL,采用速冻的方法,每分钟降温10-15℃,降温至-45-50℃,维持1小时,抽真空。冻干12-18小时后,在真空状态下缓慢升温,升温速度每小时4~5℃,温度升至室温(25℃)时停止升温,待温度接近室温后取出,加盖密封,既得冻干粉针剂。
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 一种含有Cys-Ser的高锌螯合活性锌螯合肽及其应用
- 一种含有Ser-Cys的高锌螯合活性锌螯合肽及其应用
