用于治疗脊髓损伤的Zn-MOF及其制备方法和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于生物医药技术领域,特别涉及用于治疗脊髓损伤的Zn-MOF及其制备方法和应用。
背景技术
脊髓损伤(Spinal cord injury, SCI)是脊柱损伤的严重并发症,通常继发于直接或间接外力所致的脊柱骨折,比如直接暴力、运动、跌倒、交通事故、高处坠落等因素。脊髓损伤可能导致患者的四肢、肠道、膀胱以及性功能障碍等,从而给患者造成了严重的身体以及精神上的伤害,极大地降低了患者的生活质量。据统计,全球约有2000多万脊髓损伤的患者,并且以每年约70万名患者的数量在增加,其中男女比例约为2:1,且成人数量多于儿童。目前对于脊髓损伤的治疗主要集中在手术治疗、药物治疗、干细胞治疗等,尚无确切有效的治疗方法。因此,急需对脊髓损伤进行更深入的研究。。
脊髓损伤有着极其复杂的病理生理机制,比如细胞缺失和死亡、缺乏神经营养因子、炎症反应、轴突断裂、脱髓鞘以及胶质瘢痕形成等抑制因素,阻碍了脊髓损伤后受损神经的再生和恢复。脊髓损伤发生后,在其损伤区域发生了一系列复杂的病理生理变化,根据时间和病理生理改变可以分为原发性损伤和继发性损伤。原发性损伤是损伤的最初阶段,伤后立即发生,包括损伤时的脊髓震荡、挫伤与骨折,以及脊髓血管破裂、受损区域红细胞脱落、轴突断裂、髓鞘破裂等现象,其损伤的严重程度主要取决于最初破坏的程度以及脊髓受压持续的时间。继发性损伤发生于原发性损伤之后,原发性损伤促发复杂的继发性损伤级联反应,对脊髓组织产生进一步的化学和机械损伤,包括各种激活的炎性细胞聚集到损伤区域而产生的一系列炎症级联反应、脂质过氧化、自由基形成、细胞凋亡、沃勒变性、组织水肿、胶质瘢痕形成等。脊髓损伤分为急性期、亚急性期和慢性期。脊髓损伤48h之内属于急性期,损伤48h到14d属于亚急性期,14d到6个月属于中期,超过6个月属于慢性期。在脊髓损伤的急性期,由于脊髓血管破裂导致严重的出血,以及许多炎症因子如IL-6、IL-1β和TNF-α的水平显著增加,可以导致细胞功能障碍以及死亡。在脊髓损伤的急性期和亚急性期,由于血脊髓屏障的破坏、剧烈的炎症反应以及炎症细胞释放的包括自由基(比如超氧阴离子和过氧化氢等)在内的许多细胞毒性物质,可以加重脊髓的进一步损伤。随着急性炎症反应的消退,即到了脊髓损伤的中慢性期,在此期可以发生血管的重塑、髓鞘的形成以及神经回路的重塑等。
金属-有机框架材料(MOFs)又称多孔性配位聚合物,是一类由金属离子/簇合物和功能性有机配体通过强配位键组装而成的多孔性晶体材料。MOFs具有多种多样的结构,它具有合成简单、易于表面功能化、高孔隙率、低密度、高比表面积和负载量、孔道规则、孔径可调、拓扑结构多样性和可裁剪性、良好的生物相容性和可生物降解性等优点,已经被广泛应用于药物输送、生物成像与传感、气体吸附/分离/储存、海水淡化以及生物医学应用等领域。在MOFs的药物运输与释放等领域上表现出很好的药物承载以及控制释放的能力。然而,常规搭载的金属是锰和铬,具有较大的毒性,因此并不适用于生物医学的应用。为了将MOFs成功应用于生物领域上,比如细胞内成像、药物载体等,必须确保MOFs的无毒性。
目前,对于脊髓损伤的治疗仍然十分有限,因此,深入研究脊髓损伤的发病机制对于治疗脊髓损伤至关重要。有研究表明,氧化应激介导的炎症反应是脊髓损伤的重要发病机制之一,并且可以通过缓解氧化应激来减少脊髓损伤治疗过程中的继发性损伤。此外,许多研究表明,金属-有机框架材料(MOFs)可以将药物稳定、无毒地包裹在其孔隙内,并将药物缓慢释放。因此,MOFs可以作为有效的药物载体用于药物的运输。锌是一种低毒性的过渡金属阳离子,已经成为制备Zn-MOF的理想候选者,Zn-MOF可用于生物系统的应用,特别是作为药物的载体。然而,目前Zn-MOF在脊髓损伤方面的研究较少,并且尚未有文章报道Zn-MOF对脊髓损伤后的修复作用。本研究旨在探讨Zn-MOF是否具有抗氧化能力以及是否可以促进脊髓损伤的修复,进而研究Zn-MOF促进脊髓损伤修复的机制,为临床上治疗脊髓损伤提供一定的参考依据。
发明内容
本发明的目的在于解决现有技术中所存在的不足,提供一种用于治疗脊髓损伤的Zn-MOF及其制备方法和应用。本发明所提供的Zn-MOF化合物,能够有效降低细胞内活性氧水平、实现显著的抗氧化能力,且能够促进神经元生长和脊髓损伤后运动功能的恢复。同时,本发明的Zn-MOF化合物相较于常规锰、铬等金属框架化合物安全性更好,无论是对神经元细胞还是对机体主要器官组织均无明显毒副作用,为脊髓损伤药物助治疗提供一种新的药物来源。
为了解决上述技术问题,本发明是通过如下技术方案得以实现的。
本发明第一方面提供了一种Zn-MOF化合物,其通过如下制备方法制备得到:
(1)将ZnCl
(2)使用NaOH溶液将pH值调整为7-9,并在马弗炉中进行加热,得到混合物;
(3)将步骤(2)得到的混合物进行离心,弃上清取沉淀得到浅灰色固体;
(4)将步骤(3)得到的浅灰色固体用水洗涤并干燥,即得。
作为优选地,步骤(1)中所述ZnCl
作为优选地,步骤(2)中所述NaOH的浓度为10mol/L。
作为优选地,步骤(2)中所述加热的温度为110-170℃,加热的时间为12-36h;最优选地,所述加热的温度为140℃,加热的时间为24h。
作为优选地,步骤(3)中所述离心的转速为10000-15000rpm,离心的时间为10-20min,离心的温度为2-6℃;最优选地,所述离心的转速为10000-15000rpm,离心的时间为15min,离心的温度为4℃。
作为优选地,步骤(4)中所述洗涤的次数为1-3次;最优选地,所述洗涤的次数为2次。
本发明第二方面提供了一种Zn-MOF化合物的制备方法,包括如下步骤:
(1)将ZnCl
(2)使用NaOH溶液将pH值调整为7-9,并在马弗炉中进行加热,得到混合物;
(3)将步骤(2)得到的混合物进行离心,弃上清取沉淀得到浅灰色固体;
(4)将步骤(3)得到的浅灰色固体用水洗涤并干燥,即得。
作为优选地,步骤(1)中所述ZnCl
作为优选地,步骤(2)中所述NaOH的浓度为10mol/L。
作为优选地,步骤(2)中所述加热的温度为110-170℃,加热的时间为12-36h;最优选地,所述加热的温度为140℃,加热的时间为24h。
作为优选地,步骤(3)中所述离心的转速为10000-15000rpm,离心的时间为10-20min,离心的温度为2-6℃;最优选地,所述离心的转速为10000-15000rpm,离心的时间为15min,离心的温度为4℃。
作为优选地,步骤(4)中所述洗涤的次数为1-3次;最优选地,所述洗涤的次数为2次。
本发明第三方面提供了上述Zn-MOF化合物或根据上述制备方法制备得到的Zn-MOF化合物在制备治疗与氧化应激相关的疾病的药物中的应用。
作为优选地,所述与氧化应激相关的疾病选自脊髓损伤。
本发明第四方面提供了一种用于治疗与氧化应激相关的疾病的药物组合物,包括上述Zn-MOF化合物或根据上述制备方法制备得到的Zn-MOF化合物,以及药学上可接受的载体。
作为优选地,所述与氧化应激相关的疾病选自脊髓损伤。
作为优选地,所述药学上可接受的载体选自填充剂、崩解剂、润滑剂、粘合剂、抗氧剂、抑菌剂、矫味剂、芳香剂、螯合剂中的一种或多种。
脊髓损伤涉及复杂的炎症反应过程,由包括IL-1β、IL-6在内的许多炎症因子协调。脊髓损伤后,IL-1β、IL-6的表达是急剧增加的。有研究发现,过表达IL-6可以促进胶质细胞增生,因此,在脊髓损伤的急性期降低IL-6的水平可以抑制胶质瘢痕的形成。此外,脊髓损伤后高水平的IL-6会抑制神经元轴突的生长。IL-1β是研究最广泛的促炎细胞因子之一,它主要由小胶质细胞产生,此外,神经元和星形胶质细胞等也可以产生IL-1β。在损伤的中枢神经系统中,IL-1β的表达是急剧增加的。IL-1β可以激活免疫系统,促进炎症因子以及其他细胞因子的产生,还可以激活神经毒性介质。IL-1β对脊髓损伤后胶质细胞的形成、轴突的可塑性等方面有很大的负面影响,并与严重的功能预后相关。有研究表明,敲除IL-1β可以减少星形胶质细胞的增生,并可抑制脊髓损伤后的炎症反应。
基质金属蛋白酶9(MMP9)是基质金属蛋白酶(Matrix Metalloproteinases,MMPs)家族中最被广泛研究的成员之一,它是一种明胶酶。MMP9参与细胞外基质的降解,可以促进明胶、Ⅳ型、Ⅴ型和XI型胶原、髓鞘碱性蛋白、弹性蛋白等的降解。死亡。在脊髓损伤后,MMP9的表达是增加的,它与脊髓损伤后的炎症以及血脊髓屏障的破坏有关。参与脊髓损伤炎症反应的中性粒细胞、巨噬细胞和单核细胞均可以表达MMP9。MMP9在脊髓损伤后12-24h上调并达到最大活性,脊髓损伤部位的中性粒细胞是MMP9的主要来源。在脊髓损伤后的前3天,抑制MMP9的活性可以降低血管通透性并减轻炎症。在整个神经系统的发育过程中,均有MMP9的表达并且其参与了发育过程中轴突的生长。
本发明所制备合成的Zn-MOF能够有效降低细胞内活性氧水平,实现显著的抗氧化能力,且可降低脊髓损伤后IL-6和IL-1β的水平,抑制MMP9的表达。经Zn-MOF处理后可促进分支形成和神经突生长,表明Zn-MOF可修复神经元细胞,对抗氧化应激诱导的损伤。此外,体内研究表明,在采用Zn-MOF处理后,能够显著促进脊髓损伤小鼠运动功能的恢复,BMS评分改善明显。同时,Zn-MOF处理后的脊髓损伤小鼠体内ROS生物发光强度显著降低,充分证实了Zn-MOF在体内具有显著的氧自由基清除以及脊髓损伤修复作用。除此以外,踏空实验、转棒实验、足印实验、CatWalk步态分析以及电生理评估等方法显示经Zn-MOF治疗后小鼠后肢运动功能则显著优于SCI模型组,进一步证明了Zn-MOF能够显著改善脊髓损伤修复、促进肢体功能的恢复。
本发明相对于现有技术具有如下有益效果:
(1)本发明所提供的Zn-MOF化合物能够有效降低细胞内活性氧水平,降低脊髓损伤后IL-6和IL-1β的水平,抑制MMP9的表达,实现显著的抗氧化能力,可修复海马神经元细胞,对抗氧化应激所诱导的损伤,并可促进神经元分支形成和神经突生长。同时,本发明的Zn-MOF能够显著促进脊髓损伤小鼠机体内的氧自由基,促进脊髓损伤的修复以及运动功能的恢复。
(2)本发明所制备得到的Zn-MOF化合物无论是对HT22细胞、海马神经元细胞还是对机体的主要组织和器官均无明显毒副作用,相较于现有技术中常用的锰、铬等金属框架化合物来说安全性得到明显提升,从而为包括脊髓损伤在内的氧化应激相关疾病的治疗提供一种新的研究思路和药物来源,具有显著的临床应用前景和社会价值。
附图说明
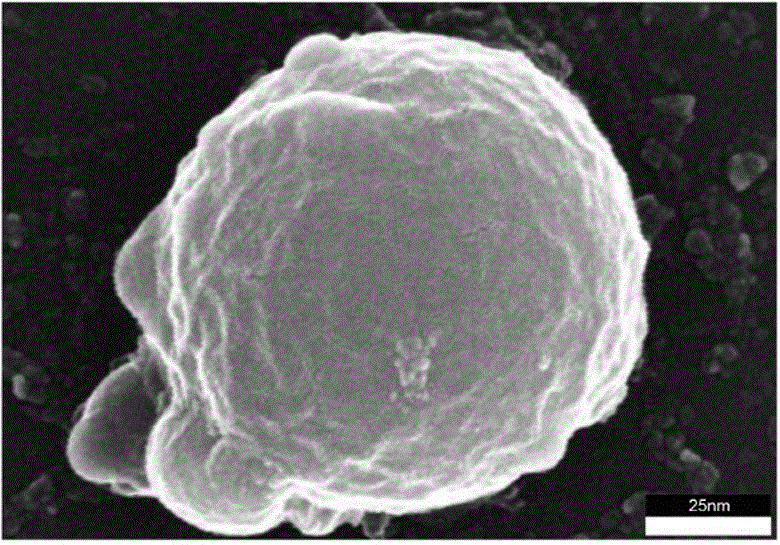
图1为Zn-MOF的透射电子显微镜表征示意图。
图2为Zn-MOF中C、O、Zn元素的分布情况示意图。
图3为傅里叶红外光谱仪和纳米粒度分析仪对Zn-MOF分析结果示意图。
图4为Zn-MOF自由基清除能力结果示意图。
图5为DCFH-DA染色分析不同浓度Zn-MOF对HT22细胞ROS水平影响结果示意图。
图6为流式细胞术分析不同浓度Zn-MOF对HT22细胞ROS水平影响结果示意图。
图7为不同浓度Zn-MOF对HT22细胞活力影响结果示意图。
图8为不同浓度Zn-MOF对海马神经元细胞活力影响结果示意图。
图9为Zn-MOF对原代海马神经元轴突延伸的影响结果示意图。
图10为不同组别的BMS评分结果示意图。
图11为脊髓损伤60天后不同小组小鼠的形态图。
图12为不同组别小鼠体内的活性氧水平结果示意图。
图13为不同组别小鼠的足失误率结果示意图。
图14为不同组别小鼠的掉落潜伏期结果示意图。
图15为不同组别小鼠的步长和步宽结果示意图,
图16为不同组别小鼠的左后肢最大接触面积平均值与左后肢最大接触平均强度结果示意图。
图17为不同组别小鼠的右后肢最大接触面积平均值与右后肢最大接触平均强度结果示意图。
图18为不同组别小鼠的步序正常指数结果示意图。
图19为不同组别小鼠的运动诱发电位结果示意图。
图20为脊髓损伤60天后不同组别小鼠脊髓组织的HE染色结果示意图。
图21为不同组别小鼠的主要脏器HE染色结果示意图。
图22为不同组别小鼠血清IL-6和IL-1β含量检测结果示意图。
图23为不同组别小鼠MMP9含量检测结果示意图。
具体实施方式
为使本发明的目的、技术方案及效果更加清楚、明确,以下参照实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
在无特别说明的情况下,本发明上下文中所使用的试剂中,均通过市售获得。对于动物实验,相关程序及方法符合医学伦理学要求。本发明所使用的实验方法均为本领域的常规方法和技术。
生物学实验重复中选择具有代表性的结果呈现在上下文附图中,数据按照图示中规定的以mean±SD和mean±SEM展示。所有实验至少重复三次。数据采用GraphPad Prism5.0或SPSS 22.0软件进行分析。采用t检验、卡方检验、方差分析等常规医学统计学方法比较两组或两组以上的平均值差异。
实施例1 Zn-MOF的制备和表征
(1)将1.0g ZnCl
(2)使用10mol/L的NaOH溶液将pH值调整为8,并在马弗炉(Sxi-8-10,新韩仪器设备有限公司)中进行140℃下加热24h,得到混合物。
(3)将步骤(2)得到的混合物于4℃、12000rpm条件下离心15min,弃上清取沉淀得到浅灰色固体。
(4)将步骤(3)得到的浅灰色固体用水洗涤2次并干燥,即得Zn-MOF化合物。
取上述制备得到的Zn-MOF化合物,采用透射电子显微镜对其形貌和结构进行观察,通过对携带有样品内部结构信息的电子束进行放大成像而获得样品的形貌和结构信息,结果如图1所示。随后使用X射线光电子能谱仪对Zn-MOF化合物表面的元素进行表征,结果如图2所示。结果显示,制备得到的Zn-MOF化合物呈现类似球形,直径约为100nm,图2中展示了其中Zn、C、O元素的分布情况。进一步地分别通过纳米粒度分析仪对Zn-MOF化合物进行检测,结果如图3所示。纳米粒度分析仪测试结果显示:Zn-MOF的直径约等于100nm,与前述透射电子显微镜检测结果相一致。以上测试结果表明成功合成了Zn-MOF化合物。
实施例2 Zn-MOF在体外对氧化应激的作用研究
取实施例1制备得到的Zn-MOF化合物,采用ABTS法对其自由基清除能力进行检查,具体步骤如下:
(1)取20mL PBS溶液置于50mL离心管中,然后称取54.87mg的ABTS并将其加入至含有PBS溶液的离心管中,充分混合均匀制得ABTS储备液。
(2)准备一张滤纸并在滤纸上放置足够量的MnO
(3)将100μL不同浓度的Zn-MOF(6μg/mL、12.5μg/mL、25μg/mL、50μg/mL、100μg/mL)分别与100μL ABTS自由基混合溶液混合;另设置空白组和对照组,其中空白组中仅加入200μL的PBS溶液,对照组中加入100μL的PBS溶液和100μL的ABTS自由基混合溶液。
(3)使用细胞成像多模式阅读器(Cytation 5,BioTek Instruments Inc.)分别于10min、20min、40min、60min、90min和120min时检测734nm下的吸光度。
检测结果如图4所示。结果显示,Zn-MOF能够明显抑制ABTS自由基的形成,且呈时间和剂量依赖性,在浓度为6μg/mL时即可对ABTS自由基产生显著的抑制作用,在浓度为12.5μg/mL时即可达接近100%的ABTS自由基抑制率(***
随后,通过使用活性氧荧光探针(DCFH-DA)和流式细胞术对HT22细胞进行检测,以此来验证Zn-MOF在细胞内是否同样具有显著的自由基清除活性,其中DCFH-DA实验具体步骤如下:
(1)吸取9mL不含血清的DMEM培养基置于采用锡纸包裹避光的15mL离心管中,加入9μL的DCFH-DA原液,充分混匀后制得DCFH-DA溶液,置于避光环境中保存。
(2)向HT22细胞中加入120mmol/L的L-谷氨酸钠构建细胞损伤模型,随后置于37℃,5% CO
(3)细胞损伤模型构建成功后,分别采用不同浓度的Zn-MOF(12.5μg/mL、25μg/mL、50μg/mL、100μg/mL)对细胞进行处理12h;另设置空白组和对照组,其中空白组(Control组)为正常HT22细胞,对照组为经L-谷氨酸钠损伤且Zn-MOF加入量为0μg/mL的HT22细胞。
(4)将HT22细胞(培养在24孔板中)从细胞培养箱中拿出,去除原培养基,每个孔沿着孔壁轻轻加入200μL经步骤(1)配制得到DCFH-DA溶液,然后用锡纸将24孔板包住避免透光,再将其放置于37℃,5% CO
(5)将细胞于培养箱中拿出至避光的房间里,去掉DCFH-DA溶液,用PBS洗两遍,然后每孔加入500μL的TBST(含Triton×-100)溶液打孔3遍,每遍5min;随后采用ICC技术进行封片,在激光共聚焦显微镜下进行拍照。
结果如图5所示。结果显示,与空白组(Control组)相比,对照组(损伤而不加药)的荧光强度是显著增加的,说明L-谷氨酸钠损伤HT22细胞模型构建成功。并且,与对照组相比,Zn-MOF组的荧光强度是显著下降的,说明Zn-MOF有效抑制了细胞内的ROS而缓解了氧化应激。
流式细胞术检测活性氧的具体步骤如下:
(1)取对数生长期的HT22细胞,去除原培养基,加入120mmol/L的L-谷氨酸钠溶液,随后置于37℃,5% CO
(2)细胞损伤模型构建成功后,分别采用不同浓度的Zn-MOF(12.5μg/mL、25μg/mL、50μg/mL、100μg/mL)对细胞进行处理12h;另设置空白组和对照组,其中空白组(Control组)为正常HT22细胞,对照组为经L-谷氨酸钠损伤且Zn-MOF加入量为0μg/mL的HT22细胞。
(3)将细胞上清液取出,培养板中加入胰酶消化细胞并重悬,随后细胞重悬液和细胞上清液混合后置于5mL的离心管中,2000rpm离心5min,弃上清。加入500μL的PBS溶液重悬细胞,并转移至1.5mL离心管中,2000rpm离心5min。
(7)加入300μL活性氧DCFH-DA染液(碧云天),轻轻混匀后避光孵育20min;随后2000rpm离心5min,弃上清,加入500μL的PBS溶液,轻轻混匀后再次2000rpm离心5min,弃上清;加入300μL的PBS溶液,轻轻混匀后转移至流式管中上机检测。
结果如图6所示。结果与DCFH-DA实验相类似,即与空白组(Control组)相比,对照组(损伤而不加药)的ROS水平显著增加;与对照组相比,Zn-MOF组的ROS水平是显著下降的,说明Zn-MOF有效抑制了细胞内的ROS而缓解了氧化应激。通过上述活性氧荧光探针和流式细胞术对HT22细胞的ROS水平检测,充分证明了Zn-MOF可以有效抑制细胞内的ROS而起到缓解氧化应激的作用。
进一步地,选择HT22细胞进行Zn-MOF的毒性测试,具体步骤如下:
(1) 使用细胞计数器将HT22细胞以5000cells/100μL/孔的细胞数接种于96孔板中。
(2)细胞粘附后,分别在每孔中加入不同浓度(1.57,3.13,6.25,12.5,25,50,100,单位:μg/mL)的Zn-MOF,再孵育12小时。另设空白组和对照组,其中空白组只加入等体积培养基,不接种细胞,对照组(Control组)接种等量细胞,不用Zn-MOF处理。
(3)12h之后,加入110μL配好的CCK-8溶液(10μL的MEM溶液+10μL的CCK-8原液,混匀后加入),用锡纸包裹住96孔板以起到避光的作用,然后继续孵育1h。
(4)孵育完成后,用酶标仪检测每组细胞在450nm波长处的OD值(吸光度),然后根据公式计算其细胞活力:细胞活力(%)=(加药组-空白组)/(Control组-空白组)×100%。
结果如图7所示。结果显示,在所研究的1.57-100μg/mL的各浓度下,Zn-MOF处理后海马神经元细胞存活率均接近100%,其生存率与对照组(Control组)相比无显著性差异(
随后,选择大鼠海马组织细胞进一步对Zn-MOF的毒性进行验证,具体步骤如下:
(1)取1日龄Sprague-Dawley(SD)大鼠的脑海马组织,用眼科剪剪碎后加入至15mL离心管(Corning)中,加入木瓜蛋白酶(Sigma,Cat#P4762)于37℃下消化25分钟。
(2)用牛血清蛋白终止蛋白酶作用后清洗组织。
(3)将分离的海马神经元以20000细胞/mL的浓度接种在96孔板(Corning)中,每孔200μL,用含10%胎牛血清、10%营养混合物F-12的DMEM培养基(含谷氨酰胺,Gibco,Carlsbad,CA,Cat#12430054),置于37℃、95% O
(4)用含5% B-27(Gibco)的Neurobasal培养基替代原培养基,置于37℃、95% O
(5)细胞粘附后,分别在每孔中加入不同浓度(0.40,0.79,1.57,3.13,6.25,12.5,25,50,100,单位:μg/mL)的Zn-MOF,再孵育24小时。另设空白组和对照组,其中空白组只加入等体积培养基,不接种细胞,对照组(Control组)接种等量细胞,不用Zn-MOF处理。
(6)12h之后,加入110μL配好的CCK-8溶液(10μL的MEM溶液+10μL的CCK-8原液,混匀后加入),用锡纸包裹住96孔板以起到避光的作用,然后继续孵育1h。
(7)孵育完成后,用酶标仪检测每组细胞在450nm波长处的OD值(吸光度),然后根据公式计算其细胞活力:细胞活力(%)=(加药组-空白组)/(Control组-空白组)×100%。
结果如图8所示。结果显示,在所研究的0.40-100μg/mL的各浓度下,Zn-MOF处理后海马神经元细胞存活率均接近100%,其生存率与空白对照组相比无显著性差异(
实施例3 Zn-MOF对神经元的修复作用
选择大鼠海马组织进行Zn-MOF神经元损伤修复检测,具体步骤如下:
(1)取1日龄Sprague-Dawley(SD)大鼠脑海马组织,用眼科剪剪碎后加入至15mL离心管(Corning)中,加入木瓜蛋白酶(Sigma,Cat#P4762)于37℃下消化25分钟;用牛血清蛋白终止蛋白酶作用后清洗组织。
(2)将分离的海马神经元以20000细胞/mL的浓度接种在24孔板(Corning)中,每孔500μL,用含10%胎牛血清、10%营养混合物F-12的DMEM培养基(含谷氨酰胺,Gibco,Carlsbad,CA,Cat#12430054),置于37℃、95% O
(3)用含120μM L-谷氨酸钠的培养基替代原培养基,置于37℃、95% O
(4)细胞粘附后,分别在每孔中加入不同浓度(12.5,25,50,100,单位:μg/mL)的Zn-MOF,继续孵育24小时,其中Control组为空白对照组,海马神经元细胞未进行损伤处理;另设空白组(Control组)和对照组(Injury组),其中空白组为正常海马神经元细胞,对照组为经损伤造模处理的海马神经元细胞,不采用Zn-MOF处理。使用ICC技术对海马神经元细胞进行染色并封片,使用激光共聚焦显微镜拍摄封好的玻片,最后使用Image J软件描绘和统计神经元一级突起、二级突起以及总突起的数目及其长度。
通过量化神经元突起的长度和总数来评估Zn-MOF对神经元损伤修复的影响,结果如图9所示。结果显示,与Control组相比,Injury组的神经元一级突起、二级突起以及总突起的数目和长度是显著减少的,说明L-谷氨酸钠损伤原代海马神经元模型的构建是成功的。在经Zn-MOF处理过的组中,神经元一、二级分支长度以及突起总长度明显多于模型组(*
实施例4 Zn-MOF的体内功能性研究
(1)选取24只6周龄雌性小鼠,分为四组,每组6只,包括空白对照组(Control组,6只,不作任何处理)、假处理对照组(sham组,6只,只切除椎板,不损伤脊髓)、模型组(Injury组,6只)、Zn-MOF组(Injury+Zn-MOF,6只),脊髓损伤后第二天开始腹腔注射各药物,注射体积为100μL/只,注射剂量为50μg ,sham组和Injury组注射等体积PBS,每日1次),每天一次,连续注射三天。构建脊髓损伤小鼠模型的方法如下:
a.剔除小鼠背部的毛发,显露小鼠背部的皮肤。
b.麻醉:用1.25%三溴乙醇以200μg/20g的剂量腹腔注射麻醉,呼吸平稳、四肢肌力明显减弱、疼痛反射与角膜反射消失表示麻醉成功。
c.显露脊髓:用碘伏棉球擦拭2遍消毒皮肤;确定胸椎第9-11段(T9-T11)水平,并在T9-T11水平在背部正中作一个2.5cm长的纵向切口。钝性剥离椎旁肌,用咬骨钳去除棘突和椎板,彻底暴露T9-T11节段脊髓,使用固定器固定T10平面,切除T10椎板,操作过程中要小心避免额外的组织损伤。随后用固定器撑开固定,以充分暴露脊髓。
d.将小鼠固定到路易斯维尔损伤系统装置上(Louisville Injury SystemApparatus,LISA),将脊髓调调整至冲击器下,并同时由其监测激光束确认冲击位置,以冲击深度来确定脊髓损伤程度,本实施例中设置碰撞尖端为18psi,冲击深度为0.8mm,损伤时间为0.5s;碰撞完成后将小鼠从损伤装置中取出,并从固定器中取下。给予充分止血后使用缝线缝合小鼠肌肉及皮肤。假手术组的小鼠行T10椎板切除,不行脊髓碰撞。
e.关闭切口,术后皮下注射庆大霉素2000U,每日1次,连续3d,每8h进行1次人工膀胱排空直至自主排尿为止。
(2)监测:从造模后开始,每天监测各组小鼠的运动状态,且每3天进行一次BMS评分,结果如图10所示。结果显示,开始时,除空白对照组外,所有SCI小鼠的后肢运动完全丧失。随后,随着时间的推移,各组SCI小鼠的后肢运动功能开始逐渐恢复,其中在损伤第6天时,Zn-MOF治疗组的恢复速度即已经明显高于模型组(Injury组),BMS评分逐渐改善。整个实验期间,Control组和Sham组小鼠的BMS评分的分值一直持续在9分,Injury组小鼠的BMS评分虽有缓慢增加的趋势,但到第60天的时候评分仍然不超过1分,且评分增加的速度很缓慢。然而,与Injury组相比,Zn-MOF组小鼠的BMS评分的分值增加的速度更快,分值更高,直到第60天的分值均接近4分,说明Zn-MOF可以促进脊髓损伤小鼠运动功能的恢复。损伤后第60天后,各组小鼠的形态如图11所示,其中Control组和Sham组小鼠的后肢形态正常,Injury组小鼠的后肢呈瘫痪状态,Zn-MOF组小鼠的后肢形态较Injury组小鼠则有所改善。结果表明,Zn-MOF处理明显增强了小鼠SCI后的行为功能恢复。
(3)小动物活体成像:损伤后第3天进行小鼠活体成像。先腹腔注射0.1mL/20g L-012(化学发光(CHL)探针),L-012的浓度为4mg/ml。5分钟后,用1.25%三溴乙醇以200µg/20g的剂量腹腔注射麻醉,待麻醉成功后,进行小动物活体成像。
结果如图12所示。结果显示,在正常小鼠脊髓中很少见ROS的生物发光,而脊髓损伤小鼠脊髓中ROS的生物发光强度明显提高,并随时间增加而增加。在经过Zn-MOF处理后,ROS的生物发光强度显著降低,明显低于模型组(Injury组),甚至低于Sham组(*
在小鼠脊髓损伤后的第60天,对小鼠进行了踏空实验和转棒实验。其中踏空实验具体步骤如下:将小鼠放置于平行杆上,用一正方形架子框住小鼠,让小鼠在限定的范围内自由活动,然后进行视频摄像3-5 min。在小鼠爬行的过程中,如下肢未踏至平行杆上,则感应装置会自行记录为足失误一次,记录小鼠在平行杆上爬行60步的足失误总次数,然后计算每只小鼠的足失误率。足失误率=双下肢掉落平行杠的次数/总步数(60步)。
实验结果如图13所示。结果显示,与Control组和Sham组相比,Injury组小鼠的足失误率显著增高,表明Injury组小鼠的后肢运动功能很差。然而,与Injury组相比,Zn-MOF组小鼠的足失误率是显著下降的,说明Zn-MOF可以促进脊髓损伤小鼠后肢运动功能恢复。
转棒实验具体步骤如下:打开转动棒开关,使其不断地转动;抓取1只小鼠放在转动棒上,使小鼠运动的方向与转动棒旋转的方向相反,从小鼠刚放到转动棒上即开始计时,到小鼠从转动棒上掉落结束计时,记录每只小鼠在转动棒上运动的时间;收集数据并进行分析。
实验结果如图14所示。结果显示, Injury组小鼠的掉落潜伏期比Control组和Sham组明显缩短。而Zn-MOF组小鼠的掉落潜伏期比Injury组显著延长,进一步说明了Zn-MOF可以促进脊髓损伤小鼠运动功能的恢复。
在损伤早期(7天)半切损伤小鼠右后肢瘫痪,呈现拖行,关节活动少,无法进行评测。随后7天到14天,下肢功能逐渐恢复,拖行减少,膝关节、髋关节活动明显增加。因此在损伤后14天进行了足迹分析,足迹分析实验中评测参数包括了步长和步宽。具体步骤如下:
取实验小鼠,随机分为4组,记为组1-组4,按照前述方法进行脊髓损伤模型制备。其中组1为空白对照组(Control),组2为假手术组(Sham),组3为模型组(Injury),组4为Zn-MOF组,行T10右侧脊髓半切,同时给予Zn-MOF治疗,给药方式同前述方法。实验前准备一个狭长通道,通道内铺上白纸,将各组小鼠双后足用无毒的红色墨水染色,紧接着将小鼠放入事先准备的通道,小鼠沿通道自由行走,此时白纸上可见小鼠后爪脚印,通过计算连续3次脚印的平均值来分析步长或步宽。
实验结果如图15所示,结果显示,脊髓半切模型会导致小鼠后肢运动功能的部分丧失,与Sham组(组2)相比,Injury组(组3)小鼠后肢运动存在拖行(图15A),而经Zn-MOF治疗后(组4)小鼠后肢运动功能则显著优于Injury组。足迹定量统计分析结果显示,术后14天实验组小鼠步幅和步宽均优于SCI组(图15B、图15C)(所有组中n=6,*
随后,对不同组别小鼠进行了CatWalk步态分析,具体步骤如下:将小鼠置于黑暗房间中适应片刻;随后抓取小鼠置于CatWalk不太分析系统的有机玻璃地板上的末端出,盖上盖子,让其自由地从地板一端穿越到另一端,同时在电脑上观察小鼠自由穿过有机玻璃地板的过程,注意小鼠在穿过有机玻璃地板的过程中不能有停留,否则必须重复一次,当小鼠十分顺畅地穿过有机玻璃地板后,电脑会自动保存小鼠的运动录像;重复以上步骤,直至采集完所有实验小鼠的步态相关数据。
实验结果如图16-18所示。结果显示,与Control组和Sham组相比,Injury组小鼠的双后肢最大接触面积平均值与双后肢最大接触平均强度都非常小,表明Injury组小鼠的双后肢运动功能很差。然而,与Injury组相比,Zn-MOF组小鼠的双后肢最大接触面积平均值与双后肢最大接触平均强度均显著增加(图16-17)。与Control组和Sham组相比,Injury组小鼠的步序正常指数非常小,表明Injury组小鼠的后肢运动功能很差。而与Injury组相比,Zn-MOF组小鼠的步序正常指数则显著增加(图18)。CatWalk步态分析结果说明Zn-MOF可以促进脊髓损伤小鼠运动功能的恢复。
以上小鼠行为学测试证明了Zn-MOF可以促进脊髓损伤小鼠运动功能的恢复。随后通过电生理测试以验证Zn-MOF是否可以促进脊髓损伤小鼠神经传导功能的恢复。具体步骤如下:采用1.25%的2,2,2-三溴乙醇对小鼠进行麻醉(剂量为0.2mL/10g),剔除小鼠头部和大腿部的毛,解剖出小鼠大脑皮层运动区和双侧大腿腓肠肌群;打开神经生理监测仪,参数设置为:电压0.05mV,电流0.05mA。所有的信号处理程序都在BL-420N生物信号采集与分析系统(成都泰盟)上进行;在小鼠的大脑皮层运动区插入刺激电极,并在小鼠双侧腓肠肌群处插入接受电信号的电极,然后对小鼠腓肠肌运动诱发电位的信号进行采集,每只小鼠运动诱发电位的采集均重复3次;收集完所有小鼠的数据后,对其进行分析。
实验结果如图19所示。结果显示,Injury组小鼠运动诱发电位的幅度比Control组和Sham组的显著减小,而Zn-MOF组小鼠运动诱发电位的幅度比Injury组显著增加,说明Zn-MOF可以有效促进脊髓损伤小鼠神经传导功能的恢复。
为了更加直观地评估Zn-MOF对小鼠损伤脊髓的修复情况,在脊髓损伤后第60天对各组小鼠脊髓组织进行HE染色,以观察脊髓组织的形态。结果显示,Control组和Sham组的脊髓组织未见明显损伤;Injury组的脊髓组织可见明显的结构损伤;与Injury组相比,Zn-MOF组小鼠的脊髓组织损伤的程度明显减小,说明Zn-MOF确实可以促进小鼠损伤脊髓的修复(参见图20)。
前述实验中验证了Zn-MOF在体外对HT22细胞和海马神经元细胞无明显毒副作用,为了进一步评估其安全性,在脊髓损伤后第60天对各组小鼠的主要器官进行HE染色,以观测闹、心、肝、脾、肺、肾的病理学变化,结果如图21所示。结果显示,不同组别小鼠的脑、心、肝、脾、肺、肾均无明显的差异,表明Zn-MOF对小鼠的脑、心、肝、脾、肺、肾均无明显的毒副作用,进一步证实了Zn-MOF具有较高的安全性。
实施例5 Zn-MOF的作用机制研究
为了明确Zn-MOF的作用机制及其与脊髓损伤后炎症反应之间的关系,于脊髓损伤小鼠体内注射Zn-MOF,连续注射三天。随后对不同组别小鼠的血清进行酶联免疫吸附实验(ELISA),以检测不同组别小鼠血清中炎症因子IL-6和IL-1β的含量,结果如图22所示。结果显示,与Control组和Sham组相比,Injury组小鼠血清IL-6和IL-1β的含量是显著增加的,而与Injury组相比,Zn-MOF组小鼠血清IL-6和IL-1β的含量则显著下降,说明Zn-MOF可以抑制IL-6和IL-1β从而减轻脊髓损伤后的炎症反应。
由于脊髓损伤后MMP9的表达水平通常会增加,MMP9作为一种细胞外酶,可以降解一系列细胞外基质蛋白,并参与脊髓损伤的过程。对此,进一步对不同组别脊髓损伤小鼠皮层神经元以及脊髓组织进行蛋白提取并进行免疫印迹实验(Western blot),然后使用MMP9抗体进行检测,结果如图23所示。结果显示,不同组别皮层神经元MMP9的含量比较:与Control组相比,Injury组MMP9的表达增加,而与Injury组相比,Zn-MOF组MMP9的表达则有所下降(图23A)。不同组别小鼠脊髓组织MMP9的含量比较:与Control组和Sham组相比,Injury组MMP9的表达增加,而与Injury组相比,Zn-MOF组MMP9的表达则明显下降(图23B)。说明Zn-MOF可以降低脊髓损伤后MMP9的表达。
脊髓损伤涉及非常复杂的病理生理机制,而氧化应激介导的炎症反应就是其中之一。本发明从氧化应激与脊髓损伤的关系出发,探讨Zn-MOF与氧化应激的关系,研究Zn-MOF在细胞水平上对受损神经元轴突延伸的影响以及在动物水平上对小鼠脊髓损伤修复的影响,并研究Zn-MOF在脊髓损伤修复中的作用机制。
首先,本发明通过ABTS+·自由基清除实验证明了Zn-MOF在细胞外具有抗氧化效能,并在细胞水平上验证了Zn-MOF可以抑制细胞内的ROS而起到抗氧化作用、促进受损神经元的轴突延伸。然后,通过构建了小鼠脊髓损伤模型并研究Zn-MOF在小鼠脊髓损伤后的作用,发现Zn-MOF在脊髓损伤小鼠体内具有抗氧化作用,可以降低脊髓损伤后IL-6和IL-1β的水平以及MMP9的表达,促进脊髓损伤小鼠运动功能和神经传导功能的恢复,从而促进小鼠损伤脊髓的修复。
有研究表明,神经退行性疾病的发病机制可能与氧化应激以及兴奋性毒素有关。兴奋性神经递质谷氨酸可能会导致某些神经系统疾病,它可以介导氧化应激性损伤和兴奋性毒性,这种现象被称为谷氨酸的神经毒性。它可以引起包括线粒体在内的许多细胞成分的损伤,最终导致细胞的死亡。在细胞死亡的过程中会产生大量的活性氧(ROS)比如超氧阴离子(O2·
神经元是中枢神经系统中最容易受到氧化应激影响的细胞类型,它特别容易受到ROS的影响。ROS可以损害细胞的核酸、蛋白质和脂质等,从而导致神经元功能障碍甚至神经元死亡。ROS参与了许多神经退行性疾病的发生发展,比如阿尔茨海默病、肌萎缩侧索硬化症、帕金森病等。以往认为内源性产生的ROS可以作为信号分子调节一系列神经系统的生理过程,比如神经元的发育、神经元的极性、突触的可塑性、生长锥的寻路以及神经回路的调节等。然而,过量ROS的产生则会导致氧化与抗氧化机制的失衡,从而引起氧化应激。本发明通过统计神经元突起数目和长度以验证Zn-MOF是否通过抑制ROS来促进受损神经元的修复。结果显示,与Injury组相比,Zn-MOF组的神经元一级突起、二级突起以及总突起的数目和长度均是显著增加的。说明Zn-MOF可以通过抑制ROS来促进受损神经元的轴突延伸。进一步地,通过使用L-012检测小鼠体内活性氧水平以及小鼠活体成像以验证Zn-MOF是否可以在脊髓损伤小鼠体内发挥其抗氧化作用。结果显示Zn-MOF可以降低脊髓损伤后小鼠体内的高活性氧水平,从而起到了缓解氧化应激的作用。
为了研究Zn-MOF是否可以促进小鼠脊髓损伤的修复,通过BMS评分、踏空实验、转棒实验、足印实验、CatWalk步态分析以及电生理评估等方法对不同组别小鼠进行了测试。结果显示,脊髓损伤后60天Zn-MOF组小鼠后肢运动功能恢复更快,其BMS评分已接近4分,足失误率较Injury组显著减少;转棒实验结果显示Zn-MOF组小鼠的掉落潜伏期比Injury组显著延长;足印实验结果显示Zn-MOF组小鼠的步长和步宽较Injury组都是显著增加的;CatWalk步态分析结果显示Zn-MOF组小鼠的双后肢最大接触面积平均值、双后肢最大接触平均强度以及步序正常指数较Injury组都有线束改善。此外,在脊髓损伤后的第60天,通过对不同组别小鼠的脊髓组织进行了HE染色,以观察脊髓组织的形态。结果显示与Injury组相比,Zn-MOF组的脊髓组织损伤的程度则明显减小。以上结果共同说明了Zn-MOF可以促进脊髓损伤小鼠运动功能的恢复。
除此以外,本发明还对Zn-MOF的安全性进行了深入探索。结果发现Zn-MOF对HT22细胞和原代海马神经元均无明显的毒性。且在对脊髓损伤60天后不同小鼠主要脏器进行检测分析发现,不同组别小鼠的脑、心、肝、脾、肺、肾均无明显的差异,表明Zn-MOF对小鼠的脑、心、肝、脾、肺、肾均无明显的毒副作用,说明Zn-MOF具有较高的安全性。
以上具体实施方式部分对本发明所涉及的分析方法进行了具体的介绍。应当注意的是,上述介绍仅是为了帮助本领域技术人员更好地理解本发明的方法及思路,而不是对相关内容的限制。在不脱离本发明原理的情况下,本领域技术人员还可以对本发明进行适当的调整或修改,上述调整和修改也应当属于本发明的保护范围。
- 一类用于治疗肝损伤的茋类化合物、其制备方法及其应用
- 一种用于治疗脊髓损伤的金属铱化合物、其制备方法及应用
- 低氧处理的干细胞外泌体在制备用于治疗脊髓损伤的药物或支架材料中的应用
