一种负载生物相容相变微胶囊的控温保湿医用敷料的制备方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于医用敷料材料技术领域,具体涉及一种负载生物相容相变微胶囊的控温保湿医用敷料的制备方法。
背景技术
医用伤口敷料在促慢性伤口恢复领域起着至关重要的作用,其通过紧密贴合局部伤口部位,吸收渗出液,抵抗炎症并避免外部环境刺激,可以有效地促使伤口成纤维细胞的生长,加快伤口愈合速度。同时,伤口的局部温度也是影响其恢复的重要因素,当温度低于33℃时中性粒细胞、纤维蛋白原和人角质形成细胞活性降低,从而导致愈合延迟,当温度高于38℃时局部温度向周边部位扩散刺激炎症。因此,研究一种能够同时进行体温调控的医用多功能伤口敷料是十分必要的。目前,在敷料中添加相变微胶囊是实现控温效果的主要方法,但相关研究依然较少。
相变微胶囊是一种对相变材料进行胶囊化微封装技术应用的产物。当直接在敷料中添加相变材料时,相变材料在相变过程中会存在泄露流失的现象,导致调温能力大幅减弱。相变微胶囊可以较好的解决这一问题,微胶囊具有完整的壳核结构,相变材料作为芯材,有机高分子聚合物或无机材料等作为壁材包覆芯材防止其泄露并使胶囊具有一定的机械强度。但是,相变微胶囊在添加至医用敷料使用的过程中,依然无法避免少量的芯材泄露,使得胶囊壁材与芯材都可能与伤口直接接触。因此,为保证安全,在医用伤口敷料基质满足生物相容的同时,添加的相变微胶囊也应具备生物相容性。
公开号为CN 106400199 B的专利公开了一种相变调温微胶囊材料、其制备方法及其制备的敷料,相变调温微胶囊材料由相变微胶囊和壳聚糖制成;相变微胶囊具有相变调温的效果,壳聚糖具有抗菌作用。公开号为CN 115192763 A的专利公开了一种多功能调温创面敷料及其制备方法与应用,由相变保温层和长效抗菌层组成,利用壳聚糖、相变微胶囊和酶溶性胶原蛋白,制备调温创面敷料的相变调温层;利用聚己内酯和头孢他啶,通过静电纺丝技术制得长效抗菌层。上述专利方案通过添加相变微胶囊实现了伤口辅料的控温抗菌化,但所使用相变微胶囊的壁材与芯材未能同时满足生物相容性,相变焓值较低,相变温区未能精确控制到适合伤口恢复的体温区间(33-38℃),且敷料的制备工艺复杂。。
发明内容
本发明所要解决的技术问题是针对上述现有技术的不足,提供一种负载生物相容相变微胶囊的控温保湿医用敷料的制备方法,通过微流控装置,将相变微胶囊悬浮液、葡聚糖基凝胶以及青敷散溶液三维打印形成具有释药层、控温层以及保湿层三层结构的敷料;相变微胶囊悬浮液由相变微胶囊与表面活性剂溶液配置获得,且相变微胶囊的芯材与壁材均具有良好的生物相容性;葡聚糖基凝胶由复合骨架材料葡聚糖与聚丙烯酸钠,增稠剂羧甲基纤维素钠,交联剂甘羟铝,保湿剂甘油、丙二醇以及去离子水配置获得;青敷散溶液由青敷散、酒石酸以及去离子水配置获得。最终通过微流控装置异步控制打印制备出负载生物相容相变微胶囊的多层控温保湿医用敷料。
为实现上述技术目的,本发明采取的技术方案为:
一种负载生物相容相变微胶囊的控温保湿医用敷料的制备方法,包括:
步骤1:由生物相容相变微胶囊与表面活性剂溶液配置获得相变微胶囊悬浮液;
步骤2:由复合骨架材料葡聚糖与聚丙烯酸钠,增稠剂羧甲基纤维素钠,交联剂甘羟铝,保湿剂甘油、丙二醇以及去离子水配置获得葡聚糖基凝胶;
步骤3:由青敷散、酒石酸以及去离子水配置获得青敷散溶液;
步骤4:通过微流控装置,将相变微胶囊悬浮液、葡聚糖基凝胶以及青敷散溶液三维打印形成具有释药层、控温层以及保湿层三层结构的负载生物相容相变微胶囊的控温保湿医用敷料。
为优化上述技术方案,采取的具体措施还包括:
上述的步骤1将等质量相变微胶囊与表面活性剂溶液搅拌混合形成相变微胶囊悬浮液,其中生物相容相变微胶囊的制备方法为:
将交联剂、引发剂、壁材单体甲基丙烯酸甲酯、复合相变芯材混合,通过超声振荡得到油相混合物;配制表面活性剂溶液作为水相;将油相与水相混合,并通过高速均质机乳化形成水包油微乳液;将微乳液在水浴环境中搅拌引发聚合反应,最终经过过滤洗涤干燥后得到生物相容相变微胶囊。
上述的步骤1中,所述相变微胶囊悬浮液中相变微胶囊质量占比30%-60%;所述交联剂、引发剂、壁材单体甲基丙烯酸甲酯、复合相变芯材的质量比例为1-2:0.3:7-8:10;其中交联剂为季戊四醇四丙烯酸酯、季戊四醇三丙烯酸酯、乙二醇二甲基丙烯酸酯、二乙烯基苯中的一种或多种;引发剂为偶氮二异丁腈、过硫酸钾、过硫酸铵、过氧化苯甲酰的一种或多种;复合相变芯材由月桂酸与硬脂酸混合而成,两者的质量比例为7.6-8:2-2.4,其混合物的相变温区贴近体温。
上述的超声震荡的温度和持续时间分别为45-50℃和15-25min。所述表面活性剂溶液的浓度为0.625%-1.000%,表面活性剂为苯乙烯-马来酸酐钠盐、聚乙烯醇、聚乙烯吡咯烷酮、明胶、十二烷基硫酸钠中的一种或多种。通过高速均质机乳化油相和水相形成水包油微乳液时,乳化的温度、转速以及持续时间分别为45-55℃、3000-6000r/min以及10-15min;将微乳液在水浴环境中搅拌引发聚合反应时,搅拌反应的温度、转速以及持续时间分别为70-80℃、300-500r/min以及5-7h。
上述的步骤2将葡聚糖、聚丙烯酸钠、羧甲基纤维素钠、甘油、丙二醇、甘羟铝、去离子水搅拌混合,然后离心分散得到葡聚糖基凝胶,其中葡聚糖、聚丙烯酸钠、羧甲基纤维素钠、甘油、丙二醇、甘羟铝、去离子水的质量比例为1:0.1:0.15:1.25:0.5:0.05:5;离心分散的转速和持续时间分别为6000-8000r/min和3-5min。
上述的步骤3将青敷散、酒石酸、去离子水混合得到青敷散溶液,其中青敷散、酒石酸、去离子水的质量比例为1:0.4:6。
上述的步骤4取步骤1-3制备的相变微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置分别控制三者流量比以及喷嘴移速进行三维打印,依次形成释药层、控温层以及保湿层,最后在鼓风干燥箱中干燥得到负载生物相容相变微胶囊的控温保湿医用敷料;其中,释药层的材料为青敷散溶液、微胶囊悬浮液以及葡聚糖基凝胶,控温层的材料为微胶囊悬浮液与葡聚糖基凝胶,保湿层的材料为葡聚糖基凝胶。
上述的微流控装置包含注射器、注射泵、微通道、混合装置以及喷嘴;通过微流控装置控制的流量范围为30-100µL/min;微流控装置喷嘴的移速为2-10 mm/s。打印释药层时,相变微胶囊悬浮液、葡聚糖基凝胶以及青敷散溶液三者的流量比例为2-4:3:3;打印控温层时,相变微胶囊悬浮液、葡聚糖基凝胶二者的流量比例为6-8:4,青敷散溶液流量为0;打印保湿层时,所需材料为葡聚糖基凝胶,相变微胶囊悬浮液与青敷散溶液流量为0。
上述的敷料包括通过微流控装置,将相变微胶囊悬浮液、葡聚糖基凝胶以及青敷散溶液三维打印形成具有释药层、控温层以及保湿层三层结构;其中相变微胶囊悬浮液由生物相容相变微胶囊与表面活性剂溶液配置获得;葡聚糖基凝胶由复合骨架材料葡聚糖与聚丙烯酸钠,增稠剂羧甲基纤维素钠,交联剂甘羟铝,保湿剂甘油、丙二醇以及去离子水配置获得;青敷散溶液由青敷散、酒石酸以及去离子水配置获得。
本发明具有以下有益效果:
(1)本发明将有机高分子材料聚甲基丙烯酸甲酯包覆在复合脂肪酸相变材料的外侧,得到具备生物相容性的相变微胶囊,然后配置得到相变微胶囊悬浮液,预处理得到葡聚糖基凝胶与青敷散溶液,最后通过微流控装置调控流量,制备得到含有释药层、控温层以及保湿层的三层结构医用多功能伤口敷料,所制备的敷料,负载相变微胶囊的芯材与壁材均具有良好的生物相容性,化学性质稳定性,以及无毒无害的优越性,使用更安全,作为一种应用于医疗与生物领域的复合相变材料,相变微胶囊的生物相容性能的优先级应高于其相变保温性能。
(2)本发明制备的生物相容相变微胶囊具有较好的热力学性能与机械性能。凝固与熔化温度均控制在人体体温33-38℃间,相变温区贴近体温,具有较小的过冷度以及124.7J/g的高焓值,利于低温度差的快速响应体温调节,可以有效促进伤口的愈合。生物相容相变微胶囊还可以应用于食品、环境、化工、建筑等领域。
(3)本发明通过一步法三维打印制备出侧重不同性能的三层结构医用伤口多功能敷料,操作简单,生产成本低,释药层具有抗菌、消炎、止痛、促进成纤维细胞增长的效果,控温层侧重于吸收于放出热量并实现精确的体温调节,保湿层可以给伤口提供持续湿润的环境。三维打印方法使得敷料形状不受限制,每层组分、厚度等都可通过打印流量与移速精准调控,从而制备出不规则形状的敷料,紧密贴敷伤口,提升伤口贴敷的舒适度。
附图说明
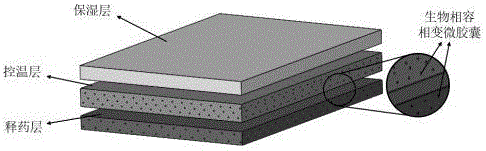
图1为生物相容相变微胶囊的控温保湿医用敷料外观结构图;
图2为微流控装置示意图;
图3为生物相容相变微胶囊SEM扫描电镜形貌图;
图4为负载生物相容相变微胶囊的控温保湿医用敷料实物图;
图5为生物相容相变微胶囊DSC差式扫描量热仪测试图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
本发明中的步骤虽然用标号进行了排列,但并不用于限定步骤的先后次序,除非明确说明了步骤的次序或者某步骤的执行需要其他步骤作为基础,否则步骤的相对次序是可以调整的。可以理解,本文中所使用的术语“和/或”涉及且涵盖相关联的所列项目中的一者或一者以上的任何和所有可能的组合。
如图1所示,本发明的一种负载生物相容相变微胶囊的控温保湿医用敷料,由图2所示的微流控装置将相变微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液三维打印形成,具有释药层,控温层以及保湿层的三层结构,其制备方法包括以下四个步骤:
步骤1:由生物相容相变微胶囊与表面活性剂溶液配置获得相变微胶囊悬浮液;
步骤2:由复合骨架材料葡聚糖与聚丙烯酸钠,增稠剂羧甲基纤维素钠,交联剂甘羟铝,保湿剂甘油、丙二醇以及去离子水配置获得葡聚糖基凝胶;
步骤3:由青敷散、酒石酸以及去离子水配置获得青敷散溶液;
步骤4:通过微流控装置,将相变微胶囊悬浮液、葡聚糖基凝胶以及青敷散溶液三维打印形成具有释药层、控温层以及保湿层三层结构的负载生物相容相变微胶囊的控温保湿医用敷料。
具体实施时,所述步骤1将等质量相变微胶囊与表面活性剂溶液搅拌混合形成相变微胶囊悬浮液,其中生物相容相变微胶囊的制备方法为:
将交联剂、引发剂、壁材单体甲基丙烯酸甲酯、复合相变芯材混合,通过超声振荡得到油相混合物;配制表面活性剂溶液作为水相;将油相与水相混合,并通过高速均质机乳化形成水包油(O/W)微乳液;将微乳液在水浴环境中搅拌引发聚合反应,最终经过过滤洗涤干燥后得到生物相容相变微胶囊。图3所示为生物相容相变微胶囊SEM扫描电镜形貌图。
所述相变微胶囊悬浮液中相变微胶囊质量占比30%-60%。所述交联剂、引发剂、壁材单体甲基丙烯酸甲酯、复合相变芯材的质量比例为1-2:0.3:7-8:10;其中交联剂为季戊四醇四丙烯酸酯、季戊四醇三丙烯酸酯、乙二醇二甲基丙烯酸酯、二乙烯基苯中的一种或多种;引发剂为偶氮二异丁腈、过硫酸钾、过硫酸铵、过氧化苯甲酰的一种或多种;复合相变芯材由月桂酸与硬脂酸混合而成,两者的质量比例为7.6-8:2-2.4,其混合物的相变温区贴近体温。所述超声震荡的温度和持续时间分别为45-50℃和15-25min。所述表面活性剂溶液的浓度为0.625%-1.000%,表面活性剂为苯乙烯-马来酸酐钠盐、聚乙烯醇、聚乙烯吡咯烷酮、明胶、十二烷基硫酸钠中的一种或多种。通过高速均质机乳化油相和水相形成水包油(O/W)微乳液时,乳化的温度、转速以及持续时间分别为45-55℃、3000-6000r/min以及10-15min;将微乳液在水浴环境中搅拌引发聚合反应时,搅拌反应的温度、转速以及持续时间分别为70-80℃、300-500r/min以及5-7h。生物相容微胶囊的壁材聚甲基丙烯酸甲酯与复合相变芯材均具有良好的生物相容性。
具体实施时,所述步骤2将葡聚糖、聚丙烯酸钠、羧甲基纤维素钠、甘油、丙二醇、甘羟铝、去离子水搅拌混合,然后离心分散得到葡聚糖基凝胶。其中葡聚糖、聚丙烯酸钠、羧甲基纤维素钠、甘油、丙二醇、甘羟铝、去离子水的质量比例为1:0.1:0.15:1.25:0.5:0.05:5;离心分散的转速和持续时间分别为6000-8000r/min和3-5min。
具体实施时,所述步骤3将青敷散、酒石酸、去离子水混合得到青敷散溶液,其中青敷散、酒石酸、去离子水的质量比例为1:0.4:6。
具体实施时,所述步骤4取一定量步骤1-3制备的相变微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置分别控制三者流量比以及喷嘴移速进行三维打印,依次形成释药层、控温层以及保湿层,最后在鼓风干燥箱中干燥得到负载生物相容相变微胶囊的控温保湿医用敷料;其中,释药层的材料为青敷散溶液、微胶囊悬浮液以及葡聚糖基凝胶,控温层的材料为微胶囊悬浮液与葡聚糖基凝胶,保湿层的材料为葡聚糖基凝胶。
如图2所示,所述微流控装置包含注射器、注射泵、微通道、混合装置以及喷嘴;通过微流控装置控制的流量范围为30-100µL/min;微流控装置喷嘴的移速为2-10mm/s。打印释药层时,相变微胶囊悬浮液、葡聚糖基凝胶以及青敷散溶液三者的流量比例为2-4:3:3;打印控温层时,相变微胶囊悬浮液、葡聚糖基凝胶二者的流量比例为6-8:4,青敷散溶液流量为0;打印保湿层时,所需材料为葡聚糖基凝胶,相变微胶囊悬浮液与青敷散溶液流量为0。在鼓风干燥箱中干燥的温度和持续时间分别为40-60℃和3-5h。通过微流控装置可以打印形成任意形状的单层或多层敷料。图4所示为负载生物相容相变微胶囊的控温保湿医用敷料实物图。图5所示为生物相容相变微胶囊DSC差式扫描量热仪测试图,从图5可以看出,凝固与熔化温度分别为33℃与35℃,均控制在人体体温33-38℃间,相变温区贴近体温,具有较小的过冷度以及124.7J/g的高焓值,利于低温度差的快速响应体温调节,可以有效促进伤口的愈合。
实施例1
将1g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、8g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,配制150ml质量分数为0.66%的聚乙烯醇溶液作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将9g相变微胶囊与6g聚乙烯醇溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将1.5g青敷散、0.6g酒石酸、9g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置同时以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为70µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为4mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料。
实施例2
将2g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、8g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,配制150ml质量分数为0.66%的聚乙烯醇溶液作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将12g相变微胶囊与8g聚乙烯醇溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将2g青敷散、0.8g酒石酸、12g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置同时以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为70µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为4mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料。
实施例3
将1.5g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、8g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,配制150ml质量分数为0.66%的苯乙烯-马来酸酐钠盐溶液作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将9g相变微胶囊与6ml苯乙烯-马来酸酐钠盐溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将1.5g青敷散、0.6g酒石酸、9g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置同时以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为70µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为4mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料。
实施例4
将1.5g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、7g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,分别配制150ml质量分数为0.66%的十二烷基硫酸钠/明胶溶液(各占50%)作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将12g相变微胶囊与8g十二烷基硫酸钠/明胶溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将2g青敷散、0.8g酒石酸、12g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置同时以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为70µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为6mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料。
实施例5
将1g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、8g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,配制150ml质量分数为0.66%的聚乙烯醇溶液作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将9g相变微胶囊与6g聚乙烯醇溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将1.5g青敷散、0.6g酒石酸、9g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置使A以20µL/min,B、C以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为80µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为6mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料。
实施例6
将2g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、8g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,配制150ml质量分数为0.66%的聚乙烯醇溶液作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将12g相变微胶囊与8g聚乙烯醇溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将2g青敷散、0.8g酒石酸、12g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置使A以20µL/min,B、C以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为80µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为6mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料。
实施例7
将1.5g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、8g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,配制150ml质量分数为0.66%的苯乙烯-马来酸酐钠盐溶液作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将9g相变微胶囊与6ml苯乙烯-马来酸酐钠盐溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将1.5g青敷散、0.6g酒石酸、9g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置使A以20µL/min,B、C以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为80µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为6mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料。
实施例8
将1.5g季戊四醇四丙烯酸酯、0.3g偶氮二异丁腈、7g甲基丙烯酸甲酯、7.6g月桂酸、2.4g硬脂酸混合,然后在45℃下超声振荡分散25min作为油相,分别配制150ml质量分数为0.66%的十二烷基硫酸钠/明胶溶液(各占50%)作为水相,然后将油相与水相混合,升温至50℃并以速率6000r/min进行乳化10-15min形成微乳液,以300r/min的速率在75-80°C水浴环境中搅拌反应5-7h,最终过滤干燥洗涤后得到生物相容相变微胶囊。
将12g相变微胶囊与8g十二烷基硫酸钠/明胶溶液搅拌混合形成相变微胶囊悬浮液,将2g葡聚糖、0.2g聚丙烯酸钠、0.3g羧甲基纤维素钠、2.5g甘油、1g丙二醇、0.1甘羟铝、10g去离子水搅拌混合,然后以速率8000r/min离心分散3-5min得到葡聚糖基凝胶,将2g青敷散、0.8g酒石酸、12g去离子水均匀分散得到青敷散溶液。
分别取10ml实验制备的微胶囊悬浮液、葡聚糖基凝胶、青敷散溶液至注射器A、B、C内,通过微流控装置使A以20µL/min,B、C以30µL/min的流量推进,100min后停止推进C,然后调整A的流量为80µL/min,B的流量为40µL/min,同时推进A与B直至A结束,调整B的流量为100µL/min后推动B直至结束,上述过程喷嘴的移速为6mm/s,最后在鼓风干燥箱中60℃干燥3-5h得到负载生物相容相变微胶囊的控温保湿医用敷料;
通过表1可知:本发明制备的负载生物相容相变微胶囊的控温保湿医用敷料具有较好的热力学性能,相变温度控制在人体体温33-38℃间,具有较小的过冷度以及 49.88J/g的高焓值,利于低温度差的快速响应体温调节,可以有效促进伤口的愈合。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 一种生物可降解医用敷料的制备方法
- 一种制备金属包壳高温相变储热微胶囊的方法以及由此得到的储热微胶囊
- 一种相变蓄能控温内墙涂料及其制备方法
- 一种相变控温材料载体的制备方法及其负载相变控温材料的方法
- 一种相变控温材料载体的制备方法及其负载相变控温材料的方法
