一种鲥鱼来源的I型胶原注射剂及原位成胶方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于医用生物材料技术领域,尤其涉及一种鲥鱼来源的I型胶原注射剂及原位成胶方法。
背景技术
国内医美市场处于高速成长阶段,低风险、恢复快等优势驱动注射填充类轻医美项目占比提高。相比于手术类整形,以注射类为代表的非手术类微创医美恢复时间快、价格及风险相对较低,因此市场接受度较高。当前玻尿酸和肉毒素占据医美注射填充类的主导,但是胶原蛋白的市场渗透有望逐步提升。胶原蛋白作为生物机体内含量最丰富、结构最复杂的细胞外基质的结构蛋白之一,对生物机体的组织结构与生命活动有着重要的意义。胶原蛋白本身的支撑作用能够缓解皮肤由于失去支撑而产生的局部皱纹,同时也具备修复、保湿和美白的作用。
注射类胶原蛋白由于其优越的生物相容性、生物吸收性、细胞粘附性、安全性等特点,且其作为皮肤组织的主要组分,被认为是纠正面部软组织缺陷较为理想的材料。传统的胶原蛋白注射剂是胶原蛋白颗粒悬浮液制成的产品,或胶原蛋白生产细胞制成的注射液等,其用于人体皮肤组织填充修复时效果有限,因此研究人员将目光聚焦于注射类胶原蛋白水凝胶。
然而,目前市场动物源胶原主要来自于猪和牛等哺乳动物,但是采用猪和牛提取胶原无法绕开免疫性和病毒性两大问题:尽管胶原蛋白与许多其他蛋白质相比,其免疫原性很弱,但免疫学分析和研究结果表明,胶原蛋白分子中非螺旋的区域(端肽)是引起免疫原性的主要位点,因此需要有选择性的水解或失活来去除端肽;另外,疯牛病等疫病的发生,会对陆生哺乳动物胶原蛋白及其制品的安全性造成威胁。除此之外,为满足临床需要,在填充剂加工过程中还会引入某些添加剂(如各种交联剂、消化酶等),这些外源物质虽然在产品中含量甚微,但若使用不当仍然存在不良反应隐患。
目前的注射类胶原蛋白水凝胶制剂,大多通过对胶原蛋白进行化学修饰、生物改造、与其他材料复合等方式制备,如中国专利201310268278.2公开了一种注射用胶原蛋白水凝胶,其以胶原蛋白为原料,使用酶活环氧类化合物为交联剂使原料分子间或分子内发生交联反应形成水凝胶,中国专利202011209275.8公开了一种重组胶原蛋白可注射水凝胶,以重组胶原蛋白为凝胶主体,以酶为催化剂制备可注射凝胶。但以上都是基于哺乳动物源胶原蛋白制备,同样存在免疫性、病毒性和引入外源物质的缺陷,而且制备技术不成熟,成本高。尤其是其三螺旋结构(基本螺旋构象)遇热不稳定,影响其在针剂注射领域中的填充与支撑作用。
水产来源的胶原蛋白能够有效解决哺乳动物胶原蛋白免疫性和病毒性的问题,因此本发明旨在基于水产来源的胶原蛋白进行可注射水凝胶的制备。但哺乳动物来源的胶原蛋白经酸溶再加碱调节pH后不会立刻成胶(成胶时间可能在数个小时),因此可以保证注射进体内之后才会成胶,但水产来源的胶原蛋白加碱时在体外瞬间成胶,不适宜作为可注射填充剂使用。因此,一种不引入外源物质、在体外不成胶但在体内可快速原位成胶的胶原蛋白注射剂有着独特的优势。
发明内容
为解决上述问题,本发明提供了一种I型胶原体内注射原位自组装成水凝胶的方法,形成的水凝胶具有保湿抗皱的效果;形成的水凝胶具有明显抑菌效果。本发明的制备方法保留了胶原天然三螺旋结构,不需要酸溶解胶原,保障了体内安全性;不需要酶溶解胶原,保障了异种蛋白引入的免疫原性;不需要交联剂,保障了注射填充胶原的纯净;操作简单作为医用级注射填充产品具有优异的保湿抗皱效果;制备的水凝胶在体外实验中具有优异的抗菌效果。在医美应用领域潜力巨大。
本发明的第一个目的是提供一种鲥鱼来源的I型胶原注射剂,所述注射剂包括I型胶原注射液制剂和缓冲液制剂,其中,
I型胶原注射液的制备方法包括以下步骤:
S1、在1-10℃下提取鲥鱼来源的I型胶原,并冷冻干燥;
S2、采用去离子水复溶冷冻干燥的I型胶原,得到所述I型胶原注射液;
缓冲液选自磷酸盐缓冲液、柠檬酸磷酸氢二钠缓冲液、Hanks平衡盐溶液中的至少一种。
进一步地,所述注射剂可在体内或体外混合形成凝胶,体内注射时可原位成胶。
进一步地,所述I型胶原注射剂中可加入天然药物、外泌体、细胞制剂等,不影响成胶。
进一步地,在步骤S1中,所述提取鲥鱼来源的I型胶原为,将鲥鱼原料进行酸溶,得到酸性胶原溶液,而后盐析、透析。
进一步地,所述透析可包括多次透析,最终获取的I型胶原为去离子水透析后的产物。
进一步地,所述鲥鱼原料包括但不限于鲥鱼鳞、皮、骨、鳔、鳍、肉等。
进一步地,在步骤S2中,复溶温度为1-10℃,复溶时可采用搅拌等手段加速溶解,溶解时间约为6至48小时。
进一步地,在步骤S2中,复溶后I型胶原的浓度为0.1%-5%。
进一步地,缓冲液的初始浓度为0.05-0.1M。
进一步地,缓冲液和I型胶原注射液的体积比为1:4-9,即缓冲液与I型胶原注射液混合后,缓冲液的终浓度为1倍浓度。
本发明的第二个目的是提供上述鲥鱼来源的I型胶原注射剂在医学、美容领域中的应用。
进一步地,所述鲥鱼来源的I型胶原注射剂用于制备医用填充材料。
进一步地,所述鲥鱼来源的I型胶原注射剂用于制备抗菌材料。
进一步地,所述鲥鱼来源的I型胶原注射剂用于制备保湿材料。
进一步地,所述鲥鱼来源的I型胶原注射剂用于制备药物递送载体。
本发明的第三个目的是提供一种医用级I型胶原原位成胶的方法,包括以下步骤:
将I型胶原注射液制剂和缓冲液制剂加至待成胶处,其中,
I型胶原注射液的制备方法包括以下步骤:
S1、在1-10℃下提取鲥鱼来源的I型胶原,并冷冻干燥;
S2、采用去离子水复溶冷冻干燥的I型胶原,得到所述I型胶原注射液;
缓冲液选自磷酸盐缓冲液、柠檬酸磷酸氢二钠缓冲液、Hanks平衡盐溶液中的至少一种。
本发明的有益效果:
(1)本发明提取的鲥鱼胶原冻干制剂保留了I型胶原天然三螺旋结构,没有使用蛋白酶提取避免了异种蛋白的引入,保证了I型胶原的纯净。
(2)本发明在复溶I型胶原的过程中采用水溶,没有使用酸或者蛋白酶,避免注射后酸的体内毒性;避免了异种蛋白酶产生的免疫原性。
(3)本发明在注射I型胶原时只同时注射了缓冲液。I型胶原依靠缓冲液体内原位自组装形成水凝胶,没有交联剂的使用,保证了体内I型胶原的纯净性和安全性,而且操作简便。
(4)本发明注射的I型胶原在动物皮下原位自组装形成水凝胶,水凝胶形成饱满的皮下填充;取出的水凝胶具有优异的抗菌性能。
(5)本发明可制备高质量的皮下注射用I型胶原,用于保湿除皱的医美应用。其操作简单、成功率高,易于大规模推广,具有良好的市场潜力,尤其是医美注射填充市场潜力巨大。
(6)相比于哺乳动物的胶原,本发明发现鲥鱼胶原自组装速度更快,而且鲥鱼胶原对成胶等条件更为敏感,极易发生注射后不能自组装从而不能有效填充或者在注射时已经在注射针管内完成自组装的现象,本发明解决了这个问题,且方法极为简单。
附图说明
图1为鲥鱼I型胶原冷冻干燥后的图片;
图2为鲥鱼I型胶原在动物皮下原位自组装形成水凝胶形成饱满填充的图片;
图3为鲥鱼I型胶原在动物皮下原位自组装形成水凝胶后剖开表皮后的水凝胶图片(先注射胶原后注射PBS);
图4为鲥鱼I型胶原在动物皮下原位自组装形成水凝胶后剖开表皮后的水凝胶图片(先注射PBS后注射胶原);
图5为鲥鱼I型胶原在动物皮下原位自组装形成水凝胶后剖开表皮后的水凝胶冻干后的图片;
图6为先注射胶原后注射Hanks平衡盐溶液形成的凝胶图片;
图7为对比例1中模拟体内环境,采用流变仪检测鲥鱼I型胶原自组装的过程,捕捉不到成胶点;
图8为不同水凝胶表面的菌落繁殖比较;
图9为不同水凝胶的持水率。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
本发明涉及的方案如下:
S1,在低温冷室中从鲥鱼提取纯净I型胶原,过程包括清洗、溶解、盐析、透析和冷冻干燥;
S2,低温下将冷冻干燥的鲥鱼I型胶原在去离子水中复溶,期间采用磁力搅拌持续加速溶解;
S3,采用预冷的注射器将溶解后的鲥鱼I型胶原和PBS在动物皮下同一部位分别注射。
S4,鲥鱼I型胶原在动物皮下原位形成水凝胶,在注射处形成饱满的填充。
S5,一段时间后剖开动物表皮,取出水凝胶,体积溶胀显著。进行细菌培养试验具有显著的抗菌效果。
本发明的原理:胶原可因为pH、离子、浓度、温度等物理环境的变化物理成胶,本发明通过缓冲液中的离子作用使胶原自组装形成水凝胶。此外,缓冲液除了促进凝胶形成外,还可以用于维持和体内相同的渗透压。
实施例1鲥鱼鳞I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室(冷室温度1-10℃,下同)中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳞I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥,如图1所示;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶6小时。鲥鱼鳞I型胶原浓度为0.3%;
(6)采用预冷的注射器将溶解后的鲥鱼鳞I型胶原和PBS在大鼠皮下同一部位分别注射;PBS浓度为5倍,PBS与胶原水溶液的体积比为1:4。
先注射胶原后即刻注射PBS,注射后形成的填充如图2所示,解剖开表皮后水凝胶如图3所示。注射填充过程中,在注射处形成饱满的填充,观察到饱满填充的时间为注射后30秒左右,相比于哺乳动物的胶原,鲥鱼胶原自组装速度更快。
实施例2鲥鱼骨I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室中从鲥鱼骨提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼I型胶原,乙酸浓度为0.1mol/L;
(2)向酸性胶原溶液加入终浓度为0.8mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为60kDa;
(4)将透析后的鲥鱼骨I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼骨I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶10小时,鲥鱼骨I型胶原浓度为0.4%;
(6)采用预冷的注射器将溶解后的鲥鱼骨I型胶原和PBS在小鼠皮下同一部位分别注射;PBS浓度为8倍,PBS与胶原水溶液的体积比为1:7。
先注射PBS后即刻注射胶原,解剖开表皮后水凝胶如图4所示。
实施例3鲥鱼鳔I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室中从鲥鱼鳔提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳔I型胶原,乙酸浓度为0.15mol/L;
(2)向酸性胶原溶液加入终浓度为1mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为80kDa;
(4)将透析后的鲥鱼鳔I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳔I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶6小时,鲥鱼鳔I型胶原浓度为0.3%;
(6)采用预冷的注射器将溶解后的鲥鱼鳔I型胶原和PBS在动物皮下同一部位分别注射,PBS浓度为10倍,PBS与胶原水溶液的体积比为1:9。
本实施例中采用双针管同时注射,将皮下自组装的水凝胶冷冻干燥后电镜如图5所示。
实施例4鲥鱼皮I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室中从鲥鱼皮提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼皮I型胶原,乙酸浓度为0.2mol/L;
(2)向酸性胶原溶液加入终浓度为0.7mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为80kDa;
(4)将透析后的鲥鱼皮I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼皮I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶9小时,鲥鱼皮I型胶原浓度为0.5%;
(6)采用预冷的注射器将溶解后的鲥鱼皮I型胶原和PBS在动物皮下同一部位分别注射(采用双针管同时注射),PBS浓度为7倍,PBS与胶原水溶液的体积比为1:6。
实施例5鲥鱼鳞I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳞I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶6小时。鲥鱼鳞I型胶原浓度为0.3%;
(6)采用预冷的注射器将溶解后的鲥鱼鳞I型胶原和Hanks平衡盐溶液在大鼠皮下同一部位分别注射;Hanks平衡盐溶液浓度为5倍,Hanks平衡盐溶液与胶原水溶液的体积比为1:4。
先注射胶原后即刻注射Hanks平衡盐溶液,注射后形成的凝胶经冷冻干燥后的电镜图如图6所示。
实施例6鲥鱼鳞I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳞I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶6小时。鲥鱼鳞I型胶原浓度为0.3%;
(6)采用预冷的注射器将溶解后的鲥鱼鳞I型胶原和柠檬酸磷酸氢二钠缓冲液在大鼠皮下同一部位分别注射;柠檬酸磷酸氢二钠缓冲液浓度为10倍,柠檬酸磷酸氢二钠缓冲液与胶原水溶液的体积比为1:9。
实施例7鲥鱼鳞I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳞I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶6小时。鲥鱼鳞I型胶原浓度为0.3%;
(6)采用预冷的注射器将溶解后的鲥鱼鳞I型胶原和柠檬酸磷酸氢二钠缓冲液在大鼠皮下同一部位分别注射;柠檬酸磷酸氢二钠缓冲液浓度为5倍,柠檬酸磷酸氢二钠缓冲液与胶原水溶液的体积比为1:4。
实施例8鲥鱼鳞I型胶原通过体内注射原位自组装成水凝胶的方法
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳞I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,加入去离子水于4℃在磁力搅拌器上复溶6小时。鲥鱼鳞I型胶原浓度为0.3%;
(6)采用预冷的注射器将溶解后的鲥鱼鳞I型胶原和Hanks平衡盐溶液在大鼠皮下同一部位分别注射;Hanks平衡盐溶液浓度为10倍,Hanks平衡盐溶液与胶原水溶液的体积比为1:9。
对比例1酸碱中和法制备鲥鱼鳞I型胶原注射剂
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳞I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,加入终浓度为0.01M的HCl于4℃在磁力搅拌器上溶解得到浓度为0.5%的鲥鱼鳞I型胶原,充分溶解后稀释成0.3%,在4℃环境中用NaOH调节PH至7(因为注射必须将HCl中和成中性,哺乳动物采用酸碱中和的方法在鲥鱼胶原上行不通),来不及注射迅速成胶。
采用流变仪检测鲥鱼I型胶原自组装的过程,显示鲥鱼I型胶原在加入PBS后即刻成胶,37度下捕捉不到成胶点(图7)。
对比例2复溶后的鲥鱼鳞I型胶原在生理盐水环境下的成胶情况
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼鳞I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,采用去离子水于4℃在磁力搅拌器上溶解得到浓度为0.5%的鲥鱼鳞I型胶原,充分溶解后稀释成0.3%,在4℃环境中加入NaCl成0.9%生理盐水浓度,然后加入PBS不成胶;注射至小鼠皮下也不成水凝胶。
对比例3调低PBS浓度
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,采用去离子水于4℃在磁力搅拌器上溶解得到浓度为0.5%的鲥鱼鳞I型胶原,充分溶解后稀释成0.3%,加入1倍PBS不成胶,PH调成7不成胶。
对比例4调高PBS浓度
在低温冷室中从鲥鱼鳞提取纯净I型胶原:
(1)采用乙酸溶液提取鲥鱼I型胶原,乙酸浓度为0.05mol/L;
(2)向酸性胶原溶液加入终浓度为0.5mol/L的NaCl溶液进行盐析;
(3)将盐析后的胶原进行透析,将胶原转移至预处理后的再生纤维素透析袋中,先用乙酸溶液透析并换水若干次,再用大量去离子水透析并换水若干次,透析袋的大小为50kDa;
(4)将透析后的鲥鱼鳞I型胶原冷冻干燥;
(5)将冷冻干燥后的鲥鱼鳞I型胶原称量,采用去离子水于4℃在磁力搅拌器上溶解得到浓度为0.5%的鲥鱼鳞I型胶原,充分溶解后稀释成0.3%,加入12倍PBS不成胶(PBS与胶原水溶液的体积比为1:11),PH调成7不成胶。
对比例5调整制备环境温度
在常温环境(20℃)中从鲥鱼鳞提取纯净I型胶原,经检测,无法提取到I型胶原,胶原降解成明胶。
对比例6替换胶原蛋白来源
将鲥鱼鳞I型胶原替换为牛I型胶原蛋白,其余操作同实施例1。
经测试,哺乳动物来源的I型胶原蛋白在体内成胶需要30min左右,因此其可以用来制备注射剂,但成胶时间过长皮下胶原水溶液会流失,从而影响胶原的保持率。
测试例
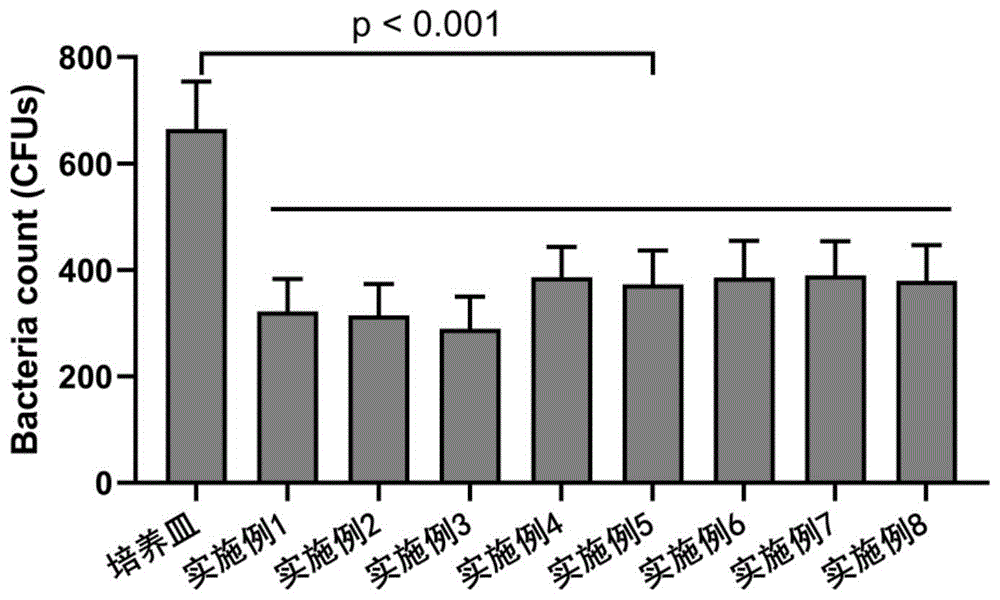
(1)体内注射原位自组装形成的水凝胶的抗菌性
获取上述实施例1-8中的水凝胶,将200μL金黄色葡萄球菌分散液(1*10
(2)获取实施例1-8形成的水凝胶,检测不同胶原注射下水凝胶的持水率。结果见图9。
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 一种原位交联的胶原纤维的制备方法
- 一种紧压成腔式灌胶装置及灌胶方法
- 一种牛腱来源的高纯度胶原蛋白海绵的制备方法
- 一种可原位聚合的胶原注射剂及其使用方法
- 一种氧化壳寡糖交联胶原并原位生成纳米银制备抗菌型胶原的方法
