Mcoln1蛋白在预防、缓解或治疗阿尔茨海默病中的功能和应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及生物技术和医学领域,具体涉及Mcoln1蛋白在预防、缓解或治疗阿尔茨海默病中的功能和应用。
背景技术
阿尔茨海默病(简称AD)作为最常见的神经退行性疾病,其患者和发病率已呈逐年升高的趋势。目前中国65岁以上老人AD的发病率在3.21%左右,并且已有超过700万人的AD患者,然而目前针对AD仍无有效的治疗措施。AD的病理特征主要为大脑中出现了大量的老年斑(主要成分为细胞外沉积的Aβ)和神经原纤维缠结(主要成分为细胞内过度磷酸化的Tau),目前针对Aβ沉积的机制研究仍是解决临床上Aβ药物疗效不佳的热点和难点。
Mcoln1(Mucolipin-1)是一种非选择性阳离子通道蛋白,主要调控Ca
然而,目前关于Mcoln1在AD疾病自噬、Aβ病理及认知障碍之间的相关研究尚无报道。
发明内容
本发明的目的是:提供一种Mcoln1蛋白在预防、缓解或治疗阿尔茨海默病中的功能和应用,解决以上问题。
为了实现上述目的,本发明提供如下的技术方案:
本发明首次检测了Mcoln1蛋白在AD模型鼠(5×FAD转基因鼠)中显著性下调,并且关联了AD患者基因表达数据库,发现Mcoln1也在AD患者脑中出现显著性下调;研究发现,蛋白组学揭示AD模型鼠自噬相关蛋白中仅有Mcoln1出现显著性下调,并且AD患者RNA数据库也显示Mcoln1在AD患者脑中出现显著性下调;而在体外给予Mclon1上调剂或激动剂能够抑制Aβ的生成,在AD模型鼠中过表达Mcoln1能够改善AD小鼠的学习记忆能力,抑制Aβ斑块的形成;因此,Mcoln1蛋白是一个潜在的阿尔茨海默病治疗的新靶点。
具体的技术方案如下:
Mcoln1基因作为药物靶标在筛选预防、缓解或治疗阿尔茨海默病的药物中的应用,所述的预防、缓解或治疗阿尔茨海默病的药物是促进Mcoln1基因表达的药物。
Mcoln1上调剂或激动剂在制备预防、缓解或治疗阿尔茨海默病的药物中的应用,所述Mcoln1上调剂或激动剂是用于提高Mcoln1蛋白水平或提高Mcoln1活性的物质,所述Mcoln1上调剂或激动剂通过增强自噬体与溶酶体的融合,或者促进自噬活性,或者抑制Aβ斑块的形成来预防、缓解或治疗阿尔茨海默病。
进一步,所述Mcoln1上调剂或激动剂选自Mcoln1蛋白、Mcoln1蛋白类似物、Mcoln1蛋白的重组基因治疗剂中的一种或多种。
优选地,所述激动剂为MK6-83。
进一步,所述Mcoln1蛋白的重组基因治疗剂为rAAV基因重组Mcoln1物(过表达人源性Mcoln1的腺病毒)或Lenti基因重组Mcoln1物。
具体的,所述提高Mcoln1蛋白水平或活性可采用各种化学、物理、生物的方法,包括但不限于:(1)在中枢神经系统内直接增加Mcoln1蛋白水平,可将人源性Mcoln1或Mcoln1类似物进入中枢神经系统内直接增加中枢神经系统内Mcoln1蛋白水平;(2)采用基因转染,在神经系统内过表达人源性的Mcoln1蛋白,采用基因转染可以是rAAV基因重组Mcoln1物或Lenti基因重组Mcoln1物来上调Mcoln1的蛋白水平;(3)采用激动剂提高神经系统内Mcoln1的活性,采用激动剂可以是小分子化合物或大分子蛋白、多肽能够提高Mclon1活性。
进一步,所述预防、缓解或治疗阿尔茨海默病的药物还包括至少一种除Mcoln1上调剂或激动剂之外的其它阿尔茨海默病治疗药物。
进一步,所述其它阿尔茨海默病治疗药物为Aducanumab抗Aβ的抗体药物、Lecanemab抗Aβ的抗体药物、甘露寡糖二酸中的至少一种。
本发明的有益效果为:本发明首次指出Mcoln1基因作为药物靶标在筛选预防、缓解或治疗阿尔茨海默病的药物中的应用,采用Mcoln1上调剂或激动剂直接在中枢神经系统中增加Mcoln1蛋白水平或提高Mcoln1的活性,可获得增强自噬体与溶酶体的融合、促进自噬、抑制Aβ的生成的效果,进而达到缓解或治疗阿尔茨海默病的目的;进一步,Mcoln1上调剂或激动剂配合其他药物治疗阿尔茨海默病的效果明显增加。
附图说明
图1为Mcoln1的蛋白及RNA水平分别在AD模型鼠和AD患者脑中出现显著性的降低。(A)蛋白组学定量检测到的5×FAD转基因鼠海马脑区的自噬相关蛋白的表达水平;(B)AlzData数据库中Mcoln1的RNA水平在AD患者颞叶皮层和内嗅皮层的表达水平;(C)和(D)Western-blot和免疫荧光检测5月龄5×FAD转基因鼠海马脑区的Mcoln1的表达水平,*p<0.05,***p<0.001vs WT。
图2为Mcoln1激动剂(MK6-38)处理Aβ病理细胞系能够促进自噬、抑制Aβ水平生成。(A)Western-blot检测MK6-83(Mclon1的激动剂)30μM的浓度处理N2a-APP(Aβ病理细胞系)后,自噬活性相关蛋白p-Beclin1、Beclin1、LC3和P62的水平;(B)30μM浓度的MK6-83处理N2a-APP及其对照N2a细胞后,反应Aβ生成变化的6E10免疫荧光。*p<0.05,**p<0.01vsControl。
图3为rAVV-Mcoln1(Mcoln1过表达基因转染物)处理AD模型鼠后,能够促进自噬活性、新物体和条件恐惧的学习记忆能力。(A)rAVV-Mcoln1及空载体rAVV-control处理5月龄5×FAD转基因鼠的实验流程;(B)过表达Mclon1后,5×FAD转基因鼠海马脑区中Mcoln1、LC3和P62蛋白水平的表达量;(C)过表达Mclon1后,5×FAD转基因鼠的新物体识别数据;(D)过表达Mclon1后,5×FAD转基因鼠的条件恐惧数据;*p<0.05,**p<0.01vs WT。
图4为过表达Mclon1能够显著性改善5×FAD转基因鼠的水迷宫记忆能力(长期记忆)。(A)水迷宫训练期(5天),各组小鼠找到平台的时间(潜伏期);(B)-(D)依次为,水迷宫测试期,各组小鼠潜伏期、穿越平台次数、在目标象限中的时间以及游泳的总路程;*p<0.05,**p<0.01,***p<0.001,****p<0.0001vs WT;&p<0.05,&&p<0.01vs 5×FAD。
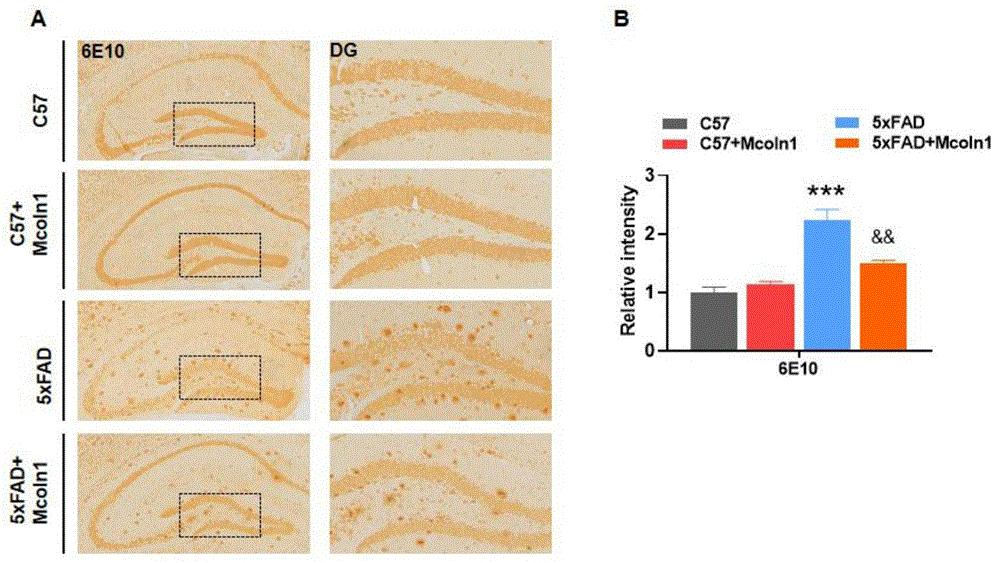
图5为过表达Mclon1能够显著性的降低5×FAD转基因鼠海马脑区的Aβ斑块(特征性病理)。(A)Aβ检测抗体6E10对各组小鼠海马脑区的免疫组化染色;(B)对免疫组化染色(Aβ阳性染色)进行统计;***p<0.001,vs WT;&&p<0.01vs 5×FAD。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明作进一步的详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
一.材料与方法
1.实验材料及条件
(1)阿尔茨海默病小鼠模型5×FAD转基因鼠表达Swedish(APPK670N/M671L),London(APPV717I)and Florida(APPI716V)APP mutations andthe PS1M146L andPS1L286V mutations。
(2)Mcoln1及其他实验抗体购买获得。
(3)蛋白质组学分析在市级疾病预防控制中心实施。
(4)N2a-APP及其对照N2a细胞系从大学基础医学院脑研究所获得。
(5)Mcoln1过表达载体(rAVV-Mcoln1)由国内生物公司制备。
2.实验方法
(1)5×FAD转基因小鼠的海马蛋白组学检测
海马蛋白组学具体步骤如下:①用冰冷的匀浆缓冲液(PBS配置8M尿素,pH 8.0,1×蛋白酶抑制剂)裂解海马组织,然后进行超声破碎以进行蛋白质提取;将样品裂解物在12000g,4℃下离心20分钟以除去沉淀,后用BCA蛋白质测定试剂盒测量蛋白质浓度;②取每组样本小鼠海马组织的100ug蛋白,然后用10mM二硫苏糖醇(DTT)在55℃处理30分钟,然后在室温下用25mM碘乙酰胺(IAA)避光孵育1小时;③将样品用PBS(PH8.0)稀释至最终尿素浓度为1.0M,并用胰蛋白酶Lys-C(1:100w/w)在37℃下消化过夜;④酶切后,用1%三氟乙酸(TFA)将多肽溶液调节至pH值1-2,并以12000g离心15分钟以收集上清液,然后通过反相柱色谱法脱盐,样品脱完盐后在真空离心机中干燥,并溶于50μL三乙基碳酸氢铵缓冲液(TEAB,200mM,pH8.5)中;⑤用TMT试剂(0.8mg TMT溶于41μl乙腈中)在室温下标记1小时,然后在室温下加入5ul的l5%羟胺孵育15分钟以终止反应,最后将不同TMT标签标记的多肽进行混合、脱盐、干燥并重新溶解在100μL 0.1%FA中用于多肽的组分分离;⑥将重新溶解的多肽混合物加载到HPLC(UltiMate 3000UHPLC,Thermo Fisher Scientific)系统进行分离,流动相A为纯水(pH=10),B相为纯乙腈(pH=10),在3-75min的分离梯度过程中收集到总共45个级分;将收集到的级分干燥并重新溶解在20μL0.1%FA中,最后用液相色谱与质谱串联系统(LC-MS/MS)采集数据;⑦将标记的多肽混合物加载到LC-MS/MS系统中进行数据采集,多肽通过液相色谱分离并与Q-Exactive质谱仪连接,质谱扫描参数设置为电压2.1kV,温度320℃,400-1800m/z,质谱扫描分辨率设置为70,000,将得到的质谱数据使用ProteomeDiscoverer 2.1软件在UniProt-Mus musculus(2021年更新,https://www.uniprot.org/)数据库中搜索,并进行蛋白注释和定量分析,蛋白错误发现率(FDR)设置为1%;⑧蛋白组学数据采用Perseus(http://www.coxdocs.org/)软件进行计算,以P值≤0.05来判断,使用Uniprot数据筛选自噬相关蛋白。
(2)N2a-APP、N2a细胞用Mcoln1激动剂(MK6-38)方法
N2a-APP细胞按1×10
(3)5×FAD转基因小鼠rAVV-Mcoln1脑立体定位注射
①用1%的戊巴比妥钠麻醉小鼠后,将小鼠放在脑立体定位仪上,小鼠上门齿扣于横杆并调节旋钮适当压紧鼻杆;将两侧耳杆插入小鼠耳道,调节左右耳杆使小鼠两耳间连线与左右耳杆在同一水平线;向小鼠眼部涂抹适量红霉素眼膏以减少灯光照射损害;②定位前囟点(Bregma点):选取头顶靠中线位置,剃除小鼠头顶部被毛,碘酒消毒后纵向切开头皮暴露颅骨(切口长度以暴露前后囟为宜),使用干燥棉签擦除颅骨骨膜组织,识别Bregma点(冠状缝和矢状缝交点),并将Bregma点坐标设定为三维坐标原点0点;③定位注射点:根据小鼠脑图谱选定双侧海马CA1区注射点坐标(前囟后AP-1.94,中缝左右ML±1.2,前囟水平下DV-1.6),在脑立体定位仪上坐标显示即为X=±1.2,Y=-1.94,Z=-1.6;以Bregma点为0点,移动操作臂至上述坐标点X=±1.2,Y=-1.94,用颜色笔标记这两个坐标点的位置并用颅骨钻在此打开合适大小的骨窗(窗口尽量小但不影响注射器进针);④取等量rAAV-Mcoln1或rAAV-control病毒,使用10μL的微量注射器吸取2μl病毒,缓慢下针至目标三维坐标点位置(Z=-1.6),以100nL/min的速度泵入病毒,注射完毕后停针20min,最后缓慢拔出注射器针头;完成一侧海马CA1区病毒注射后以同样方法再进行另一侧的注射;注射结束后使用1%碘伏溶液消毒切口并进行外科缝合,将小鼠置于电热毯上促进苏醒,待小鼠苏醒完毕后放回鼠笼。
(4)小鼠学习记忆行为学实验
新物体识别实验:将小鼠单独放入空塑料盒中(长×宽×高:47.5cm×35cm×20cm),第1天适应环境5min;第二天,将小鼠放入相同的塑料盒,但有两个相同的物体,放置在测试区域的相对两侧,并允许其自由探索5min,在探索过后1小时,两个物体中的一个被替换为一个材质和大小相同但形状不同的新物体;然后将小鼠单独放入盒子中自由探索5min,记录小鼠鼻子与物体接触或与物体距离≤2cm内的时间,并且将小鼠在物体上站立、坐着或靠在物体上所花费的时间排除在统计之内;在每只小鼠训练和测试之前,用70%乙醇清洁场地和物体并用纸擦拭干净,至少留出5min让乙醇蒸发,结果用优先指数百分比表示,其计算公式为[新对象探索时间/(新对象探索时间+旧对象探索时间)]×100%。
条件恐惧实验:实验当天提前1h将小鼠放入实验间;训练时,现将小鼠放入电击箱内自由探索2min(适应期)后,给予30s声音刺激(85dB,5000Hz),后2s伴随给予不可逃避的足底电击(0.6mA,持续2s),声音-电击共配对5次,每次间隔2min;计算机软件记录各个阶段(包括适应期、5轮声音刺激期和5轮间歇期)的僵住时间,僵住时间百分率(%)=僵住时间(s)/总时间(s)×100%;条件性恐惧训练24h后,将小鼠再次置于接受过电击的装置中,不给与任何刺激,进行环境重现,记录5min内的僵住时间,计算僵住时间百分率,和小鼠运动总路程。
水迷宫实验:Morris水迷宫(MWM)测试用来评估小鼠的学习和空间记忆能力;圆形水池中装满含有溶解奶粉的水,并分成四个等面积的象限;一个平台隐藏在第三象限的水面以下1.2厘米的位置,动物从四个象限中的一个面向池壁的中间开始,连续5天训练寻找平台,每天4次,间隔30秒;对于训练实验,允许小鼠在60秒内找到平台并在平台上再停留30秒;如果动物在60秒内未能找到平台,我们将时间记录为60秒;然后将这些小鼠引导到平台上并停留30秒;测试实验在训练实验结束后24小时进行,移除水下平台并将小鼠单独放置在与原始平台位置相对的象限中;动物到达先前放置平台的时间、跨越平台的次数、游泳速度和游泳距离由摄像机自动记录,最后对数据统计分析。
(5)蛋白免疫印迹(Western-blot)
①小鼠海马组织按照组织裂解液比例(1:10)加入适量的RIPA裂解液后,超声破碎提取组织蛋白,4℃离心后取上清;细胞样本在经MK6-38处理后,按6孔板每孔加入200μl的IP细胞裂解液后4℃裂解半小时,后用细胞刮收集细胞裂解样本,最后4℃离心后取上清;对组织和细胞样本的上清液采用BCA试剂盒定量蛋白浓度;②定量后的蛋白,加入适量的Loadingbuffer后95℃煮10min,后室温冷却;③配置10%-12%SDS-PAGE胶,取20ug煮过的蛋白上样,然后80v恒压电泳30min进行蛋白浓缩,后120v恒压电泳45min对蛋白进行分离;④转膜,用电转缓冲液浸泡滤纸、海绵、甲醇活化的PVDF膜、分离胶,之后按照转膜夹白面、海绵、滤纸、PVDF膜、分离胶、滤纸、海绵及转膜夹黑面的顺序夹好,置于转膜仪中,倒入电转缓冲液于冰浴中恒流200mA运行90min;⑤转膜结束后,取出PVDF膜用5%脱脂奶粉(1×PBST配置)室温封闭1h,后将PVDF膜稍微清洗,根据目的蛋白分子量裁剪相应的条带,最后将条带放入稀释后的一抗溶液中(p-beclin1、beclin1、LC3、P62、Mcoln1、GAPDH)进行4℃摇晃孵育过夜;⑥一抗孵育后,用1×PBST清洗条带3次,每次10min,后加入适量的稀释后的二抗(羊抗鼠或羊抗兔)室温摇床孵育1h;⑦二抗孵育过后,用用1×PBST清洗条带3次,每次10min,后将eECL-A和eECL-B(Thermo,34075)按照1:1的比例等体积混合,避光均匀滴加到目的条带上,使用化学发光成像仪进行曝光及成像。
(6)脑组织免疫组化和免疫荧光染色
免疫荧光和免疫组化具体步骤如下:①脑组织切片经过二甲苯脱蜡1h,100%、95%、90%、85%以及70%乙醇梯度水化各5min,PBS水化5min;②抗原修复(pH6.0柠檬酸修复液),水化后的组织切片在抗原修复液中95℃修复30min,冷却至室温;③使用2%的H2O2酶封闭切片15min,后用PBS清洗3次每次5min(免疫荧光跳过此步骤);④采用5%的BSA封闭切片1h,后甩掉多于封闭液,分别滴加适量稀释后的一抗(6E10抗体与稀释液比例为1:1000,Mcoln1抗体与稀释液比例为1:300)4℃孵育过夜;⑤孵育完一抗的切片,用PBS清洗3次每次5min,后滴加适量的二抗(PV-6001山羊抗兔IgG/HRP聚合物)室温孵育20分钟,最后用PBS清洗3次每次5分钟(免疫组化过程);对于免疫荧光过程,一抗清洗后的切片采用对于一抗种属的TITC荧光二抗室温孵育1小时;⑥对于免疫组化,二抗孵育完后,滴加适量的DAB(中衫金桥)显色液,显色2min左右,后用PBS清洗切片;免疫荧光的切片用PBS清洗3次,每次10分钟;⑦对于免疫组化,切片最后经过苏木素复染,1%盐酸乙醇分化,5%氨水反蓝,梯度酒精脱水,二甲苯透明后进行树脂封片;对于免疫荧光的切片,采用DIPA染色3分钟,后用PBS清洗3次每次5分钟,后用抗荧光淬灭剂封片。
(7)细胞免疫荧光
检测Mcoln1激动剂MK6-38对Aβ生成的影响的步骤如下:①N2a-APP、N2a细胞在铺板24小时后,细胞密度50%时,用Mcoln1激动剂处理24小时;②对Mcoln1转染后的N2a-APP细胞,去掉培养基,用PBS清洗3次每次5分钟,然后用10%的多聚甲醛固定20分钟;③用PBS清除3次每次5分钟,用0.3%的Triton孵育15分钟,后用PBS清除3次每次5分钟;④加入5%的BSA封闭1个小时,随后倒掉封闭液,加入适量的稀释后的一抗溶液(6E10:PBS=1:500)4℃孵育过夜;⑤使用PBS清洗3次每次5分钟,后用适量稀释后的二抗(568兔抗)室温孵育1小时;⑥使用PBS清洗3次每次5分钟,后滴加适量的DIPA室温孵育3分钟,最后用PBS清洗,并用抗荧光淬灭剂封片,在激光共聚焦下观察。
3.统计方法
使用GraphPad Prism 8.0软件进行数据分析和图表制作,利用Student’s t-test比较两组均值。
二.实验结果
1.蛋白组学和AD患者数据库揭示Mcoln1在AD中出现显著性降低。
通过蛋白质组学技术检测了5×FAD小鼠的海马组织的蛋白表达变化,并和AD患者数据库数据进行了比对,图1中A显示,在鉴定定量到的5×FAD小鼠的海马组织中自噬相关蛋白仅有Mcoln1出现下调;图1B显示,Mclon1的RNA水平在AD患者的颞叶皮层和内嗅皮层中出现显著性降低;图1C和1D显示,5月龄5×FAD小鼠的海马中Mclon1的蛋白水平及免疫荧光强度明显降低。
2.Mcoln1激动剂MK6-38处理N2a-APP细胞,能够促进自噬、抑制Aβ的生成。
为了验证Mcoln1激动剂MK6-38能否在体外促进自噬改善Aβ病理,我们在Aβ病理细胞系(N2a-APP)中给予Mcoln1激动剂(MK6-38),并检测自噬活性蛋白和Aβ的生成变化;图2中A显示,30μM的MK6-38处理能够显著提高p-Beclin1及LC3的水平,图2中B显示,MK6-38处理N2a-APP细胞能够明显减少Aβ的产生(红色荧光明显降低)。
3.过表达Mcoln1能够促进5×FAD小鼠的自噬活性和行为学的改善
为了验证Mcoln1能否作为预防、缓解或治疗阿尔茨海默病的靶点,我们在5月龄5×FAD小鼠的海马CA1区域过表达Mcoln1的蛋白水平,并检测自噬蛋白表达水平、学习记忆能力和Aβ的生成变化;图3中A显示,rAVV处理5×FAD小鼠的脑区部位和实验时间节点,图3中B显示,过表达Mcoln1后,5×FAD小鼠海马脑区的Mcoln1、P62和LC3蛋白的表达量,图3中C显示,过表达Mcoln1后,5×FAD小鼠及其对照小鼠的新物体偏好程度,图3中D显示,过表达Mcoln1后,5×FAD小鼠及其对照小鼠的静止时间和运动的总距离。
4.过表达Mcoln1能够改善5×FAD小鼠的长期学习记忆能力
采用水迷宫实验来检测过表达Mcoln1后5×FAD小鼠的长期学习记忆能力;图4中A显示,水迷宫训练期,每天各组小鼠找到目标平台所需的时间(潜伏期),图4中B-E显示,水迷宫测试期,各组小鼠的潜伏期、穿越平台次数、所在目标象限的时间和运动总路程。
5.过表达Mcoln1能够抑制5×FAD小鼠的Aβ病理进展
为了说明过表达Mclon1能够改善5×FAD小鼠的病理进展,我们采用6E10免疫组化检测,过表达Mclon1后,5×FAD小鼠海马脑区Aβ的表达水平;图5中A显示,不同组别小鼠海马区域以及海马DG区域Aβ的阳性着色程度,图5中B显示,不同组别小鼠海马区域Aβ染色阳性强度的统计。
三.实验结论
促进自噬体和溶酶体融合过程的关键蛋白Mclon1在5月龄的5×FAD转基因鼠和AD患者中出现显著性下调;上调Mcoln1蛋白或提高Mcoln1的活性能够促进自噬活性、抑制Aβ的生成、改善AD模型小鼠的学习记忆能力、延缓Aβ病理进展,因此Mcoln1蛋白可作为潜在的阿尔茨海默病治疗的新靶点。
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本公开的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本公开实施例的不同方面的许多其它变化,为了简明它们没有在细节中提供。
上述实施例用于对本发明作进一步的说明,但并不将本发明局限于这些具体实施方式。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应理解为在本发明的保护范围之内。
- 仿生重组高密度脂蛋白在制备预防和治疗阿尔茨海默病药物中的应用
- 预防、缓解或治疗阿尔茨海默病的肽及其应用
