用于抑制生物膜沉积和产生的组合物和方法
文献发布时间:2024-04-18 19:58:53
本申请是国际申请日为2017年5月12日,中国国家申请号为201780043739.2,发明名称为“用于抑制生物膜沉积和产生的组合物和方法”的发明专利申请的分案申请。
本申请要求2016年5月12日提交的美国临时申请号62/335,650的优先权,全部公开内容通过引用并入本文,如同详细地阐述一样。
本发明是在美国国立卫生研究院授予的基金号:R01 HL107904和R01HL109442的政府支持下完成的。政府拥有本发明的某些权利。
技术领域
本发明涉及生物膜沉积和疾病治疗领域。更具体地,本发明提供了可用于治疗龋齿和其他口腔疾病的组合物和方法。本发明还提供了用于涂覆生物医学装置以抑制不希望的生物膜沉积其上的方法。
背景技术
在整篇说明书中引用了若干出版物和专利文献,以描述本发明所属领域的现有技术。这些引文中的每一篇都通过引用并入本文,如同详细地阐述一样。
在现有体系中生产的生物药品非常昂贵,并且对于绝大多数全球人口来说都是不可承受的。蛋白质药物的成本(2013年为1400亿美元)超过了全球>75%国家的GDP[Walsh2014],使得它们难以负担。全球三分之一的人口每天收入<2美元,无法负担任何蛋白质药物(包括美国的贫困、老年和社会经济地位较低的群体)。如此高的成本与蛋白质在极其昂贵的发酵罐中生产、纯化、冷运输/储存、保质期短和无菌递送方法相关[Daniell等人,2015、2016]。
生物膜由复杂的微生物细胞群形成,其粘附于存在于医疗装置表面上的胞外多糖基质。与医疗装置植入相关的生物膜相关感染会引起严重问题并且会不利地影响该装置的功能。用于口腔和整形外科手术的医疗植入物使用合金例如不锈钢和钛制造。已经尝试通过各种物理和化学技术对医疗植入物进行表面处理,以改善表面性质,促进生物整合并抑制细菌粘附,因为细菌粘附与周围组织损伤有关并且经常导致植入物的故障。
人体中的许多感染性疾病,包括在口腔中发生的那些,都是由生物膜引起的[Hall-Stoodley等人,2004;Marsh,等人,2011]。例如,龋齿(或蛀牙)仍然是一种最常见的生物膜相关口腔疾病,主要影响美国和全世界的贫困儿童和成人,导致每年支出>810亿美元[Beike和Flemmig,2011;Dye等人,2015;Kassebaum等人,2015]。当细菌在牙齿表面积聚时形成导致龋齿的(致龋)生物膜,形成有组织的细菌细胞簇,该细菌细胞簇牢固地粘附并陷入由聚合物质如胞外多糖(EPS)组成的细胞外基质中[Bowen和Koo,2011]。目前用于控制致龋生物膜的局部抗微生物方式是有限的。氯己定(CHX)被认为是口服抗微生物治疗的“金标准”,但有不良副作用,包括牙齿着色和结石形成,并且不推荐用于日常治疗用途[Jones,1997;Autio-Gold,2008]。作为替代方案,已经出现了几种抗微生物肽(AMP),它们针对导致龋齿的口腔病原体如变形链球菌(Streptococcus mutans)具有潜在的抗生物膜作用[daSilva等人,2012;郭等人,2015]。
抗微生物肽(AMP)是先天免疫应答的进化上保守的组分,并且天然存在于包括人在内的不同生物中。与常规抗生素相比,用AMP不太可能发生耐药性。它们对细菌、真菌和病毒具有强烈的活性,并且可以通过与病原体的表面抗原融合来进行定制以靶向特定的病原体(Lee等人,2011;DeGray等人,2001;Gupta等人,2015)。与具有复杂二级结构的AMP相比,线性AMP的稳定性或抗微生物活性差。例如,retrocyclin或protegrin在环化时(Wang等人,2003)或当其通过二硫键形成而形成发夹结构时(Chen等人,2000)具有高抗微生物活性或稳定性。RC 101在pH 3、4、7和温度25℃至37℃以及人阴道液中高度稳定48小时(Sassi等人,2011a),而其抗微生物活性维持长达6个月(Sassi等人,2011b)。同样,protegrin在盐或人体液中高度稳定(Lai等人,2002;Ma等人,2015),但当线性化时失去效力。具有复杂二级结构的抗微生物肽的这些有趣特征可促进新疗法的开发。然而,生产足量抗微生物肽的高成本是其临床发展和商业化的主要障碍。
发明内容
根据本发明,提供了一种多组分组合物,其包含至少一种抗微生物肽(AMP)和至少一种生物膜降解酶,所述AMP和生物膜降解酶协同作用以降解生物膜结构并抑制生物膜沉积。在某些实施方案中,AMP选自protegrin 1、RC-101和表1中列出的AMP。生物膜降解酶包括例如变聚糖酶(mutanase)、右旋糖酐酶(dextranase)、葡糖淀粉酶、脱氧核糖核酸酶I、DNA酶、分散蛋白B(dispersin B)、糖苷水解酶和表2中提供的酶。在某些实施方案中,这些酶的编码序列经密码子优化以在植物叶绿体中表达。在特别优选的实施方案中,所述至少一种AMP和至少一种生物膜降解酶是重组产生的。在特别优选的实施方案中,AMP和生物膜降解酶作为融合蛋白表达。当将组合物用于治疗口腔疾病时,组合物可任选地进一步包括抗生素、氟化物、CHX或所有上述物质。组合物可以包含在口香糖、硬糖中或口腔冲洗剂中。本发明的优选的融合蛋白包括但不限于PG-1-Mut、PG-1-Dex、PG-1-Mut-Dex、RC-101-Mut、RC-101-Dex、RC-101-Mut-Dex,其单独使用或组合使用以降解生物膜。值得注意的是,表1中列出的任何AMP均可以替代上述融合蛋白中的PG-1或RC-101,以改变或改善融合蛋白的杀菌作用。为了改变融合蛋白的降解活性,上文和下文列出的酶可以替代本发明的融合蛋白中的Mut、Dex或两者。在另一个实施方案中,当在组合物中使用两种不同的EPS酶时,这些酶可以以不同的比例递送,例如1:2、1:3、1:4、1:5、1:6、1:7、1:8等。例如,当Mut和Dex以口香糖或口腔冲洗剂一起递送时,优选的比例是5:1Dex:Mut。
另一方面,本发明提供了降解和/或除去生物膜的方法,其包括当所述生物膜存在于需要所述减少或消除的动物受试者之中或之上时,使含有所述生物膜的表面与上述组合物接触,所述组合物具有杀菌作用,并减少或消除包含一种或多种不需要的微生物的所述生物膜。在某些实施方案中,生物膜存在于口腔中。在其他实施方案中,生物膜存在于植入的医疗装置上。所述方法还可以用于除去存在于选自由以下组成的组的身体内部或外部表面上的生物膜:尿道、中耳、前列腺、血管内膜、心脏瓣膜、皮肤、头皮、指甲、牙齿和伤口的内部中的表面。
在另一个实施方案中,包含所述至少一种AMP和所述至少一种生物膜降解酶的本发明组合物在植物质体中产生。植物可以是烟草植物,并且编码所述AMP和酶的序列经密码子优化以在植物质体中表达。在一个优选的实施方案中,AMP和生物膜降解酶在莴苣植物中、在莴苣质体中存在的内源调节元件的控制下,作为融合蛋白表达。
附图说明
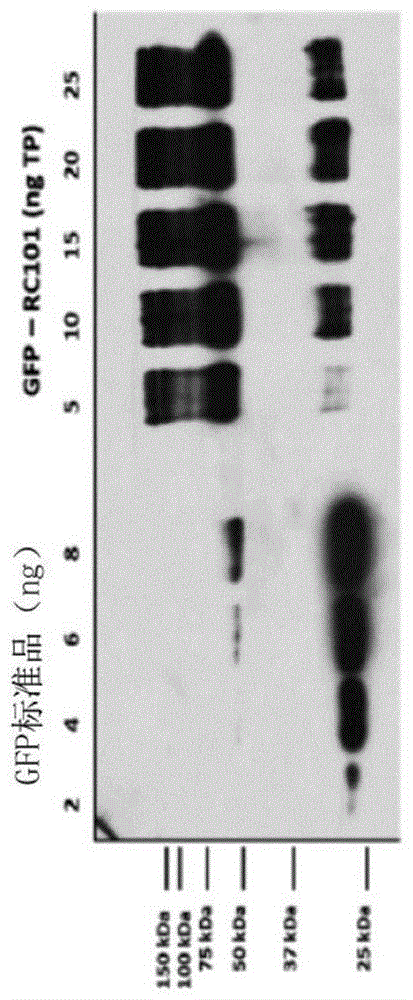
图1A-1D—在烟草叶绿体中表达的GFP融合的Retrocyclin(RC101)和Protegrin(PG1)的纯化—图1A.使用抗-GFP抗体对纯化的GFP-RC101融合物进行Western印迹分析。图1B.纯化的GFP-RC101融合物的天然荧光凝胶。图1C.使用抗-GFP抗体对纯化的GFP-PG1融合物进行Western印迹。图1D.纯化的GFP-PG1的天然荧光凝胶。注—用于图1A-1D的所有样品均基于从Bradford方法获得的总蛋白质值上样。使用Image J软件进行光密度测定以确定GFP浓度表达水平、纯度和产量。由相对于总蛋白质值的GFP浓度计算表达水平和产量。通过将GFP浓度与纯化后的回收体积相乘来确定产量。通过将GFP产量除以摩尔因子14(GFP MW与肽MW的比例)来确定单个肽产量。通过将%纯度除以植物粗提物中的%表达来计算富集倍数。
图2A-2E。AMP(GFP-PG1和GFP-RC101)对变形链球菌和其他口腔微生物的抗微生物活性。通过随时间测量吸光度(A
图3A-3C。通过共聚焦荧光和SEM成像确定的GFP-PG1的细菌杀伤(图3A)用10μg/ml的GFP-PG1处理的变形链球菌的延时杀伤。对照组(图3B)由仅用缓冲液处理的变形链球菌细胞组成。碘化丙锭(PI)(红色)与共聚焦显微镜一起用于确定在单细胞水平上随时间变化的细菌活力。PI是细胞不可渗透的,只进入膜受损的细胞;在濒死和死亡细胞中,PI与DNA结合后产生明亮的红色荧光。GFP-PG1显示为绿色。(图3C)使用扫描电子显微镜对用浓度为10μg/ml的GFP-PG1处理1小时的变形链球菌进行形态学观察。红色箭头显示凹陷的膜和细胞内含物的挤出。
图4A-4C通过GFP-PG1的单一局部处理抑制生物膜形成。该图显示了变形链球菌生物膜的三维(3D)效果图的代表图像。用SYTO 9(绿色)对细菌细胞进行染色,并用AlexaFluor 647(红色)标记EPS。用GFP-PG1单一局部处理唾液涂覆的羟基磷灰石(sHA)盘表面,短期暴露30分钟(图4B)。对照组(图4A)仅用缓冲液处理。然后,将处理后的sHA盘转移到含有1%(w/v)蔗糖并活跃生长变形链球菌细胞(10
图5。EPS降解酶消化生物膜基质。用右旋糖酐酶和变聚糖酶组合处理的变形链球菌生物膜中EPS降解的代表性延时图像。用SYTO 9(绿色)对细菌细胞进行染色,并用AlexaFluor 647(红色)标记EPS。白色箭头显示酶促降解EPS后细菌细胞簇和“裸露的(uncovering)”细胞之间的空间的“打开”。
图6A-6C。单独的合成PG1或与EPS降解酶组合的合成PG1破坏生物膜。(图6A)使用COMSTAT对完整生物膜内的EPS降解进行延时定量。(图6B)通过ImageJ分析用合成PG1和EPS降解酶(Dex/Mut)(单独或组合)处理的变形链球菌生物膜的活力。(图6C)合成型PG1的抗生物膜活性被EPS降解酶(Dex/Mut)增强。星号表示不同实验组的值彼此显著不同(P<0.05)。
图7。用共聚焦显微镜观察纯化的融合蛋白CTB-GFP、PTD-GFP、Protegrin-1-GFP(PG1-GFP)和Retrocyclin101-GFP(RC101-GFP)在不同的人牙周细胞系:人牙周膜干细胞(HPDLS)、上颌骨间充质干细胞(MMS)、人头颈部鳞状细胞癌细胞(SCC)、牙龈来源的间充质基质细胞(GMSC)、成人牙龈角质形成细胞(AGK)和成骨细胞(OBC)中的体外摄取。将人细胞系HPDLS、MMS、SCC、GMSC、AGK和OBC的2×10
图8。来自叶绿体转基因(transplastomic)烟草的GFP融合物的下游处理:流程图说明了从温室中生长的叶绿体转基因烟草植物生产纯化的GFP融合物所涉及的不同步骤。
图9A-9B。用于变聚糖酶(图9A)和右旋糖酐酶(图9B)的载体和密码子优化的序列。密码子优化的变聚糖酶:SEQ ID NO:1。密码子优化的右旋糖酐酶:SEQ ID NO:2。
图10。表达与GVGVP融合的AMP的串联重复序列的叶绿体载体的示意图,其用于单独使用或用于表达包含图9中的EPS蛋白的融合蛋白。
图11。新的纯化策略:逆相变温度循环(inverse temperature cycling)纯化过程显示了高产量。
图12A-12B:功能性密码子优化的变聚糖酶在大肠杆菌中的表达。图12示出了Western印迹,其示出了大肠杆菌中的变聚糖酶表达。图12B示出了0.5%蓝色右旋糖酐平板上涂布的大肠杆菌。转化的克隆能够产生通常在变形链球菌中产生的重组右旋糖酐酶,并且能够清除菌落周围的蓝色晕圈。图12C表示凝胶扩散测定,其比较了来自转化的大肠杆菌的粗裂解物(总蛋白加载)中存在的重组右旋糖酐酶与来自青霉素的商业纯化的酶对蓝色右旋糖酐的降解活性。
图13。为AMP/生物膜降解酶生产而工程化莴苣植物的步骤的流程图。
图14。示出了口香糖片剂制备。虽然本文举例说明了GFP,但包含AMP-酶融合蛋白的口香糖(例如,图9和10中提供的那些)也在本发明的范围内。
图15。通过荧光、并通过Western印迹对口香糖片剂进行评估以确定GFP的浓度。基于(i)Western印迹(ii)荧光计(Fluoroskan Ascent
图16。显示了咀嚼模拟器,其使用人工唾液来评估来自本发明的口香糖片剂的生物膜降解剂的释放动力学。
图17。显示了从口香糖释放的GFP的定量的图。在人工唾液的存在下,在咀嚼模拟器中对口香糖片剂进行了评估以确定GFP释放动力学,所述口香糖片剂包含在莴苣叶中表达的增加浓度的GFP。
图18。该图证明当与李施德林(Listerine)混合时,包含由叶绿体载体表达的酶的粗提取物与商业化酶一样有效地抑制CFU形成。使用补充有李施德林的大肠杆菌衍生的变聚糖酶和右旋糖酐酶(比例1:5)对体外变形链球菌生物膜进行酶促降解。商业化变聚糖酶(来自芽孢杆菌(Bacillus sp.),Amano)和右旋糖酐酶(来自青霉菌(Penicillium sp.),Sigma)用作阳性对照,而大肠杆菌粗提取物用作阴性对照。CFU/ml表示为平均值±标准偏差(n=2)。***,与大肠杆菌提取物相比P<0.001。
具体实施方式
人体中的许多感染性疾病,包括在口腔内发生的那些(例如龋齿和牙周病),是由毒性生物膜引起的。龋齿(或蛀牙)仍然是美国和全世界最费钱且最普遍的生物膜相关口腔疾病。它影响儿童和成年人,并且是导致工作和学校缺勤的急诊室就诊的主要原因。不幸的是,龋齿的患病率仍然很高(>90%的美国成年人口),并且它仍然是影响儿童和青少年特别是社会经济背景不佳的儿童和青少年的最常见的慢性疾病。此外,口腔健康状况不佳往往会导致全身后果并影响整体健康。重要的是,仅在美国,治疗这种疾病(例如龋损和牙髓感染)的损害的费用就超过400亿美元/年。氟化物是龋齿预防的主要支柱。然而,其广泛使用对该疾病提供了不完全保护。氟化物可有效减少脱矿质并增强早期龋损的脱矿质,但对生物膜的作用有限。相反,目前用于控制导致龋齿的生物膜的抗微生物方式在很大程度上是无效的。
迫切需要开发有效的疗法来控制毒性口腔生物膜。根据本发明,提供了用于低成本生产和递送优于当前抗生物膜/抗龋模式的治疗有效的植物表达的生物药品的方法。
定义:
如本文所用,抗微生物肽是具有任意细菌活性的小肽。“RC-101”是retrocyclin(一种环状十八肽)的类似物,它可以保护人CD4+细胞免受体外HIV-1的T-向性和M-向性菌株的感染,并预防人宫颈阴道组织中的HIV-1感染。RC-101在阴道液的存在下预防HIV-1感染并保持完全活性的能力使其成为其他局部杀微生物剂应用(特别是在口腔生物膜中的应用)的良好候选物。RC-101的序列在Plant Biotechnol J.2011Jan;9(1):100–115中提供,该文献通过引用并入本文。
“C16G2”是一种新的合成的抗微生物肽,对变形链球菌具有特异性,
“Protegrin-1(PG)”是富含半胱氨酸的18残基β-折叠肽。它对大范围的微生物包括细菌、真菌、病毒,尤其是一些临床相关的抗生素抗性细菌具有强大的抗微生物活性。例如,在实验室测试中,PG有效地杀死细菌病原体大肠杆菌和真菌机会性白色念珠菌。PG-1的序列在Plant Biotechnol J.2011Jan;9(1):100–115中提供,该文献通过引用并入本文。
另外的抗微生物肽包括下面表1中列出的那些。
表1
CSP、含CSP
靶向肽和杀伤肽之间的连接区域标有下划线。
肽C-末端酰胺化。
“生物膜”是一种复杂的结构,其粘附于经常与水接触的表面,由细菌菌落和通常其他微生物如酵母、真菌和原生动物组成,这些微生物分泌粘液保护层,这些微生物被装入其中。生物膜可以在固体或液体表面以及生物体中的软组织上形成,并且通常对常规消毒方法具有抗性。牙菌斑,淤塞管道和贮器的粘性层,以及水体上的藻垫是生物膜的例子。生物膜在体内通常是致病的,引起诸如龋齿、囊性纤维化和中耳炎之类的疾病。
“生物膜降解酶”包括但不限于胞外多糖降解酶,例如右旋糖酐酶、变聚糖酶,DNA酶、内切核酸酶、脱氧核糖核酸酶I、分散蛋白B和糖苷水解酶例如1→3)-α-D-葡聚糖水解酶,尽管优选使用编码右旋糖酐酶和变聚糖酶的叶绿体密码子优化序列,但是技术人员熟知本领域中的许多不同的生物膜降解酶。下面提供了在本发明的融合蛋白中使用的其他酶序列。
如本文所用,术语向受试者“施用”(“administering”或“administration”)药剂、药物或肽包括将化合物引入或递送至受试者以执行其预期功能的任意途径。施用可以通过任意合适的途径进行,包括口服、局部、鼻内、胃肠外(静脉内、肌肉内、腹膜内或皮下)或直肠施用。施用包括自己施用和由其他人施用。
如本文所用,术语“疾病”、“病症”或“并发症”是指受试者与正常状态的任意偏离。
如本文所用,术语“有效量”(“effective amount”,“amount effective”等)是指达到所期望的结果所必需的剂量和时间段的有效量。
如本文所用,术语“抑制”或“预防”是指使疾病状态的临床症状不会恶化或发展,例如,在可能面临或倾向于疾病状态,但尚未经历或表现出疾病状态症状的受试者中,抑制疾病发作。
如本文所用,在基因或多核苷酸背景下的术语“表达”涉及基因或多核苷酸转录成RNA。该术语还可以但不一定涉及RNA随后翻译成多肽链,以及其组装成蛋白质。
植物残余体(plant remnant)可包括衍生自植物的一种或多种分子(例如但不限于蛋白质及其片段、矿物质、核苷酸及其片段、植物结构组分等),该植物中表达目的蛋白质。因此,与全植物材料(例如植物叶,茎,果实等的全部或部分)或植物粗提物有关的组合物肯定含有高浓度的植物残余体,以及具有一种或多种可检测植物残余体的、包含纯化的目的蛋白质的组合物。在一个具体实施方案中,植物残余体是核酮糖-1,5-二磷酸羧化酶/加氧酶(rubisco)。
在另一个实施方案中,本发明涉及一种可施用组合物,用于治疗或预防原位(例如,在口腔中)生物膜形成和可用于手术植入的生物医学装置(例如支架、人工关节等)上的生物膜形成。在该实施方案中,用所述组合物涂覆装置以抑制在装置上不希望的生物膜沉积。所述组合物包含治疗有效量的一种或多种抗微生物肽(AMP)和一种或多种具有生物膜降解活性的酶的组合,所述AMP和酶中的每一种已经由植物和植物残余体表达并且以协同方式作用以降解所述生物膜。在某些实施方案中,AMP和酶由单独的质体转化载体表达。在其他实施方案中,质体转化载体包含多顺反子编码序列,其中AMP和酶均由单一载体表达。
根据本文教导的某些实施方案表达的蛋白质可通过以各种方式施用于受试者、人或动物而体内使用。药物组合物可以口服、局部、皮下、肌内或静脉内施用,尽管口服局部施用是优选的。
可以通过食用由产生质体衍生的治疗性蛋白质的转基因植物制造的食品,来施用本发明实施方案所产生的口服组合物。植物或其部分的可食用部分用作膳食组分。可以使用适合于所需施用模式的固体或液体溶媒、稀释剂和添加剂以经典方式配制治疗组合物。组合物可以与至少一种溶媒,如淀粉、碳酸钙、蔗糖、乳糖、明胶等,以片剂、胶囊、颗粒、粉末、口香糖等形式口服施用。可任选地从植物匀浆中纯化目的治疗性蛋白质。制剂也可以被乳化。通常将活性成分与药学上可接受的并且与活性成分兼容的赋形剂混合。合适的赋形剂例如是水、盐水、右旋糖、甘油、乙醇等及其组合。另外,如果需要,组合物可以含有少量的辅助性物质,例如湿润剂或乳化剂、pH缓冲剂或佐剂。在一个优选的实施方案中,产生药物的转基因植物的可食用植株、汁、谷物、叶片、块茎、茎、种子、根或其它植物部分由人或动物摄取,由此提供了非常便宜的治疗疾病的手段。
在一个具体实施方案中,将包含表达AMP和生物膜降解酶及其组合的叶绿体的植物材料(例如莴苣材料)均质化并包封。在一个具体实施方案中,将莴苣材料的提取物进行包封。在一个替代实施方案中,莴苣材料在包封之前被粉化。如前所述,生物膜降解蛋白也可以在表达后从植物中纯化。
在一个替代实施方案中,为了方便施用,可以以转基因植物的汁液的形式提供组合物。为了所述目的,待转化的植物优选选自由番茄、胡萝卜和苹果等组成的可食用植物,其通常以汁液的形式被食用。
根据另一个实施方案,本发明涉及经转化的叶绿体基因组,所述叶绿体基因组已经用这样的载体转化,所述载体包含表达如本文所公开的肽的组合的异源基因。
目前特别感兴趣的是转化的叶绿体基因组,所述转化的叶绿体基因组用包含以下的载体转化:表达一种或多种AMP和生物膜降解酶或其组合(多肽)的异源基因。在一个相关的实施方案中,本发明涉及包含至少一种被转化以表达本文公开的肽的细胞的植物。
本文中提及遗传序列是指单链或双链核酸序列,并且包含目的多肽的编码序列或编码序列的互补序列。编码多肽的简并核酸序列,以及与cDNA具有至少约50、55、60、65、60,优选约75、90、96或98%同一性的同源核苷酸序列,根据本文的教导可以是多核苷酸。使用计算机程序,例如采用FASTA算法的ALIGN,使用空位开放罚分(gap open penalty)为-12且空位扩展罚分(gap extension penalty)为-2的仿射空位搜索(affine gap search),来确定两个多核苷酸序列之间的百分比序列同一性。编码生物活性多肽的核酸序列的互补DNA(cDNA)分子、物种同源物和变体也是可用的多核苷酸。
上述核酸序列的变体和同源物也是可用的核酸序列。通常,如本领域已知的,可以通过在严格条件下使候选多核苷酸与已知多核苷酸杂交,来鉴定同源多核苷酸序列。例如,使用以下洗涤条件:2×SSC(0.3M NaCl,0.03M柠檬酸钠,pH 7.0),0.1%SDS,室温两次,每次30分钟;然后2×SSC,0.1%SDS,50℃一次,30分钟;然后2X SSC,室温两次,每次10分钟,可以鉴定出含有至多约25-30%碱基对错配的同源序列。更优选地,同源核酸链含有15-25%碱基对错配,甚至更优选地,含有5-15%碱基对错配。
本文中提及的多核苷酸的物种同源物还可以通过制备合适的探针或引物并筛选cDNA表达文库来鉴定。众所周知,同源性每下降1%,双链DNA的Tm降低1-1.5℃(Bonner等人,J.Mol.Biol.81,123(1973))。在严格的杂交和/或洗涤条件下与目的多核苷酸或其互补序列杂交的核苷酸序列,也是可用的多核苷酸。严格的洗涤条件是本领域熟知和理解的,并公开于例如Sambrook等人,MOLECULAR CLONING:ALABORATORYMOLECULAR CLONING:ALABORATORY MANUAL,第二版,1989,第9.50-9.51页。
提供了以下材料和方法以便于实践本发明。
微生物和生长条件
在本研究中使用了变形链球菌UA159血清型c(ATCC 700610)、内氏放线菌ATCC12104、戈登链球菌DL-1和白色念珠菌SC5314。选择这些菌株是因为变形链球菌是一种成熟的致病性致龋菌[
表达带不同标签的GFP融合蛋白的叶绿体转基因株系的创建
如先前的研究[Limaye等人,2006;Kwon等人,2013;肖等人,2016;李等人,2011]所述创建表达与CTB、PTD、retrocyclin和protegrin融合的GFP的叶绿体转基因植物。如先前所述[Verma等人,2008],使用Southern印迹测定法确认表达GFP融合蛋白的叶绿体转基因株系。此外,通过在UV照射下观察来自每个构建体的叶片的绿色荧光来确认GFP标签蛋白的表达。
标签融合的GFP蛋白的纯化
通过有机提取然后通过先前进行的疏水层析(Lee等人,2011)来完成从叶绿体转基因烟草中纯化GFP融合物Protegrin-1(PG1)和Retrocyclin(RC101)。取约0.2-1gm冻干的叶片材料,并将其在10-20ml植物提取缓冲液(0.2M Tris HCl pH 8.0,0.1M NaCl,10mMEDTA,0.4M蔗糖,0.2%Triton X,补充有2%苯基甲基磺酰氟和1蛋白酶抑制剂混合物)中重构。将重悬浮液在冰中孵育1小时,每15分钟进行涡旋匀浆。然后将匀浆在75000g、4℃下旋转1小时(Beckman LE-80K optima超速离心机),得到澄清的裂解液。裂解液用70%饱和硫酸铵和1/4体积的100%乙醇预处理,然后剧烈摇动2分钟(Yakhnin等人,1998)。将处理后的溶液在2100g离心3分钟。收集上部乙醇相,并用1/16体积的100%乙醇重复该过程。将合并的乙醇相进一步用1/3体积的5M NaCl和1/4体积的1-丁醇处理,剧烈均化2分钟并在2100g下离心3分钟。收集最下面的相并装载到7kDa MWCO zeba旋转脱盐柱(Thermo scientific)上,并按照制造商的建议进行脱盐。
然后将脱盐后的提取物在捕获阶段进行疏水相互作用层析以进一步纯化。将脱盐后的提取物注入Toyopearl丁基-650S疏水相互作用柱(Tosoh bioscience)中,使其在FPLC单元(Pharmacia LKB-FPLC系统)上运行。用2.3倍柱体积的盐缓冲液(10mM Tris-HCl,10mMEDTA和50%饱和硫酸铵)平衡柱至最终20%盐饱和度,以促进GFP结合在树脂上。然后用5.8倍柱体积的盐缓冲液和无盐缓冲液混合物进行柱洗,然后用无盐缓冲液(10mM Tris-HCl,10mM EDTA)洗脱。基于在色谱图中观察到的峰识别并且收集GFP级分。通过过夜透析对收集的级分进行最终精制(polishing)步骤。透析后,将纯化的蛋白质冻干(labconco冻干机)以浓缩成品,然后储存在-20℃。
纯化的GFP融合物的定量
通过Western印迹和基于荧光的方法进行GFP-RC101和GFP-PG1的定量。将冻干的纯化蛋白质重悬于无菌1×PBS中,并通过Bradford方法测定总蛋白质。然后通过如下操作对纯化的蛋白质进行定量:通过SDS-PAGE方法,通过将变性蛋白质样品与商业GFP标准品(Vector labs)一起上样到12%SDS凝胶上,然后使用1:3000稀释的小鼠抗-GFP抗体(Millipore)进行Western印迹,然后用1:4000稀释的HRP缀合的山羊抗小鼠二抗(Southernbiotech)探测。
还使用GFP荧光定量纯化的蛋白质。将蛋白质样品在天然条件下在12%SDS凝胶上运行。运行后,将凝胶置于UV灯下,然后拍照。通过用商业GFP标准品使用Image J软件进行光密度分析来确定Western方法和天然荧光方法中的GFP浓度,以获得标准曲线。基于GFP定量,相对于在Bradford方法中测定的总蛋白质值来确定纯度。
人牙周细胞系摄取纯化的标签融合的GFP蛋白
如前所述(Xiao,等人,2016),为了确定四种标签CTB、PTD、PG1和RC101在不同的人牙周细胞系(包括人牙周膜干细胞(HPDLS)、上颌骨间充质干细胞(MMS)、人头颈部鳞状细胞癌细胞(SCC-1)、牙龈来源的间充质基质细胞(GMSC)、成人牙龈角质形成细胞(AGK)和成骨细胞(OBC))中的摄取,简要地说,将每种人细胞系细胞(2×10
评价抗菌活性
通过延时杀伤试验分析AMP(Gfp-PG1和Gfp-RC101)对变形链球菌的杀伤动力学。使变形链球菌生长至对数期并在生长培养基中稀释至10
还通过延时测量来评估AMP对变形链球菌细胞活力的影响。使变形链球菌生长至对数期并通过离心(5500g,10min)收获,并将沉淀用磷酸钠缓冲盐水(PBS)(pH7.2)洗涤一次,重悬于PBS中并调节至终浓度为1×10
评估抗生物膜活性
使用良好表征的、生产EPS基质的口腔病原体——变形链球菌UA159,在唾液涂覆的羟基磷灰石盘表面上形成生物膜。简言之,用过滤灭菌的澄清的人全唾液(sHA)涂覆羟基磷灰石盘(直径1.25cm,表面积2.7±0.2cm
为了检测PG1对变形链球菌在sHA盘上19小时形成的生物膜的影响,我们在生物膜与1)对照,2)仅EPS降解酶,3)仅PG1,或4)PG1和EPS降解酶一起孵育长达60分钟后,使用延时共聚焦显微镜检查了EPS基质的3D结构和原位细胞活力。这里使用的EPS降解酶是右旋糖酐酶和变聚糖酶,它们能够通过水解α-1,6糖苷键和α-1,3糖苷键来消化来自变形链球菌的EPS[Hayacibara等人,2004]。由青霉菌产生的右旋糖酐酶购自Sigma(St.Louis,MO),并且由哈茨木霉菌(Trichoderma harzianum)产生的变聚糖酶由William H.Bowen博士(罗切斯特大学医学中心口腔生物学中心)友情提供。在应用于生物膜之前,将右旋糖酐酶和变聚糖酶以5:1的比例混合[Mitsue F.Hayacibara等人,2004]。使用Alexa Fluor 647标记的右旋糖酐缀合物标记EPS基质,而使用SYTO 9和PI标记活细胞和死细胞。在0、10、30和60分钟时使用共聚焦荧光成像检查生物膜,并进行AMIRA/COMSTAT/ImageJ分析。使用COMSTAT和ImageJ对每个共聚焦图像系列中EPS基质、活细胞和死细胞的总生物质进行定量。计算每个时间点的活细菌与总细菌的比例,并绘制活细胞的存活率(相对于在0分钟时的活细胞)。在0分钟时间点的活细胞的初始数量被认为是100%。通过与0分钟时间点比较来确定存活率百分比。
微生物测定
在选定的时间点(19小时),除去生物膜,通过超声均质化并进行微生物分析,如前所述[Xiao J等人,2012,Koo H等人。2010];我们的超声程序不会杀死细菌细胞,而是提供最佳的分散和最大的可恢复(recoverable)计数。将生物膜悬浮液的等分试样连续稀释,并使用自动化Eddy Jet Spiral Plater(IUL,SA,Barcelona,Spain)在血琼脂平板上铺板。同时,使用叠氮溴化丙锭(PMA)结合定量PCR(PMA-qPCR)来分析变形链球菌的细胞活力,如Klein MI等所述[Klein MI等人。2012]。PMA和qPCR的组合将仅定量具有完整膜的细胞(即活细胞),因为与死细胞的DNA和细胞外DNA交联的PMA会修饰DNA并抑制所提取的DNA的PCR扩增。简言之,将生物膜沉淀用500μl TE(50mM Tris,10mM EDTA,pH 8.0)重悬。用移液管将生物膜悬浮液转移到1.5ml微量离心管中;然后与PMA混合。将1.5μl PMA(20mM,在20%二甲基亚砜中;Biotium,Hayward,CA)加入到生物膜悬浮液中。将管在黑暗中在室温下孵育5分钟,偶尔混合。接下来,将样品暴露于光下3分钟(600-W卤素光源)。在光诱导的交联后,将生物膜悬浮液离心(13,000g/10min/4℃)并弃去上清液。将沉淀用100μl TE重悬,然后与10.9μl溶菌酶(100mg/ml储备液)和5μl变溶菌素(mutanylysin)(5U/μl储备液)一起孵育(37℃/30分钟)。然后使用MasterPure DNA纯化试剂盒(Epicenter Technologies,Madison,WI)分离基因组DNA。使用iQ SYBR Green supermix(Bio-Rad Laboratories公司,CA)和变形链球菌特异性引物(16S rRNA)通过MyiQ实时PCR检测系统扩增每个样品的十皮克(pictogram)的基因组DNA和阴性对照(无DNA)[Klein MI等人,2010]。
统计分析
数据表示为平均值±标准偏差(SD)。所有测定均在至少两个不同的实验中一式两份进行。使用学生t检验在测试和对照之间进行成对比较。对于本研究的所有统计学检验,所选择的显著性水平均为P<0.05。
提供以下实施例以说明本发明的某些实施方案。它们不意图以任何方式限制本发明。
实施例I
叶绿体转基因株系的创建和表征
将所有融合标签(CTB、PTD、protegrin、retrocyclin)与绿色荧光蛋白(smGFP)在N-末端融合以评估其效率和特异性。将编码这些融合蛋白的融合构建体克隆到叶绿体转化载体中,然后将其用于转化目的植物,如美国专利申请号13/101,389所述,该美国专利申请通过引用并入本文。为了创建表达GFP融合蛋白的植物,使用生物射弹颗粒递送系统转化烟草叶绿体。如图1B所示,各标签融合的GFP由相同的调节序列驱动—由光调节的psbA启动子和5'UTR,并且所转录的mRNA由3'psbA UTR稳定。psbA基因是表达最高的叶绿体基因,因此在我们的实验室中使用psbA调控序列来进行转基因表达[7,34]。为了促进表达盒整合到叶绿体基因组中,在表达盒侧翼连接两个侧翼序列异亮氨酰-tRNA合成酶(trnI)和丙氨酰-tRNA合成酶(trnA)基因,这与天然叶绿体基因组序列相同。研究了来自选择培养基的新出芽的转基因盒在trnI和trnA间隔区的特异性整合,然后通过Southern印迹分析证实了每个植物细胞中所有叶绿体基因组的转化(不存在未转化的野生型叶绿体基因组)。因此,在提取融合蛋白之前,证实了所有GFP表达盒的稳定整合和叶绿体基因组与转基因的同质性(homoplasmy)。另外,通过在UV光下观察绿色荧光,在表型上确认了GFP表达。然后转移经确认的同质株系并在自动温室中培养以增加生物质。
为了放大每个带GFP标签的植物叶材料的生物质,使每个同质株系在温度和湿度受控的温室中生长。在深夜收获完全生长成熟的叶片,以最大化由光调节的调节序列驱动的GFP融合蛋白的累积。为了进一步增加以重量为基础的融合蛋白的含量,将冷冻的叶片在-40℃下真空冷冻干燥。除了蛋白质的浓度效应外,冻干还使在植物中表达的治疗性蛋白质在室温下的保质期超过一年[Daniell等人,2015;2016]。因此,在该研究中,使用表达GFP融合标签蛋白的冻干和粉末化的植物细胞以向小鼠口服递送。
来自叶绿体转基因烟草的GFP融合抗微生物肽的表达与纯化。
从温室收获表达GFP融合抗微生物肽RC101和PG1的烟草叶片,随后冻干用于蛋白质提取和纯化。发现基于光密度测定法GFP-RC101的平均表达水平为粗提取物中总蛋白质的8.8%,而GFP-PG1的表达为总蛋白质的3.8%。表达水平的差异与之前报道的(Lee等人,2011,Gupta等人,2015)相似。
进行了与不同抗微生物肽(RC101和PG1)融合的GFP的纯化,以测试针对浮游变形链球菌和形成生物膜的变形链球菌的杀微生物活性。使用表达不同GFP融合物的冻干的烟草材料进行提取和随后的下游处理(参见图8)以获得最终的纯化产物,随后将其定量以确定GFP融合肽的浓度。通过Western印迹和天然GFP荧光方法进行了纯化的GFP-RC101和GFP-PG1的定量,其中纯化的GFP-RC101显示94%的平均纯度,平均产量为1624μg GFP(116μgRC101肽)/gm冻干叶片材料(图1A和1B)。在GFP-PG1中,两种方法(图1C和1D)均显示17%的平均纯度,平均产量为58.8μg GFP(4.2μg PG1肽)/gm冻干叶片材料。纯度的差异可归因于与GFP融合的标签的类型的差异,如先前研究中所见(Xiao等人,2015,Skosyrev等人,2003)。来自植物提取物的纯化的GFP-RC101和GFP-PG1的富集倍数分别为10.6和4.5。Western印迹还显示27kDa的GFP标准品,其对应于单体片段,以及54kDa GFP二聚体,载量范围为6-8ng GFP。在GFP-RC101 Western印迹中,清楚可见29kDa和58kDa片段,其对应于融合物的单体和二聚体形式(图1A)。这可归因于GFP形成二聚体的能力(Ohashi等人,2007)。GFP-PG1的Western印迹(图1D)清楚地显示29kDa单体以及40kDa片段,可能是由于GFP-PG1与可能已被共纯化的其他非特异性植物蛋白结合引起的迁移率变化,如前所述(Morassuttia等人,2002)。GFP-RC101和GFP-PG1的天然荧光(图1B和1D)显示多聚体条带,其中一些在27kDa GFP标准大小以下可见,这可能是因为GFP与阳离子肽融合,导致每个GFP片段的电泳迁移率变化,如先前研究中所述(Lee等人,2011)。
AMP的抗菌活性
我们首先使用剂量-反应时间-杀伤研究检查了GFP-PG1的抗微生物活性,如图2(A-E)所示。GFP-PG1对变形链球菌(一种经过验证的形成生物膜的并导致龋齿的病原体)表现出强大的抗菌活性,在低浓度下在1小时内迅速杀死细菌细胞(图2A)。GFP-PG1还杀死了早期口腔定植者戈登链球菌和内氏放线菌,但在测试浓度下显示对白色念珠菌的抗真菌活性有限(图2E)。延时共聚焦成像显示,相对于未处理的对照(图3B),变形链球菌的生存力早在10分钟就受到了影响,如图3A所示。SEM成像显示变形链球菌膜表面的破坏,引起细胞内内含物挤出以及细胞形态不规则,而未处理的细菌显示完整且光滑的表面,没有任何可见的细胞裂解或碎片(图3C)。在已经显示了GFP-PG1对变形链球菌的抗微生物功效后,我们检查了该抗微生物肽防止生物膜形成或破坏预先形成的生物膜的潜力。
AMP抑制生物膜起始
防止病原性口腔生物膜的形成是具有挑战性的,因为药物需要在局部施用后发挥治疗作用。为了确定GFP-PG1是否可以破坏生物膜的起始,我们用GFP-PG1单一局部处理30分钟来处理唾液涂覆的磷灰石(sHA)表面(牙齿替代物),然后与活跃生长的变形链球菌细胞在致龋(富含蔗糖)的条件下一起孵育。我们观察到在GFP-PG1处理的sHA表面上,变形链球菌的生物膜形成显著受损,且EPS基质的累积最小(图4B和4C)。与对照相比(图4A),少数贴壁细胞簇大部分是无活力的,表明尽管局部、短期暴露,但是GFP-PG1对生物膜起始具有强有力的作用。
在有或没有EPS降解酶的情况下通过AMP破坏预先形成的生物膜
破坏在表面上形成的生物膜是具有挑战性的。破坏致龋生物膜特别困难,因为药物通常不能到达致病细菌(例如变形链球菌)簇,因为周围的富含胞外多糖(EPS)的基质会使致病细菌陷入其中并保护它们[Bowen和Koo,2011]。EPS降解酶如右旋糖酐酶和变聚糖酶可以帮助消化致龋生物膜的基质,尽管它们没有抗菌作用。我们首先优化了破坏EPS基质而不影响细胞活力所需的右旋糖酐酶和/或变聚糖酶(数据未显示)。如图5所示,右旋糖酐酶和变聚糖酶的组合可以消化细菌细胞簇(绿色)和“裸露的”细胞(见箭头)之间的EPS(红色)和“开放空间(open space)”(见箭头)。因此,GFP-PG1和EPS降解酶的组合协同地增强了整体抗生物膜效果。
为了探索这一概念,在sHA表面上预先形成了变形链球菌生物膜,并用GFP-PG1和EPS降解酶(Dex/Mut)单独或组合局部处理。进行了延时共聚焦成像和定量计算分析,以分析生物膜内的EPS-基质降解和活/死细菌细胞(图6A)。与单独的GFP-PG或Dex/Mut相比,酶-肽组合导致EPS-基质降解超过60%,同时增加细菌杀伤。通过标准培养测定通过确定菌落形成单位进一步验证了这些发现。与Dex/Mut组合的PG对变形链球菌生物膜的抗菌活性比任何单独一个都显著增强。单独的Dex/Mut的局部暴露显示对生物膜细胞活力没有影响,而单独的GFP-PG-1显示有限的杀伤活性(图6B)。总之,数据证明了这种组合方法协同增强GFP-PG-1对已建立的生物膜的抗微生物功效的潜力(图6C)。
人牙周细胞对与不同标签融合的GFP的摄取。
当与人类培养细胞(包括HPDLS、MMS、SCC-1、GMSC、AGK和成骨细胞(OBC))孵育时,纯化的GFP融合蛋白显示出有趣的结果。虽然只呈现了每个细胞系的一个代表性图像,但是摄取研究一式三份进行,并在共聚焦显微镜下记录至少10-15个图像。没有融合标签时,GFP不进入任何测试的人类细胞系。尽管CTB-GFP和PTD-GFP的定位模式不同,但它们都有效地穿透了所有测试的细胞类型。与CTB-GFP一起孵育后,GFP信号主要定位于HPDLSC和MMSC的外周,在SSC-1、AGK、OBC中为均匀的小的细胞质斑点(cytoplasmic puncta),并在GMSC中为大的细胞质聚集点(cytoplasmic foci)。在MMSC中观察到PTD-GFP为小的细胞质聚集点,在HPDLSC、GMSC、AGK、OBC中以及SCC-1细胞的细胞质和外周为大小可变的细胞质斑点。PG1-GFP是进入所有测试的人类细胞的最有效的标签,因为GFP可以在比任何其他融合蛋白低十倍的浓度定位。PG1-GFP在HPDLSC、SCC-1、GMSC和AGK细胞中仅显示细胞质定位,并且定位于MMSC的外周和胞质溶胶,但它仅定位于OBC的外周。RC101-GFP定位于SCC-1、GMSC、AGK和OBC,但它在HPDLSC中的定位可忽略不计,并且在MMSC细胞中检测不到。
讨论和结论
致龋口腔生物膜的组装是致病细菌如何随着细胞外EPS基质发展在表面(牙齿)上积聚的主要例子。预防致龋生物膜形成需要用局部治疗破坏牙齿表面上的细菌积聚。氯己定(CHX)被认为是局部抗微生物治疗的“金标准”(Flemmig和Beikler 2011;Marsh等人,2011;Caufield等人,2001)。CHX有效抑制唾液中变形链球菌的水平,但它具有不良副作用,包括牙齿着色和牙结石形成,并且不建议用于日常预防或治疗用途(Autio-Gold 2008)。作为替代方案,已经开发了几种抗微生物肽(AMP)并且针对口腔细菌进行了测试,并且已显示出对生物膜的潜在效果(尽管与浮游细胞相比效果降低)(如Silva等人,2012所述)。不幸的是,大多数这些研究使生物膜连续、长时间暴露于AMP(几小时)来测试抗生物膜效力,而不是临床使用的局部治疗方案。此外,合成AMP的生产成本昂贵,使得它们在牙科应用中难以承受。在这里,我们示出了一种植物生产的AMP,它通过单一、短期局部处理牙齿替代物表面而在控制生物膜形成方面表现出强大的效果。
开发的致龋生物膜的特征在于细菌嵌入EPS基质中,使得生物膜处理和除去极其困难(Paes Leme等人,2006;Koo等人,2013)。富含EPS的基质促进微生物粘附、凝聚和保护以及阻碍扩散(Koo等人,2013;Flemming和Wingender2010)。EPS基质在生物膜中创建空间和微环境异质性,在局部调节病原体针对抗微生物剂的生长和保护以及高粘性支架,所述高粘性支架确保生物膜牢固附着在牙齿表面(Flemming和Wingender,2010;Peterson等人,2015)。CHX对已形成的致龋生物膜的效果要差得多(Hope和Wilson,2004;Van Strydonck等人,2012;Xiao等人,2012)。EPS主要由不溶性葡聚糖(高含量的α1,3连接的葡萄糖)和可溶性葡聚糖(主要是α1,6连接的葡萄糖)的混合物组成(Bowen和Koo 2011)。因此,已经研究了使用EPS-基质降解右旋糖酐酶或变聚糖酶(来自真菌)来破坏生物膜并预防龋齿的可能性,并将其包括在市售的非处方漱口水(例如Biotene PBF)中。然而,单独的酶的局部应用在临床上产生了中等的抗生物膜/抗龋效应(Hull 1980),可能是由于缺乏抗菌作用和在口腔中酶活性降低(Balakrishnan等人,2000)。有趣的是,最近的体外研究表明,由融合的右旋糖酐酶和变聚糖酶组成的嵌合葡聚糖酶在破坏菌斑生物膜方面比任一单独的酶更有效(Jiao等人,2014)。然而,可能是由于与成本和制剂相关的困难,尚未开发出将抗微生物剂与两种EPS-基质降解酶组合成单一治疗系统的方法。在本研究中,我们证明PG1与基质降解酶一起协同且有效地破坏致龋生物膜。这种可行且有效的局部抗生物膜方法能够使用与EPS消化酶组合的抗微生物肽同时降解生物膜基质支架并杀死嵌入的细菌。
通过protegrin和GFP融合物保持高水平的抗微生物活性为许多临床应用打开了大门,以在破坏生物膜之外增强口腔健康。除了破坏生物膜之外,增强牙龈组织中的伤口愈合也是重要的临床需求。我们最近报道,protegrin和retrocyclin均可进入人肥大细胞并诱导脱颗粒,这是伤口愈合过程中的重要一步(Gupta等人,2015)。因此,抗微生物肽protegrin和retrocyclin在杀死生物膜中的细菌和通过肥大细胞的脱颗粒引发伤口愈合中起重要作用。此外,重要的是有效地递送生长激素或其他蛋白质以增强细胞粘附、刺激骨生成、血管生成、骨再生、成骨细胞或内皮细胞的分化。先前鉴定的细胞穿透肽具有若干局限性。CTB通过普遍存在的GM1受体进入所有细胞类型,并且这需要CTB的五聚体形式。另一方面,PTD不进入免疫细胞(Xiao等人,2016)。
在这项研究中,我们测试了PG1-GFP或RC101-GFP进入牙周细胞和牙龈细胞的能力。PG1-GFP是进入人牙周细胞或牙龈细胞的最有效标签,因为即使比任意其他融合蛋白浓度低10倍,GFP信号也可以被检测到。尽管在细胞内定位方面存在一些变化,但PG1-GFP有效地进入HPDLSC、SCC-1、GMSC、AGK、MMSC和OBC。相比之下,RC101-GFP进入SCC-1、GMSC、AGK和OBC,但其在HPDLSC和MMSC细胞中的定位很差或不可检测。因此,该研究确定了protegrin在将药物递送至成骨细胞、牙周膜细胞、牙龈上皮细胞或成纤维细胞以增强口腔健康方面的新作用。通过机械研磨释放在植物细胞中合成的蛋白质药物是可行的,并且嵌入在口香糖中的冻干植物细胞生物包封的蛋白质药物由于其缓慢且持续释放更长时间而提供了理想的药物递送模式。这克服了目前口腔冲洗制剂的主要限制—抗微生物剂在牙龈/牙齿表面上的接触持续时间短。
除了局部应用之外,在植物细胞中表达的与protegrin融合的蛋白质药物可以以非侵入性方式口服递送至牙龈组织的更深层并增加患者的依从性。植物中生物包封的蛋白质药物可以在室温下储存多年而不会丧失其功效(Su等人,2015;Daniell等人,2016)。目前蛋白质药物的高成本是由于它们在极其昂贵的发酵罐中生产、纯化、冷运输/储存、保质期短和无菌递送方法。使用这种新的药物递送理念来增强口腔健康可以消除所有这些挑战。最近FDA批准了用于生产蛋白质药物的植物细胞(Walsh 2014),预示着这一新理念良好的临床进展。
参考文献
Agrawal P,Verma D,Daniell H.2011.Expression of Trichoderma reeseiβ-mannanase in tobacco chloroplasts and its utilization in lignocellulosicwoody biomass hydrolysis.PLoS One.6:e29302.
D,McShan WM,McLaughlin RE,/>
Autio-Gold J.2008.The role of chlorhexidine in caries prevention.OperDent.33(6):710-6.
Banas JA,Vickerman MM.2003.Glucan-binding proteins of the oralstreptococci.Crit Rev Oral Biol Med.14(2):89-99.
Balakrishnan M,Simmonds RS,Tagg JR.2000.Dental caries is apreventable infectious disease.Aust Dent J.45:235-45.
Bowen WH.1972.The effect of dextranase on caries activity in monkeys(macacairus).Caries Res.6:75-6.
Bowen WH and Koo H.2011.Biology of streptococcus mutans-Derivedglucosyltransferases:Role in extracellular matrix formation of cariogenicbiofilms.Caries Res 45:69-86.
Burne RA.1998.Oral streptococci...products of their environment.JDent Res.77(3):445-52.
Caufield PW,Dasanayake AP,Li Y.2001.The antimicrobial approach tocaries management.J Dent Educ 65:1091-5.
Chen J,Falla TJ,Liu H,Hurst MA,Fujii CA,Mosca DA,Embree JR,Loury DJ,Radel PA,Cheng Chang C,Gu L,Fiddes JC.2000.Development of protegrins for thetreatment and prevention of oral mucositis:structure-activity relationshipsof synthetic protegrin analogues.Biopolymers.55:88-98.
da Silva BR,de Freitas VA,Nascimento-Neto LG,Carneiro VA,Arruda FV,deAguiar AS,Cavada BS,Teixeira EH.2012.Antimicrobial peptide control ofpathogenic microorganisms of the oral cavity:a review of theliterature.Peptides 36:315-321.
Daniell H,Lin CS,Yu M,Chang WJ.2016.Chloroplast genomes:diversity,evolution and applications in genetic engineering.Genome Biology,in press
DeGray G,Rajasekaran K,Smith F,Sanford J,Daniell H.2001.Expression ofan antimicrobial peptide via the chloroplast genome to controlphytopathogenic bacteria and fungi.Plant Physiol.127(3):852-62.
Dige I,Raarup MK,Nyengaard JR,Kilian M,Nyvad B.2009.Actinomycesnaeslundii in initial dental biofilm formation.Microbiology 155:2116-2126.
Dye BA,Hsu KL,Afful J.2015.Prevalence and Measurement of DentalCaries in Young Children.Pediatr Dent 37:200-216.
Flemmig TF,Beikler T.2011.Control of oral biofilms.Periodontol2000.55:9-15.
Flemming HC,Wingender J.2010.The biofilm matrix.Nat Rev Microbiol.8:623-33.
Giles FJ,Miller CB,Hurd DD,Wingard JR,Fleming TR,Sonis ST,BradfordWZ,Pulliam JG,Anaissie EJ,Beveridge RA,Brunvand MM,Martin PJ;PROMPT-CT TrialInvestigators.2003.A phase III,randomized,double-blind,placebo-controlled,multinational trial of iseganan for the prevention of oral mucositis inpatients receiving stomatotoxic chemotherapy(PROMPT-CT trial).LeukLymphoma.44:1165-72.
Guggenheim B,Regolati B,Schmid R,Mühlemann HR.1980.Effects of thetopical application of mutanase on rat caries.Caries Res.14:128-35.
Guo L,McLean JS,Yang Y,Eckert R,Kaplan CW,Kyme P,Sheikh O,Varnum B,Lux R,Shi W,He X.2015.Precision-guided antimicrobial peptide as a targetedmodulator of human microbial ecology.Proc Natl Acad Sci U S A 112:7569-7574.
Gupta,Kshitij,Akhil Kotian,Hariharan Subramanian,Henry Daniell,andHydar Ali.“Activation of Human Mast Cells by Retrocyclin and ProtegrinHighlight Their Immunomodulatory and Antimicrobial Properties.”Oncotarget 6,no.30(October 6,2015):28573–87.doi:10.18632/oncotarget.5611.
Hajishengallis E,Parsaei M,Klein MI,Koo H.2015.Advances in themicrobial etiology and pathogenesis of early childhood caries.Molecular OralMicrobiology doi:10.1111/omi.12152.
Hall-Stoodley L,Costerton JW,Stoodley P.2004.Bacterial biofilms:fromthe natural environment to infectious diseases.Nat Rev Microbiol 2:95-108.
Hayacibara MF,Koo H,Vacca-Smith AM,Kopec LK,Scott-Anne K,Cury JA,Bowen WH.2004.The influence of mutanase and dextranase on the production andstructure of glucans synthesized by streptococcal glucosyltransferases.Carbohydrate Research 339:2127-2137.
Hope CK and Wilson M.2004.Analysis of the effects of chlorhexidine onoral biofilm vitality and structure based on viability profiling and anindicator of membrane integrity.Antimicrob Agents Chemother 48:1461-8.
Hull PS.1980.Chemical inhibition of plaque.J Clin Periodontol.7:431–42.
Jin S,Daniell H.2015.The Engineered Chloroplast Genome Just GotSmarter.Trends Plant Sci 20:622-640
Jiao YL,Wang SJ,Lv MS,Jiao BH,Li WJ,Fang YW,LiuS.2014.Characterization of a marine-derived dextranase and its application tothe prevention of dental caries.J Ind Microbiol Biotechnol.41:17-26.
Jones CG.1997.Chlorhexidine:is it still the gold standard?Periodontol2000 15:55-62.
Jin S,Kanagaraj A,Verma D,Lange T,Daniell H.2011.Release of hormonesfrom conjugates:chloroplast expression ofβ-glucosidase results in elevatedphytohormone levels associated with significant increase in biomass andprotection from aphids or whiteflies conferred by sucrose esters.PlantPhysiol.155:222-35.
Kassebaum NJ,BernabéE,Dahiya M,Bhandari B,Murray CJ,MarcenesW.2015.Global burden of untreated caries:A systematic review andmetaregression.J Dent Res.94:650-658.
Kohli N,Westerveld DR,Ayache AC,Verma A,Shil P,Prasad T,Zhu P,ChanSL,Li Q,Daniell H.2014.Oral delivery of bioencapsulated proteins acrossblood-brain and blood-retinal barriers.Mol Ther.22:535-46.
Klein MI,Scott-Anne KM,Gregoire S,Rosalen PL,Koo H.Molecularapproaches for viable bacterial population and transcriptional analyses in arodent model of dental caries.Molecular Oral Microbiology 27:350–361.
Klein MI,DeBaz L,Agidi S,Lee H,Xie G,Lin AHM,Hamaker BR,Lemos JA,KooH.2010.Dynamics of Streptococcus mutans transcriptome in response to starchand sucrose during biofilm development.PLoS One:e1347840.
Koo H,Falsetta ML,Klein MI.2013.The exopolysaccharide matrix:avirulence determinant of cariogenic biofilm.J Dent Res.92:1065-73.
Koo H,Xiao J,Klein MI,Jeon JG.2010.Exopolysaccharides produced byStreptococcus mutans glucosyltransferases modulate the establishment ofmicrocolonies within multispecies biofilms.J Bacteriol 192:3024-3032.
Kwon KC,Verma D,Singh ND,Herzog R,Daniell H.2013.Oral delivery ofhuman biopharmaceuticals,autoantigens and vaccine antigens bioencapsulated inplant cells.Adv Drug Deliv Rev.65(6):782-99.
Kwon KC,Nityanandam R,New JS,Daniell H.2013.Oral delivery ofbioencapsulated exendin-4 expressed in chloroplasts lowers blood glucoselevel in mice and stimulates insulin secretion in beta-TC6 cells.PlantBiotechnol J.11:77-86.
Odd FC.1988.Candida and candidosis.2
Peterson BW,He Y,Ren Y,Zerdoum A,Libera MR,Sharma PK,van WinkelhoffAJ,Neut D,Stoodley P,van der Mei HC,Busscher HJ.2015.Viscoelasticity ofbiofilms and their recalcitrance to mechanical and chemical challenges.FEMSMicrobiol Rev 39:234-245.
Lakshmi PS,Verma D,Yang X,Lloyd B,Daniell H.2013.Low costtuberculosis vaccine antigens in capsules:expression in chloroplasts,bio-encapsulation,stability and functional evaluation in vitro.PLoS One.8:e54708.
Lai JR,Huck BR,Weisblum B,Gellman SH.2002.Design of non-cysteine-containing antimicrobial beta-hairpins:structure-activity relationshipstudies with linear protegrin-1 analogues.Biochemistry.41:12835-42.
Lee SB,Li B,Jin S,Daniell H.2011.Expression and characterization ofantimicrobial peptides Retrocyclin-101 and Protegrin-1 in chloroplasts tocontrol viral and bacterial infections.Plant Biotechnol J.9:100-15.
Ma Z,Wei D,Yan P,Zhu X,Shan A,Bi Z.2015.Characterization of cellselectivity,physiological stability and endotoxin neutralization capabilitiesofα-helix-based peptide amphiphiles.Biomaterials.52:517-30.
Marsh PD,Moter A,Devine DA.2011.Dental plaque biofilms:communities,conflict and control.Periodontology 2000.55:16-35.
Morassutti,Carla,Francesca De Amicis,Barbara Skerlavaj,MargheritaZanetti,and Stefano Marchetti.Production of a Recombinant AntimicrobialPeptide in Transgenic Plants Using a Modified VMA Intein ExpressionSystem.FEBS Letters 519:141–46.
Ohashi,Tomoo,Stephane D.Galiacy,Gina Briscoe,and Harold P.Erickson.AnExperimental Study of GFP-Based FRET,with Application to IntrinsicallyUnstructured Proteins.Protein Science:A Publication of the Protein Society16,no.7(July 2007):1429–38.doi:10.1110/ps.072845607.
Otsuka R,Imai S,Murata T,Nomura Y,Okamoto M,Tsumori H,Kakuta E,HanadaN,Momoi Y.2015.Application of chimeric glucanase comprising mutanase anddextranase for prevention of dental biofilm formation.Microbiol Immunol.59:28-36.
Paes Leme AF,Koo H,Bellato CM,Bedi G,Cury JA.2006.The role of sucrosein cariogenic dental biofilm formation-new insight.J Dent Res.85:878-87.
Sassi AB,Bunge KE,Hood BL,Conrads TP,Cole AM,Gupta P,RohanLC.2011.Preformulation and stability in biological fluids of the retrocyclinRC-101,a potential anti-HIV topical microbicide.AIDS Res Ther.8:27.
Sassi AB,Cost MR,Cole AL,Cole AM,Patton DL,Gupta P,RohanLC.2011.Formulation development of retrocyclin 1 analog RC-101 as an anti-HIVvaginal microbicide product.Antimicrob Agents Chemother.55:2282-9.
Skosyrev,Vitaly S.,Natalja V.Rudenko,Alexander V.Yakhnin,VasilyE.Zagranichny,Lubov I.Popova,Mikhail V.Zakharov,Andrey Yu Gorokhovatsky,andLeonid M.Vinokurov.EGFP as a Fusion Partner for the Expression and OrganicExtraction of Small Polypeptides.Protein Expression and Purification 27,no.1(January 2003):55–62.
Trotti A,Garden A,Warde P,Symonds P,Langer C,Redman R,Pajak TF,Fleming TR,Henke M,Bourhis J,Rosenthal DI,Junor E,Cmelak A,Sheehan F,PulliamJ,Devitt-Risse P,Fuchs H,Chambers M,O'Sullivan B,Ang KK.2004.A multinational,randomized phase III trial of iseganan HCl oral solution for reducing theseverity oforal mucositis in patients receiving radiotherapy for head-and-neck malignancy.Int J Radiat Oncol Biol Phys.58:674-81.
Van Strydonck DA,Slot DE,Van der Velden U,Van der WeijdenF.2012.Effect of a chlorhexidine mouthrinse on plaque,gingival inflammationand staining in gingivitis patients:a systematic review.J ClinPeriodontol.39:1042-55.
Verma D,Kanagaraj A,Jin S,Kolattukudy PE,Daniell H.2010.Chloroplast-derived enzyme cocktails hydrolyse lignocellulosic biomass and releasefermentable sugars.Plant Biotechnol J.8:332-50.
Walsh G.2014.Biopharmaceutical benchmarks 2014.Nat Biotechnol.32:992-1000.
Wang W,Cole AM,Hong T,Waring AJ,Lehrer RI.2003.Retrocyclin,anantiretroviral theta-defensin,is a lectin.J Immunol.170(9):4708-16.
Xiao,Yuhong,Kwang-Chul Kwon,Brad E.Hoffman,Aditya Kamesh,NoahT.Jones,Roland W.Herzog,and Henry Daniell.Low Cost Delivery of ProteinsBioencapsulated in Plant Cells to Human Non-Immune or Immune ModulatoryCells.Biomaterials 80(February 2016):68–79.doi:10.1016/j.biomaterials.2015.11.051.
Xiao,J.et al.2012.The exopolysaccharide matrix modulates theinteraction between 3D architecture and virulence of a mixed-species oralbiofilm.PLoS Pathog 8,e1002623.
Yakhnin,A.V.,L.M.Vinokurov,A.K.Surin,and Y.B.Alakhov.GreenFluorescent Protein Purification by Organic Extraction.Protein Expression andPurification 14,no.3(December 1998):382–86.doi:10.1006/prep.1998.0981.
实施例II
表达AMP、生物膜降解酶和其融合蛋白的叶绿体载体的创建
生物膜相关感染的有效治疗是成问题的,因为抗微生物剂通常无法到达存在于周围细胞外基质中的微生物簇,周围细胞外基质使这些微生物簇嵌入并保护它们。此外,开发针对生物膜相关口腔疾病的新疗法和维持口腔健康需要具有成本效益且易于获得。
为了确保试剂的持续供应,右旋糖酐酶/变聚糖酶和protegrin/retrocyclin独立地并作为融合蛋白在烟草和其他植物叶绿体如莴苣中表达。蛋白质将以低成本的纯化策略生产和使用。烟草植物产生百万粒种子,因此容易扩大生产。每英亩的烟草将产生高达40公吨的生物质,有利于AMP、酶和编码它们的融合构建体的低成本大规模生产。在另一种方法中,蛋白质在可食用植物如莴苣中产生。
已从真菌和细菌中分离出了几种右旋糖酐酶(Dex)和变聚糖酶(Mut),并表征了它们的酶活性。最佳的右旋糖酐酶和变聚糖酶应具有适合人类口腔环境的酶性质。基于口服治疗的短持续时间,非常需要对菌斑生物膜的强结合/保留特性和对两种类型的EPS(右旋糖酐和变聚糖)的催化活性。在商业化含右旋糖酐酶的漱口水(例如Biotene)中加入的酶主要来源于真菌(青霉菌和无定毛壳菌(Chaetomium erraticum))。然而,真菌右旋糖酐酶显示出比细菌右旋糖酐酶(35-40℃)更高的最适温度(50-60℃)。此外,细菌右旋糖酐酶在口腔温度(~37℃)下更稳定和有效,并且适用于预防龋齿。最近,当与真菌右旋糖酐酶相比时,来自节杆菌(Arthrobacter sp)菌株Arth410的右旋糖酐酶在见于口腔和致龋生物膜中的最佳温度(35-45℃)和pH值(pH 5-7)下显示出优异的右旋糖酐降解性质。此外,细菌右旋糖酐酶的局部应用在体内减少龋齿方面比真菌右旋糖酐酶更有效。同样,来自类芽孢杆菌(Paenibacillus sp.)菌株RM1的细菌变聚糖酶表明,即使在除去变聚糖酶(先前首先与生物膜一起孵育了3分钟)后,生物膜在6小时孵育后也被有效地降解了。此外,当与其他微生物物种比较时,RM1变聚糖酶显示出增强的生物膜降解特性。值得注意的是,真菌酶需要糖基化,这排除了它们在叶绿体中的表达。此外,人体系统中糖蛋白的免疫原性可能引起另外的调节问题。因此,本发明涉及使用细菌右旋糖酐酶和变聚糖酶用于在叶绿体中表达。
为了增加叶绿体中Arth410右旋糖酐酶和RM1变聚糖酶蛋白的生产,两种序列都经过密码子优化以进行叶绿体表达。见图9A和9B。
Retrocyclin和Protegrin。
为了最大化AMP的合成并降低AMP的毒性,使用了PG1或RC101的10个串联重复序列,其由蛋白酶切割位点分开,如图10所示。对于表达基因的每个拷贝,将制备PG1或RC101的10个功能拷贝。为此目的,我们选择了烟草蚀纹病毒(TEV)蛋白酶,其具有高特异性和七个氨基酸的短切割位点。或者,也可以使用弗林蛋白酶(furin)切割位点。还可以将该载体工程化以包括编码生物膜降解酶的核酸。编码区可以在用于表达AMP的启动子下表达,或者可以连接到与第二启动子区可操作地连接的载体中。生物膜降解酶编码序列还可含有TEV蛋白酶切割位点以促进酶的释放。该方法提供比化学切割方法更安全且更洁净的选择。最重要的是,融合蛋白中的单个PG1肽在切割之前不会形成二级结构,从而避免了可能对宿主生产系统致命的功能性肽的累积。可以使用实施例I中公开的方法,使用切割后的PG1/RC101、生物膜降解酶或其融合蛋白的抗微生物活性降解生物膜。
如上所述,编码AMP/生物膜降解酶的序列在插入到叶绿体转化载体如pLD中之前任选地进行密码子优化。叶绿体转化依赖于双同源重组事件。因此,叶绿体载体包含叶绿体基因组的同源区域,其位于编码目的异源蛋白质的表达盒的侧翼,这有利于将转基因盒插入到叶绿体基因组的基因间间隔区中,而不破坏任何功能基因。虽然任何基因间间隔区都可用于插入转基因,但最常用的转基因整合位点是trnI-trnA基因(位于rrn操纵子中)之间的转录活性基因间隔区,位于叶绿体基因组的IR区域内(图10)。由于大肠杆菌和叶绿体之间具有相似的蛋白质合成装置(protein synthetic machinery),因此还可以在大肠杆菌中评估密码子优化的效率,然后可以创建植物。两种系统均可用于表达AMP、生物膜降解酶或其融合蛋白,以及用于AMP或酶活性的纯化和评估。
纯化策略
可以使用疏水相互作用柱(HIC;TOSOH Butyl Toyopearl 650m)来纯化与绿色荧光蛋白(GFP)融合的PG1。GFP选择性地结合HIC并促进Rc101/PG1纯度>90%。尽管使用昂贵的HIC色谱法,但回收率非常差(<20%)。为了解决该问题并提高产量,将具有弹性蛋白样生物聚合物(GVGVP(SEQ ID NO:11);图10)的PG1的10个串联重复序列工程化到载体中。该生物聚合物具有独特的热性质,当温度升高到其逆相变温度(inverse transitiontemperature,Tt)以上时,其从溶液中沉淀出来。GVGVP在Tt以下保持可溶性单体状态并且在Tt以上形成不溶性聚集体。这种从可溶状态到不溶状态的相转变可通过改变溶液的温度而可逆,这有利于蛋白质纯化。随后通过冷却至Tt以下使融合蛋白重新溶解,并除去任何共沉淀的不溶性污染物,如图11所示。加热(37℃)和冷却(4℃)的过程被称为逆相变循环(Inverse Transition Cycling,ITC)并且进行3-5轮ITC产生高度纯化的蛋白质(纯度>98%,图11)。
在另一种方法中,将信号肽与右旋糖酐酶或变聚糖酶融合用于在大肠杆菌中表达,其中信号肽将导致酶分泌到细胞外培养基中。此外,分泌蛋白应该穿过大肠杆菌的两个膜系统,在此期间它们穿过其中存在二硫键异构酶、折叠酶和分子伴侣的周质环境。因此,酶促进分泌蛋白的正确折叠和二硫键形成,导致蛋白质的生物活性增强(对于AMP是理想的)。该生产策略的另一个优点是用于增强重组蛋白的稳定性的培养基中的蛋白水解活性水平低。分泌蛋白的信号序列在输出过程中被切割,为天然蛋白产生真正的N-末端。有几种分子可用于将蛋白质转移到细胞外介质,例如TAT、SRP或SecB依赖性途径。然而,不同的途径彼此紧密相互作用,而非独立地工作。SRP和SecB依赖性途径可以共同靶向单个蛋白质。此外,在Sec缺陷条件下,TAT系统可以拯救Sec途径底物的易位。
在众多信号序列中,外膜蛋白A(OmpA)和Seq X(源自lac Z)信号肽显示出优异的输出功能,并且能够将融合蛋白分别以高达4g/L和1g/L输出到细胞外培养基中。因此,使用这些信号序列将Arth 410Dex和RM1 Mut有效输出至细胞外环境。将通过蛋白质定量和酶测定确定输出到培养基中的右旋糖酐酶和变聚糖酶的累积。
已经实现了这些蛋白质在大肠杆菌中的成功表达。参见图12中所示的Western印迹结果。将含有这些序列的叶绿体载体轰击到烟草或莴苣叶片中以产生能够大规模生产右旋糖酐酶/变聚糖酶/AMP蛋白质的植物。在收获大规模生物质后,将叶片冻干并在室温下储存。在另一种方法中,可以包括临床上证实的抗龋齿化合物,例如(氟化物250ppm)和广谱杀菌剂氯己定0.12%,以评估这些剂是否增加功效。
AMP-酶组合有效地破坏了致龋生物膜形成和体内成腔的发生。此外,AMP-酶融合蛋白似乎优于目前用于抗微生物治疗和龋齿预防的化学方式。
如前所述,可以在内源莴苣调节元件的控制下在莴苣叶绿体中表达有效的AMP-酶(独立地或组合地),用于大规模GLP生产和稳定性评估。一个关键的优点是通过消除过于昂贵的纯化过程降低了生产成本。表达AMP/酶的冻干叶材料可以在环境温度下储存数月或数年,同时保持其完整性和功能性。参见图13。除了长期储存,蛋白质药物浓度的增加和微生物污染的减少也是其他优点。与新鲜叶片相比,冻干后的莴苣叶片显示蛋白质药物浓度增加了20-25倍,从而减少了用于口服或局部递送的材料的量。冷冻干燥后,可以将植物材料掺入到口香糖中以递送其中所含的生物膜降解组合物。
用于生产AMP/酶或其融合物的步骤显示在图12中。用于表达本发明蛋白质的莴苣叶绿体载体先前描述于美国专利申请号12/059,376中,其通过引用并入本文。在治疗性蛋白质如胰岛素原的情况下,使用该系统可以实现在莴苣叶绿体中高达70%的总蛋白质的表达水平。
当用于治疗口腔疾病和预防和抑制龋齿形成时,在可食用植物中表达的AMP-酶优选口服递送(局部)。为了增强植物细胞在口腔内的裂解,任选地将表达AMP/酶的植物细胞与表达细胞壁降解酶的植物细胞混合,如美国专利申请12/396,382中所述,该专利申请也通过引用并入本文。
口香糖片剂制备显示在图14中。使用GFP作为目的蛋白质的实例,该数据示出了可以在口香糖片剂中掺入的GFP的量。通过荧光和Western印迹评估了GFP水平。结果显示在图15中。本发明人使用图16中所示的咀嚼模拟器和人工唾液来评估包含GFP的口香糖片剂的GFP释放动力学。图17示出了说明口香糖片剂的随时间的释放动力学的图,所述口香糖片剂包含重组莴苣中存在的不同量的GFP。
从这些数据清楚地看出,包含本发明的AMP-酶融合蛋白的口香糖片剂将递送活性材料持续适当的时间以实现细菌杀灭以及菌斑或生物膜降解。然而,也可以使用口腔冲洗剂如李施德林来递送本发明的AMP-酶融合蛋白或组合。图18显示,与李施德林混合的包含本发明酶的粗提物与商业上生产和纯化的酶一样有效,商业上生产和纯化的酶的制备成本非常高。数据显示,不同组合(不同比例和量)的双酶以剂量依赖性方式显著降低变形链球菌生物膜的生物质。在不同组合中,25U Dex和5U Mut(5:1,Dex:Mut比例)是最有效的,导致在120分钟内超过80%的总生物质降解。进一步的实验证实,5:1Dex/Mut活性比例对李施德林的EPS降解和细菌杀伤显示出最高的效力。令人兴奋的是,双酶预处理显著增强了李施德林介导的细菌杀伤的效力(与溶媒预处理和李施德林相比,降低>3log)。包含第三种酶进一步增强了整体抗生物膜活性。此外,混合物种模型的结果表明,当酶预处理后使用李施德林时,双酶组合不仅能够增强整体抗菌活性,还能够诱导变形链球菌优势的靶向减少(同时增加共生的/益生的口腔链球菌(S.oralis)的比例)。因此,酶+李施德林策略应选择性地靶向病原体变形链球菌,同时增加共生的口腔链球菌的比例,从而防止混合物种生物膜内的微生态不平衡。
除抗微生物活性外,AMP还具有刺激先天免疫和伤口愈合的能力。利用AMP的这种新型的肥大细胞宿主防御功能及其抗微生物特性,扩展了它们的临床应用。生物膜相关龋齿是开发局部治疗的最具挑战性的模型。当开发后,这种局部药物递送可以容易地适应于其他生物膜,因为基质形成阻碍了药物在许多其他生物膜相关疾病中的功效。基质是所有生物膜中固有的,因此该应用超出了口腔中的生物膜的范围。本文描述的生物膜抑制组合物还可用于涂覆支架、人工关节、植入物、瓣膜和插入人体中用于治疗疾病的其他医疗装置。
如上所述,可以将AMP/酶或表达其的叶片掺入到口香糖中,以有效地局部应用它们,来治疗口腔疾病。也可以将该组合物掺入到口腔冲洗剂例如李施德林中。如前所述,这种口香糖或口腔冲洗剂中也可以包含其他抗龋齿剂如氟化物或CHX。
表2中的参考文献描述了来自各种生物来源的许多不同的变聚糖酶。这些参考文献中的每一篇都通过引用并入本文。
可用于实施本发明的另外的生物膜降解酶编码序列包括但不限于,
I)腐殖质类芽孢杆菌(Paenibacillus humicus)NA1123
还参见http://www.ncbi.nlm.nih.gov/nuccore/AB489092
Genbank AB489092
长度:1,146
质量(Da):119,007
参考文献:Otsuka R,et al.Microbiol Immunol.2015Jan;59(1):28-36.
2.来自腐殖质类芽孢杆菌NA1123的变聚糖酶的蛋白质序列
>gi|257153265|dbj|BAI23187.1|推定的变聚糖酶[腐殖质类芽孢杆菌]
MRIRTKYMNWMLVLVLIAAGFFQAAGPIAPATAAGGANLTLGKTVTASGQSQTYSPDNVKDSNQGTYWESTNNAFPQWIQVDLGASTSIDQIVLKLPSGWETRTQTLSIQGSANGSTFTNIVGSAGYTFNPSVAGNSVTINFSAASARYVRLNFTANTGWPAGQLSELEIYGATAPTPTPTPTPTPTPTPTPTPTPTVTPAPSATPTPTPPAGSNIAVGKSITASSSTQTYVAANANDNNTSTYWEGGSNPSTLTLDFGSNQSITSVVLKLNPASEWGTRTQTIQVLGADQNAGSFSNLVSAQSYTFNPATGNTVTIPVSATVKRLQLNITANSGAPAGQIAEFQVFGTPAPNPDLTITGMSWTPSSPVESGDITLNAVVKNIGTAAAGATTVNFYLNNELAGTAPVGALAAGASANVSINAGAKAAATYAVSAKVDESNAVIEQNEGNNSYSNPTNLVVAPVSSSDLVAVTSWSPGTPSQGAAVAFTVALKNQGTLASAGGAHPVTVVLKNAAGATLQTFTGTYTGSLAAGASANISVGSWTAASGTYTVSTTVAADGNEIPAKQSNNTSSASLTVYSARGASMPYSRYDTEDAVLGGGAVLRTAPTFDQSLIASEASGQKYAALPSNGSSLQWTVRQGQGGAGVTMRFTMPDTSDGMGQNGSLDVYVNGTKAKTVSLTSYYSWQYFSGDMPADAPGGGRPLFRFDEVHFKLDTALKPGDTIRVQKGGDSLEYGVDFIEIEPIPAAVARPANSVSVTEYGAVANDGKDDLAAFKAAVTAAVAAGKSLYIPEGTFHLSSMWEIGSATSMIDNFTVTGAGIWYTNIQFTNPNASGGGISLRIKGKLDFSNIYMNSNLRSRYGQNAVYKGFMDNFGTNSIIHDVWVEHFECGMWVGDYAHTPAIYASGLVVENSRIRNNLADGINFSQGTSNSTVRNSSIRNNGDDGLAVWTSNTNGAPAGVNNTFSYNTIENNWRAAAIAFFGGSGHKADHNYIIDCVGGSGIRMNTVFPGYHFQNNTGITFSDTTIINSGTSQDLYNGERGAIDLEASNDAIKNVTFTNIDIINAQRDGVQIGYGGGFENIVFNNITIDGTGRDGISTSRFSGPHLGAAIYTYTGNGSATFNNLVTRNIAYAGGNYIQSGFNLTIK(SEQ ID NO:12)
3.来自腐殖质类芽孢杆菌NA1123的mRNA的序列
>gi|257153264|dbj|AB489092.1|编码推定的变聚糖酶腐殖质类芽孢杆菌mut基因,完整cds
/>
/>
II)解凝乳类芽孢杆菌(Paenibacillus curdlanolyticus)MP-1
1.来自解凝乳类芽孢杆菌MP-1的变聚糖酶的一般信息
http://www.ncbi.nlm.nih.gov/nuccore/HQ640944
Genbank HQ640944;长度:1,261;质量(Da):131,631
参考文献:Pleszczyńska M,et al.Protein Expr Purif.2012Nov;86(1):68-74.
2.来自解凝乳类芽孢杆菌MP-1的变聚糖酶的蛋白质序列
>gi|315201261|gb|ADT91063.1|α-1,3-葡聚糖酶[解凝乳类芽孢杆菌]
MRNKYVTWTLALTMLFSSFFLAVGPNKVVHAAGGTNLALGKNVTASGQSQTYSPNNVKDSNQSTYWESTNNAFPQWIQVDLGATTSIDQIVLKLPAGWGTRTQTLAVQGSTDGSSFTNIVGSAGYVFNPAVANNAVTINFSAASTRYVRLNVTANTAWPAAQLSEFEIYGAGGTTTPPTTPAGTYEAESAALSGGAKVNTDHTGYTGTGFVDGYWTQGATTTFTANVSAAGNYDVTLKYANASGSAKTLSVYVNGTKIRQTTLASLANWDTWGTKVETLSLNAGNNTIAYKYEASDSGNVNIDSIAVAPSTSTPVDPEPPITPPTGSNIAIGKAISASSNTQAFVAANANDNDTNTYWEGGAASSTLTLDLGANQNVTSIVLKLNPSSAWSTRTQTIQVLGHNQSTTTFSNLVSSQSYTFNPATGNSVTIPVTATVKRLQLSITANSGSGAGQIAEFQVYGTPAPNPDLTITGMSWTPASPIETDAVTLNATVKNSGNADAPATTVNFYLNNELVGSSPVGALAAGASSTVSLNVGTKTAATYAVSAKVDESNSIIEQNDANNSYTNASSLVVAPVASSDLVGATTWTPSTPVAGNAIGFMVNLKNQGTIASASGAHGITVVVKNAAGAALQSFSGTYSGAIAAGASVNVTLPGTWTAVNGSYTVTTTVAVDANELTNKQGNNVSTSNLVVYAQRGASMPYSRYDTEDATRGGGATLQTAPTFNQAQIASEASGQSYIALPSNGSSAQWTVRQGQGGAGVTMRFTMPDSTDGMGLNGSLDVYVNGVKVKTVSLTSYYSWQYFSGDMPGDAPSAGRPLFRFDEVHWKLDTPLQPGDTIKIQKGNGDSLEYGIDFLEIEPVPTAIAKPANSLSVTEYGAVANDGQDDLAAFKATVTAAVAAGKSVYIPAGTFNLSSMWEIGSANNMINNITITGAGYWHTNIQFTNPNAAGGGISLRISGQLDFSNVYMNSNLRSRYGQNAIYKGFMDNFGTNSKIHDVWVEHFECGMWVGDYAHTPAIYATGLVVENSRIRNNLADGINYSQGTSNSIVRNSSIRNNGDDGLAVWTSNTNGAPAGVNNTFSYNTIENNWRAGGIAFFGGGGHKADHNLIVDTVGGSGIRMNTVFPGYHFQNNTGITFSDNTLINTGTSQDLYNGERGAIDLEASNDAIKNVTFTNIDIINTQRDAIQFGYGGGFENIVFNNININGTGLDGVTTSRFAGPHKGAAIYTYTGNGSATFNNLTTSNVAYPGLNFIQQGFNLVIQ(SEQ ID NO:14)
3.来自解凝乳类芽孢杆菌MP-1的mRNA的序列
/>
/>
III)类芽孢杆菌菌株RM1。
1.变聚糖酶的一般信息
Genbank E16590;长度:1,291;质量(Da):135kD
参考文献:Shimotsuura I,et al.Appl Environ Microbiol.2008May;74(9):2759-65.2.
来自类芽孢杆菌菌株RM1的变聚糖酶的蛋白质序列
变聚糖酶RM1的推导的氨基酸序列。信号肽区域加下划线,连接子区域加框。箭头表示蛋白质的N-末端结构域的切割位点。DNA序列以GenBank登记号E16590登记。(SEQ IDNO:16)
3.来自类芽孢杆菌菌株RM1的mRNA的序列
/>
/>
/>
IV)哈茨木霉菌(CCM F-470)
1.来自哈茨木霉菌的变聚糖酶的一般信息
还参见http://www.uniprot.org/uniprot/Q8WZM7长度:635
质量(Da):67,726
最后修改日期:2002年3月1日-v1
Checksum:iBB0D864E2F432C58
2.来自哈茨木霉菌的变聚糖酶的蛋白质序列
http://www.uniprot.org/uniprot/Q8WZM7.fasta)
>tr|Q8WZM7|Q8WZM7_TRIHA α-1,3-葡聚糖酶OS=哈茨木霉菌GN=p3 PE=2 SV=1
MLGVFRRLRLGALAAAALSSLGSAAPANVAIRSLEERASSADRLVFCHFMIGIVGDRGSSADYDDDMQRAKAAGIDAFALNIGVDGYTDQQLGYAYDSADRNGMKVFISFDFNWWSPGNAVGVGQKIAQYANRPAQLYVDNRPFASSFAGDGLDVNALRSAAGSNVYFVPNFHPGQSSPSNIDGALNWMAWDNDGNNKAPKPGQTVTVADGDNAYKNWLGGKPYLAPVSTWVFNHFGPEVSYSKNWVFPSGPLIYNRWQQVLQQGFPRVEIVTWNDYGESHYVGPLKSKQFHDGNSKWVNDMPHDGFLDLSKPFIAAYKNRDTDISKYVQNEQLVYWYRRNLKALDCDATDTTSNRPANNGSGNYFEGRPDGWQTMDDTVYVAALLKTAGSVTVTSGGTTQTFQANAGANLFQIPASIGQQKFALTRNGQTVFSGTSLMDITNVCSCGIYNFNPYVGTIPAGFDDPLQADGLFSLTIGLHVTTCQAKPSLGTNPPVTSGPVSSLPASSTTRASSPPPVSSTRVSSPPVSSPPVSRTSSAPPPPGNSTPPSGQVCVAGTVADGESGNYIGLCQFSCNYGYCPPGPCKCTAFGAPISPPASNGRNGCPLPGEGDGYLGLCSFSCNHNYCPPTACQYC(SEQ ID NO:18)
3.mRNA的序列(哈茨木霉菌
http://www.ebi.ac.uk/ena/data/view/AJ243799&display=fasta)
>ENA|AJ243799|AJ243799.1编码α-1,3-葡聚糖酶的哈茨木霉菌mRNA(p3基因)
ATGTTGGGCGTTTTCCGCCGCCTCAGGCTCGGCGCCCTTGCCGCCGCAGCTCTGTCTTCTCTCGGCAGTGCCGCTCCCGCCAATGTTGCTATTCGGTCTCTCGAGGAACGTGCTTCTTCTGCTGACCGTCTCGTATTCTGTCATTTCATGATTGGGATCGTGGGTGACCGTGGCAGCTCGGCAGATTATGATGACGATATGCAACGTGCCAAAGCCGCTGGCATTGACGCCTTCGCCCTGAACATCGGCGTTGACGGCTATACCGACCAGCAGCTCGGCTATGCCTATGACTCTGCCGATCGTAATGGCATGAAAGTCTTCATTTCATTTGATTTCAACTGGTGGAGCCCCGGCAATGCAGTTGGTGTTGGCCAGAAGATTGCGCAGTATGCCAACCGCCCTGCCCAGCTGTATGTCGACAACCGGCCATTCGCCTCTTCCTTCGCCGGTGACGGTCTGGATGTAAATGCGTTGCGCTCTGCTGCAGGCTCCAACGTTTACTTTGTGCCCAACTTCCACCCTGGTCAATCTTCCCCCTCCAACATTGATGGCGCCCTTAACTGGATGGCCTGGGATAATGATGGAAACAACAAGGCACCCAAGCCGGGCCAGACTGTCACAGTGGCAGACGGTGACAACGCTTATAAGAATTGGTTGGGTGGCAAGCCTTACCTGGCGCCTGTCTCAACTTGGGTTTTCAACCATTTCGGGCCCGAAGTTTCATATTCCAAGAACTGGGTTTTCCCAAGTGGGCCTCTGATCTATAACCGGTGGCAACAAGTCTTGCAGCAAGGGTTCCCAAGGGTTGAGATCGTTACCTGGAATGACTACGGGGAATCTCACTACGTCGGTCCCCTGAAGTCTAAGCAATTTCATGATGGGAACTCCAAATGGGTCAATGATATGCCCCACGATGGATTCCTGGATCTTTCGAAGCCGTTCATAGCCGCATATAAAAACAGGGATACCGACATCTCCAAGTATGTTCAAAATGAGCAGCTTGTTTACTGGTACCGCCGCAACTTAAAGGCACTGGACTGTGACGCCACCGACACAACCTCTAACCGCCCGGCTAACAATGGAAGCGGCAATTACTTTGAGGGACGCCCCGATGGTTGGCAAACTATGGATGATACGGTTTACGTGGCGGCACTTCTCAAGACTGCCGGTAGCGTCACGGTCACGTCTGGTGGCACCACTCAAACGTTCCAGGCCAACGCCGGAGCCAATCTCTTCCAAATCCCGGCCAGCATCGGCCAGCAAAAGTTTGCTCTGACTCGTAACGGTCAGACCGTCTTTAGCGGAACCTCATTGATGGATATCACCAACGTTTGCTCTTGCGGTATCTACAACTTCAACCCATATGTTGGCACCATTCCTGCCGGCTTTGACGACCCTCTTCAGGCTGACGGTCTTTTCTCTTTGACCATCGGATTGCACGTCACAACTTGTCAGGCCAAGCCATCTCTTGGAACTAACCCTCCTGTCACTTCCGGCCCTGTGTCCTCGCTTCCAGCTTCCTCCACCACCCGCGCATCCTCGCCGCCTCCTGTTTCTTCAACTCGTGTCTCTTCTCCCCCTGTCTCTTCCCCTCCAGTTTCTCGCACCTCTTCTGCCCCTCCCCCTCCGGGCAACAGCACGCCGCCATCGGGTCAGGTTTGCGTTGCCGGCACCGTTGCCGACGGCGAGTCTGGCAACTACATCGGCCTGTGCCAATTCAGCTGCAACTACGGTTACTGCCCACCAGGACCGTGTAAGTGCACCGCCTTTGGTGCTCCCATCTCGCCACCGGCATCCAACGGCCGCAACGGCTGCCCTCTGCCGGGAGAAGGCGATGGTTATCTGGGCCTGTGCAGTTTCAGTTGTAACCATAATTACTGCCCGCCAACGGCATGTCAATACTGCTAGGAGGGATCAATCTCAGTATGAGTATATGGAGGCTGCTGAAGGACCAATTAGCTGTTCTTATCGGCAGACGAAACCCATAGAGTAAGAAGTTAAATAAAATGCAATTAATGTGTTTTCAAAAAAAAAAAAAAAA(SEQID NO:19)
(由于哈茨木霉菌是真菌,因此存在polyA尾)
V)哈茨木霉菌
1.来自哈茨木霉菌的变聚糖酶的一般信息
还参见http://www.uniprot.org/uniprot/Q8WZM7;
2.来自哈茨木霉菌的变聚糖酶的蛋白质序列
参见:http://www.uniprot.org/uniprot/Q8WZM7.fasta)
>tr|Q8WZM7|Q8WZM7_TRIHA α-1,3-葡聚糖酶OS=哈茨木霉菌GN=p3 PE=2 SV=1
MLGVFRRLRLGALAAAALSSLGSAAPANVAIRSLEERASSADRLVFCHFMIGIVGDRGSSADYDDDMQRAKAAGIDAFALNIGVDGYTDQQLGYAYDSADRNGMKVFISFDFNWWSPGNAVGVGQKIAQYANRPAQLYVDNRPFASSFAGDGLDVNALRSAAGSNVYFVPNFHPGQSSPSNIDGALNWMAWDNDGNNKAPKPGQTVTVADGDNAYKNWLGGKPYLAPVSTWVFNHFGPEVSYSKNWVFPSGPLIYNRWQQVLQQGFPRVEIVTWNDYGESHYVGPLKSKQFHDGNSKWVNDMPHDGFLDLSKPFIAAYKNRDTDISKYVQNEQLVYWYRRNLKALDCDATDTTSNRPANNGSGNYFEGRPDGWQTMDDTVYVAALLKTAGSVTVTSGGTTQTFQANAGANLFQIPASIGQQKFALTRNGQTVFSGTSLMDITNVCSCGIYNFNPYVGTIPAGFDDPLQADGLFSLTIGLHVTTCQAKPSLGTNPPVTSGPVSSLPASSTTRASSPPPVSSTRVSSPPVSSPPVSRTSSAPPPPGNSTPPSGQVCVAGTVADGESGNYIGLCQFSCNYGYCPPGPCKCTAFGAPISPPASNGRNGCPLPGEGDGYLGLCSFSCNHNYCPPTACQYC(SEQ ID NO:20)
3.mRNA的序列(哈茨木霉菌,进一步信息可见于
http://www.ebi.ac.uk/ena/data/view/AJ243799&display=fasta)
>ENA|AJ243799|AJ243799.1编码α-1,3-葡聚糖酶的哈茨木霉菌mRNA(p3基因)
ATGTTGGGCGTTTTCCGCCGCCTCAGGCTCGGCGCCCTTGCCGCCGCAGCTCTGTCTTCTCTCGGCAGTGCCGCTCCCGCCAATGTTGCTATTCGGTCTCTCGAGGAACGTGCTTCTTCTGCTGACCGTCTCGTATTCTGTCATTTCATGATTGGGATCGTGGGTGACCGTGGCAGCTCGGCAGATTATGATGACGATATGCAACGTGCCAAAGCCGCTGGCATTGACGCCTTCGCCCTGAACATCGGCGTTGACGGCTATACCGACCAGCAGCTCGGCTATGCCTATGACTCTGCCGATCGTAATGGCATGAAAGTCTTCATTTCATTTGATTTCAACTGGTGGAGCCCCGGCAATGCAGTTGGTGTTGGCCAGAAGATTGCGCAGTATGCCAACCGCCCTGCCCAGCTGTATGTCGACAACCGGCCATTCGCCTCTTCCTTCGCCGGTGACGGTCTGGATGTAAATGCGTTGCGCTCTGCTGCAGGCTCCAACGTTTACTTTGTGCCCAACTTCCACCCTGGTCAATCTTCCCCCTCCAACATTGATGGCGCCCTTAACTGGATGGCCTGGGATAATGATGGAAACAACAAGGCACCCAAGCCGGGCCAGACTGTCACAGTGGCAGACGGTGACAACGCTTATAAGAATTGGTTGGGTGGCAAGCCTTACCTGGCGCCTGTCTCAACTTGGGTTTTCAACCATTTCGGGCCCGAAGTTTCATATTCCAAGAACTGGGTTTTCCCAAGTGGGCCTCTGATCTATAACCGGTGGCAACAAGTCTTGCAGCAAGGGTTCCCAAGGGTTGAGATCGTTACCTGGAATGACTACGGGGAATCTCACTACGTCGGTCCCCTGAAGTCTAAGCAATTTCATGATGGGAACTCCAAATGGGTCAATGATATGCCCCACGATGGATTCCTGGATCTTTCGAAGCCGTTCATAGCCGCATATAAAAACAGGGATACCGACATCTCCAAGTATGTTCAAAATGAGCAGCTTGTTTACTGGTACCGCCGCAACTTAAAGGCACTGGACTGTGACGCCACCGACACAACCTCTAACCGCCCGGCTAACAATGGAAGCGGCAATTACTTTGAGGGACGCCCCGATGGTTGGCAAACTATGGATGATACGGTTTACGTGGCGGCACTTCTCAAGACTGCCGGTAGCGTCACGGTCACGTCTGGTGGCACCACTCAAACGTTCCAGGCCAACGCCGGAGCCAATCTCTTCCAAATCCCGGCCAGCATCGGCCAGCAAAAGTTTGCTCTGACTCGTAACGGTCAGACCGTCTTTAGCGGAACCTCATTGATGGATATCACCAACGTTTGCTCTTGCGGTATCTACAACTTCAACCCATATGTTGGCACCATTCCTGCCGGCTTTGACGACCCTCTTCAGGCTGACGGTCTTTTCTCTTTGACCATCGGATTGCACGTCACAACTTGTCAGGCCAAGCCATCTCTTGGAACTAACCCTCCTGTCACTTCCGGCCCTGTGTCCTCGCTTCCAGCTTCCTCCACCACCCGCGCATCCTCGCCGCCTCCTGTTTCTTCAACTCGTGTCTCTTCTCCCCCTGTCTCTTCCCCTCCAGTTTCTCGCACCTCTTCTGCCCCTCCCCCTCCGGGCAACAGCACGCCGCCATCGGGTCAGGTTTGCGTTGCCGGCACCGTTGCCGACGGCGAGTCTGGCAACTACATCGGCCTGTGCCAATTCAGCTGCAACTACGGTTACTGCCCACCAGGACCGTGTAAGTGCACCGCCTTTGGTGCTCCCATCTCGCCACCGGCATCCAACGGCCGCAACGGCTGCCCTCTGCCGGGAGAAGGCGATGGTTATCTGGGCCTGTGCAGTTTCAGTTGTAACCATAATTACTGCCCGCCAACGGCATGTCAATACTGCTAGGAGGGATCAATCTCAGTATGAGTATATGGAGGCTGCTGAAGGACCAATTAGCTGTTCTTATCGGCAGACGAAACCCATAGAGTAAGAAGTTAAATAAAATGCAATTAATGTGTTTTCAAAAAAAAAAAAAAAA(SEQID NO:21)
(由于哈茨木霉菌是真菌,因此存在polyA尾)
来自朱黄青霉菌(Penicillium minioluteum)的右旋糖酐酶(Dex)基因GenBank:L41562.1
(http://www.ncbi.nlm.nih.gov/nuccore/L41562.1)
成熟蛋白质具有574个氨基酸,MW为67KD。最佳反应条件为pH 5.5和40℃。pH范围是3-6。
氨基酸序列
MATMLKLLALTLAISESAIGAVMHPPGNSHPGTHMGTTNNTHCGADFCTWWHDSGEINTQTPVQPGNVRQSHKYSVQVSLAGTNNFHDSFVYESIPRNGNGRIYAPTDPPNSNTLDSSVDDGISIEPSIGLNMAWSQFEYSHDVDVKILATDGSSLGSPSDVVIRPVSISYAISQSDDGGIVIRVPADANGRKFSVEFKTDLYTFLSDGNEYVTSGGSVVGVEPTNALVIFASPFLPSGMIPHMTPDNTQTMTPGPINNGDWGAKSILYFPPGVYWMNQDQSGNSGKLGSNHIRLNSNTYWVYLAPGAYVKGAIEYFTKQNFYATGHGILSGENYVYQANAGDNYIAVKSDSTSLRMWWHNNLGGGQTWYCVGPTINAPPFNTMDFNGNSGISSQISDYKQVGAFFFQTDGPEIYPNSVVHDVFWHVNDDAIKIYYSGASVSRATIWKCHNDPIIQMGWTSRDISGVTIDTLNVIHTRYIKSETVVPSAIIGASPFYASGMSPDSRKSISMTVSNVVCEGLCPSLFRITPLQNYKNFVVKNVAFPDGLQTNSIGTGESIIPAASGLTMGLNISNWTVGGQKVTMENFQANSLGQFNIDGSYWGEWQIS(SEQ ID NO:22)
DNA序列
/>
/>
/>
2.来自棘孢青霉菌(Penicillium aculeatum)(Talaromyces aculeatus菌株z01)的右旋糖酐酶(Dex)基因
GenBank:KF999646.1(
最佳pH值约为5。pH范围是3-6。
氨基酸序列
MATMLKLLTLALAISESAIGAVLHPPGSSHPSTRTDTTNNTHCGADFCTWWHDSGEINTQTPVQPGNVRQSHKYSVQVSLAGANNFQDSFVYESIPRNGNGRIYAPTDPPNSNTLDSSVDDGISIEHSIGLNMAWSQFEYSQDVDIKILAADGSSLGSPSDVVIRPVSISYAISQSDDGGIVIRVPADANGRKFSVEFKNDPYTFLSDGNEYVTSGGSVVGVEPTNALVIFASPFLPSGMIPHMTPDNTQTMTPGPINNGDWGSKSILYFPPGVYWMNQDQSGNSGKLGSNHIRLNSNTYWVYFAPGAYVKGAIEYFTKQNFYATGHGVLSGENYVYQANAGENYVAVKSDSTSLRMWWHNNLGGGQTWYCVGPTINAPPFNTMDFNGNSGISSQISDYKQVGAFFFQTDGPEIYPNSVVHDVFWHVNDDAIKIYYSGASVSRATIWKCHNDPIIQMGWTSRDISGVTIDTLNVIHTRYIKSETVVPSAIIGASPFYASGMSPDSSKSISMTVSNVVCEGLCPSLFRITPLQNYKNFVVKNVAFPDGLQTNSIGTGESIIPAASGLTMGLDISNWSVGGQKVTMQNFQANSLGQFDIDGSYWGEWQIN(SEQ ID NO:24)
DNA序列
/>
3.编码右旋糖酐酶的绳状青霉菌(Penicillium funiculosum)dexA基因GenBank:AJ272066.1(http://www.ncbi.nlm.nih.gov/nuccore/7801166)最佳pH值约为5.5。最佳温度为60℃。pH范围是5-7.5(http://www.sciencedirect.com/science/article/pii/S0032959298001277)
氨基酸序列
MATMLKLLALTLAISESAIGAVMHPPGVSHPGTHTGTTNNTHCGADFCTWWHDSGEINTQTPVQPGNVRQSHKYSVQVSLAGTNNFHDSFVYESIPRNGNGRIYAPTDPSNSNTLDSSVDDGISIEPSIGLNMAWSQFEYSQDVDIKILATDGSSLGSPSDVVIRPVSISYAISQSNDGGIVIRVPADANGRKFSVEFKNDLYTFLSDGNEYVTSGGSVVGVEPTNALVIFASPFLPSGMIPHMKPHNTQTMTPGPINNGDWGAKSILYFPPGVYWMNQDQSGNSGKLGSNHIRLNSNTYWVYLAPGAYVKGAIEYFTKQNFYATGHGVLSGENYVYQANAGDNYVAVKSDSTSLRMWWHNNLGGGQTWYCVGPTINAPPFNTMDFNGNSGISQISDYKQVGAFFFQTDGPEIYPNSVVHDVFWHVNDDAIKIYYSGASVSRATIWKCHNDPIIQMGWTSRDISGVTIDTLNVIHTRYIKSETVVPSAIIGASPFYASGMSPDSSKSISMTVSNVVCEGLCPSLFRITPLQNYKNFVVKNVAFPDGLQTNSIGTGESIIPAASGLTMGLNISSWTVGGQKVTMENFQANSLGQFNIDGSYWGEWQISRISSSQSA(SEQ ID NO:26)
DNA序列
/>
尽管以上已经描述并具体例示了本发明的某些优选实施方案,但是本发明不意图限于这些实施例。在不脱离本发明的范围和精神的情况下可以对其做出各种修改,如同在所附权利要求中阐述。
- 用于由氢氧化亚铁产生麦芽酚铁组合物的方法
- 用于促进人毛发生长和/或抑制或延迟毛发脱落的化合物以及用于此类用途的组合物
- 用于抑制WNT信号传导的组合物和方法
- 用于抑制ALAS1基因表达的组合物与方法
- 用于抑制生物膜沉积和产生的组合物和方法
- 用于抑制生物膜沉积和产生的组合物和方法
