双模态适体生物传感器及其在检测赭曲霉毒素A中的应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明属于生物传感检测技术领域,具体涉及一种双模态适体生物传感器及其在检测赭曲霉毒素A中的应用,更具体的涉及一种基于共价有机框架Fe-MIL-88和滚环扩增信号放大策略的双模态适体生物传感器用于赭曲霉毒素A的检测。
背景技术
赭曲霉毒素A(OTA)是谷物、坚果、葡萄、干果和葡萄酒等多种农产品和食品中常见的污染物,主要由曲霉属和青霉属的真菌产生。OTA会对脂质、蛋白质和DNA造成损害,对健康具有肾毒性、致癌性、遗传毒性和免疫毒性,被归类为人类潜在致癌物(2B组)。快速、高选择性和高灵敏地检测OTA是食品安全、质量监控和环境分析的需要。液相色谱法和质谱法是常用的OTA检测方法。然而,这些方法需要昂贵的仪器和设备,而且它们依赖于实验室条件,限制了其在即时检测(POCT)分析中的广泛应用。此外,许多报道的方法是单模读出,其可靠性容易受到工作人员和仪器的异常的影响。因此,构建一个高灵敏度、高选择性、双模式读出、易于实现的OTA检测分析平台,特别是POCT检测平台是非常必要的。
利用核酸适配体作为识别元件,基于纳米技术的生物传感器实现玉米中OTA快速检测是的一种良好选择。电化学生物传感器以其高灵敏度、低成本和易于携带等优点为临床诊断提供了一种可靠的替代方案。特别是随着电化学装置的小型化和智能化的发展,电化学生物传感器在临床诊断和POCT中具有重要的应用价值。值得注意的是,在电化学传感器中,选择稳定、无干扰的信号探头尤为重要。目前,二茂铁(Fc)、亚甲基蓝(MB)等几种经典的电活性有机小分子主要被用作电化学信号指示器。但是,它们很容易从电极表面脱落。为了解决上述问题,一种流行的策略是将信号分子(如MB或Fc)共轭在寡核苷酸上,构建寡核苷酸辅助的比例传感,这无疑会造成操作复杂和成本高的问题。此外,电活性有机小分子不仅难以固定,而且电活性不够强。
金属有机框架材料(MOF)由通过多齿有机连接体相互连接的金属簇构成,由于其迷人的结构拓扑和有趣的特性,已显示出多种潜在应用。特别是,铁基MOF材料由于广泛存在的Fe
由于OTA的浓度一般很低,因此采用信号扩增的方法是非常有必要的。滚环扩增(RCA)是一种强大的等温DNA复制工具,具有高灵敏度和简单的优点,可以自主合成具有串联重复序列的长单链序列。在合理设计的基础上,许多基于RCA的策略已被广泛应用于DNA、RNA、蛋白质和小分子的分析中。同时,由于它们的同质性,适体通常被整合到基于RCA的分析策略中,从而实现结构转换适体传感器。通常,在RCA扩增之前,扩增模板生产的准备是从线性DNA挂锁结扎开始的,通过设计圆形模板,可以在单链中生成数千个周期性的用户指定序列。此外,滚动助行器的所有基底都固定在传感表面上,不需要外部解离链来进一步驱动助行器运动。在此策略中,一个非常小的环状寡核苷酸(例如,长度为25-100个核苷酸)充当DNA或 RNA聚合酶的模板,产生长的重复产物链,作为环状序列的放大拷贝。同时结合短序列DNA与环状序列特定序列的互补,最终实现信号放大。
基于此,本发明通过以具有过氧化物酶活性和电化学活性信号的Fe-MIL-88,结合RCA的信号放大策略,构建比色/电化学双模感应传感器,实现对OTA的高灵敏度检测。本项目开发了一种即插即用的方法,利用智能设备配置的电化学生物传感器,实现了对各种食品样品中OTA的灵敏、准确、快速检测,为POCT提供了一种简单、低成本、实用的方法。此外,Fe-MIL-88作为催化四甲基联苯胺(TMB)氧化产物的纳米酶,也利用智能设备进行了数字分析,利用原色三色通道(R/G/B)。该策略为OTA的检测提供了一个良好的信号转导平台,并可与其他识别元件集成,以扩大其在生物测定中的应用。
发明内容
本发明的主要目的是提供一种基于滚环扩增信号放大策略的双模态适体生物传感器用于赭曲霉毒素A的检测,以解决背景技术中提到的现有检测技术成本高,稳定性差的问题。
为实现以上目的,本发明提供以下技术方案:
一种滚环链复合物的制备方法,包括以下步骤:
(1)将10 μL 5.76 μmol/L primer probe和10 μL 5.76 μmol/L Padlock probe混合,加入20 μL连接缓冲液A退火3 min,在室温下逐渐冷却3 h;
(2)步骤(1)所得产物,加入2 μL 5 U/μL T4 DNA连接酶,在37 ℃下反应3 h,使得Padlock probe链闭合起来;
(3)然后加入5 μL 10 mmol/L dNTP、5 μL 10 U/μL Phi29 DNA聚合酶和20 μL缓冲溶液B,在37 ℃条件下,进行50 min的滚环复制,然后在75 ℃条件下加热灭活终止反应,制得所需的产物;
所述Primer probe序列如SEQ ID NO:3所示;所述Padlock probe序列如SEQ IDNO:4所示。
进一步的,步骤(3)中的缓冲溶液B由50 mmol/L Tris HCl、10 mmol/L MgCl
进一步的,步骤(1)中,连接缓冲液A由5 mmol/L Tris HCl、1 mmol/L MgCl
本发明还提供了一种双模态适体生物传感器的制备方法,包括以下步骤:
S1:Au NPs@Fe-MIL-88/SA复合物的制备;
S2:传感器的制备,包括以下步骤:
S2-1:10 μL 5 mg/mL的氨基磁珠中加入10 μL 0.5 mmol/L Sulfo-SMCC和30 μLPBST缓冲溶液,在37 ℃条件下震荡2 h;
S2-2:用PBST洗涤,弃去上层溶液,在氨基磁珠中加入25 μL 5 μmol/L mDNA/OTAaptamer双链复合物、5 μL 100 mmol/L TCEP和20 μL PBST缓冲溶液,在37 ℃条件下震荡过夜反应,所述mDNA/OTA aptamer双链复合物由序列如SEQ ID NO:2所示的mDNA 和序列如SEQ ID NO:1所示的OTA aptamer等浓度等比例混合制备获得;
S2-3:用PBST洗涤,弃去上层溶液,在氨基磁珠中加入1%BSA震荡反应30 min以封闭活性位点;
S2-4:用PBST洗涤,弃去上层溶液,在氨基磁珠中加入10 μL OTA 和40 μL PBST缓冲溶液,在37 ℃条件下震荡1 h;
S2-5:用PBST洗涤,弃去上层溶液,在氨基磁珠中加入50 μL 2.78 μmol/L滚环链复合物,在37 ℃条件下震荡2 h;
S2-6:用PBST洗涤,弃去上层溶液,在氨基磁珠中加入10 μL Au NPs@Fe-MIL-88/SA复合物和40 μL PBST缓冲溶液,在37 ℃条件下震荡2 h;
S2-7:反应结束用PBST洗涤,弃去上层溶液,加入10 μL 0.005 g/mL壳聚糖与氨基磁珠均匀混合以后,即获得双模态适体生物传感器。
进一步的,所述PBST缓冲溶液由137 mmol/L NaCl,2.7 mmol/L KCl、8.3 mmol/LNa
进一步的,步骤S1具体为:
S1-1:Fe-MIL-88的制备
将0.756 g 2-氨基对苯二甲酸和1.122 g FeCl
S1-2:Au NPs@Fe-MIL-88的制备
将100 mg Fe-MIL-88粉末分散在去离子水50 mL中,持续搅拌下缓慢加入50 mLAu NPs,室温搅拌24 h,用无菌水洗涤3次,将产物于60 ℃下真空干燥后获得Au NPs@Fe-MIL-88产物;
S1-3:取10 mg Au NPs@Fe-MIL-88溶于500 μL灭菌水中,与200μL、400 mmol/LEDC和200 μL、100 mmol/L NHS混合反应30 min,离心,用缓冲溶液C清洗两次,得沉淀;
S1-4:将沉淀物分散到200 μL灭菌水中,加入200 μL、0.5 mg/L SA,在4 ℃下振荡反应4 h,在同一温度下加入250 μL、10 μmol/L DNA 1链反应2 h,所述DNA 1链序列如SEQID NO:5所示;
S1-5:最后,另取1 mL 10% MCH加入到S1-4的混合溶液,在4 ℃下振荡1 h封闭非特异性结合位点,把混合溶液离心10000 r/min 3 min,并用缓冲溶液D清洗两次,将产物分散在500 μL灭菌水中,得到Au NPs@Fe-MIL-88/SA复合物,保存在4 ℃环境下备用。
进一步的,缓冲溶液C为浓度25 mmol/L PBS,pH 7.4,缓冲溶液D为浓度10 mmol/LPBS,pH 7.4。
本发明方法制备获得的双模态适体生物传感器主要应用在检测赭曲霉毒素A中。
作为一种具体的实施方法,检测方法为电化学法,步骤为:
(1)丝网应刷电极的清洗:将SPE电极片拆封,然后用超纯水和无水乙醇分别浸渍10 min,分别冲洗三次,阴干备用;
(2)将制备获得的双模态适体生物传感器涂覆在洗净的丝网印刷电极上,干燥后,连接U盘式电化学工作站使用差分脉冲伏安法在PBS缓冲溶液中进行测量,所述PBS缓冲溶液浓度为10 mmol/L,pH 7.0。
作为另一种具体的实施方法,检测方法为比色法,步骤为:将制备获得的双模态适体生物传感器与100 μL 320 mmol/L的H
本发明达到的技术效果:
本发明通过使用Fe-MIL-88催化H
同时,通过滚环扩增反应制备一条长的重复产物链实现信号放大,最终,生物素化的DNA 1链和链霉亲和素(SA)化的Au NPs@Fe-MIL-88特异性结合,将Fe-MIL-88/DNA 1连接到磁珠表面用于电化学的检测。Fe-MIL-88在过氧化氢(H
附图说明
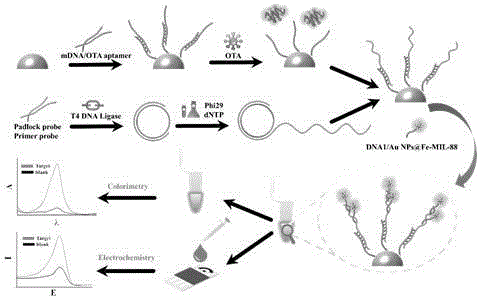
图1 滚环扩增的双模态适体传感器示意图;
图2 Fe-MIL-88和Au NPs@Fe-MIL-88复合物的XRD谱图(a:Fe-MIL-88 b:Au NPs@Fe-MIL-88);
图3 Fe-MIL-88材料的透射电镜图(A:Fe-MIL-88;B:Au NPs@ Fe-MIL-88;C:Fe-MIL-88的EDX元素映射图);
图4 磁珠的透射电镜图;
图5 Au NPs@Fe-MIL-88的XPS光谱图((A)扫描全谱,(B)Fe 2p,(C)C 1s,(D)N 1s,(E)O 1s,(F)Au 4f);
图6 DNA分子量标记(条带M)、mDNA(条带1)、OTA aptamer(条带2)、Primer probe(条带3)、Padlock probe(条带4)、mDNA+OTA aptamer(条带5)、mDNA+Primer probe(条带6)、Primer probe+Padlock probe(条带7)、Primer probe+Padlock probe/RCA(条带8)的PAGE电泳图;
图7 磁珠连接mDNA前后的Zeta电位变化图;
图8(A)不同实验条件下DPV反应的曲线图和(B)柱状图(OTA浓度:250 ng/mL)(a:mDNA+OTA aptamer/RCA; b: OTA aptamer+OTA/RCA; c: mDNA+OTA aptamer+OTA; d:mDNA+OTA/RCA; e: mDNA+OTA aptamer+OTA/RCA);
图9 Primer probe链浓度对电化学响应的影响图(OTA浓度:100 ng/mL);
图10 RCA反应时间对电化学响应的影响图(OTA浓度:100 ng/mL);
图11 OTA的反应时间对电化学响应的影响图(OTA浓度:100 ng/mL);
图12 pH对电化学响应的影响图(OTA浓度:100 ng/mL);
图13 (A)传感器对不同浓度的OTA的DPV响应曲线图(a到l:0、1 fg/mL、10 fg/mL、100 fg/mL、1 pg/mL、10 pg/mL、100 pg/mL、1 ng/mL、10 ng/mL、50 ng/mL、100 ng/mL、250ng/mL);
(B)电流响应与OTA浓度之间的关系图(插图为电流响应和不同OTA浓度的对数值之间的关系);
(C)传感器对不同浓度的OTA的紫外吸收曲线图(a到l:0、1 fg/mL、10 fg/mL、100fg/mL、1 pg/mL、10 pg/mL、100 pg/mL、1 ng/mL、10 ng/mL、25 ng/mL、50 ng/mL、100 ng/mL);
(D)吸光度与OTA浓度之间的关系图;(E)OTA浓度对溶液颜色的影响图;
图14 传感器的选择性效果图;
图15 传感器(A)电化学法和(B)比色法的稳定性效果图(OTA浓度:100 ng/mL);
图16 (A)不同浓度OTA的ELISA试剂盒紫外吸收光谱图和(B)校准曲线图。
具体实施方式
以下将结合实施例对本申请的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本申请的目的、特征和效果。除非本文另有定义,否则结合本发明公开使用的科学和技术术语应具有本领域普通技术人员通常理解的含义,试验方法中购入商品参考表1、表2,如未注明具体条件者,按照常规条件或制造商建议的条件进行,所使用的试剂或仪器未注明生产厂商者,均可以通过市售购买获得的常规产品。DMF中文名称为N’N二甲基甲酰胺,MCH中文名称为巯基乙醇。
表1试剂
表2 实验所用DNA 序列(参看说明书ST.26标准核苷酸序列表)
实施例1
1、氨基化磁珠的清洗
吸取200 μL购买的氨基化的磁珠(200 nm,50 mg/mL),加入2 mL PBST缓冲溶液(137 mmol/L NaCl,2.7 mmol/L KCl,8.3 mmol/L Na
2、丝网应刷电极的清洗
将SPE电极片拆封,然后用超纯水和无水乙醇分别浸渍10 min,分别冲洗三次,阴干备用即可。
3、
Au NPs合成步骤为:将去离子水(100 mL)与HAuCl
的合成
Fe-MIL-88的制备:将2-氨基对苯二甲酸(0.756 g)和FeCl
Au NPs@Fe-MIL-88的制备:将Fe-MIL-88粉末(100 mg)分散在去离子水(50 mL)中,持续搅拌下缓慢加入Au NPs(50 mL),室温搅拌24 h,用无菌水洗涤3次,将产物于60 ℃下真空干燥。
5、Au NPs@Fe-MIL-88/SA复合物的制备
取10 mg Au NPs@Fe-MIL-88复合物溶于500 μL灭菌水中,与EDC(200 μL,400mmol/L)和NHS(200 μL,100 mmol/L)混合反应30 min,离心,用缓冲溶液C(25 mmol/L PBS,pH 7.4)清洗两次,将沉淀物分散到200 μL灭菌水中,加入SA(200 μL,0.5 mg/L),在4℃下振荡反应4 h,在同一温度下加入DNA 1链(250 μL,10 μmol/L)反应2 h;最后,另取1 mLMCH(10%)加入到以上混合溶液,在4℃下振荡1 h封闭非特异性结合位点;最后把混合溶液离心3 min(10000 r/min),并用缓冲溶液D(10 mmol/L PBS,pH 7.4)清洗两次,将产物分散在500 μL灭菌水中,保存在4 ℃环境下备用。
6、滚环链复合物的制备
将10 μL Primer probe(20 μmol/L)和10 μL Padlock probe(20 μmol/L)混合,加入20 μL连接缓冲液A(5 mmol/L Tris HCl,1 mmol/L MgCl
7、真实样品检测液制备
首先,称取5 g的玉米颗粒,溶解在10 mL的甲醇溶液(90% V/V)中。然后,将混合物在室温下搅拌30 min。接下来,将混合物通过孔径为0.22 μm的滤膜,收集的滤液用蒸馏水以1:20的比例稀释,并在4 °C下储存备用。使用同样的方法制备小麦的检测液。
8 传感器的制备、测量
参考图1,首先,在10 μL的氨基磁珠中(5 mg/mL)加入10 μL Sulfo-SMCC(0.5mmol/L)和30 μL PBST缓冲溶液,在37 ℃条件下震荡2 h。用PBST洗涤磁珠三次,弃去上层溶液,在磁珠中加入25 μL mDNA/OTA aptamer双链复合物(5 μmol/L)、5 μL TCEP(100mmol/L)和20 μL PBST缓冲溶液,在37 ℃条件下震荡过夜反应,mDNA/OTA aptamer双链复合物由12.5 μL 10 μmol/L mDNA 和12.5 μL 10 μmol/L OTA aptamer混合制备获得。
用PBST洗涤磁珠三次,弃去上层溶液,在磁珠中加入BSA(1%)震荡反应30 min以封闭活性位点,用PBST洗涤磁珠三次,弃去上层溶液,在磁珠中加入10 μL OTA 和40 μL PBST缓冲溶液,在37 ℃条件下震荡1 h;用PBST洗涤磁珠三次,弃去上层溶液,在磁珠中加入50μL 2.78 μmol/L滚环链复合物,在37 ℃条件下震荡2 h;用PBST洗涤磁珠三次,弃去上层溶液,在磁珠中加入10 μL Au NPs@Fe-MIL-88/SA复合物和40 μL PBST缓冲溶液,在37 ℃条件下震荡2 h。反应结束用PBST洗涤磁珠三次,弃去上层溶液,加入10 μL 0.005 g/mL壳聚糖,与氨基磁珠均匀混合以后,制备获得双模态适体生物传感器。
电化学法测量:制备获得双模态适体生物传感器涂覆在洗净的丝网印刷电极上,干燥后,连接U盘式电化学工作站使用差分脉冲伏安法(DPV)在PBS(10 mmol/L,pH 7.0)缓冲溶液中进行测量。
比色法的测量:在最后一步,将制备获得双模态适体生物传感器与100 μL 320mmol/L的H
清洗所用的PBST缓冲溶液均为137 mmol/L NaCl,2.7 mmol/L KCl,8.3 mmol/LNa
实施结果与讨论
1材料的表征
1.1 Fe-MIL-88材料的X-射线衍射(XRD)表征
利用X-射线衍射对合成的铁多孔材料进行表征。如图2 中a所示,制备的Fe-MIL-88与文献报道的一致,而图2中b表明Au NPs@Fe-MIL-88的XRD谱图中有4个主要特征峰,都位于面心立方Au单晶的晶格上,表明了Au NPs的成功掺杂。
1.2 材料的的透射电镜表征
用电子透射显微镜(TEM)观察Fe-MIL-88和Au NPs@Fe-MIL-88的微观形貌,从图3A中可以看出,Fe-MIL-88呈现出八面体结构;从图3 B中可以看出,金纳米颗粒均匀吸附在Fe-MIL-88表面上,表明我们制备的复合物是成功的。图3 C的EDX元素映射图证明Fe-MIL-88中存在C、N、O、Fe四种元素,并且从EDX成像照片来看,这些元素的分布非常均匀。
同样的,用电子透射显微镜(TEM)观察氨基磁珠的形貌(图4),磁珠的形貌总体呈现为均匀的球状,粒径基本保持在200 nm。
1.3 Au NPs@Fe-MIL-88材料的X射线光电子能谱表征
XPS检测方法可以表征合成材料内部新形成的化学键。如图5A所示,Au NPs@Fe-MIL-88的XPS光谱显示,样品由Fe、O、N、C、Au元素组成,表明Au NPs@Fe-MIL-88复合物的制备成功的。
由图5 B可知,Fe 2p区域拟合为三个峰,出现在711.2 eV、716.2 eV和724.5 eV处的峰为Fe
1.4 聚丙烯酰胺凝胶(PAGE)电泳表征
DNA组装过程通过聚丙烯酰胺凝胶电泳(PAGE)实验得到验证。在图6中,条带M代表DNA分子量标记(25-500 bp),用于对比其它DNA分子的长度。条带1代表单链的mDNA;条带2代表OTA aptamer;条带3代表Primer probe;条带4代表Padlock probe;条带5代表条带1和条带2杂交,迁移速率的降低,表明mDNA、OTA aptamer链可以杂交;条带6代表由条带1和条带3杂交,迁移速率明显降低,表明mDNA链可以与Primer probe完全杂交;条带7代表由条带3和条带4杂交,迁移速率明显降低,表明Primer probe可以与Padlock probe杂交;而条带8代表由条带3和条带4杂交且通过RCA反应,与条带7对比,电泳槽内有分子量更大的物质生成,表明Primer probe可以与Padlock probe杂交且进行滚环扩增反应。通过上述这些明显的电泳表征结果表明本研究实验的序列设计是成功的。
1.5 电动电势(Zeta potential)表征
为了探究DNA链与传感平台-氨基磁珠的连接效率,我们通过检测磁珠在连接DNA链前后的电动电势来证明。由图7可知,在连接mDNA链之前,磁珠的电动电势为-14.84 mV;而在将mDNA修饰到磁珠表面以后,电动电势为-24.10 mV。电动电势前后的巨大差异表明,mDNA链可以高效的连接MBs。
2 实验可行性
实验设计的可行性通过一系列的控制实验得到了验证。图8 A显示在没有OTA(a)和mDNA(b)的情况下,只能检测到较低的电化学信号;同时没有经过RCA反应时(c),检测到的电化学信号也偏低。相反,在没有OTA aptamer(d)和存在目标OTA(e)的情况下,可以检测到较高的电化学信号。图8 B为响应信号数据的柱状图,便于更直观的对比各种实验条件下的差距。通过这些对照实验验证了实验方案的可行性。
3 实验条件的探索
在构建传感器的过程中,由于DNA链连接效率是一定的,因此,在实际加入量与理论计算值之间存在差距。为了节省构建传感器的成本,我们优化了加入的滚环链Primerprobe的浓度。图9显示,随着Primer probe链浓度的增加,传感器的响应信号也在增加,在0.8 μmol/L时,电流响应的I值保持稳定,意味着Primer probe链的浓度达到了最高。因此,在进一步的实验中,本文选择Primer probe链的浓度为0.8 μmol/L。
在RCA反应制备滚环的过程中,由于原料、酶等因素的影响,滚环扩增反应的时间是一定的。因此,我们优化了滚环扩增的时间。图10显示,随着RCA时间的增加,传感器的响应信号也在增加,在50 min时,电流响应的I值保持稳定,意味着RCA过程基本结束。因此,在进一步的实验中,本文选择RCA的时间为50 min。
在传感器中,OTA与OTA aptamer的识别过程是传感器产生信号差的关键步骤。为了探究该步骤的时间,本文优化了OTA的反应时间。图11显示,随着OTA加入时间的增加,传感器的响应信号也在增加,在60 min时,电流的响应值达到最高,意味着OTA与OTA aptamer的反应完全。因此,在进一步的实验中,本文选择OTA的反应时间为60 min。
电化学法测量步骤中,PBS缓冲溶液的pH值可能会影响Fe-MIL-88的响应电流,为了获得最佳性能,探索了pH值与响应电流之间的关系。图12显示,随着缓冲溶液的pH值的改变,传感器的响应信号先增加后减小,并在pH=7.0时,电流响应的I值达到最高,意味着pH=7.0为Fe-MIL-88的响应的最优pH。因此,在进一步的实验中,本文选择缓冲溶液的pH为7.0。
4 传感器对OTA的响应性能
为了验证提出的传感器可用于OTA的定量分析,在最佳的反应条件下,设计的双模态传感器被用于检测不同浓度的OTA,证明了传感器在量化分析物方面的潜力。图13 A展示了传感器对不同浓度的OTA的DPV电流响应。随着OTA浓度的增加,可以启动更多的RCA反应,产生更多的MOFs结合位点,导致Fe-MIL-88的峰值电流逐渐增加(图13 B)。此外,从图13B的校正曲线可以看出,在1 fg/mL-250 ng/mL的范围内,电流响应与OTA浓度有良好的关系。得到的OTA的检测线性方程为I=3.59lgc+40.39(R
5 传感器的稳定性
为了验证传感器的稳定性,我们分别用电化学法和比色法来重复实验,然后分别测量得到10组数据。结果表明,我们设计的传感器电化学检测值波动幅度较小,具有较高稳定性,平均电流值为50.91 μA,RSD为1.81% (图15 A);比色法检测值同样波动较小,具有较高稳定性,平均吸光度值为2.05,RSD为1.65% (图15 B)。通过对该传感器的稳定性评价,证实了该传感器在双模态下都具有较高的稳定性和准确性。
6 传感器的选择性
由于选择性是评估生物传感器的重要因素,采用OTB(赭曲霉毒素B)、ZEN(玉米赤霉烯酮)、FB1(伏马毒素)、AFB1(黄曲霉毒素)与本发明研究的OTA来评估传感器的选择性。图14表明,尽管其他毒素的浓度(1000 ng/mL)比OTA(100 ng/mL)的浓度高得多(10倍),但它们的响应电流比却比OTA的小得多,几乎与空白一致。干扰物质对目标检测的影响可以忽略不计,突出了所提出的传感器的良好的选择性。
7 回收率的测定
本实验在最优的条件下,我们采用标准加入法,在稀释了50倍的红葡萄酒中,通过加入三种水平的OTA溶液(100、10、0.1 ng/mL)来测试传感器的准确性和可靠性。结果表明,回收率在98.3%至105.0%之间(表3)。这些结果表明,所提出的传感器适用于真实样品的检测。
表3 红葡萄酒样品中OTA的回收率的测定
8 与商业化酶联免疫法(ELISA)的比较
采用商业化酶联免疫法试剂盒进行了回收率的测定,并将测定结果与该传感器的测定结果进行比较,以评估该传感器的检测可信度。图16 A所示,随着OTA浓度的增加,试剂盒的吸光度也相应增加。线性方程为A=0.05c+0.39 (R
表4 研制的传感器与ELISA试剂盒检测玉米、麦子样品中OTA的比较
将DNA组装在磁珠表面上,利用OTA核酸适配体识别OTA,RCA实现信号放大,使用Fe-MIL-88催化H
尽管已经示出和描述了本发明的较佳实施例,本领域的普通技术人员应当理解不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰仍然视为本发明的保护范围。
- 一种检测赭曲霉毒素A的荧光生物传感器及其制备方法和应用
- 一种检测赭曲霉毒素A的生物传感器、其制备方法与使用该传感器检测赭曲霉毒素A的方法
- 一种赭曲霉毒素A降解酶及其应用和检测赭曲霉毒素A的免疫层析试纸条
