一种注射剂用玻璃包装容器性能快速预评价方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及药包材研究技术领域,尤其涉及一种注射剂用玻璃包装容器性能快速预评价方法。
背景技术
注射剂指可直接注入人体的给药剂型,为高风险制剂,包括溶液剂、注射用无菌粉末、注射用浓溶液,以及注射用微球、纳米乳和脂质体等特殊注射剂。药用玻璃容器是注射剂尤其是小容量注射剂最常用的包装形式,相比于其他材质(如塑料包装中大量的添加剂),它配方简单,生物安全性更高,绝对阻隔水气与氧气,保护性能优,并且高度透明,可经受高温灭菌,除热源过程,耐冷冻。这些特性决定了药用玻璃容器在注射剂包装中占据了不可替代的重要地位。最早2010年,由于碳酸氢钠注射液中可能存在的玻璃薄片,召回了约300批产品(每批100000支玻璃小瓶),规模较大,给企业带来了巨大损失。10年至今,FDA有多起由于玻璃包装质量问题而导致的召回事件,近5年来,共有21起,主要的问题是在玻璃容器包装的药品中发现了肉眼可见玻璃颗粒或是浑浊的硅胶等。我国也有多起类似问题的报道,涉及多种注射液。针对上述问题,国内外均基于药品申报要求提出药品生产企业需开展药物与包装容器的相容性研究以保证药品的安全有效。而相容性研究周期长,一旦结果不理想,需要重新选择包装继续开展相关研究,会更加耗时、耗力。尤其是注射剂为一种高风险制剂,相容性研究内容更加复杂。在相容性研究前,需对不同的玻璃包装容器进行初筛;在相容性研究后,对于检测同一供应商来源的玻璃容器性能的稳定性,以避免“相容性一次性”问题也十分重要,这就意味着需要对玻璃容器性能进行预评价。
现有并无系统性的性能评价方法,主要是以现行标准进行检验,而现行标准项目多、操作复杂、检测周期长,且结果难以区分不同产品性能的优劣。因此,本领域的技术人员致力于开发一种注射剂用玻璃包装容器性能快速预评价方法,以解决上述现有技术的不足。
发明内容
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是目前针对于注射剂用玻璃包装容器尚无系统性性能预评价方法,现有的检验方法需进行的项目多、检测周期长的缺陷问题。
为实现上述目的,本发明提供了一种注射剂用玻璃包装容器性能快速预评价方法,所述方法包括以下步骤:
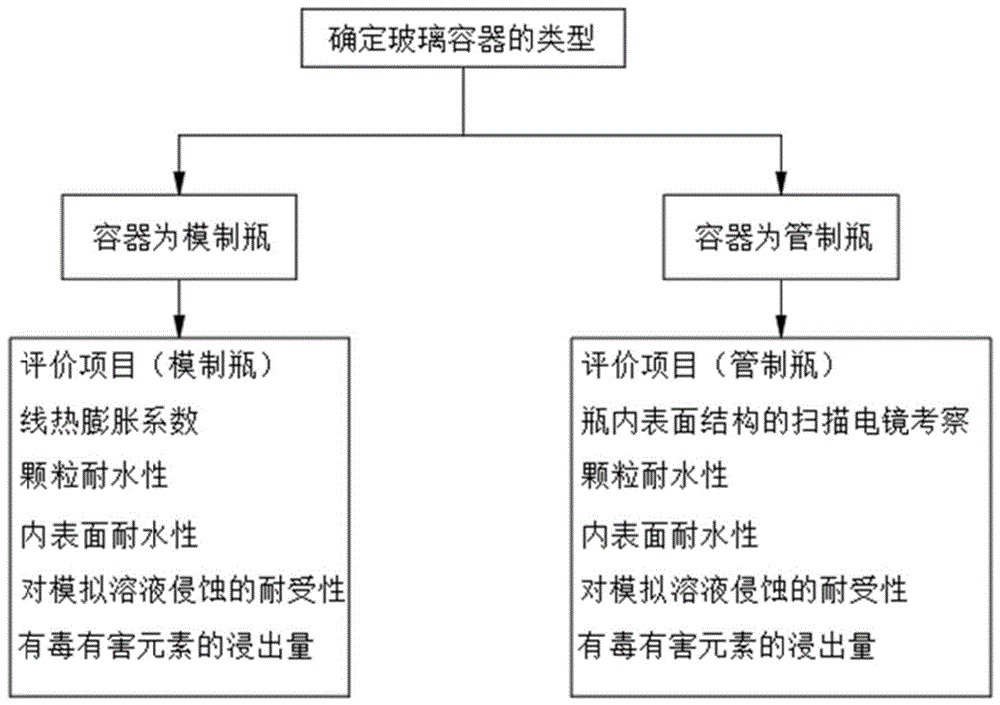
步骤1、确定被检测的注射剂用玻璃包装容器类型;
步骤2、根据容器类型确定需要具体测定的关键性能参数;
步骤3、根据项目类型对样品进行实验测定及数据收集整理;
步骤4、根据数据进行分析评价,得出最后结论,确定各编号样品性能评估结果,将玻璃包装容器与注射液进行最终相容性实验,验证结论;
进一步地,所述玻璃包装容器类型按照生产工艺的不同分为模制瓶、管制瓶;所述模制瓶制作工艺为一次成型;所述管制瓶以玻璃管为原料,借助火焰热二次加工成型;
进一步地,所述性能项目包括三大类,分别为物理性能研究、化学稳定性能研究、安全性能研究;
所述物理性能研究的项目包括扫描电镜观察内表面结构、线膨胀系数;所述化学稳定性能研究的项目包括颗粒耐水性、内表面耐水性、对模拟溶液侵蚀的耐受性;所述安全性能研究的项目为有毒有害元素浸出量;
所述扫描电镜观察内表面结构为扫描电镜观察玻璃容器的内表面的形貌,步骤为:将样品清洗干净,于不同部位切割制取边长约为5mm的矩形样品,用低流速的水冲洗后,再用乙醇超声清洗5分钟,自然晾干,用扫描电镜进行检测,同法制备空白样品(未接触过药液的玻璃容器)进行对比;电压:5KV,观测模式:二次电子模式;观察瓶壁内测扫描电镜图像;如果瓶壁出现大面积的凸起样形貌,则标识为警示样品;因为玻璃容器内壁出现的“凸起”形貌为二次加工生产过程中组分挥发后凝结于瓶壁的产物,表明二次成型过程中组分挥发严重,导致玻璃容器更易被侵蚀,存在与药物不相容的风险;
所述线膨胀系数可反应玻璃的配方组成;所述颗粒耐水性、内表面耐水性可分别表征玻璃材质与容器本身的化学稳定性、有毒有害元素浸出量可反应玻璃容器的安全性、通过扫描电镜观察玻璃表面结构可反应生产工艺对玻璃容器性能的影响;
所述颗粒耐水性测定需将样品制备为一定尺寸的颗粒后再进行测定,表征玻璃材质化学稳定性;颗粒耐水性测定的测定结果,钠钙玻璃每1g玻璃颗粒耗用盐酸滴定液(0.02mol/L)的体积应为0.10~0.80ml,硼硅玻璃每1g玻璃颗粒耗用盐酸滴定液(0.02mol/L)的体积应≦0.09ml;
所述内表面耐水性是一定材质的玻璃制成容器后的化学稳定性,内表面耐水性的测定结构应均符合HC1级,且测定结果应小于限度的90%;对于经过硫酸铵中性化处理的样品,处理后的样品内表面耐水性均较优,应提前消除表面结构对于内表面耐水性评估的影响,再次进行测定,如果试验结果高于原始内表面的试验结果5倍以上,则认为这些样品经过表面处理。如果高于原始内表面的试验结果30倍以上,则认为这些样品经过过度表面处理,表明产品本身材质不好,依靠过度中性化处理满足标准要求,反而进一步影响样品的耐久性,易产生脱片,不符合要求;
所述对模拟溶液侵蚀的耐受性研究需将包装容器灌装不同种类模拟溶液进行实验并测定,进一步根据表征玻璃容器的化学稳定性以及玻璃浸出物对所包装溶液质量的潜在影响;所述模拟溶液与预包装药品配方组成应相近;
所述对模拟溶液侵蚀的耐受性研究的步骤为:1)将玻璃容器清洗后沥干水分;2)模拟药品生产工艺中烘干除热源过程,将药用玻璃容器加入0.7ml水,300℃烘干30min;3)灌装与药品性质相近的模拟溶液4)模拟药品的生产工艺中终端灭菌的过程,121℃灭菌1h;5)80℃条件下放置1、2、3、5、7、10天;6)测定药用玻璃容器被侵蚀情况以及浸出物对模拟溶液质量的影响;测定内容包括模拟溶液pH值变化,玻璃脱片检测、ICP-OES测定玻璃主成分元素Si、B、Al、Na、K、Ca的迁移量、扫描电镜与亚甲基蓝染色观察玻璃容器内表面被侵蚀情况;
如发现玻璃脱片,则终止试验,该玻璃容器被淘汰;如未发生玻璃脱片,则进一步进行亚甲基蓝染色、扫描电镜观察内表面被侵蚀情况,ICP-OES测定玻璃主成分元素Si、B、Al、Na、K、Ca的迁移量评价玻璃容器发生脱片的倾向性,如果玻璃表面被亚甲基蓝明显着色或扫描电镜可见内表面明显侵蚀或是玻璃主成分元素Si、B、Al、Na、K、Ca元素的迁移量随时间的延长呈线性增加,则表明玻璃容器有发生玻璃脱片的倾向,存在与药物不相容的风险,应谨慎选择。
所述亚甲基蓝染色步骤为:将样品清洗干净,排干瓶内残留的水分,灌装0.5%亚甲蓝溶液,静置20分钟后倒出,用低流速水灌入瓶内再倒出,反复5~10次,至样品内表面蓝色不变为止;
所述扫描电镜观察内表面被侵蚀情况操作步骤同上;
扫描电镜试验应注意管制瓶的取样部位,不同部位的耐侵蚀性能不同,注射剂瓶正置放置,分三个部位取样,玻璃安瓿平置放置,取四个部位取样;取样位置示意图如图3所示;
所述安全性能研究为模拟试验后,进一步通过ICP-MS法测定As、Sb、Pb、Cd、Ce、Li、Ba、Mg、Zn、Fe、Mn、Ti、Co、Cr等元素的迁移量,参考ICH Q3D和《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则》中的附件6;将药品中已建立PDE值的30%定义为控制阈值,对检测到的元素杂质水平的显著性进行衡量;如果元素的迁移量随时间变化有明显升高的趋势,且每日最大摄入量超过30%PDE值,则不通过预评价;
进一步地,所述模制瓶需进行测定的性能项目有线热膨胀系数、颗粒耐水性、内表面耐水性、对模拟溶液侵蚀的耐受性、有毒有害元素浸出量;所述管制瓶需进行测定的性能项目有扫描电镜观察内表面结构、颗粒耐水性性、内表面耐水性、对模拟溶液侵蚀的耐受性、有毒有害元素浸出量;
采用以上方案,本发明公开的一种注射剂用玻璃包装容器性能快速预评价方法,具有以下优点:
(1)本发明的一种注射剂用玻璃包装容器性能快速预评价方法,针对于不同玻璃容器的特点确定其相应需要研究的关键性能指标,更精准的获取不同批次、厂家的同类型玻璃容器性能,方便进行优劣产品区分;
(2)本发明的一种注射剂用玻璃包装容器性能快速预评价方法,对于可能会最终影响与药物相容性研究结果的五项关键性能指标相关研究方法进行了改进与提升,使其更贴合不同种类玻璃包装容器的性能评价要求,检测周期相较于现有检验短,测定更加灵敏;
综上所述,本发明公开的一种注射剂用玻璃包装容器性能快速预评价方法,根据不同玻璃包装容器的特点,研究可能影响与药物相容性结果的关键性能指标,建立注射剂用玻璃包装容器性能预评价方法,对不同种类玻璃包装容器性能进行评价,并通过与药物的相容性研究结果验证了方法的可行性;检测周期相较于现有检验短,每项指标监测过程操作相对简单。
以下将结合具体实施方式对本发明的构思、具体技术方案及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
图1为本发明注射剂用玻璃包装容器性能快速预评价方法的流程图;
图2为对模拟溶液侵蚀的耐受性研究步骤示意图;
图3扫描电镜试验管制瓶取样部位示意图(左管制注射剂瓶,右玻璃安瓿);
图4为实施例1中21批样品线热膨胀系数的测定结果;
图5为实施例1中121℃颗粒耐水性测定结果;
图6为实施例1中钠钙玻璃输液瓶被侵蚀后亚甲蓝染色图;
图7为实施例1中样品表面被侵蚀后扫描电镜图;
图8为实施例1中以3%枸橼酸钠为模拟溶液不同样品Si元素浸出量;
图9为实施例1中以3%枸橼酸钠为模拟溶液不同样品Al元素浸出量;
图10为实施例2中不同中硼硅玻璃安瓿厂家样品扫描电镜结果;
图11为实施例2中内表面耐水性测定结果;
图12为实施例2中样品被侵蚀后典型的亚甲基蓝染色结果图;
图13为实施例2中样品被侵蚀后典型的扫描电镜观察图;
图14为实施例2中模拟试验B元素迁移结果;
图15为实施例2中模拟试验Si元素迁移结果。
具体实施方式
以下介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,这些实施例为示例性描述,本发明的保护范围并非仅限于文中提到的实施例。
如若有未注明具体条件的实验方法,通常按照常规条件,如相关说明书或者手册进行实施。
为方便理解,并结合药用玻璃容器筛选实际需要,以多批次药用玻璃容器的筛选,选择性能较优的产品进行介绍;
如图1~15所示,本发明的注射剂用玻璃包装容器性能快速预评价方法,其中,
试验用样品:21批次不同厂家的钠钙玻璃输液瓶(模制瓶)、5个厂家6批中硼硅玻璃安瓿(管制瓶);
下面结合实施例对本发明提供的一种注射剂用玻璃包装容器性能快速预评价方法进行详细说明,
实施例1、对21批次不同厂家的钠钙玻璃输液瓶进行性能预评价
步骤1、钠钙玻璃输液瓶(模制瓶);
步骤2、针对于模制瓶,选定研究项目为:线热膨胀系数、颗粒耐水性、内表面耐水性、对模拟溶液侵蚀的耐受性以及有毒有害元素浸出量;
步骤3、根据项目类型对样品进行实验测定及数据收集整理;
(1)对于物理性能研究中线热膨胀系数的测定,可间接反应玻璃的配方组成,
21批样品膨胀系数的测定结果如图4所示,样品间差异明显,对以上样品进行成份进行分析,分析结果如表1所示,发现膨胀系数偏大的样品普遍氧化硅含量偏低,Na、Ca、Mg、Ba氧化物含量偏高,致使结构网络易发生解聚,网络连接程度降低,最终导致样品化学稳定性差,与药物不相容的风险增加;
表1钠钙玻璃输液瓶线热膨胀系数与成分结果关联性
(2)化学稳定性能研究
耐水性测定分为颗粒耐水性与内表面耐水性;
①颗粒耐水性:测定结果如图5所示;通过图片数据发现21批样品就结果差异明显,将数据与线热膨胀系数测定结果及玻璃成分结合观察,发现样品颗粒耐水性与其膨胀系数、成分组成有一定相关性;
②内表面耐水性:为保证评估的合理性,结合钠钙玻璃输液瓶的生产工艺,会通过硫酸铵中性化处理,处理后的样品内表面耐水性均较优,且不同样品间无差异;故应提前消除表面结构对于内表面耐水性评估的影响,使用40%氢氟酸溶液-2mol/L盐酸溶液(1:9)的混合溶液预消除内表面中性化处理的影响,再次进行测定。如果高于原始内表面的试验结果30倍以上,则认为这些样品经过度表面处理,表明产品本身材质不好,依靠过度中性化处理满足标准要求,反而进一步影响样品的耐久性,易产生脱片;如下表2所示的样品则存在过度的表面处理的问题,存在与药物不相容的风险,不符合要求;
表2钠钙玻璃输液瓶内表面耐水性测定结果
钠钙玻璃输液瓶经过线热膨胀系数、颗粒耐水性的测定以及内表面耐水性测定,编号1-5的样品质量较优,可优选并进行后续的预评价试验,其他批次的样品未通过与评价,可不再进行后续试验;本次实例只是为进一步说明该方法的合理性,以下步骤仍对所有样品开展了试验;
③对模拟溶液侵蚀的耐受性测定:使用3%枸橼酸钠为模拟溶液,对21批钠钙玻璃输液瓶进行耐侵蚀性能研究(可根据玻璃容器预包装药品的处方及生产工艺设计模拟溶液及条件),设定侵蚀温度为80℃,加热时间为24h,溶液初始pH值为8.0;样品均未见玻璃脱片,编号为11#、14#、15#的样品可见亚甲基蓝的明显着色,且扫描电镜可见明显的被侵蚀痕迹(图6、图7);测定主要成分Si、Al元素的迁移量,放置1d后,各批次样品均有一定的迁移,但优选的5批次样品迁移量远小于其他批次(图8、图9);进一步测定溶液pH值,样品编号14#、19#及21#分别增加1.1、0.8及1.0,存在与药物不相容的风险;总之,经过模拟试验,编号1-5的样品耐侵蚀性能较优,进一步证明其可优选;
(3)安全性能研究:ICP-MS法测定As、Sb、Pb、Cd、Ce、Li、Ba、Mg、Zn、Fe、Mn、Ti、Co、Cr元素的迁移量,均未检测出,结果未列出;
步骤4将数据进行对比分析,得出结论为:编号1-5的样品质量较优,经过系列预评价后,性能较好,可优选经相容性评估后用于包装注射剂;
将上述21批样品最后与氯化钠、葡萄糖注射液开展相容性研究验证,各样品与葡萄糖注射液的相容性均较优;而对于氯化钠溶液,与性能评估较差的样品存在不相容风险;
实施例2、对5个厂中硼硅玻璃安瓿进行性能预评价
步骤1、中硼硅玻璃安瓿(管制瓶);
步骤2、针对于管制瓶,选定研究项目为:扫描电镜观察内表面结构、颗粒耐水性、内表面耐水性、对模拟溶液侵蚀的耐受性及有毒有害元素浸出量;
步骤3、根据项目类型对样品进行实验测定及数据收集整理;
(1)对于物理性能研究中,扫描电镜对内表面结构的观察,扫描图如图10所示,部分样品玻璃表面存在有大小不一的“凸起”原始缺陷;产生大量此类缺陷,表明管制瓶生产过程中温度较高,部分易挥发组分相对更多地挥发冷却成核,玻璃容器结构发生改变,最终增加玻璃容器被侵蚀的风险,进一步增大其与注射液不相容的风险;
样品1、2、3原始样品内表面有大量密集的“凸起”形貌,存在被进一步侵蚀导致与注射液不相容的风险,标识为警示样品;样品4、5玻璃表面原始缺陷较少,可优选;
(2)进一步对于化学稳定性能研究中颗粒耐水性、内表面耐水性、对不同模拟溶液的耐侵蚀性能的测定;
颗粒耐水性测定结果均较优,0.03ml-0.05ml之间,结果未列出
内表耐水性测定结果虽均小于限度值的90%(该规格样品限度值0.8ml),但是样品5的内表面耐水性远优于其他样品(图11);
进一步模拟药品生产工艺中烘干除热源过程,将药用玻璃容器加入0.7ml水,300℃烘干30min;灌装10%氯化钾溶液,模拟药品的生产工艺中终端灭菌的过程,121℃灭菌1h;5)80℃条件下放置1、5、10天;
样品1、2、3均可见脱片,扫描电镜下可见明显被侵蚀形貌;样品4亚甲基蓝可明显着色,对比样品5主成分元素可见明显迁移,pH值明显增加(图12-15);
(3)安全性能研究
ICP-MS法测定As、Sb、Pb、Cd、Ce、Li、Ba、Mg、Zn、Fe、Mn、Ti、Co、Cr元素的迁移量,可检出微量的As、Li、Ce元素,均为玻璃容器生产过程中的添加剂引入,如AS
步骤4、将上述数据进行对比分析,得出厂家5样品属“性能较优,建议选择”,将各厂家样品与氯化钾注射液进行相容性验证,结果样品1-4均与氯化钾注射液不相容,样品5与氯化钾注射液相容性最好;
表3结果统计表
“/”表示无需再进行进一步的检测
根据实施例1~2的相关分析可知,本发明的一种注射剂用玻璃包装容器性能快速预评价方法可根据不同玻璃包装容器的特点,研究可能影响与药物相容性结果的关键性能指标,对不同种类玻璃包装容器性能进行针对性评价,建立注射剂用玻璃包装容器性能预评价方法,所用测定方法相较于现有方法进行了缩短周期、提高实验数据灵敏度的改进,并对性能评价结果进行后期验证;检测周期相较现有检验短,每项指标监测过程操作相对简单。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思做出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的试验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 一种评价玻璃微珠表面预负载纳米二氧化钛量的方法
- 一种采用玻璃材料基因方法预测激光玻璃性能的方法
- 一种玻璃纤维复合材料湿热性能的快速评价方法
- 一种利于发动机机油快速老化评价和性能评价的方法
