一种基于凝集反应的检测试纸及其测试方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及体外诊断技术领域,尤其是涉及一种基于凝集反应的检测试纸及其测试方法。
背景技术
免疫层析技术主要借助免疫层析试纸条完成,免疫层析技术不仅操作简便、检测快速、特异性强、稳定性好,而且携带方便,已广泛应用于临床诊断、食品安全、药物检测、环境污染等领域。
目前市面上的免疫层析试纸要有胶体金免疫层析试纸和荧光免疫层析试纸等,市面上的试纸条大多为配套定量分析仪器使用的定量检测试纸条,并且,这些试纸条都是通过测试线信号的增大以实现检测的;也正是基于上述信号放大的原理,传统免疫层析试纸在做定性或者半定量检测时,其灰区较大,在临床上使用时容易引起假阴性或者假阳性结果,降低测试的准确度。
发明内容
为了降低免疫层析试纸的测试灰区,提高免疫层析试纸的灵敏度以及定性和定量的准确性,本申请提供一种基于凝集反应的检测试纸及其测试方法。
第一方面,本申请提供一种基于凝集反应的检测试纸的测试方法,采用如下的技术方案:
一种基于凝集反应的检测试纸的测试方法,包括如下步骤:
预处理步骤:制备含有检测样本的样本混合液,向所述样本混合液中引入被信号标志物标记的一抗,由此得到层析液;
层析步骤:使所述层析液通过层析到达信号检测区,所述信号检测区设置有用于捕获所述一抗的二抗,且,在所述层析液到达所述信号检测区域之前向所述层析液中引入双特异性抗体,所述双特异性抗体能够特异性捕获目标抗原,且,所述双特异性抗体能够特异性捕获所述层析液中的凝集化物料,所述凝集化物料为可发生凝集反应的物料;
检测步骤:对所述信号检测区进行检测,读取属于所述信号标志物的实测信号值,将所述实测信号值与所述信号标志物的标准信号值进行比对,基于比对结果对所述目标抗原在所述检测样本中的含量情况进行估算,所述标准信号值为所述信号标志物在标准浓度下测得的信号值。
在层析液到达显色区域之前向其中加入凝集化抗体,凝集化抗体捕获目标抗原发生凝集反应,而凝集反应得到的凝胶化物料会随着层析过程的进行继续向靠近显色区域处移动,并且凝集反应得到的凝胶化物料随着层析过程的进行其颗粒粒径逐渐增加,颗粒粒径较大的凝胶化物料会逐渐堵塞向显色区域移动过程中的供层析液和凝胶化物料通过的可用孔道,随着层析过程的进行,降低一抗和信号标志物被层析至信号检测区域处的浓度,使信号检测区域中的二抗能够结合的一抗和信号标志物降低,从而降低荧光信号的强度;通过与标准信号值做对比得到反应样本中的目标抗原的含量,从而用于制成定性、定量或者半定量的检测试剂。
凝集反应是一种血清学反应;颗粒性抗原与相应抗体结合,在有电解质存在的条件下,经过一定时间,出现肉眼可见的凝集小块。具体地,凝集反应可分为直接凝集反应和间接凝集反应两类。
相对于传统层析方法中通过信标在测试线处的富集从而显出光信号,本申请的检测方法并不是和传统的试剂盒一样存在信号放大的效果;本测试方法通过凝集反应生成的凝胶化物料堵塞通向信号检测区域的孔道,使信号标志物不能顺利到达信号检测区中,是信号从有到无的过程;并且在堵塞孔道的过程中,一个孔道被堵塞就可以截留大量的信号标志物,并且堵塞程度与截留的信号标志物的量并不是简单的1:1的关系,因此,本申请的检测方法存在截留信号放大的机理,相对于现有技术中使用的免疫层析方法而言检测灰区更窄,灵敏度更高,将上述检测方法应用在试剂盒中后,相对于传统试剂盒的灵敏度会有数量级的提升。
并且,本申请中的测试方法无需使用单克隆抗体,并且重新引入的双特异性抗体的成本也不高,能够降低该测试方法的物料成本;并且,由于本测试方法无需进行偶联单克隆抗体的操作,能够降低应用此方法的试剂盒的生产工序,缩短研发周期;传统试剂盒在研发过程中往往需要投入很高的人力和物力在单克隆抗体等几种核心物料的筛选上,因此,应用本申请检测方法的试剂盒最终的成本可比传统方式降低60%-80%甚至更多。
优选地,所述目标抗原发生所述凝集反应的情况包括:
所述目标抗原通过与所述凝集化物料发生直接凝集反应而形成凝胶化物料;和/或,所述凝集化物料发生间接凝集反应而形成凝胶化物料。
优选地,所述目标抗原包括D-二聚体、肌钙蛋白、脑钠肽、C反应蛋白、降钙素原、白介素6、血清淀粉样蛋白A等中的任意一种。
优选地,所述凝集化物料包括红细胞、聚苯乙烯微球中的任意一种;当所述凝集化物料为聚苯乙烯微球时,聚苯乙烯微球上耦合有链霉亲和素或抗体,所述双特异性抗体通过与所述链霉亲和素或抗体发生免疫反应实现对所述聚苯乙烯微球的捕获。
当所述凝集化物料为红细胞时,所述目标抗原与所述凝集化物料发生的凝集反应是直接凝集反应。当所述凝集化物料为聚苯乙烯微球时,双特异性抗体通过与链霉亲和素或抗体发生免疫反应实现对聚苯乙烯微球的捕获是间接凝集反应。
本申请中的测试方法适用于检测所有能参与发生凝集反应的目标抗原,只要选取合适的凝集化物料,就能够在凝集反应生成的凝胶化物料的作用下,在层析过程中将信号标志物截留,降低信号检测区信号标志物的检测强度,实现对目标抗原的定性、定量检测。
第二方面,本申请提供一种基于凝集反应的检测试纸,采用如下的技术方案:
一种基于凝集反应的检测试纸,所述检测试纸包括加样区和层析区,所述加样区与所述层析区相连接,沿远离所述加样区的方向上,所述层析区上依次设有扩散区和信号检测区;
所述加样区设置有被信号标志物标记的一抗,所述信号检测区设置有用于捕获所述一抗的二抗,在利用所述检测试纸进行检测时,含有检测样本的层析液从所述加样区进入所述扩散区并经由所述扩散区向所述信号检测区层析;
所述检测试纸还包括双特异性抗体,所述双特异性抗体能够特异性捕获所述层析液中的凝集化物料,所述凝集化物料为可发生凝集反应的物料;所述双特异性抗体设置在所述加样区和/或所述扩散区。
通过选用能够发生凝集反应的凝集化物料与目标抗原反应生成凝胶化物料,降低传递到信号检测区的目标抗原的浓度,降低信号检测区的无需像现有技术中的检测试纸一样筛选特定的单克隆抗体来实现对目标抗原的检测,不仅能够降低检测试纸的应用工序、降低应用成本;而且,在实际的操作过程中,偶联单克隆抗体的难度最大、容错率较低、偶联效果也最不稳定,不利于检测试纸的稳定性和检测准确性,而本申请中的检测试纸却能够克服上述检测不稳定的问题,显著提高测试准确性。
优选地,所述双特异性抗体的浓度为0.1-5μg/mL
通过控制双特异性抗体的浓度,在实现对目标抗原定性分析的同时,也能够实现定量、半定量分析。
优选地,所述一抗包括鸡IgY、兔IgG中的任意一种。
优选地,所述一抗的浓度为0.1-5μg/mL。
通过控制一抗的浓度,使转移到信号检测区上的一抗能被二抗充分地检测到,提高测试灵敏度。
优选地,所述信号标志物包括胶体金、胶体碳、荧光微球、彩色微球等免疫层析标记物中的任意一种。
本测试方法中使用的信标物质来源易得,降低测试方法的应用成本。
优选地,所述二抗包括兔抗鸡IgY、羊抗兔IgG中的任意一种。
优选地,当所述一抗为鸡IgY时,所述二抗为兔抗鸡IgY;当所述一抗为兔IgG时,所述二抗为羊抗兔IgG。
优选地,所述层析区的孔隙率沿所述层析液的层析方向逐渐减小。
当层析区的孔隙率沿着层析液的层析方向逐渐减小时,凝胶化物料随着层析过程的进行逐渐被堵塞在层析区中,从而降低一抗层析到信号检测区处的含量,进一步增强因凝胶化物料的出现而使信号检测区的测试线处出现光信号减弱幅度较大,测试效果显著。
优选地,所述层析区的细孔孔径为5-12μm。
优选地,本申请提供的一种基于凝集反应的检测试纸,包括PVC底板1和设置于所述PVC底板1上的样品垫2、结合垫3、NC膜4和吸水垫5,所述样品垫2、所述结合垫3、所述NC膜4与所述吸水垫5两两依次搭接,所述NC膜4上设置有测试线41;所述样品垫2和所述结合垫3对应所述加样区,所述结合垫3与所述测试线41之间的所述NC膜4对应所述扩散区,所述测试线41对应所述信号检测区。
附图说明
图1是本申请各实施例中检测试纸的结构示意图。
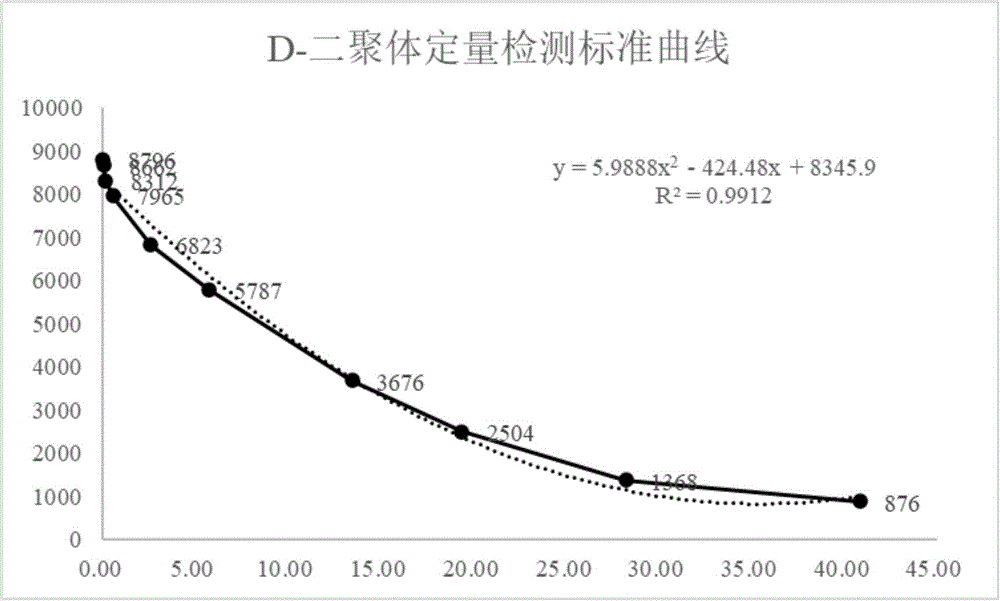
图2是实施例1中的D-二聚体定量检测标准曲线图。
附图标记说明:
1、PVC底板;2、样品垫;3、结合垫;4、NC膜;41、测试线;5、吸水垫。
具体实施方式
为了更好地理解和实施,下面将结合实施例对本发明的技术方案进行清楚、完整地描述。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在限制本发明。
除非另有说明,否则在说明书和权利要求书中使用的表达成分的量、反应条件等的所有数值被理解为在被术语“约”修饰。因此,除非有相反指示,否则在这里阐述的数值参数是能够根据需要获得的所需性能来变化的近似值。
本文中所用的“和/或”是指所提及的要素之一或全部。
本文中所用“包括”和“包含”涵盖只有所提及要素的情形以及除了所提及要素还存在其它未提及要素的情形。
本发明中所有百分比均为重量百分比,另有说明的除外。
除非另有说明,否则在本说明书中所用的“一”、“一种”、“一个”和“该”意在包括“至少一种”或“一种或多种”。例如,“一组分”是指一种或多种组分,因此在所述实施方案的实施中可能考虑并可能采用或使用多于一种组分。
实施例
在本实施例中,样品垫2和结合垫3的基材均为玻璃纤维膜,NC膜4为德国多利斯的CN140。
实施例1
一种基于信号减弱的检测试纸,如图1所示,包括PVC底板1和设置于PVC底板1上的样品垫2、结合垫3、NC膜4和吸水垫5,样品垫2、结合垫3、NC膜4与吸水垫5两两依次搭接,NC膜4上设置有测试线41;
样品垫2用PBS缓冲液添加蔗糖PEG4000等浸泡处理后于干燥箱中37℃恒温干燥4h,备用;
结合垫3用BB缓冲液添加海藻糖、表面活性剂S9、吐温20等浸泡处理后烘干,结合垫烘干后包被0.1-5μg/mL的双特异性抗体和0.1-5μg/mL鸡IgY-胶体金偶联物,于干燥箱中37℃恒温干燥4h,备用;
测试线41包被0.1-5μg/mL兔抗鸡IgY,于干燥箱中37℃恒温干燥4h,备用
检测试纸中,结合垫3上的孔道尺寸大于NC膜4中的孔道尺寸,NC膜4上的孔道直径为5-12μm。
一种基于信号减弱的检测试纸的测试方法:
预处理步骤:将全血样本作为样本混合液滴加到样品垫2上,样本混合液中D-二聚体的浓度为0.00、0.03、0.11、0.52、2.56、5.69、13.42、19.35、28.21、40.87μg/L,每个浓度分别测试三次;
层析步骤:含有D-二聚体的全血样本从样品垫2处层析至结合垫3处,在双特异性抗体的作用下全血样本中的红细胞与D-二聚体发生凝集反应从而形成具有密集的空间立体结构的凝胶化物料;随着层析反应的进行,凝胶化物料会逐渐堵塞结合垫3与NC膜4搭接处以及结合垫3与测试线41之间的NC膜4,使能够通过层析作用扩散到测试线41处的鸡IgY-胶体金偶联物的浓度降低;
检测步骤:扩散到测试线41处的鸡IgY-胶体金偶联物能够被兔抗鸡IgY捕获,读取属于鸡IgY-胶体金偶联物的实测信号值,将实测信号值与信号标志物的标准信号值进行比对,基于比对结果对D-二聚体的含量情况进行估算。
具体地,标定样本混合液中D-二聚体浓度为0.00μg/L的检测光信号值作为标准值,以浓度为横坐标,以三次测试显色信号的均值作为纵坐标建立散点图,拟合标准曲线,通过计算得到检出限低至0.026μg/mL,线性范围为0.026-28.21μg/mL;将含有不同浓度D-二聚体的样本混合液的显色光信号值与上述标准值进行对比,得到样本混合液中D-二聚体的具体含量。本实施例中D-二聚体的定量检测标准曲线图如图2所示。
实施例2
一种基于信号减弱的检测试纸,如图1所示,包括PVC底板1和设置于PVC底板1上的样品垫2、结合垫3、NC膜4和吸水垫5,样品垫2、结合垫3、NC膜4与吸水垫5两两依次搭接,NC膜4上设置有测试线41;
样品垫2用PBS缓冲液添加蔗糖PEG4000等浸泡处理后于干燥箱中37℃恒温干燥4h,备用;
结合垫3用BB缓冲液添加海藻糖、表面活性剂S9、吐温20等浸泡处理后烘干,结合垫烘干后喷上包被链霉亲和素的聚苯乙烯微球、0.1-5μg/mL的双特异性抗体和0.1-5μg/mL的鸡IgY-胶体金偶联物,于干燥箱中37℃恒温干燥4h,备用;
测试线41上包被0.1-5μg/mL兔抗鸡IgY,于干燥箱中37℃恒温干燥4h,备用;
检测试纸中,结合垫3上的孔道尺寸大于NC膜4中的孔道尺寸,NC膜4上的孔道直径为5-12μm。
一种基于信号减弱的检测试纸的测试方法:
预处理步骤:将血清样本作为样本混合液滴加到样品垫2上,样本混合液中D-二聚体的浓度为0.00、0.03、0.11、0.52、2.56、5.69、13.42、19.35、28.21、40.87μg/L,每个浓度分别测试三次;
层析步骤:含有D-二聚体的血清样本从样品垫2处层析至结合垫3处,在双特异性抗体的作用下聚苯乙烯微球发生凝集反应,具体地,双特异性抗体与链霉亲和素发生免疫反应实现对聚苯乙烯微球的捕获,从而发生凝集反应形成具有密集的空间立体结构的凝胶化物料;随着层析反应的进行,凝胶化物料会逐渐堵塞结合垫3与NC膜4搭接处以及结合垫3与测试线41之间的NC膜4,使能够通过层析作用扩散到测试线41处的鸡IgY-胶体金偶联物的浓度降低;
检测步骤:扩散到测试线41处的鸡IgY-胶体金偶联物能够被兔抗鸡IgY捕获,读取属于鸡IgY-胶体金偶联物的实测信号值,将实测信号值与信号标志物的标准信号值进行比对,基于比对结果对D-二聚体的含量情况进行估算。
具体地,标定样本混合液中D-二聚体浓度为0.00μg/L的检测光信号值作为标准值,以浓度为横坐标,以三次测试显色信号的均值作为纵坐标建立散点图,拟合标准曲线,通过计算得到检出限低至0.027μg/mL,线性范围为0.027-28.11μgμg/mL;将含有不同浓度D-二聚体的样本混合液的显色光信号值与上述标准值进行对比,得到样本混合液中的D-二聚体的含量。
对比例1
使用现有技术中的检测试纸进行测试,检测试纸包括PVC底板1和设置于PVC底板1上的样品垫2、结合垫3、NC膜4和吸水垫5,样品垫2、结合垫3、NC膜4与吸水垫5两两依次搭接,NC膜4上沿层析液层析方向依次设置有T线和C线;
样品垫2用PBS缓冲液添加蔗糖PEG4000等浸泡处理后于干燥箱中37℃恒温干燥4h,备用;
结合垫3用BB缓冲液添加海藻糖、表面活性剂S9、吐温20等浸泡处理后烘干,结合垫烘干后使用划膜喷金仪喷上0.1-5μg/mL的胶体金标记的D-二聚体单克隆抗体结合物,于干燥箱中37℃恒温干燥4h,备用;
在NC膜4中,T线上包被鼠抗人D二聚体单克隆抗体结合物,C线上包被0.1-5μg/mL羊抗鼠IgG,于干燥箱中37℃恒温干燥4h,备用;
检测试纸中,结合垫3上的孔道尺寸大于NC膜4中的孔道尺寸,NC膜4上的孔道直径为5-12μm。
通过测试可以看出,将样本混合液滴加到样品垫2上,经过结合垫3时样本混合液中的D-二聚体与胶体金鼠抗人D-二聚体单克隆抗体结合物结合形成胶体金标记的抗体-抗原复合物;胶体金标记的抗体-抗原复合物随样本混合液继续扩散到NC膜4上,被包被有鼠抗人D-二聚体单克隆抗体结合物的T线(检测线)拦截,捕获胶体金标记的抗体-抗原复合物,形成胶体金标记抗体-抗原-包被抗体的免疫复合物;未被拦截的胶体金标记抗体-抗原-包被抗体的免疫复合物继续上行,与C线(质控线)包被的羊抗鼠IgG结合,指示反应完成。
C线处的信号值相对稳定且不受样本混合液影响,T线处的信号值与样本混合液中D二聚体的浓度成正比,计算T线处与C线处信号值的比值,建立T/C与样本中D二聚体浓度的标准曲线,从而通过检测未知样本的T/C值计算出未知样本中的D二聚体浓度值。
通过计算得到本对比例中D-二聚体的检出限低为0.1μg/mL,线性范围为0.5-10μg/mL。
结合实施例1、对比例1和图1,可以看出,本申请的检测试纸具有更低的检测限和检测灵敏度,检测灰区较大,这是由于,当样本中的D-二聚体与全血样本中的红细胞在双特异性抗体的作用下发生凝集反应时,随着层析反应的进行,凝胶化物料也逐渐向测试线41的方向移动,由于层析过程中凝胶化物料的粒径尺寸不断增加且结合垫3与NC膜4搭接处的孔径尺寸变小,凝胶化物料就被堵塞在结合垫3与NC膜4搭接处以及结合垫3与测试线41之间的NC膜4处;随着层析反应的进行,结合垫3上的鸡IgY抗体因为凝胶化物料堵塞层析通道,堵塞程度与样本中目标抗原的含量成正比;使转移到测试线41处的鸡IgY抗体-信标物质的浓度变少,进而降低测试线41上兔抗鸡IgY能够结合的鸡IgY抗体-信标物质的浓度,使测试线41上显示的信号强度变弱。另外,在NC膜4被堵塞的过程中,一个孔堵塞就可以截留大量的信标物质,堵塞程度与截留的信标物质的量不是简单的1:1的关系,因此,本申请中的检测试纸存在一个截留信号放大的机理,使本方案的检测灵敏度相比于传统试剂盒会有数量级的提升;并且降低生产成本,无需选用特定的单克隆抗体,缩短研发周期。
结合实施例1-2和图1,可以看出,通过采用本申请中的测试方法,针对不同的目标抗原测试,选择合适的双特异性抗体和凝集化物料,使凝集反应产生的凝胶化物料随着层析过程的进行沿着层析液方向移动,从而将NC膜4与结合垫3搭接处的孔道堵住或/和结合垫3与测试线41之间的NC膜4中的孔道堵住,截留一抗和信号标志物,从而通过测试线41处显示的荧光信号的强弱程度来判断目标抗原的浓度,显著提高本检测试纸的灵敏度。并且,针对D-二聚体的测试,实施例2中的检测限与实施例1中的检测限相近,并且在具体的操作过程中发现,实施例2中的层析背景较实施例1中更为干净。
本具体实施例仅仅是对本申请的解释,其并不是对本申请的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本申请的权利要求范围内都受到专利法的保护。
- 一种NSE检测试纸条的制备方法、试纸条、检测卡及NSE检测试剂盒
- 一种血液检测用的试纸检测系统
- 一种用于检测Co(Ⅱ)的荧光试纸及其制备和检测方法
- 一种基于重组表达流感病毒血凝素的真核细胞凝集反应的流感病毒抗体的检测方法
- 一种基于重组表达流感病毒血凝素的真核细胞凝集反应的流感病毒抗体的检测方法
