医药组合物
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及医药组合物等。
背景技术
通常,癌症疫苗多在皮下、皮内或肌肉内给药,但在癌症患者的免疫抑制环境中,为了诱导肿瘤特异性免疫应答,据认为将癌症疫苗高效地递送到邻近淋巴结,创造淋巴结中抗原提呈细胞能够向T细胞提呈抗原的环境是重要的,并且与提高治疗效果有关。用于癌症疫苗的蛋白质、肽、核酸大多具有稳定性低,即使投予体内也容易分解、失活的性质。因此,目前需要开发能够将疫苗稳定地输送到目标部位并能够缓释的药物递送系统(DDS)。
导入了疏水性基团的透明质酸衍生物发生自缔合形成复合体,典型地形成纳米颗粒状的纳米凝胶。该复合体通过交联的三维网格结构和疏水性相互作用,能够容易地包埋封入蛋白质或肽、难溶性的低分子化合物,并稳定地将包埋物质递送到目标部位,进行缓释,期待应用在新型的DDS中。在专利文献1中,报道了制作上述复合体的癌症疫苗,并对小鼠进行皮下给药,结果迅速且高效地转移到邻近淋巴结,诱导抗肿瘤效果。
另一方面,目前正在进行癌症疫苗的全世界范围的研究开发,但其效果还远远不能令人满意。
现有技术文献
专利文献
专利文献1:国际公开第2020/158771号
发明内容
发明所要解决的技术问题
本发明的技术问题在于提供能够更强、更有效、更持续地和/或在更宽范围内发挥抗肿瘤效果的医药组合物。
用于解决技术问题的技术方案
本发明的发明人鉴于上述技术问题而进行了深入研究,结果发现,通过组合使用含有导入了疏水性基团的透明质酸衍生物和抗原的组合物、与表达针对上述抗原的免疫受体的淋巴细胞,能够解决上述技术问题。本发明的发明人基于该发现深入进行了研究,结果完成了本发明。即,本发明包括下述方案。
项1.一种医药组合物,其含有导入了疏水性基团的透明质酸衍生物和抗原,用于与表达针对上述抗原的免疫受体的淋巴细胞联合给药。
项2.如项1所述的医药组合物,其中,上述疏水性基团为甾醇基。
项3.如项1或2所述的医药组合物,其中,上述透明质酸衍生物与上述抗原形成复合体。
项4.如项1~3中任一项所述的医药组合物,其中,上述抗原为癌抗原。
项5.如项1~4中任一项所述的医药组合物,其中,上述抗原为抗原肽或抗原蛋白。
项6.如项5所述的医药组合物,其中,上述抗原包含CD8阳性细胞毒性T细胞识别表位和/或CD4阳性辅助性T细胞识别表位。
项7.如项1~6中任一项所述的医药组合物,其中,上述免疫受体为T细胞受体或嵌合抗原受体。
项8.如项1~7中任一项所述的医药组合物,其还含有佐剂,或者用于与佐剂联合给药。
项9.如项1~8中任一项所述的医药组合物,其用于预防或治疗癌症。
项10.一种医药组合物,其含有表达针对抗原的免疫受体的淋巴细胞,用于与含有导入了疏水性基团的透明质酸衍生物和上述抗原的组合物联合给药。
项11.一种癌症治疗试剂盒,其包含:含有导入了疏水性基团的透明质酸衍生物和癌抗原的医药组合物;和表达针对上述癌抗原的免疫受体的淋巴细胞。
项12.一种T细胞激活疫苗,其含有导入了疏水性基团的透明质酸衍生物和抗原。
项13.一种癌症治疗试剂盒,其为包含表达针对癌抗原的免疫受体的T细胞、和医药组合物的癌症治疗试剂盒,上述医药组合物含有导入了疏水性基团的透明质酸衍生物、源自上述癌抗原的抗原肽或抗原蛋白、和佐剂,上述透明质酸衍生物包含1个以上的式(I)所示的重复单元,
[式中,R
R
Z表示价键、或由2~30个任意的氨基酸残基构成的肽接头;X
-NR
-NR
-NR
-NR
-COO-R、
-O-COO-R、
-S-R、
-CO-Y
-O-CO-Y
-NR
-S-S-R、
所示的基团中的疏水性基团;
R
R
R为甾醇基;
Y为C
R
Y
Y
m为选自1~100的整数]。
项14.如项13所述的癌症治疗试剂盒,其中,上述透明质酸衍生物的葡萄糖醛酸部分的羧基的由疏水性基团的修饰率为5~50%。
项15.如项14所述的癌症治疗试剂盒,其中,Z为价键,Y为C
项16.如项13所述的癌症治疗试剂盒,其中,上述透明质酸衍生物的重均分子量为5,000~2,000,000。
项17.如项13所述的癌症治疗试剂盒,其中,上述透明质酸衍生物包含式(IIIc)所示的重复单元:
[式中,R
R
项18.如项13所述的癌症治疗试剂盒,其中,上述医药组合物含有上述癌抗原与上述透明质酸衍生物的复合体。
项19.如项13所述的癌症治疗试剂盒,其中,上述抗原肽包含2个以上CD8阳性细胞毒性T细胞识别表位和/或CD4阳性辅助性T细胞识别表位。
项20.如项19所述的癌症治疗试剂盒,其中,上述抗原肽为包含2种以上的CD8阳性细胞毒性T细胞识别表位、或者1种以上的CD8阳性细胞毒性T细胞识别表位和1种以上的CD4阳性辅助性T细胞识别表位的长链肽抗原。
项21.如项13所述的癌症治疗试剂盒,其被用于针对低免疫原性的癌症、转移性的癌症或肿瘤内T细胞数少的癌症的T细胞输注疗法。
项22.如项13所述的癌症治疗试剂盒,其中,上述医药组合物在施用上述T细胞之前给药。
项23.如项22所述的癌症治疗试剂盒,其中,将在施用1次上述医药组合物后输注1次上述T细胞作为给药次数的单位时,在进行1单位或2单位的给药后,施用至少1次上述医药品组合物。
项24.如项22所述的癌症治疗试剂盒,其中,上述医药组合物皮下或静脉内给药至少2次,上述T细胞在上述医药品组合物的第1次给药后且上述医药品组合物的第2次给药前输注。
项25.一种治疗癌症的方法,其包括:将含有导入了疏水性基团的透明质酸衍生物和癌抗原的医药组合物、和表达针对癌抗原的免疫受体的淋巴细胞对患有癌症的对象联合给药的步骤。
项26.一种癌症治疗试剂盒,其中,用于在癌症治疗中使用的上述癌症治疗试剂盒包含:含有导入了疏水性基团的透明质酸衍生物和癌抗原的医药组合物、和表达针对上述癌抗原的免疫受体的淋巴细胞。
项27.一种医药组合物,用于在施用表达针对癌抗原的免疫受体的淋巴细胞的癌症治疗中使用,且含有导入了疏水性基团的透明质酸衍生物和癌抗原。
项28.一种医药组合物,其用于在施用含有导入了疏水性基团的透明质酸衍生物和癌抗原的医药组合物的癌症治疗中使用,且含有表达针对癌抗原的免疫受体的淋巴细胞。
项29.含有导入了疏水性基团的透明质酸衍生物和癌抗原的医药组合物、与表达针对上述癌抗原的免疫受体的淋巴细胞的组合在制造癌症治疗试剂盒中的用途。
项30.含有导入了疏水性基团的透明质酸衍生物和癌抗原的医药组合物在制造用于与表达针对癌抗原的免疫受体的淋巴细胞联合给药的癌症治疗剂中的用途。
项31.表达针对癌抗原的免疫受体的淋巴细胞在制造用于与含有导入了疏水性基团的透明质酸衍生物和癌抗原的医药组合物联合给药的癌症治疗剂中的用途。
发明的效果
利用本发明,能够提供能够更强、更有效、更持续地和/或在更宽范围内发挥抗肿瘤效果的医药组合物。
附图说明
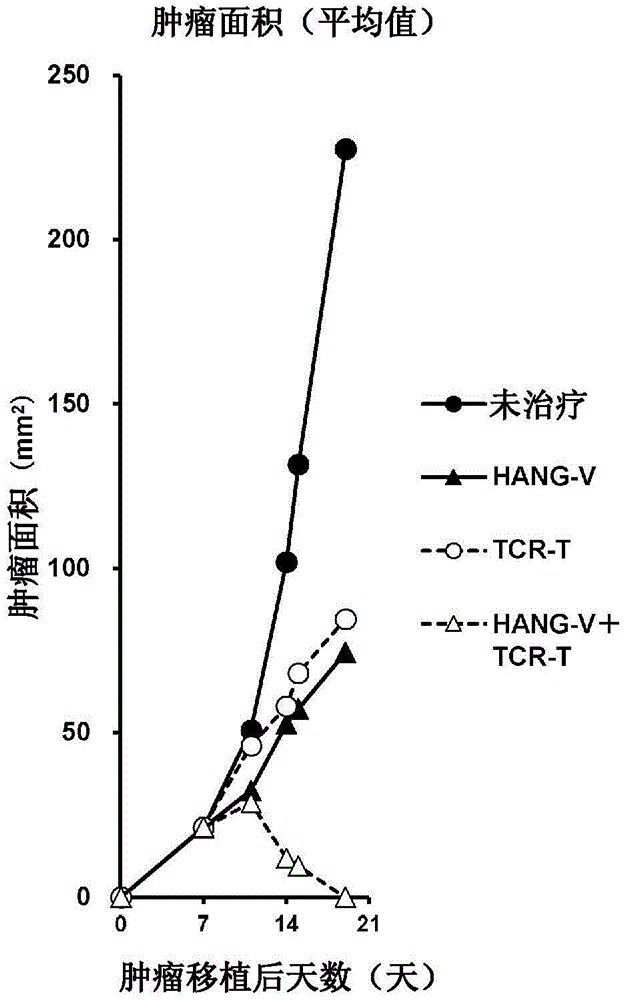
图1-1是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的治疗效果(肿瘤增殖抑制)的图表(实施例1)。图例表示各组的个体的肿瘤面积的平均值。
图1-2是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的治疗效果(肿瘤增殖抑制)的图表(实施例1)。图例表示各组的个体的肿瘤面积的测定值。
图1-3是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗和CpG寡聚DNA、抗原特异性T细胞后,对于肿瘤完全消退后无复发的个体再移植(CR-Re)CMS5a肿瘤时的肿瘤的复发抑制效果(肿瘤增殖抑制)的照片图。WT是表示将相同肿瘤在相同时期对野生型BALB/c小鼠(WT)移植时的肿瘤的大小的照片图(实施例1)。
图2-1是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)的细胞数的图表(实施例2)。
图2-2是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)和肿瘤的大小的照片图(实施例2)。
图2-3是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的树突状细胞或者巨噬细胞的比例的图表(实施例2)。另外,还是表示CD207阳性朗格汉斯细胞相对于全部CD11c阳性细胞的比例的图表。
图2-4-1是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的T细胞或者B细胞、NK细胞、树突状细胞、巨噬细胞的细胞数的图表(实施例2)。
图2-4-2是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的T细胞或者B细胞、NK细胞的细胞数的图表(实施例2)。
图2-4-3是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的树突状细胞、巨噬细胞的细胞数的图表(实施例2)。
图2-5是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的CD90.1阳性输注细胞相对于全部CD8阳性T细胞的比例的图表(实施例2)。
图2-6是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的干扰素γ(IFN-γ)产生细胞相对于全部CD90.1阳性CD8阳性T细胞或者CD90.1阴性CD8阳性T细胞的比例的图表(实施例2)。
图3-1是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图3-2是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图3-3是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图3-4是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图3-5是对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图3-6是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图3-7是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图4是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的肿瘤内的CD8阳性T细胞的显微镜照片的图(实施例4)。
图5是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、在HANG-V组中分别以不同的细胞数(2×10
图6-1是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的治疗效果(肿瘤增殖抑制)的图表(实施例6)。图例表示各组的个体的肿瘤面积的平均值。
图6-2是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的治疗效果(肿瘤增殖抑制)的图表(实施例6)。图例表示各组的个体的肿瘤面积的测定值。
图6-3是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)或者与抗原特异性T细胞输注疗法联用(HANG-V+TCR-T组)时的肿瘤的大小和形状的照片图(实施例6)。
图6-4是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的治疗效果(生存期间延长)的图表(实施例6)。图例表示各组的个体的存活率。
图6-5是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,通过长链肽抗原搭载癌症疫苗与CpG寡聚DNA、抗原特异性T细胞输注疗法联用而肿瘤完全消退的个体的照片图(实施例6)。
图7-1是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载癌症疫苗(HANG-V或CHP-V)与CpG寡聚DNA,联用抗原特异性T细胞输注疗法(HANG-V+TCR-T组或CHP-V+TCR-T组)时的治疗效果(肿瘤增殖抑制)的图表(实施例7)。图例表示各组的个体的肿瘤面积的平均值。
图7-2是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载癌症疫苗(HANG-V或CHP-V)与CpG寡聚DNA、联用抗原特异性T细胞输注疗法(HANG-V+TCR-T组或CHP-V+TCR-T组)时的治疗效果(肿瘤增殖抑制)的图表(实施例7)。图例表示各组的个体的肿瘤面积的测定值。
图7-3是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,施用长链肽抗原搭载癌症疫苗(HANG-V或CHP-V)与CpG寡聚DNA、联用抗原特异性T细胞输注疗法(HANG-V+TCR-T组或CHP-V+TCR-T组)时的肿瘤的大小和形状的照片图的一例(实施例7)。
图7-4是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载癌症疫苗(HANG-V或CHP-V)与CpG寡聚DNA、联用抗原特异性T细胞输注疗法(HANG-V+TCR-T组或CHP-V+TCR-T组)时的治疗效果(生存期间延长)的图表(实施例7)。图例表示各组的个体的存活率。
图8-1是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞的比例的图表(实施例8)。
图8-2是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的gp100四聚体阳性(tet+)CD8阳性T细胞相对于全部CD8阳性T细胞的比例的图表(实施例8)。
图8-3是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)中的gp100四聚体阳性CD8阳性T细胞的CD44或KLRG1的表达强度的图表(实施例8)。
图8-4是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA(HANG-V组)、抗原特异性T细胞输注疗法(TCR-T组)、两治疗联用(HANG-V+TCR-T组)时的疫苗施用部位的区域淋巴结(腹股沟淋巴结)细胞中的干扰素γ(IFN-γ)产生细胞相对于CD90.1阳性CD8阳性T细胞的比例的图表(实施例8)。
图9-1是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,将长链肽抗原搭载癌症疫苗与CpG寡聚DNA、抗原特异性T细胞输注疗法联用时的各组织(疫苗施用部位的区域淋巴结(dLN)、非区域淋巴结(NdLN)、脾脏(Spleen)、肿瘤(TIL)和外周血(PBMC))细胞中的CD90.1阳性CD8阳性输注T细胞相对于全部CD8阳性T细胞的比例的图表(实施例9)。
图9-2是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,将长链肽抗原搭载癌症疫苗与CpG寡聚DNA、抗原特异性T细胞输注疗法联用时的各组织(疫苗施用部位的区域淋巴结(dLN)、非区域淋巴结(NdLN)、脾脏(Spleen)、肿瘤(TIL)和外周血(PBMC))细胞中的gp100四聚体阳性(tet+)CD8阳性T细胞相对于全部CD8阳性T细胞的比例的图表(实施例9)。
图10-1是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,肿瘤完全消退后无复发的个体(CR)的外周血中的CD90.1阳性或/且gp100四聚体(tet)阳性CD8阳性输注T细胞相对于全部CD8阳性T细胞的比例的图表(实施例10)。
图10-2是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,对于肿瘤完全消退后无复发的个体,再移植B16F10肿瘤的个体(CR-Re)或再接种疫苗的个体(CR-Vac)的外周血中的CD90.1阳性或/且gp100四聚体(tet)阳性CD8阳性输注T细胞相对于全部CD8阳性T细胞的比例的图表(实施例10)。
图10-3是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,对于肿瘤完全消退后无复发的个体,再移植B16F10肿瘤的个体(CR-Re)或再接种疫苗的个体(CR-Vac)的外周血中的CD44阳性CD62L阴性(效应记忆T细胞)和CD44阳性CD62L阳性(中央记忆T细胞)相对于gp100四聚体阳性CD8阳性CD90.1阳性输注T细胞的比例的图表(实施例10)。
图10-4是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,对于肿瘤完全消退后无复发的个体,再移植B16F10肿瘤的个体(CR-Re)或再接种疫苗的个体(CR-Vac)的外周血中的CD44阳性细胞相对于CD8阳性T细胞的表达强度(High/Mid/Low,高/中/低)的图表(实施例10)。
图10-5是表示对在C57BL/6小鼠皮下移植的B16F10肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,对于肿瘤完全消退后无复发的个体,再移植C57BL/6肿瘤(CR-Re)或再接种疫苗(CR-Vac)后再移植C57BL/6肿瘤时的复发抑制效果(肿瘤增殖抑制)的照片图。WT是表示将相同肿瘤在相同时期对野生型B57BL/6小鼠(WT)移植时的肿瘤的大小的照片图(实施例10)。
图11-1是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞时的治疗效果(肿瘤增殖抑制)的图表(实施例11)。图例表示各组的个体的肿瘤面积的平均值。
图11-2是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA和抗原特异性T细胞后,将对于确认到了奏效后肿瘤的再增殖的个体联用疫苗再施用、抗原特异性T细胞和免疫检查点抑制剂(ICI)时的治疗效果(肿瘤增殖抑制)与未治疗或者奏效个体比较的图表(左图)(实施例11)。另外,还是表示另外实施实施例1或实施例11同样的试验,对于确认到了肿瘤的再增殖的个体,不施行疫苗再施用等的追加治疗时的肿瘤的增殖的图表(右图)。图例表示各组的个体的肿瘤面积的测定值。
图12-1是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,对于确认到肿瘤的完全消退的个体(CR)再移植CMS5a肿瘤时的复发抑制效果(肿瘤增殖抑制)的图表。WT是表示将相同肿瘤在相同时期对野生型BALB/c小鼠(WT)移植时的肿瘤的增殖的图表(实施例12)。图例表示各组的个体的肿瘤面积的平均值。
图12-2是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,对于确认到肿瘤的完全消退的个体(CR)再移植CMS5a肿瘤时的复发抑制效果(肿瘤增殖抑制)的图表。WT是表示将相同肿瘤在相同时期对野生型BALB/c小鼠(WT)移植时的肿瘤的增殖的图表(实施例12)。图例表示各组的个体的肿瘤面积的测定值。
图13-1是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者单次施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞时的治疗效果(肿瘤增殖抑制)的图表(实施例13)。图例表示各组的个体的肿瘤面积的平均值。
图13-2是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,未治疗或者单次施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞时的治疗效果(肿瘤增殖抑制)的图表(实施例13)。图例表示各组的个体的肿瘤面积的测定值。
图14是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,施用长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞后,将对于确认到肿瘤的再增殖的个体实施疫苗再施用和免疫检查点抑制剂(ICI)的追加治疗时的治疗效果(肿瘤增殖抑制)与未治疗或者奏效个体比较的图表(实施例14)。图例表示各组的个体的肿瘤面积的测定值。
图15是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,将长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞输注疗法联用后,对于确认到肿瘤的完全消退的个体(CR)再施用HA疫苗(Vac)时和不再施用HA疫苗(UT)时的外周血细胞中的CD44阳性CD62L阴性(效应记忆T细胞)和CD44阳性CD62L阳性(中央记忆T细胞)相对于全部CD8阳性T细胞的比例的图表(实施例15)。
图16是表示对在BALB/c小鼠皮下移植的CMS5a肿瘤,将长链肽抗原搭载HA纳米凝胶癌症疫苗与CpG寡聚DNA、抗原特异性T细胞输注疗法联用,对于治疗奏效后由于肿瘤的再增殖而实施了追加治疗的个体(PD)再施用HA疫苗(Vac)时和不再施用HA疫苗(UT)时的外周血细胞中的CD44阳性CD62L阴性细胞(效应记忆T细胞)和CD44阳性CD62L阳性细胞(中央记忆T细胞)相对于全部CD8阳性T细胞的比例的图表(实施例16)。
图17-1a表示mMAGE#17zG CAR的序列。
图17-1b是表示mMAGE#17zG CAR的结构的示意图。
图17-2a表示mMAGE 28z CAR的序列。
图17-2b是表示mMAGE 28z CAR的结构的示意图。
图17-3a表示MAGE-A4表达载体的序列。
图17-3b是表示MAGE-A4表达载体的结构的示意图。
图17-4a表示HHD-A2表达载体的序列。
图17-4b是表示HHD-A2表达载体的结构的示意图。
图17-5是表示对使用抗小鼠CD3抗体和CD28抗体培养得到的来自HLA-A2 Tg小鼠的脾脏细胞导入MAGE#17zG CAR基因时的培养细胞的CD4阳性或CD8阳性T细胞的比例和CAR相对于各个T细胞的表达比例的图表(实施例17)
图17-6是表示对MC38和CT26细胞导入MAGE-A4基因和HHD-A2基因时的两基因的表达比例的图表(实施例17)。
图17-7是表示对MC38和CT26细胞添加mMAGE#17zG CAR导入T细胞或CAR基因非导入细胞并进行共培养时的培养上清中的IFN-γ产生量的图表(实施例17)。
具体实施方式
本发明在其一个方式中,涉及含有导入有疏水性基团的透明质酸衍生物和抗原的组合物(在本说明书中,有时也表示为“HA-抗原组合物”。)、与表达针对上述抗原的免疫受体的淋巴细胞(在本说明书中,有时也表示为“抗原特异性淋巴细胞”。)的组合。以下对此进行说明。
1.定义
在本说明书中,关于“含有”和“包含”的表达,包括“含有”、“包含”、“实质上由……构成”和“仅由……构成”的概念。
本说明书中提及的术语“C
本说明书中提及的术语“C
本说明书中提及的术语“C
本说明书中提及的术语“C
本说明书中提及的术语“C
本说明书中提及的术语“氨基C
本说明书中提及的术语“羟基C
本说明书中提及的术语“C
本说明书中提及的术语“C
本说明书中提及的术语“C
本说明书中提及的术语“C
本说明书中提及的术语“C
在本发明中,“芳基”是指芳香族碳环基、例如碳原子数为6~14的芳香族碳环基,作为芳基的例子可以列举苯基、萘基(1-萘基和2-萘基)等。作为取代有1个以上的羟基的芳基的例子,可以列举4-羟基苯基。
在本发明中,“杂芳基”是指在构成环的原子中,含有1或多个的选自氮原子、氧原子和硫原子中的杂原子的芳香族性的环基,可以部分饱和。环可以是单环、或与苯环或单环杂芳基环缩合的2环式杂芳基。构成环的原子的数例如为4~15,优选为5~14、更加优选为6~10。作为杂芳基的例子,可以列举例如呋喃基、噻吩基、吡咯基、咪唑基、吡唑基、噻唑基、异噻唑基、噁唑基、异噁唑基、噁二唑基、噻二唑基、三唑基、四唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、三嗪基、苯并呋喃基、苯并噻吩基、苯并噻二唑基、苯并噻唑基、苯并噁唑基、苯并噁二唑基、苯并咪唑基、吲哚基、异吲哚基、吲唑基、喹啉基、异喹啉基、噌啉基、喹唑啉基、喹喔啉基、苯并二氧杂环戊烯基、吲哚嗪基、咪唑并吡啶基等,优选列举吲哚-2-基。
本说明书中提到的“2价的C
本说明书中提到的“2价的C
本说明书中提到的术语“盐物质”只要是可溶于水的无机物就没有特别限定,可以列举例如氯化钙、磷酸钙等钙盐、硫酸镁、氯化镁等的镁盐、硫酸铝、氯化铝等铝盐、硫酸钾、碳酸钾、硝酸钾、氯化钾、溴化钾、碘化钾等钾盐、碳酸氢钠、碳酸钠、硫酸钠、硝酸钠、氯化钠、溴化钠、碘化钠、硅酸钠、磷酸三钠、磷酸二钠、硼酸钠、乙酸钠、柠檬酸钠等钠盐、氯化锂、溴化锂、碘化锂、碳酸锂等锂盐,优选列举氯化钠、磷酸三钠、磷酸二钠、氯化钾、氯化钙、氯化镁等。
本说明书中提到的术语“抗原”是指诱发免疫的物质。例如在淋巴结或脾脏中,通过使抗原提呈细胞提呈,能够诱导T细胞、B细胞等淋巴细胞活化的物质。术语“抗原蛋白”是指作为蛋白质的抗原。另外,“抗原肽”是指作为肽的抗原。例如抗原肽是抗原蛋白所含的氨基酸序列的一部分,包含T细胞识别表位。可以是组合有多个T细胞识别表位的部分。被识别为抗原的物质可以为例如蛋白质或肽本身、该蛋白质或肽与其他分子(例如主要组织相容抗原(MHC))的复合体、或者主要组织相容抗原(MHC)本身。
本说明书提到的术语“佐剂”是指通过与包含抗原的疫苗联合使用而向对象施用,从而增强对象的免疫反应的物质。
2.HA-抗原组合物
<2-1.导入了疏水性基团的透明质酸衍生物>
导入了疏水性基团的透明质酸衍生物为透明质酸或其衍生物,只要具有疏水性基团,且能够与抗原(特别是抗原肽、抗原蛋白)形成复合体即可,没有特别限制。
疏水性基团是具有疏水性的基团,透明质酸衍生物只要能够与抗原(特别是抗原肽、抗原蛋白)形成复合体即可,没有特别限制。作为疏水性基团,优选列举具有甾醇骨架的疏水性基团(甾醇基)、烃基等,特别优选列举甾醇基。
甾醇骨架是在式I所示的环五氢菲环上结合有羟基的醇。式I的A~D的记号表示构成环五氢菲环的各环。
在甾醇骨架中,环五氢菲环可以具有双键,羟基的结合位置也没有特别限定。优选为在C-3位的位置结合羟基、在B环具有双键的甾醇类,或者为在C-3位的位置结合羟基、由饱和环构成的甾烷醇类。疏水性基团可以列举修饰甾醇骨架而成的、例如在构成环的碳上取代有烃基(例如碳原子数1~20的直链状或支链状的烷基等)而成的化合物(类固醇)衍生的基团。这里,“衍生的基团”是指在某个化合物中去掉氢原子或羟基等官能团而得到的基团。
这里,作为类固醇,具体可以列举:胆固醇、脱氢胆固醇、粪甾烯醇、粪甾醇、胆甾烷醇、菜油甾烷醇、麦角甾烷醇、豆甾烷醇、粪甾烷醇、豆甾醇、谷甾醇、羊毛甾醇、麦角甾醇、西米杜鹃醇、胆汁酸(胆烷酸、石胆酸、猪脱氧胆酸、鹅脱氧胆酸、熊脱氧胆酸、脱氧胆酸、原胆酸、胆酸、脱氢胆酸、糖胆酸、牛磺胆酸)、睾酮、雌二醇、黄体酮、皮质醇、可的松、醛甾酮、皮质酮、脱氧皮质酮等。作为甾醇基,可以列举胆甾醇基、豆甾醇基、羊毛甾醇基、麦角甾醇基、胆烷酰基、胆酰基等,优选列举胆甾醇基(特别是下式所示的胆甾-5-烯-3β-基)、胆烷酰基(特别是下式所示的5β-胆烷-24-酰基)。式中,2个星号表示结合位置。
作为烃基,没有特别限制,可以列举例如碳原子数8~50(优选为10~30、更优选为12~20)的链状(优选为直链状)烃基(优选为烷基)。
导入了疏水性基团的透明质酸衍生物的重均分子量只要能够与抗原形成复合体就没有特别限制,例如为5,000~2,000,000。该重均分子量优选为10,000~1,000,000,更优选为20,000~500,000,更加优选为40,000~250,000,进一步更加优选为80,000~125,000。
疏水性基团的导入率例如为1~50%、优选为7~50%、更加优选为17~50%、更优选为20~45%。在导入率为上述范围的情况下,透明质酸衍生物能够在溶液中与抗原高效地形成复合体。疏水性基团的导入率能够按照或基于后述所示的方法测定和计算。
作为导入了疏水性基团的透明质酸衍生物的具体例,可以列举包含式(I)所示的1个以上的二糖单元(也为重复单元)的透明质酸衍生物、或包含式(II)所示的1个以上的二糖单元(也为重复单元)的透明质酸衍生物。透明质酸衍生物例如为包含1个以上的以下式(I)所示的重复单元的透明质酸衍生物;或者为包含式(II)所示的重复单元的透明质酸衍生物,
[式中,R
R
Z表示价键或由2~30个任意的氨基酸残基构成的肽接头;X
-NR
-NR
-NR
-NR
-COO-R、
-O-COO-R、
-S-R、
-CO-Y
-O-CO-Y
-NR
-S-S-R;
R
R
R为甾醇基;
Y为C
R
Y
Y
m为选自1~100的整数];
[式中,R
R
X
Q
R
Z
Z
-NR
-NR
-NR
-NR
-COO-Z
-CO-NR
-O-CO-NR
-O-COO-Z
-S-Z
-CO-Z
-O-CO-Z
-NR
-S-S-Z
R
R
R
Z
Z
Z
在不包含X
[式中,R
R
X
上述透明质酸衍生物优选导入了疏水性基团的透明质酸衍生物还包含式(IIIc)所示的重复单元,
[式中,R
R
在一个方式中,包含式(I)所示的重复单元的透明质酸衍生物实质上由(1)式(I);以及(2)式(I)和式(IIIc)的重复单元构成。
在包含上述式(I)所示的重复单元的透明质酸衍生物包含2个以上式(I)的重复单元的情况下,该重复单元可以相同,也可以不同。该透明质酸衍生物可以在式(I)的重复单元以外的位置被修饰,例如羟基可以转换成-O(C
根据一个方面,上述式(I)的基-Z-N(R
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-NH-(CH
-Z-NR
(其中,mz为2~30的整数,R
该基团优选为选自以下的基团:
-NH-(CH
-NH-(CH
-NH-(CH
(其中,mz、R和m如本说明书中已有的定义所述)。
在优选的方式中,上述式(I)的Z为价键。另外,在一个方式中,在上述式(I)的Z为肽接头的情况下,X
作为上述式(I)的Y的具体例,可以列举-CH
作为上述式(I)的Y
作为上述式(I)的Y
在一个方式中,上述式(I)的Z为-NH-[CH(-Z
作为上述式(I)的基-Z-N(R
在一个方式中,基Z-N(R
在一个方式中,包含上述式(I)所示的重复单元的透明质酸衍生物还包含式(IIIc)所示的重复单元。在包含2个以上的式(IIIc)所示的重复单元的情况下,该重复单元可以相同也可以不同。
上述式(IIIc)的Q
上述式(I)的基R
上述式(I)的基R
在一个方式中,包含上述式(I)所示的重复单元的透明质酸衍生物实质上由式(I)和(IIIc)的重复单元构成。该透明质酸衍生物中,该衍生物所含的由D-葡萄糖醛酸和N-乙酰基葡萄糖胺构成的二糖的重复单元中的例如80%以上、优选为90%以上、更优选为95%以上为式(I)或(IIIc)的重复单元。在一个方式中,仅由上述式(I)和式(IIIc)所示的重复单元构成。
式(I)中定义的Y例如可以为-(CH
根据一个方面,包含上述式(I)所示的重复单元的透明质酸衍生物中,疏水性基团相对于在该衍生物中存在的二糖的重复单元的导入率例如为1~50%、优选为7~50%、更加优选为17~50%、更优选为20~45%。在导入率为上述范围的情况下,包含上述式(I)所示的重复单元的透明质酸衍生物能够在溶液中与抗原高效地形成复合体。
其中,疏水性基团的导入率通过以下的式子计算:
(疏水性基团的导入率)=(导入了疏水性基团的二糖重复单元数/存在的二糖重复单元数)×100。
其中,“在该衍生物中存在的二糖的重复单元”中包含羧基被转换为酰胺基而导入了疏水性基团的式(I)的重复单元、和没有导入疏水性基团的式(IIIc)的重复单元。该导入率能够通过反应条件、例如试剂的比率来控制,例如能够通过NMR测定等来确定。
包含上述式(I)所示的重复单元的透明质酸衍生物优选将在R
此外,通常而言,透明质酸及其衍生物难以作为单一品得到,因此其分子量作为数均分子量或重均分子量算出。在本发明中,作为重均分子量算出。关于重均分子量的测定方法,可以利用例如中浜精一等著的《エッセンシャル高分子科学(基本高分子科学)》(讲谈社发行,ISBN4-06-153310-X)所记载的光散射法、渗透压法、粘度法等各种公知的方法,在本说明书中所示的粘均分子量也能够由使用乌伯洛德(Ubbelohde)粘度计等本发明所属的技术领域中通常使用的方法测定。在使用明示分子量而市售的透明质酸及其衍生物的情况下,也可以该明示的数值作为分子量。
上述包含式(I)的重复单元的透明质酸衍生物中,将构成重复单元的二糖之一的葡萄糖醛酸的羧基转换成酰胺基,导入疏水性基团。通过调节透明质酸衍生物的修饰的程度,也能够控制使用该衍生物制造的制剂的体内动态。
当上述含式(I)的重复单元的透明质酸衍生物的葡萄糖醛酸部分的羧基修饰率高时,抑制与以CD44为代表的透明质酸受体的结合,该透明质酸衍生物成为在体内长时间滞留的药物载体(包含疫苗)。通过再向透明质酸衍生物导入靶元件,能够靶向含淋巴结的各脏器以及细胞。作为靶元件,有例如目标组织特异性肽、抗体、片段化抗体、适体、针对癌细胞的R
上述包含式(I)的重复单元的透明质酸衍生物的葡萄糖醛酸部分的羧基的通过疏水性基团的修饰率、即疏水性基团的导入率从与抗原形成复合体的观点来看,优选为4~60%,更加优选为5~50%,更加优选为7~50%,更加优选为7~45%。从复合体的淋巴结转移的观点来看,优选为6~60%,更加优选为17~50%,更加优选为20~50%,更加优选为20~45%。
作为包含上述式(I)所示的重复单元的透明质酸衍生物的原料的分子量与疏水性基团的导入率的组合,从形成与抗原的复合体的观点来看,优选为3kDa~500kDa且4~60%,更加优选3kDa~200kDa且6~50%,更加优选5kDa~200kDa且6~50%,更加优选5kDa~150kDa且6~45%。在复合体的淋巴结转移的观点上,优选3kDa~500kDa且4~60%,更加优选3kDa~200kDa且6~50%,更加优选5kDa~200kDa且6~50%,更加优选5kDa~150kDa且20~45%。在稳定分散的观点上,优选3kDa~200kDa且4~60%,更加优选3kDa~200kDa且6~50%,更加优选5kDa~200kDa且6~50%,更加优选5kDa~150kDa且17~45%。在提高血中滞留性的观点上,优选5kDa~27kDa且2~50%,更加优选5kDa~27kDa且8~35%,更加优选5kDa~18kDa且8~35%,更加优选5kDa~18kDa且8~35%,更加优选5kDa~18kDa且15~22%。在凝胶化的观点上,优选5kDa~300kDa且2~30%,更加优选5kDa~50kDa且2~22%,更加优选5kDa~27kDa且2~22%,更加优选5kDa~27kDa且7~22%。
在一个方式中,上述包含式(II)所示的重复单元的透明质酸衍生物实质上由(1)上述式(II);(2)上述式(II)和式(III);(3)上述式(II)和式(IIIc);或(4)上述式(II)、式(III)和式(IIIc)的重复单元构成。该透明质酸酸衍生物中,该衍生物所含的由D-葡萄糖醛酸和N-乙酰基葡萄糖胺构成的二糖的重复单元中的例如80%以上、优选为90%以上、更优选为95%以上为式(II)、(III)或式(IIIc)的重复单元。在一个方式中,该透明质酸衍生物仅由(1)式(II);(2)式(II)和式(III);(3)式(II)和式(IIIc);或(4)式(II)、式(III)和式(IIIc)的重复单元构成。
上述包含式(II)所示的重复单元的透明质酸衍生物中存在的特定的二糖单元相对于二糖的重复单元的比例是指作为以二糖单元为重复单元的多糖类的上述包含式(II)所示的重复单元的透明质酸衍生物的一定量所含的特定的二糖单元相对于全部二糖单元的比例。
在表示上述包含式(II)所示的重复单元的透明质酸衍生物所含的二糖单元的式(II)中,优选R
作为式(II)中的R
在基-CHR
在式(II)中,R
作为式(II)中的基-CHR
其中,星号表示与-NR
作为基-CHR
作为基-CHR
作为基-CHR
作为基-CHR
从复合体向淋巴结递送的观点来看,作为基-CHR
作为更加优选的例子,可以列举以下的基团。
作为更加优选的例子,可以列举以下的基团。
上述基-CHR
作为式(II)中的基-CHR
作为基-CHR
作为基-CHR
作为基-CHR
作为基-CHR
这些基团,从具有生物分解性和血中滞留性这两者的特性的观点来看,也为优选的基团。
从具有生物分解性和血中滞留性这两者的特性的观点来看,作为基-CHR
从具有生物分解性和血中滞留性这两者的特性的观点来看,作为基-CHR
从在纯水中的更加适合的分散性的观点来看,作为基-CHR
这2个基团从作为持续性的皮下给药用注射制剂的基材的观点来看为优选例。
在作为持续性的皮下给药用注射制剂的基材的观点来看,作为基-CHR
作为R
在式(II)、(III)和(IIIc)中定义的羧基可以形成式-COO-Q
作为式(II)中的基-CHR
作为该基的其他具体例,可以列举以下的基团。
作为基-CHR
作为基-CHR
作为基-CHR
从复合体向淋巴结递送的观点来看,作为基-CHR
作为更加优选的基,可以列举以下的基团。
作为更加优选的例子,可以列举以下的基团。
从具有生物分解性和血中滞留性这两者的特性的观点来看,作为基-CHR
作为基-Z
在一个方式中,包含式(II)所示的重复单元的透明质酸衍生物在基X
作为复合体向淋巴结递送的观点上优选基团R
在一个方式中,也优选包含式(III)所示的重复单元、包含上述式(II)所示的重复单元的透明质酸衍生物。在更加优选的方式中,式(II)的X
根据另一个方面,包含上述式(II)所示的重复单元的透明质酸衍生物中,具有基-NR
其中,疏水性基团的导入率通过以下的式子计算:
(疏水性基团的导入率)=(导入了疏水性基团的二糖重复单元数/存在的二糖重复单元数)×100。
其中,“在该衍生物存在的二糖的重复单元”中包含式(II)和式(III)的重复单元、以及式(IIIc)的重复单元。该导入率能够通过反应条件、例如试剂的比率来控制,例如能够通过NMR测定等来确定。
包含上述式(II)所示的重复单元的透明质酸衍生物中的疏水性基团的导入率例如为3~50%,优选为5~40%,更优选为5~35%,更加优选为5~25%,更优选为5~20%,更加优选为5~10%。从与抗原形成复合体的观点出发,优选3~60%,更加优选7~50%,更加优选18~45%,更加优选20~35%。从复合体向淋巴结转移的观点出发,优选3~60%,更加优选7~50%,更加优选18~45%,更加优选20~35%。
在一个方式中,包含上述式(II)所示的重复单元的透明质酸衍生物在式(II)中X
在一个方式中,包含上述式(II)所示的重复单元的透明质酸衍生物不含X
其中,在包含上述式(II)所示的重复单元的透明质酸衍生物中,存在的二糖的重复单元中的式(III)所示的重复单元的比例优选为3~50%,更加优选为5~40%,更加优选为5~35%,更加优选为5~25%,更加优选为5~20%,更加优选为5~10%。在与抗原形成复合体的观点上,优选3~60%,更加优选7~50%,更加优选18~45%,更加优选20~35%。在复合体向淋巴结转移的观点上,优选3~60%,更加优选7~50%,更加优选18~45%,更加优选20~35%。
另外,在包含上述式(II)所示的重复单元的透明质酸衍生物中,存在的二糖的重复单元中的式(II)所示的重复单元的比例优选为20~97%,更加优选为30~95%,更加优选为35~95%,更加优选为45~95%,更加优选为50~95%,更加优选为60~95%。在与抗原形成复合体的观点上,例如为7~100%,优选为20~100%,更优选为30~100%。在复合体向淋巴结转移的观点上,例如为20~100%,优选为30~100%,更优选为70~100%。
作为制造导入了疏水性基团的透明质酸衍生物的方法,可以列举国际公开第2010/053140号和国际公开第2014/038641号中记载的方法。
根据一个方面,导入了疏水性基团的透明质酸衍生物的特征在于,在水中通过缔合形成微粒。没有特别限定,据认为通过导入的疏水性基团的疏水性相互作用在水中发生自发缔合而形成微粒。发挥该特性,可以用作疫苗用载体、淋巴结递送载体、血中缓释载体、打靶载体。该微粒的粒径没有特别限定,例如为1μm以下,优选为500nm,更优选为200nm以下,更加优选为100nm以下,进一步更优选为50nm以下。作为将导入了疏水性基团的透明质酸衍生物进行微粒化的方法,可以列举国际公开第2010/053140号中记载的方法和国际公开第2014/038641号中记载的方法。
作为用于制造导入了疏水性基团的透明质酸衍生物的原料,可以使用透明质酸或其盐或者其衍生物。作为透明质酸盐,能够列举例如钠盐、钾盐、锂盐等碱金属盐,特别优选的盐为作为医药品广泛使用的钠盐。透明质酸或其药学上可接受的盐可以使用对源自鸡冠或猪皮等生物原料进行提取的方法或生物发酵法等各种公知的方法制造,或者也可以购入市售的商品(例如购自Denka株式会社、株式会社资生堂、生化学工业株式会社、R&D system公司等)而获得。
与导入了疏水性基团的透明质酸衍生物微粒形成了复合体的抗原在施用后,有时由透明质酸衍生物微粒的分解-崩解和白蛋白等生物体成分和抗原的取代而从复合体释放。该释放的速度能够通过透明质酸衍生物的疏水性基团的导入率或分子量、氨基酸导入率来控制。另外,也能够通过国际公开第2010/053140号中记载的方法,将透明质酸衍生物化学交联、凝胶化来控制抗原释放速度。另外,也能够通过国际公开第2010/053140号中记载的方法,将透明质酸衍生物与抗原缀合来控制抗原释放速度。
<2-2.抗原>
作为与导入了疏水性基团的透明质酸衍生物组合的抗原,可以列举例如抗原肽和抗原蛋白、以及编码这些抗原序列的DNA和mRNA,优选为抗原肽和抗原蛋白,更加优选为抗原肽。
抗原也可以为癌抗原。癌抗原是在癌细胞中大量表达的抗原,在一些情况下,仅由癌细胞表达。癌抗原可以在癌细胞内或癌细胞的表面上表达。
本发明中可以使用的抗原蛋白没有限定,可以选自ERK1、ERK2、MART-1/Melan-A、gp100、腺苷脱氨酶结合蛋白质(ADAbp)、FAP、亲环素b、结肠直肠相关抗原(CRC)-C017-1A/GA733、癌胚抗原(CEA)、CAP-1、CAP-2、etv6、AML1、前列腺特异性抗原(PSA)、PSA-1、PSA-2、PSA-3、前列腺特异性膜抗原(PSMA)、T细胞受体/CD3-ζ链、CD20、MAGE-A1、MAGE-A2、MAGE-A3、MAGE-A4、MAGE-A5、MAGE-A6、MAGE-A7、MAGE-A8、MAGE-A9、MAGE-A10、MAGE-A11、MAGE-A12、MAGE-Xp2(MAGE-B2)、MAGE-Xp3(MAGE-B3)、MAGE-Xp4(MAGE-B4)、MAGE-C1、MAGE-C2、MAGE-C3、MAGE-C4、MAGE-C5、GAGE-1、GAGE-2、GAGE-3、GAGE-4、GAGE-5、GAGE-6、GAGE-7、GAGE-8和GAGE-9、BAGE、RAGE、LAGE-1、NAG、GnT-V、MUM-1、CDK4、酪氨酸酶、p53、MUC家族、HER2/neu、p21ras、RCAS1、α-甲胎蛋白、E-钙粘蛋白、α-连环蛋白、β-连环蛋白、γ-连环蛋白、p120ctn、gp100Pmel117、PRAME、NY-ESO-1、cdc27、腺瘤性息肉病蛋白质(APC)、胞衬蛋白、连接蛋白37、Ig个体基因型、p15、gp75、GM2神经节苷脂、GD2神经节苷脂、人乳头状瘤病毒蛋白质、肿瘤抗原的Smad家族、lmp-1、P1A、EBV编码的核抗原(EBNA)-1、脑糖原磷酸化酶、SSX-1、SSX-2(HOM-MEL-40)、SSX-1、SSX-4、SSX-5、SCP-1、CT-7、CD20和c-erbB-2。
作为上述抗原蛋白,可以使用其整个序列,也可以使用部分缺失的序列。
上述抗原肽是在抗原蛋白的序列之中包含1个以上CD8阳性细胞毒性T细胞识别表位和/或CD4阳性辅助性T细胞识别表位的抗原肽。在一个方式中,从经过在抗原提呈细胞的分解而搭载到I类MHC分子或II类MHC分子的观点出发,上述抗原肽优选为包含2个以上(例如2、3、4、5、6、7或8个)表位的抗原肽。具体而言,作为上述抗原肽,可以列举包含肿瘤细胞的抗原蛋白的表位的抗原肽。
在一个方式中,上述抗原肽例如具有8~120个氨基酸,优选具有8~80个氨基酸,更优选具有15~80个氨基酸,更优选具有16~80个氨基酸,更优选具有23~80个氨基酸,更优选具有23~60个氨基酸,更优选具有23~50个氨基酸。
在一个方式中,从由辅助性T细胞诱导细胞毒性T细胞(CTL)的活化的观点出发,上述抗原肽为分别包含1个以上CD8阳性细胞毒性T细胞识别表位和CD4阳性辅助性T细胞识别表位的抗原肽。
在一个方面,在包含2个以上表位的情况下,在表位间可以配置氨基酸接头。该接头具有例如2~10个氨基酸、优选为4~10个氨基酸、更优选为4~8个氨基酸。作为在该接头中使用的氨基酸,可以列举甘氨酸(G)、酪氨酸(Y)、亮氨酸(L)、色氨酸(W)等。优选为酪氨酸(Y)、亮氨酸(L)、色氨酸(W)。作为氨基酸接头的具体例,可以列举例如-YYYY-(4Y)、-LLLL-(4L)、-WWWW-(4W)、-GGGGGG-(6G)、-YYYYYY-(6Y)、-LLLLLL-(6L)、-WWWWWW-(6W)、-YYYYYYYY-(8Y)、-LLLLLLLL-(8L)和-WWWWWWWW-(8W),优选为6Y、6L和6W。
<2-3.复合体>
导入了疏水性基团的透明质酸衍生物与抗原的复合体能够通过将导入了疏水性基团的透明质酸衍生物和抗原在适当溶液中混合来制造。作为使用的溶液,可以列举水、生理盐水、各种缓冲液、糖溶液、DMSO、乙醇、DMF、它们的组合等,也可以通过透析等方法进行溶剂、缓冲液更换。
例如,能够通过将导入了疏水性基团的透明质酸衍生物的微粒与抗原混合来制造本发明的复合体。没有特别限定,能够通过上述透明质酸衍生物的微粒与抗原形成复合体,来制成透明质酸衍生物与抗原的复合体。另外,能够通过将抗原封入上述透明质酸衍生物的微粒来制成透明质酸衍生物与抗原的复合体。复合体中包含上述透明质酸衍生物微粒中的抗原封入体(包涵体)。该封入体中,抗原被上述透明质酸衍生物包覆。
作为复合体形成方法,可以列举向预先形成的导入了疏水性基团的透明质酸衍生物的微粒添加抗原溶液的方法。该方法中,所形成的该透明质酸衍生物的微粒与抗原通过水性相互作用、静电相互作用、氢键等的相互作用而形成复合体。相互作用在微粒表面、微粒内部的任意一者中均发生。没有特别限定,溶剂、盐浓度、pH、温度、时间、变性剂的添加等的条件可以适当选择使得抗原稳定且高收率地形成复合体。例如,根据复合体形成时的盐浓度或pH,透明质酸衍生物微粒的膨润度或密度变化,抗原的电离状态等也改变,因此根据其组合适当使用适合的条件即可。通过在低盐浓度下进行复合体化,能够利用透明质酸衍生物的羧基彼此的静电排斥,使微粒密度减少,使复合体化量增加,或与更高分子量的抗原进行复合体化。形成复合体后,通过使盐浓度上升来减弱静电排斥,从而使微粒密度上升,由此使凝胶网格比抗原尺寸小,从而能够牢固地保持抗原,使其释放延迟。此时,也能够将盐浓度设为生理盐浓度。可以为了微小化或尺寸均一化而使用超声波均浆器或一点集中型超声波照射装置进行超声波照射。超声波照射可以在将透明质酸衍生物和药物混合后进行,也可以仅对透明质酸衍生物进行。没有复合体化的游离的抗原能够通过透析法或尺寸排阻色谱(SEC)法等分离、除去。
另外,作为复合体形成方法,可以通过使导入了疏水性基团的透明质酸衍生物在DMSO或DMF等非质子性极性有机溶剂中溶解,与抗原混合后,置换成水或盐水溶液、各种缓冲液水溶液,来同时进行微粒形成和复合体形成。置换例如能够通过透析来进行。为了微小化或尺寸均一化,也可以使用超声波均浆器或一点集中型超声波照射装置进行超声波照射。超声波照射可以在透明质酸衍生物与抗原的混合后进行,也可以仅对透明质酸衍生物进行。另外,可以在透析前也可以在透析后。通过该方法,与透明质酸衍生物复合体化的抗原就更难以从复合体释放。没有特别限定,透明质酸衍生物与抗原混合时的溶剂种类、盐浓度、pH、温度、时间、变性剂的添加、透明质酸衍生物浓度、抗原浓度、透明质酸衍生物与抗原的比率等的条件可以适当选择以使抗原稳定且高收率地形成复合体。没有特别限定,置换成水、盐水溶液或各种缓冲液水溶液时的溶剂种类、盐浓度、pH、温度、时间、回数、变性剂的添加的有无、透明质酸衍生物浓度、抗原浓度、透明质酸衍生物与抗原的比率等的条件可以适当选择以使抗原稳定且高收率地形成复合体。微粒的尺寸通过适当选择这些条件来获得目标尺寸。没有复合体化的游离的抗原通过透析法或尺寸排阻色谱(SEC)法等分离、除去即可。
在上述复合体为颗粒的情况下,其粒径没有特别限定,从淋巴结转移的观点出发,例如为20~200nm,优选为20~100nm,更优选为20~50nm。
3.抗原特异性淋巴细胞
<3-1.免疫受体>
免疫受体只要是能够传递免疫细胞的效应功能的发挥所需要的信号、即传递抗原结合性结构域与抗原结合时、免疫细胞的活化所需要的信号的受体,则没有特别限制。作为免疫受体,优选列举T细胞受体、嵌合抗原受体(CAR)等。作为识别嵌合抗原受体的抗原,可以是细胞表面抗原,也可以是细胞内抗原与主要组织相容性基因复合体的复合体。
免疫受体典型地包含抗原结合性结构域、跨膜结构域和细胞内结构域。
抗原结合性结构域是免疫受体配置在细胞膜上时被配置在细胞外的结构域,只要是能够识别抗原并与该抗原结合的结构域即可,没有特别限制。抗原结合性结构域通常具有针对抗原的抗体或T细胞受体的CDR(例如如果是抗体的CDR,则为重链CDR1、重链CDR2、重链CDR3、轻链CDR1、轻链CDR2和轻链CDR3)之中的1个以上、优选为2个、3个、4个、5个以上、更优选为全部6个。抗原结合区更优选包含针对抗原的抗体或T细胞受体的可变区(如果为抗体的情况下,例如为重链可变区和/或轻链可变区)。
抗原结合性结构域能够采用单链抗体结构,例如能够采用scFv结构。在scFv结构这样的包含重链可变区和轻链可变区的情况下,重链可变区和轻链可变区通常经由接头连结。接头只要不明显损害抗原结合性即可,没有特别限制,是任意的。作为接头,优选为由甘氨酸或由甘氨酸和丝氨酸构成的接头(GGS接头、GS接头、GGG接头等)。接头的长度没有特别限定。接头的氨基酸残基数例如为5~30、优选为10~25。重链可变区和轻链可变区的配置关系没有特别限制,N末端侧为轻链可变区的方式和N末端侧为重链可变区中的任意一种情况均能够采用。
跨膜结构域是免疫受体配置在细胞膜上时被配置在细胞膜内的结构域,只要能够构成免疫受体即可,没有特别限制。作为跨膜结构域,能够使用例如TCRα链/β链、CD28、CD3ε、CD8α、CD3、CD4、4-1BB等的跨膜区域。各因子的跨膜区域是公知的,或者能够容易从公知的序列信息(利用例如跨膜区域的预测程序等)容易地确定。另外,也可以使用人工构建的由多肽构成的跨膜结构域。这些跨膜结构域只要不明显损害嵌合抗原受体的功能即可,可以适当导入突变。
抗原结合性结构域和跨膜结构域直接或经由间隔子连接。在使用间隔子的情况下,其序列没有特别限定,可以在间隔子中使用例如IgG、优选为人IgG(例如亚型IgG1或IgG4)的铰链部或其一部分、铰链部和CH2的一部分、或者跨膜结构域中利用的因子(例如CD28)的一部分等的序列。此外,通过利用铰链部或其一部分序列,可以期待构成柔性间隔子。
细胞内信号结构域是免疫受体配置在细胞膜上时被配置在细胞内的结构域,是能够传递免疫细胞的效应功能的发挥所需要的信号、即传递抗原结合性结构域与抗原结合时免疫细胞的活化所需要的信号的结构域。
细胞内信号结构域优选包含细胞内活性化结构域。作为细胞内活化结构域,例如除了CD3ζ以外,还能够使用FcεRIγ等的细胞内结构域。可以优选使用CD3ζ。CD3只要不损害免疫受体的功能即可,可以适当导入突变。在CD3中导入突变的情况下,优选以包含ITAM(免疫受体酪氨酸激活基序,immunoreceptor tyrosine-based activation motif)的方式进行突变。
免疫受体可以包含上述以外的其他区域。作为其他区域,可以列举例如共刺激因子细胞内结构域、为了促进免疫受体向细胞膜上的输送的前导序列(信号肽)(例如GM-CSF受体的前导序列)、间隔子/接头(例如跨膜区域与细胞内信号结构域之间、细胞内信号结构域内的各结构域之间)等。共刺激因子的细胞内结构域只要是源自T细胞等所具有的共刺激因子的细胞内结构域即可,没有特别限定。例如可以适当选择选自OX40、4-1BB、GITR、CD27、CD278和CD28等中的1种以上使用。
免疫受体可以是由1种多肽构成的分子,也可以是由2种以上的多肽的复合体构成的分子。另外,免疫受体可以是由多肽或其复合体构成的分子,也可以是多肽或其复合体上连接其他物质(例如荧光物质、放射性物质、无机颗粒等)而成的分子。
<3-2.淋巴细胞>
抗原特异性淋巴细胞只要表达针对HA-抗原组合物中的抗原(即能够与该抗原结合(优选为特异性结合)的)免疫受体即可,没有特别限制。在更具体的方式中,抗原特异性淋巴细胞在细胞膜上表达免疫受体,另外,免疫受体以抗原结合性结构域露出在细胞膜外的状态表达。
作为淋巴细胞,可以列举例如T细胞(例如CD8阳性细胞、CD4阳性细胞、CD4阳性CD8阴性T细胞、CD4阴性CD8阳性T细胞、由iPS细胞制备的T细胞、αβ-T细胞、γδ-T细胞等)、NK细胞、NKT细胞等。
抗原特异性淋巴细胞能够通过将包含免疫受体的编码序列的多聚核苷酸导入细胞而得到。
优选在上述多聚核苷酸的导入之前预先使免疫受体表达用细胞活化。例如能够用抗CD3抗体和抗CD28抗体进行刺激,使免疫受体表达用细胞活化。例如能够通过用由抗CD3抗体和抗CD28抗体包被了培养面的培养容器(例如培养皿)培养,由抗CD3抗体和抗CD28抗体施加刺激。也可以利用包被了抗CD3抗体和抗CD28抗体的磁珠(例如VERITAS公司提供的Dynabeads T-Activator CD3/CD28)进行该刺激。
为了提高细胞的存活率/增殖率,在进行活化处理时,优选使用添加有T细胞生长因子的培养液。作为T细胞生长因子,可以使用IL-2、IL-15、IL-7等。IL-2、IL-15、IL-7等T细胞生长因子可以按照常规方法制备。另外,也可以利用市售品。并不排除使用人以外的动物种类的T细胞生长因子,但通常T细胞生长因子使用来自人的T细胞生长因子(也可以是重组体)。
典型而言,为了其应用(向患者施用),使上述多聚核苷酸导入后的细胞(上述多聚核苷酸导入淋巴细胞)增殖。例如可以使用添加有T细胞生长因子的培养液培养上述多聚核苷酸导入淋巴细胞(根据需要进行传代培养)。在该培养以外,也可以进行与免疫受体表达用细胞的活化的情况下同样的处理(再活化)。
此外,在免疫受体表达用细胞和上述多聚核苷酸导入淋巴细胞的培养中也可以使用添加有血清(人血清、胎牛血清等)的培养基,但通过采用无血清培养基或血清浓度低的培养基,也可以制备具有如下优点的细胞:临床应用时的安全性高,且不易出现因血清批次间的差异引起的培养效率的差别。在使用血清的情况下,优选使用自体血清、即从接受免疫受体基因导入淋巴细胞的施用的患者采集的血清。另外,在培养时,可以使用用放射线照射(例如25-35Gy)将外周血单核细胞(例如混合(pooled)的数个健康人的外周血单核细胞)失活的饲养细胞等。
获得抗原特异性淋巴细胞的方法更具体如下所述。
编码免疫受体的核酸能够与其他核酸连结使其在适当的启动子的控制下表达。作为启动子,组成型促进表达的启动子、由药剂等(例如四环素或阿霉素)诱导型的启动子等中的任意一种都能够使用。能够使用例如磷酸甘油酸激酶(PGK)启动子、Xist启动子、β-肌动蛋白启动子、RNA聚合酶II启动子等的来自哺乳类的启动子、SV40早期启动子、巨细胞病毒启动子、单纯疱疹病毒的胸苷激酶启动子、各种逆转录病毒的LTR启动子等的来自病毒的启动子。为了实现有效的核酸的转录,可以连接包含与启动子或转录起始位点配合的其他调节元件(例如增强子序列或终止子序列)的核酸。另外,还可以整合能够成为用于确认核酸的表达的标记的基因(例如药剂耐性基因、编码报告酶的基因、或编码荧光蛋白的基因等)。
编码免疫受体的核酸可以使用载体导入细胞。
载体为了在适当的宿主内表达核酸,与适当的控制序列在功能上连结。作为这样的控制序列,包含转录核酸的启动子、控制转录的操纵子序列、编码核糖体结合位点的序列、增强子、聚腺苷酸化序列和控制转录、翻译的终止的序列等。载体能够使用公知的各种序列(例如限制酶酶切位点、药剂耐性基因等的标记基因(选择基因)、信号序列、前导序列等)。各种序列可以根据要表达的多肽的种类、宿主细胞、培养基等的条件适当选择使用。
作为载体,能够使用整合入宿主基因组的载体、没有整合入宿主基因组的载体、在细胞质中存在的自主复制的游离型载体等。作为那样的载体,能够例示例如逆转录病毒载体(包含致癌逆转录病毒载体、慢病毒载体、假型载体)、腺病毒载体、腺相关病毒(AAV)载体、猿猴病毒载体、痘苗病毒载体、仙台病毒载体、爱泼斯坦巴尔病毒(EBV)载体、HSV载体等的病毒载体。作为病毒载体,能够优选使用在感染的细胞中病毒无法自主复制这样的复制能力缺损的病毒载体。另外,通过脂质体和阳离子脂质等缩合剂的联用,也能够使用非病毒载体。此外,通过磷酸钙转染、DEAE-葡聚糖、电穿孔、粒子轰击,也可以向细胞导入核酸。
抗原特异性淋巴细胞能够通过将编码免疫受体的核酸导入细胞的工序来制备。表达免疫受体的细胞通过经由免疫受体与抗原结合,向细胞内传递信号而被活化。细胞的活化根据宿主细胞的种类或细胞内结构域的不同而不同,但能够以细胞因子的释放、细胞增殖率的提高、细胞表面分子的变化等为指标来确认。例如从活化细胞的细胞毒性的细胞因子(肿瘤坏死因子、淋巴毒素等)的释放会引起表达复合体的肿瘤细胞的破坏。另外,通过细胞因子释放或细胞表面分子的变化,刺激其他免疫细胞例如B细胞、树突状细胞、NK细胞、巨噬细胞等。因此,免疫受体表达细胞在过继性免疫疗法中有用。
将编码CAR的核酸导入细胞的工序可以在生物体外(ex vivo)或生物体内(invivo)实施。要导入核酸的细胞能够使用来自哺乳动物例如来自人的细胞或来自猴子、小鼠、大鼠、猪、牛、狗等非人哺乳动物的细胞。作为细胞的种类,能够使用例如从血液(外周血、脐带血等)、骨髓等的体液、组织或器官采集、分离、纯化、诱导的细胞。能够使用PBMC、免疫细胞[树突状细胞、B细胞、造血干细胞、巨噬细胞、单核细胞或NK细胞、血细胞系细胞(中性粒细胞、嗜碱性粒细胞、单核细胞)]、造血干细胞、脐带血单核细胞、成纤维细胞、前脂肪细胞、肝细胞、血细胞细胞、皮肤角化细胞、间充质干细胞、造血干细胞、脂肪干细胞、多能性干细胞、各种癌细胞系或神经干细胞。在本发明中,特别优选使用T细胞、T细胞的前体细胞(造血干细胞、淋巴细胞前体细胞等)、多能性干细胞或含有这些细胞的细胞群。T细胞包含CD8阳性T细胞或CD4阳性T细胞、控制性T细胞、细胞毒性T细胞、肿瘤浸润淋巴细胞。含有T细胞和T细胞的前体细胞的细胞群中包含PBMC。本发明中使用的细胞可以是从生物体采集的细胞、将其放大培养得到的细胞或作为作为细胞系建立的细胞中的任意一种。在希望将导入了核酸的细胞或由该细胞分化的细胞移植到生物体的情况下,优选在从该生物体自身或同种的生物体采集的细胞中导入核酸。
抗原特异性淋巴细胞可以在向对象施用之前使用适当的培养基和/或刺激分子进行培养和/或刺激。刺激分子包含细胞因子类、适当的蛋白质、其他成分。作为细胞因子类,可以例示例如IL-2、IL-7、IL-12、IL-15、IFN-γ等,优选例示IL-2。作为IL-2在培养基中的浓度,没有特别限定,例如为0.01~1×105U/mL,更优选为1~1×10
作为细胞的培养中使用的细胞培养用器材,没有特别限定,可以使用例如培养皿、烧瓶、袋、大型培养槽、生物反应器等。此外,作为袋,可以使用细胞培养用CO
4.用途
通过将HA-抗原组合物与抗原特异性淋巴细胞组合使用,能够更强、更有效、更持续地和/或在更宽的范围内发挥抗肿瘤效果。因此,本发明在其一部分方式中,涉及含有HA-抗原组合物的、用于与抗原特异性淋巴细胞联合给药的医药组合物;含有抗原特异性淋巴细胞的、用于与HA-抗原组合物联合给药的医药组合物;以包含HA-抗原组合物和抗原特异性淋巴细胞的组合为特征的医药组合物等。此外,HA-抗原组合物也可以作为T细胞激活疫苗等利用。
给药对象(例如人、小鼠、猴子、狗、猫等的动物(特别是哺乳类动物))可以为例如患有癌症的对象。
上述医药组合物能够用于预防或治疗(或改善)癌症(目标疾病)。目标疾病包括实体癌和血癌。作为目标疾病,可以列举例如各种B细胞性恶性淋巴瘤(B细胞性急性淋巴细胞白血病、滤泡性淋巴瘤、弥漫性淋巴瘤、套细胞淋巴瘤、MALT淋巴瘤、血管内B细胞性淋巴瘤、CD20阳性霍奇金淋巴瘤等)、骨髓增殖性疾病、骨髓增生异常/骨髓增殖性肿瘤(CMML,JMML,CML,MDS/MPN-UC)、骨髓增生异常综合征、急性骨髓性白血病、多发性骨髓瘤、肺癌、大肠癌、卵巢癌、乳腺癌、脑肿瘤、胃癌、肝癌、舌癌、甲状腺癌、肾脏癌、前列腺癌、子宫癌、骨肉瘤、软骨肉瘤、横纹肌肉瘤等。“治疗”包括缓解目标疾病特征性症状或伴随症状(轻症化)、阻止或延迟症状的恶化等。“预防”是指防止或延迟疾病(障碍)或其症状的发病/表现、或者降低发病/表现的危险性。另一方面,“改善”是指疾病(障碍)或其症状缓解(轻症化)、好转、缓解或治愈(包含部分治癒)。
免疫检查点抑制剂对黑色素瘤或肺癌等显示优异的效果,但治疗效果限于20%左右。现在,希望有对于被称为免疫沙漠型或免疫排除型的肿瘤内T细胞数少的冷肿瘤(Coldtumor)的治疗方法。
小鼠黑色素瘤细胞B16F10中MHC的表达非常低(非专利文献:Oncoimmunology.2017;6(6):e1259049)为低免疫原性的(非专利文献:Cancer Res.2000;60:5514-5521、非专利文献:Curr Opin Genet Dev.2014;24:46-51)、肿瘤内T细胞数少的典型的冷肿瘤(非专利文献:Genomics 21,2(2020)),同时具有高的转移性(非专利文献:JImmunogenet 1989;16(4-5):291-303)。使用B16F10的非临床模型作为低免疫原性的癌症、高转移性的癌症、肿瘤内T细胞数少的癌症的非临床模型被广为使用,难以显示抗肿瘤效果。
本发明的医药品组合物在该使用B16F10的模型中显示出高的效果,因此对于低免疫原性的癌症也能够发挥良好的效果。
这里,低免疫原性的癌症是指癌细胞的I类MHC的表达降低或消失、肿瘤抗原的提呈降低或不提呈、免疫原性低的癌症。具体而言,全部癌细胞中的表达I类MHC的癌细胞的比例例如为50%以下。随着I类MHC的表达量变低,癌症的治疗变难,如果为40%以下、30%以下、20%以下、10%以下、5%以下、特别是1%以下则治疗困难。I类MHC的表达量能够利用免疫组化染色或FCS解析来测定。
本发明的医药品组合物在该使用B16F10的模型中显示高的效果,因此对于转移性的癌症也能够发挥良好的效果。
其中,作为转移性癌症的原发性肿瘤部位,没有限定,可以列举:膀胱、骨、骨髓、脑、乳房、颈部、结肠、子宫内膜、食道、肠、肾脏、肝脏、肺、口腔、肌肉、卵巢、皮肤、胰脏、前列腺、皮肤、胃、睾丸、甲状腺、子宫、以及例如包含血管结构物的任意的过剩增生性组织(例如内皮细胞、平滑肌细胞、周细胞、疤痕、纤维化组织、外科的粘连组织、或过度增生性骨病变)等。其中,转移性癌症的转移性部位没有限定,可以列举肾上腺、骨、脑、肾脏、肝脏、肺、淋巴结、卵巢、腹膜、皮肤、脾脏等。
本发明的医药品组合物在该使用B16F10的模型中显示高的效果,因此对于肿瘤内T细胞数少的癌症也能够发挥良好的效果。
其中,肿瘤内T细胞数少的癌症是指在肿瘤内T细胞非常少或完全不存在的癌症。具体而言,T细胞相对于癌细胞的比例例如为10%以下。T细胞的比例越低,则免疫检查点抑制剂等抗癌剂越难以起效,如果为5%以下、3%以下、1%以下、0.5%以下、0.3%以下、0.1%以下则治疗困难。T细胞的比例能够利用免疫组化染色或FCS解析进行测定。
HA-抗原组合物与抗原特异性淋巴细胞的联合给药可以同时给药,可以同日给药,也可以隔开间隔给药。在优选的一个方式中,优选在HA-抗原组合物的给药后(更优选为HA-抗原组合物和佐剂的给药后),施用抗原特异性淋巴细胞。在该情况下,HA-抗原组合物与抗原特异性淋巴细胞的给药间隔(多次给药的情况下,相同给药次之间的间隔)能够设为例如1天~1周、1~3天、1~2天。
以包含HA-抗原组合物与抗原特异性淋巴细胞的组合为特征的医药组合物也可以为试剂盒的形态。该医药组合物例如可以为包含HA-抗原组合物和抗原特异性淋巴细胞的癌症治疗试剂盒。
<4-1.HA-抗原组合物的使用>
HA-抗原组合物可以经由口服、肠外、鼻腔内、阴道内、眼内、皮下、静脉内、肌肉内、皮内、腹腔内、关节腔内、脑内、口腔内、脂肪组织内、乳腺组织内、吸入等途径给药。优选为经由皮下、肌肉内、静脉内、皮内给药。
HA-抗原组合物能够作为包含1种或1种以上的药学上可接受的稀释剂、湿润剂、乳化剂、分散剂、辅助剂、防腐剂、缓冲剂、结合剂、稳定剂等的医药组合物,根据目标给药途径,制成适当任意的形态给药。给药途径可以是非口服的途径,也可以是口服的途径。
HA-抗原组合物的给药量可以适当确定。例如作为通常的给药量,作为抗原,可以使用0.1mg/次~100mg/次左右的量。给药次数优选为2~20次。给药间隔可以在1天~2周之间选择。
HA-抗原组合物可以和1种以上的佐剂组合给药。作为使用的佐剂,只要是具有增强抗原提呈细胞的活性的作用的物质即可,更具体而言,可以选择活化自然免疫受体(模式识别受体)的物质或其他抗原提呈细胞刺激物质、具有抑制抗原提呈细胞获得免疫抑制活性的作用的物质。自然免疫受体被分类为Toll样受体(TLR)、C型凝集素受体(CLR)、NOD样受体(NLR)、RIG-I样受体(RLR)和细胞质DNA传感器。作为是自然免疫受体激动剂的佐剂,可以选自失活菌体或菌体提取物、核酸、聚多糖、多肽、合成低分子化合物等,可以优选使用CpG寡聚DNA、聚IC RNA、咪唑并醌(例如R848或咪喹莫特等)、皂苷(例如QuilA或QS21等)、STING激动剂(例如循环di-GMP等)、单磷酰脂质或脂肽等。作为是抗原提呈细胞刺激剂的佐剂,可以使用紫杉烷类的药物或蒽环类的药物。作为是具有抑制抗原提呈细胞获得免疫抑制活性的作用的药剂的佐剂,可以选自JAK/STAT的抑制物质、吲哚脱氧酶(IDO)的抑制物质、色氨酸脱氧酶(TDO)的抑制物质等。这些抑制物质中,对于该因子具有拮抗作用的化合物之外,也包含该因子的中和抗体、小干扰RNA(small interfering RNA,siRNA)或反义DNA。
HA-抗原组合物中使用的佐剂优选作为自然免疫受体激动剂的佐剂,进而优选Toll样受体(TLR)、细胞质DNA传感器的激动剂。作为TLR激动剂,优选CpG寡聚DNA或聚ICRNA、R848或咪喹莫特这样的咪唑并醌、QuilA或QS21这样的皂苷、STING激动剂、单磷酰脂质。
佐剂既可以作为独立于HA-抗原组合物的其他制剂施用,也可以作为一体的制剂施用。另外,也可以通过国际公开第2010/053140号中记载的方法,佐剂也可以缀合于导入了疏水性基团的透明质酸衍生物施用。在联合给药时的HA-抗原组合物的给药量例如为0.01~100mg/次,优选为0.1~50mg/次,更优选为例如0.1~20mg/次,佐剂的给药量例如为0.01~100mg/kg体重,优选为0.1~50mg/kg体重,更优选为0.1~10mg/kg体重。佐剂可以与HA-抗原组合物相同的时机(包括在制剂中含有佐剂的情况)给药,也可在不同的时机给药。在不同的时机给药时,优选在施用一者后,在例如1分钟~5小时、优选为1分钟~1小时以内施用另一者。
HA-抗原组合物可以与癌症治疗中使用的1种以上的抗体联合给药。抗体为例如抑制由肿瘤造成的免疫抑制信号的抗体或使免疫细胞的共刺激信号活化的1种以上的抗体,优选为抑制由肿瘤造成的免疫抑制信号的抗体或使免疫细胞的共刺激信号活化的抗体。具体而言,为选自抗CTLA4抗体、抗PD1抗体、抗PDL1抗体、抗OX40、抗4-1BB抗体中的1种以上的抗体。联合给药时的HA-抗原组合物的给药量例如为0.01~100mg/次,优选为0.1~50mg/次,更优选为0.1~20mg/次,抗体的给药量例如为0.01~200mg/kg体重,优选为0.1~100mg/kg体重,更优选为1~40mg/kg体重。抗体可以以与HA-抗原组合物相同的时机(包括制剂中包含抗体的情况)给药,也可以在不同的时机给药。在不同的时机给药时,优选在使用一者后,在例如1分钟~24小时、优选为1分钟~5小时以内施用另一者。
HA-抗原组合物可以与上述佐剂和抗体这两者联合给药,该情况下的HA-抗原组合物的给药量例如为0.01~100mg/次,优选为0.1~50mg/次,更优选为例如0.1~20mg/次,佐剂的给药量例如为0.01~100mg/kg体重,优选为0.1~50mg/kg体重,更优选为0.1~10mg/kg体重,抗体的给药量例如为0.01~200mg/kg体重,优选为0.1~100mg/kg体重,更优选为1~40mg/kg体重。佐剂和抗体可以与HA-抗原组合物在相同时机(包括制剂中包含佐剂和抗体的情况)给药,也可以在不同的时机给药。在不同的时机给药时,优选将疫苗制剂、佐剂和抗体全部在例如1分钟~24小时、优选为1分钟~5小时以内施用
在本发明的优选的一个方式中,HA-抗原组合物优选在施用抗原特异性淋巴细胞之前给药。在本发明的优选的一个方式中,将在施用1次HA-抗原组合物后输注1次抗原特异性淋巴细胞作为给药次数的单位时,优选在进行了1单位或2单位的给药后,施用至少1次HA-抗原组合物。
在本发明的优选的一个方式中,HA-抗原组合物的第1次给药和第2次给药的间隔例如可以为1天以上、2天以上、3天以上、4天以上、5天以上、6天以上、7天以上、8天以上、9天以上、10天以上、11天以上、12天以上、13天以上或14天以上。另外,该间隔例如可以为28天以下、24天以下、21天以下、17天以下、14天以下、13天以下、12天以下、11天以下、10天以下、9天以下、8天以下、7天以下、6天以下、5天以下、4天以下、3天以下或2天以下。
<4-2.抗原特异性淋巴细胞的使用>
抗原特异性淋巴细胞可以作为细胞制剂,在表达抗原结合性结构域的靶标抗原的肿瘤/癌症(目标疾病)的治疗、预防或改善中广泛利用。
作为细胞制剂中的抗原特异性淋巴细胞的含量,没有特别限定,优选1×10
抗原特异性淋巴细胞的给药途径没有特别限定。例如通过静脉内注射、动脉内注射、门静脉注射、皮内注射、皮下注射、肌肉内注射、或腹腔内注射给药。不仅可以全身给药,也可以局部给药。作为局部给药,可以例示向目标组织、脏器、器官的直接注入。给药方案考虑对象(患者)的性别、年龄、体重、病情等制定即可。除了单次给药以外,也可以连续或定期多次给药。给药次数优选为2~20次。给药隔可以在1天~2周之间选择。
实施例
以下,根据实施例详细说明本发明,但本发明并不限定于这些实施例。
<材料和方法(实施例1~5)>
(1)细胞
RPMI1640培养基(添加2-巯基乙醇)从细胞科学研究所购入。胎牛血清(FBS)从Gibco购入。小鼠纤维肉瘤CMS5a细胞株使用从纪念斯隆凯特琳癌症中心出让、由三重大学传代的细胞。小鼠纤维肉瘤CMS5a细胞株表达突变型ERK2蛋白。包含突变型ERK2蛋白的突变部分的肽(QYIHSANVL(序列编号1))被BALB/c小鼠的CD8阳性细胞毒性T细胞识别。分离识别该肽的T细胞受体(TCR),制作出进行了TCR基因导入的转基因小鼠(DUC18小鼠)。本实施例中使用的长链肽抗原包含上述突变型ERK2的CD8阳性细胞毒性T细胞识别表位序列(QYIHSANVL)。
(2)试验动物
雌性BALB/c小鼠(CD90.2阳性)从日本SLC购入6周龄~8周龄的小鼠。DUC18转基因小鼠使用从华盛顿大学出让、由三重大学繁殖的小鼠。两小鼠用三重大学尖端科学研究支援中心动物实验设施饲养。动物实验的操作步骤(protocol)得到了三重大学医学部的伦理委员会批准。
(3)透明质酸纳米凝胶(HANG)
如国际公开第2010/053140号的实施例1和2所记载,合成了导入胆甾醇基的透明质酸纳米凝胶(重均分子量为99kDa、胆甾醇基的导入率为42%)。
(4)长链肽抗原
合成长链肽从Sigma genosis购入。序列如下:NDHIAYFLYQILRGLQYIHSANVLHRDLKPSNLLLNT(序列编号2)。
该序列作为CD8阳性细胞抑制性T细胞识别表位序列包含第16位的Q至第24位的L的9个氨基酸的序列(QYIHSANVL(序列编号1)),作为CD4阳性辅助性T细胞识别表位序列包含第13位的R至第29位的K的17个氨基酸的序列(RGLQYIHSANVLHRDLK(序列编号3))。
(5)透明质酸纳米凝胶与抗原的复合体制作
使透明质酸纳米凝胶溶解在超纯水中使其成为12mg/mL,实施超声波处理(Covaris公司制,E220X)。抗原肽以成为50mg/mL的方式溶解在DMSO中。对HA衍生物水溶液,加入抗原肽DMSO溶液,用浴型声波仪进行30分钟超声波处理。转移到透析试剂盒(Slide-A-Lyzer,截留分子量3.5K)中,在5mM碳酸缓冲液pH9、10mM磷酸缓冲液pH7、含10%蔗糖的10mM磷酸缓冲液pH7中依次透析。通过反向色谱分析,对抗原肽浓度定量,调整浓度使其达到250~500μg/mL,作为给药溶液。在没有达到目标浓度时,用超浓缩器(Vivaspin6,5000MwCO,Sartorius)浓缩。将所得到的复合体有时也表示为“长链肽抗原搭载HA纳米凝胶癌症疫苗”或“HA纳米凝胶癌症疫苗”。
(6)其他试剂
·佐剂
CpG寡聚DNA1668从Ajinomoto Bio-Pharma Services Gene Design购入。
·荧光标记抗体
eFluor450标记抗小鼠CD8a抗体(克隆53-6.7)、eFluor450标记抗小鼠KLRG1抗体(克隆2F1)、APC标记抗小鼠CD45R(B220)抗体(克隆RA3-6B2)从eBioscience购入。APC标记抗小鼠CD8a抗体(克隆53-6.7)、APC标记抗小鼠CD4抗体(克隆RM4-5)、PerCP-Cy5.5标记抗小鼠CD90.1抗体(克隆OX-7)、PerCP-Cy5.5标记抗小鼠F4/80抗体(克隆BM8)、PE标记抗小鼠CD207抗体(克隆4C7)、Pacific blue标记抗小鼠CD90.2抗体(克隆30-H12)、PurifiedCD16/32抗体(克隆93)从BioLegend购入。FITC标记抗小鼠CD11c抗体(克隆HL3)、PerCP-Cy5.5标记抗小鼠CD3抗体(克隆145-2C11)从BD BIOSCIENCES购入。APC标记抗小鼠IFN-γ抗体(克隆XMG1.2)从eBioscience或者TONBO购入。组织染色用的抗小鼠CD8a抗体(克隆4SM15)从Invitrogen购入,Alexa488标记抗大鼠IgG(H+L)抗体从Cell Signaling购入。
·短链肽抗原
CD8阳性T细胞刺激用的合成短链肽从sigma genosis购入。序列如下所示:QYIHSANVL(序列编号1)。
实施例1.肿瘤增殖试验
使用T75培养烧瓶(Corning),在含有10%FBS的RPMI1640培养基中培养小鼠纤维肉瘤CMS5a细胞株。培养的细胞用含0.5%胰蛋白酶的PBS剥离,悬浮于含10%FBS的RPMI1640培养基。将悬浮液离心分离(400×g、5分钟、4℃)后去除上清。然后,使用RPMI1640培养基清洗2次,以1×10
在施用长链肽抗原搭载HA纳米凝胶癌症疫苗的情况下,在肿瘤移植7天后和11天后,将长链肽抗原搭载HA纳米凝胶癌症疫苗50μg与溶解于PBS的50μg的CpG寡聚DNA一起在小鼠的右侧后背部进行皮下施用(HANG-V组)。
在施用抗原特异性T细胞的情况下,在肿瘤移植8天后和12天后,从突变型ERK2特异性TCR基因导入DUC18小鼠(CD90.1阳性或者CD90.2阴性)的脾脏,将CD8阳性T细胞使用CD8a微珠(Miltenyi)分离,以2×10
<实施例1结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用带来的抗肿瘤效果,使用免疫检查点抑制剂(ICI)抗性纤维肉瘤细胞株CMS5a荷瘤小鼠,制作包含在CMS5a表达的突变型ERK2抗原(mERK2)的CD8表位的长链肽抗原与HA纳米凝胶复合化的长链肽抗原搭载HA纳米凝胶癌症疫苗,与mERK2识别TCR基因导入T细胞输注疗法联用,研究治疗效果。其结果,如图1-1和图1-2所示,HANG-V和TCR-T联用治疗组,与HANG-V单独治疗组或者TCR-T单独治疗组相比,明显抑制CMS5a肿瘤的增殖,使肿瘤消退,在治疗7天后在全部小鼠中均确认到肿瘤的消失(图1-1和图1-2)。该效果长时间持续,即使在该小鼠中再移植CMS5a也没有确认到肿瘤增殖,小鼠没有复发而长时间存活(图1-3)。从这些结果可知,HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用具有强力抗肿瘤作用,能够治愈ICI抗性肿瘤。另外可知该联用即使在肿瘤治癒后也能够抑制肿瘤的复发,表明了HA纳米凝胶癌症疫苗使抗原特异性T细胞的抗肿瘤作用增强的可能性。
实施例2.疫苗施用部位区域淋巴结的抗肿瘤免疫应答解析
在实施例1的试验的肿瘤移植14天后采集疫苗施用部位的区域淋巴结(右腹股沟淋巴结),使用载玻片玻璃将淋巴结磨碎后,将细胞悬浮于RPMI1640培养基。此时,将相当于1组2只的细胞混合(pool)。离心分离(400×g、5分钟、4℃)后除去上清,用RPMI1640培养基清洗2次后,悬浮于含10%FBS的RPMI1640培养基。使用细胞血细胞计测定细胞数(图2-1),调制使得细胞浓度为2×10
骨髓系细胞的染色(图2-3、图2-4):在96孔V底微孔板(NUNC)中将细胞悬浮液在每1孔中以4×10
淋巴细胞的染色(图2-4):在96孔V底微孔板(NUNC)中,将细胞悬浮液在每1孔中以4×10
CD8阳性输注T细胞的染色(图2-5):在96孔V底微孔板(NUNC)中,将细胞悬浮液在每1孔中以4×10
抗原特异性T细胞诱导试验(细胞内细胞因子染色)(图2-6):在48孔培养板(NUNC)中,将细胞悬浮液在每1孔以4×10
<实施例2结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用中的HA纳米凝胶癌症疫苗对抗肿瘤免疫应答造成的影响,在肿瘤移植14天后采集HA疫苗施用部位的区域淋巴结,进行了淋巴结细胞的解析。其结果,HANG-V单独组和HANG-V、TCR-T联用组的淋巴结明显肿胀,在两组中与未治疗组相比较,确认到了约4~8倍的淋巴结细胞的增加(图2-1)。另外,淋巴结的肿胀在肿瘤移植22天后也持续确认到(图2-2)。接着,对流入、聚集在区域淋巴结的骨髓系抗原提呈细胞的比例进行了研究,其结果在HANG-V单独组和HANG-V、TCR-T联用组的两组中,确认到了骨髓系抗原提呈细胞的增加。特别是在联用组中明显确认到朗格汉斯细胞的增加(图2-3)。进而,为了解明HA纳米凝胶癌症疫苗对区域淋巴结细胞数造成的影响,进行了区域淋巴结的淋巴细胞和骨髓系细胞的解析。其结果,如图2-4所示,在HANG-V组中,确认到淋巴细胞(T细胞、B细胞、NK细胞)和骨髓系细胞的数倍到数十倍的增加(图2-4)。另外,对于CD8阳性输注T细胞向区域淋巴结的流入进行了研究,结果,HANG-V、TCR-T联用组,与TCR-T单独组相比较,区域淋巴结的CD8阳性输注T细胞的比例显著上升(图2-5),可知其中约80%与肿瘤抗原特异性反应产生IFN-γ(图2-6)。另外,HANG-V、TCR-T联用组也确认到了宿主的IFN-γ产生CD8阳性T细胞比例的上升(图2-6)。根据这些结果,提示了如下的可能性:HA纳米凝胶癌症疫苗在荷瘤宿主的免疫抑制环境中,使宿主的树突状细胞或巨噬细胞、朗格汉斯细胞等的抗原提呈细胞和淋巴细胞大量流入、积累在区域淋巴结中,创建有效的肿瘤抗原提呈环境。此外,在该肿瘤抗原提呈提高的环境中,通过抗原特异性T细胞输注疗法补充T细胞的结果,表明了如下的可能性:流入区域淋巴结的CD8阳性输注T细胞就能够高效地接受抗原提呈,使CD8阳性输注T细胞诱导、增殖成在质上与量上强力的肿瘤抗原特异性细胞毒性T细胞(CTL),在区域淋巴结中持续构建协同抗肿瘤免疫环境。
实施例3.输注细胞数量渐减带来的治疗效果和抗肿瘤免疫应答解析
关于小鼠肿瘤增殖试验(实施例1)和抗肿瘤免疫应答解析(实施例2),将抗原特异性T细胞使数量从2×10
<实施例3结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性输注T细胞疗法联用治疗效果中的CD8阳性输注T细胞数的影响,将CD8阳性输注T细胞使其数量逐渐减少地施用,对治疗效果和抗肿瘤免疫应答进行研究。其结果,即使在将CD8阳性输注T细胞数逐渐减少成1×10
实施例4.肿瘤内浸润CD8阳性T细胞的观察
在实施例1的试验的肿瘤移植14天后将肿瘤摘出,通过如下所示的方法实施免疫组织荧光染色。将用O.C.T.冰冻切片包埋剂(O.C.T.compound,Sakura Finetech)包埋冻结的肿瘤切成5μm厚,对所得到的肿瘤切片进行风干。对干燥的肿瘤切片用冰冷的丙酮进行10分钟的固定,用于免疫染色。将肿瘤切片用PBS清洗3次后,浸渍在Blocking One Histo(Nacalai Tesque)中,在培养室内进行30分钟阻断。接着使用由具有背景降低成分的抗体稀释剂(Antibody Diluent with Background reducing Component,Dako)稀释100倍的抗小鼠CD8抗体,在培养室对肿瘤切片在室温进行1小时染色。进而,用含0.1%Tween20的PBS进行3次清洗后,使用由PBS稀释1000倍的Alexa488标记抗大鼠抗体,在培养室对肿瘤切片在室温进行1小时染色。最后用含0.1%Tween20的PBS进行3次清洗,将肿瘤切片浸渍在Prolong Gold含DAPI的抗淬灭试剂(Prolong Gold antifade reagent with DAPI,LifeTechnologies)中,使用荧光显微镜BZ-710(Keyence)观察在肿瘤内浸润的CD8阳性T细胞。
<实施例4结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用对荷瘤宿主的肿瘤内环境造成的影响,在肿瘤移植14天后摘出各个小鼠的肿瘤,用荧光显微镜观察在肿瘤内浸润的CD8阳性T细胞。其结果,HANG-V和TCR-T联用组与未治疗或者单独治疗组相比较,在肿瘤内明显确认到CD8阳性T细胞(图4)。该结果表明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法的联用具有在肿瘤内诱导肿瘤抗原特异性细胞毒性T细胞(CTL)、使肿瘤消失的可能性。
实施例5.外周血中CD8阳性输注T细胞的解析
在实施例3的试验的肿瘤移植21天后从小鼠眼窝采集外周血,悬浮于含10%肝素的RPMI中进行混合。然后,将悬浮液缓慢注入添加到微量离心管中的Ficoll(GEHealthcare)500uL中,离心分离(4000rpm×10min、25℃、AC:1、DE:1)后,将单核细胞层回收到染色用缓冲液(含0.5% BSA的PBS)中。将细胞悬浮液离心分离(5000rpm×1min、25℃)后,将上清用抽吸器除去,用含0.5% FBS的PBS清洗2次。按照各抗体的制造商推荐的使用浓度,添加APC标记抗小鼠CD8抗体、PerCP-Cy5.5标记抗小鼠CD90.1抗体、Pacific blue标记抗小鼠CD90.2抗体混合后,在4℃的暗处静置15分钟。用200μL的染色用缓冲液将细胞清洗2次后,在200μL的染色用缓冲液中进行重悬,移到圆底聚苯乙烯管(BD BIOSCIENCES公司)。细胞通过流式细胞仪FACS Canto II(BD BIOSCIENCES公司)和附带的解析软件(FACSDiva)进行解析。
<实施例5结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注后的全身的CD8阳性输注T细胞的生存持续性(persistence),在肿瘤移植21天后采集外周血细胞,对在外周血中存在的CD8阳性输注T细胞的比例进行研究。其结果得知,CD8阳性输注T细胞在肿瘤移植21天后也在全身循环且在血中存在。另外,即使在将CD8阳性输注T细胞数渐减至2.5×10
<实施例1~5小结>
根据以上的结果可知,HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用通过HA纳米凝胶癌症疫苗促进抗原提呈细胞或输注T细胞向区域淋巴结的流入、聚集,经由抗原提呈将输注T细胞诱导至肿瘤抗原特异性细胞毒性T细胞(CTL),能够使ICI抗性肿瘤消失、治癒。本疗法除了能够在质和量上提高输注T细胞的优点以外,也能够作用于宿主的T细胞,使宿主的免疫抑制环境向抗肿瘤环境转移。
此外可知,本效果在远少于以往的输注细胞数的输注细胞数时也显示同等的效果,在治癒后在全身也长时间持续,能够抑制肿瘤的复发,宿主能够长期生存。
通常,癌症疫苗是提高抗原提呈细胞的抗原提呈能力、期待T细胞的抗肿瘤效果的治疗方法,但很多癌症患者的免疫环境是抑制性的,因此即使通过疫苗能够将肿瘤抗原提呈给T细胞,如果体内存在的T细胞少则治疗效果也有限,需要与疫苗同时补充T细胞。另一方面,抗原特异性T细胞输注疗法是将癌症患者的T细胞在体外改变为抗原特异性T细胞在回输到体内的治疗方法,但输注的T细胞缓慢耗竭、减弱,为了持续治疗效果,T细胞的持续输注和在体内维持优质的T细胞成为重要的课题。
在本发明中,补充各种治疗方法的弱点,结果,通过HA纳米凝胶癌症疫苗,在区域淋巴结创建有效的肿瘤抗原提呈环境,进而通过T细胞输注疗法在本环境下补充T细胞,结果可以认为成功构建肿瘤抗原特异性CTL在质上和量上且可持续地诱导的抗肿瘤免疫环境,发挥协同治疗效果。
<材料和方法(实施例6~16)>
(1)细胞
RPMI1640培养基(添加2-巯基乙醇)从细胞科学研究所购入。D-MEM培养基从和光纯药购入,胎牛血清(FBS)从Gibco购入。小鼠纤维肉瘤细胞株CMS5a由纪念斯隆凯特琳癌症中心出让,小鼠转移性恶性黑色素瘤细胞株B16F10从ATCC购入,使用由三重大学传代的细胞株。小鼠纤维肉瘤细胞株CMS5a表达突变型ERK2蛋白。包含突变型ERK2蛋白的突变部分的肽(QYIHSANVL(序列编号1))被BALB/c小鼠的CD8阳性细胞毒性T细胞识别。分离识别该肽的T细胞受体(TCR),制作出进行了TCR基因导入的转基因小鼠(DUC18小鼠)。本实施例中使用的长链肽抗原包含上述突变型ERK2的CD8阳性细胞毒性T细胞识别表位序列(QYIHSANVL)。小鼠转移性恶性黑色素瘤细胞株B16F10表达肿瘤抗原gp100蛋白质,该蛋白质所含的p25-33肽(EGSRNQDWL(序列编号4))被C57BL/6小鼠的CD8阳性细胞毒性T细胞识别,制作出识别该CD8阳性细胞毒性T细胞识别表位序列的进行了TCR基因导入的转基因小鼠(Pmel-1小鼠)。本实施例中使用的长链肽抗原包含本序列。
(2)试验动物
雌性BALB/c小鼠和雌性C57BL/6小鼠从日本SLC购入6周龄~8周龄的小鼠。DUC18转基因小鼠使用由华盛顿大学出让且由三重大学动物实验设施繁殖得到的小鼠。Pmel-1转基因小鼠使用从Jackson研究所购入且由三重大学动物实验设施繁殖得到的小鼠。全部小鼠由三重大学动物实验设施饲养。动物实验的操作步骤得到了三重大学医学部的伦理委员会的批准。
(3)使用分子量10k的HA纳米凝胶、肽mERK2的复合体的制作(实施例11~16中使
(3-1)透明质酸纳米凝胶(HANG)
如国际公开第2010/053140号的实施例1和2所述,合成导入了胆甾醇基的透明质酸纳米凝胶(重均分子量为10kDa、胆甾醇基的导入率为44和41%)。
(3-2)长链肽抗原
合成长链肽从Biologica购入。序列如下:NDHIAYFLYQILRGLQYIHSANVLHRDLKPSNLLLNT(序列编号2)。该序列作为CD8阳性细胞毒性T细胞识别表位序列包含第16位的Q至第24位的L的9个氨基酸的序列(QYIHSANVL(序列编号1)),作为CD4阳性辅助性T细胞识别表位序列包含第13位的R至第29位的K的17个氨基酸的序列(RGLQYIHSANVLHRDLK(序列编号3))。
(3-3)透明质酸纳米凝胶和抗原的复合体制作
称量透明质酸纳米凝胶的冻结干燥体,添加注射用水使其达到5mg/mL的浓度,搅拌过夜使其充分溶解。另一方面,在另一个容器中,以肽的浓度成为50mg/mL的方式溶解于二甲基亚砜中。接着,将上述透明质酸纳米凝胶水溶液与肽的二甲基亚砜溶液以容量比100:1的比例混合,在室温搅拌24小时,由此得到包含肽-透明质酸纳米凝胶复合体的组合物。然后,将固体的纯化蔗糖(富士胶片和光株式会社制、制造专用、制品编号198-18385)以包含肽-透明质酸纳米凝胶复合体的组合物成为10质量%蔗糖的方式添加,搅拌1小时以上。接着,用含10质量%蔗糖的25mM磷酸缓冲液(pH 7.4)以肽的理论浓度成为0.3mg/mL的方式进行稀释,用0.2μmPES(聚醚砜)(Pall公司制、Acrodisc注射式过滤器、Φ25mm)进行灭菌过滤,得到包含肽-透明质酸纳米凝胶复合体的组合物。利用反向色谱分析对此时的包含肽-透明质酸纳米凝胶复合体的组合物中的肽浓度进行定量后,以肽浓度成为250ug/mL的方式用10%蔗糖10mM磷酸缓冲液(pH 7.4)进行浓度调整,制成施用溶液。
(4)使用分子量10k的HA纳米凝胶、肽gp100的复合体的制作(实施例6~10中使用)
(4-1)透明质酸纳米凝胶(HANG)
如国际公开第2010/053140号的实施例1和2所述,合成导入了胆甾醇基的透明质酸纳米凝胶(重均分子量为10kDa、胆甾醇基的导入率为44%)。
(4-2)长链肽抗原
使用上述得到的透明质酸纳米凝胶,如下进行肽-透明质酸纳米凝胶复合体的制备。gp100 TRP2 TRP1_6Y肽从Biologica购入。序列如下:SVYDFFVWLYYYYYYTWHRYHLLYYYYYYEGSRNQDWL(序列编号5)。该序列作为CD8阳性细胞毒性T细胞识别表位序列包含下述TRP2(氨基酸序列:SVYDFFVWL(序列编号6))、TRP1(氨基酸序列:TWHRYHLL(序列编号7))、gp100(氨基酸序列:EGSRNQDWL(序列编号4)),各表位之间通过6个Y结合。
(4-3)透明质酸纳米凝胶和抗原的复合体制作
称量透明质酸纳米凝胶的冻结干燥体,添加注射用水使得成为5mg/mL的浓度,搅拌过夜充分溶解。另一方面,在另一个容器中,以肽的浓度成为50mg/mL的方式溶解于二甲基亚砜。确认溶解后,在室温,将上述透明质酸纳米凝胶水溶液和1mol/L的氢氧化钠水溶液以容量比100:2的比例混合。接着,将上述透明质酸纳米凝胶水溶液和肽的二甲基亚砜溶液以容量比102:1的比例混合,在室温搅拌24小时,由此得到包含肽-透明质酸纳米凝胶复合体的组合物。然后,将固体的纯化蔗糖(富士胶片和光株式会社制、制造专用、制品编号198-18385)以包含肽-透明质酸纳米凝胶复合体的组合物成为10质量%蔗糖的方式添加,搅拌1小时以上。接着,用含10质量%蔗糖的25mM磷酸缓冲液(pH 7.4)以肽的理论浓度成为0.3mg/mL的方式稀释,用0.2μmPES(聚醚砜)(Pall公司制、Acrodisc注射式过滤器、Φ25mm)进行灭菌过滤,得到包含肽-透明质酸纳米凝胶复合体的组合物。利用反向色谱分析对此时的包含肽-透明质酸纳米凝胶复合体的组合物中的肽浓度进行定量后,以肽浓度成为250ug/mL的方式用10%蔗糖10mM磷酸缓冲液(pH 7.4)进行浓度调整,制成施用溶液。
(5)使用CHP、肽gp100的复合体的制作(实施例7中使用)
(5-1)胆甾醇基修饰普鲁兰多糖(CHP)
使用日油株式会社制的CHP(胆甾醇基修饰普鲁兰多糖、制品编号CHP-80T)。
(5-2)长链肽抗原
使用上述gp100肽(序列编号5)。
(5-3)透明质酸纳米凝胶和抗原的复合体制作
将CHP的粉体以成为10mg/mL的浓度的方式溶解于含6M尿素的磷酸缓冲生理盐水pH 7.4中。另一方面,在另一个容器中,以肽的浓度成为50mg/mL的方式溶解于二甲基亚砜。将上述含6M尿素的CHP水溶液和肽的二甲基亚砜溶液以容量比计为100:1的比例混合,在室温孵育12小时以上,得到包含肽-CHP复合体的组合物。然后,移到透析盒(Thermo公司制、Slide-A-Lyzer G2 Dialysis Cassettes、3.5KMWCO、15mL),用含0.6M尿素的磷酸缓冲生理盐水pH 7.4透析。接着,依次用含0.06M尿素的磷酸缓冲生理盐水pH 7.4、磷酸缓冲生理盐水pH 7.4进行透析。进而用超浓缩器(Vivaspin20、MWCO:10,000、Sartorius)浓缩至所希望的浓度。最后,用0.2μmPES(聚醚砜)(Pall公司制、Acrodisc注射式过滤器、Φ25mm)灭菌过滤,得到包含CHP和抗原的复合体的给药组合物。肽的浓度定量利用反向色谱分析进行。
(6)其他试剂
·佐剂
CpG寡聚DNA1668从Ajinomoto Bio-Pharma Services Gene Design购入。
·荧光标记抗体
eFluor450标记抗小鼠CD8a抗体(克隆53-6.7)、eFluor450标记抗小鼠KLRG1抗体(克隆2F1)、APC标记抗小鼠CD44(克隆IM7)和APC标记抗小鼠IFN-γ抗体(克隆XMG1.2)从eBioscience购入。APC标记抗小鼠CD8a抗体(克隆53-6.7)、APC标记抗小鼠CD4抗体(克隆RM4-5)、PerCP-Cy5.5标记抗小鼠CD90.1抗体(克隆OX-7)、Pacific blue标记抗小鼠CD90.2抗体(克隆30-H12)、FITC标记抗小鼠CD8抗体(克隆53-6.7)、Brilliant Violet 510标记抗小鼠CD90.1抗体(克隆OX-7)、Pacific Blue标记抗小鼠CD44(克隆IM7)和Purified CD16/32抗体(克隆93)从BioLegend购入。PE标记抗小鼠CD62L抗体(克隆MEL-14)从BDBIOSCIENCES公司购入。四聚体染色用的APC标记H-2Db gp100 Tetramer和Clear Back从MBL购入。
·免疫检查点抑制剂(ICI)
抗小鼠PD-1抗体(克隆RMPI-14)从Bio Cell购入。抗小鼠CTLA-4抗体(克隆9D9)使用由MD安德森癌症中心出让的杂交瘤在三重大学制作。
·短链肽抗原
CD8阳性T细胞刺激用的合成短链肽(QYIHSANVL(序列编号1)从Sigma genosis购入。EGSRNQDWL(序列编号4)和VYDGREHTV(序列编号9)从Eurofins购入。
实施例6.肿瘤增殖试验(转移性恶性黑色素瘤细胞株B16F10)
使用T75培养烧瓶(Corning),在含10%FBS的D-MEM培养基中培养转移性恶性黑色素瘤细胞株B16F10。培养得到的细胞使用含0.5%胰蛋白酶的PBS剥离,悬浮于含10%FBS的D-MEM培养基。将悬浮液离心分离(400×g、5分钟、4℃)后,除去上清。然后,使用D-MEM培养基清洗2次,以2×10
在施用长链肽抗原搭载HA纳米凝胶癌症疫苗的情况下,在肿瘤移植后第7、11和15天,将长链肽抗原搭载HA纳米凝胶癌症疫苗50μg(仅第15天为75μg)与溶解于PBS的50μg的CpG寡聚DNA一起在小鼠的右侧后背部进行皮下给药(HANG-V组)。
在施用抗原特异性T细胞的情况下,在肿瘤移植后第8天和第12天,从gp100识别TCR基因导入转基因小鼠Pmel-1(CD90.1阳性)的脾脏,将CD8阳性T细胞使用CD8a微珠(Miltenyi)分离,在RPMI1640培养基中以2×10
<实施例6结果>
与实施例1(ICI抗性纤维肉瘤细胞株CMS5a)同样,为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用对转移性恶性黑色素瘤(黑色素瘤)的抗肿瘤效果,使用转移性恶性黑色素瘤细胞株B16F10荷瘤C57BL/6小鼠,制作包含在B16F10过剩表达的gp100肿瘤抗原的CD8表位的长链肽抗原与HA纳米凝胶复合化的长链肽抗原搭载HA纳米凝胶癌症疫苗,与gp100识别TCR基因导入T细胞输注疗法联用,研究治疗效果。其结果,HANG-V治疗组,与未治疗组或TCR-T单独组相比,确认到了B16F10肿瘤的增殖抑制(图6-1和图6-2)。特别是HANG-V和TCR-T联用组,即使对已达到100mm
由以上结果,表明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用不仅对于免疫检查点抑制剂(ICI)治疗抗性肿瘤,而且对B16F10这样伴有转移的预后不良的恶性黑色肿瘤也发挥强力的抗肿瘤效果,有望能够成为治愈肿瘤且对“冷肿瘤(Cold tumor)”和“免疫沙漠肿瘤(Immune desert tumor)”的划时代的治疗方法。
实施例7.肿瘤增殖试验(HA纳米凝胶疫苗和CHP纳米凝胶疫苗的比较)
关于小鼠肿瘤增殖试验(实施例6),在长链肽抗原搭载纳米凝胶癌症疫苗(HANG-V或CHP-V)上联用抗原特异性T细胞输注疗法,实施相同试验。长链肽抗原搭载纳米凝胶癌症疫苗与HANG-V、CHP-V一起在肿瘤移植后第7、11、15、29和36天,将50μg(第3次以后为75μg)与溶解于PBS的50μgCpG寡聚DNA一起在小鼠的右侧后背部进行皮下给药,输注抗原特异性T细胞(4×10
<实施例7结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用相对于CHP纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法(现有技术)在抗肿瘤效果上是否优异,实施肿瘤增殖试验,比较两者的治疗效果。其结果,与实施例6同样,在HANG-V和TCR-T联用组中,在全部个体中,B16F10肿瘤的增殖明显被抑制,能够强力使肿瘤消退,相对于此,在CHP-V和TCR-T联用组中,没有确认到同样的治疗效果(图7-1和图7-2)。另外,HANG-V、TCR-T联用组,与CHP-V、TCR-T联用组相比,不仅肿瘤的大小(面积),而且在向上方的进展、增殖(高度)上,都明显抑制肿瘤,在全部个体中在肿瘤的中央部分都确认到了被认为由CTL的肿瘤破坏作用造成的火山口状的空洞孔(肿瘤坏死)(图7-3)。然后,在确认到消退的全部个体内,2只的肿瘤部分呈痂状,肿瘤完全消失,剩余的3只也是肿瘤没有再次恶化,消退到了用肉眼无法确认到的程度。另一方面,CHP-V和TCR-T联用组在之后也没有抑制而是促进肿瘤的增殖,在50天以内全部个体死亡,相对于此,HANG-V和TCR-T联用组维持了100%的存活率(图7-4)。
通过以上的结果可知,HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用与现有技术的CHP纳米凝胶癌症疫苗和T细胞输注联用疗法相比,在肿瘤增殖抑制作用、肿瘤破坏作用和生存期延长作用上,都具有卓越的治疗效果。
实施例8.疫苗施用部位区域淋巴结处的gp100抗原特异性CD8T细胞的解析
实施与实施例6同样的试验,在肿瘤移植后第14天采集疫苗施用部位的区域淋巴结(右腹股沟淋巴结)(每一组2~3只),用载玻片玻璃将淋巴结磨碎后,将细胞悬浮于RPMI1640培养基。离心分离(400×g、5分钟、4℃)后除去上清,用RPMI1640培养基清洗2次后,悬浮于含10%FBS的RPMI1640培养基。测定细胞数(图8-1),调制成细胞浓度为2×10
gp100四聚体细胞的染色(图8-2和图8-3):在96孔V底微孔板(NUNC)中,将细胞悬浮液每1孔添加4×10
在细胞悬浮液中将Clear Back(MBL)各添加10μL/孔,静置10分钟后,添加H-2Dbgp100四聚体(MBL)各10μL/孔,在遮光下反应30分钟。接着,以成为各抗体的制造商推荐的最终浓度的方式,添加FITC标记抗小鼠CD8抗体、Brilliant Violet 510标记抗小鼠CD90.1抗体、Pacific Blue标记抗小鼠CD44或eFlow450标记抗小鼠KLRG1抗体并混合后,在4℃的暗处静置15分钟。加入150μL的染色用缓冲液,离心分离将上清除去后,再用200μL的染色用缓冲液将细胞清洗2次。离心分离将上清除去后,在200μL的染色用缓冲液中进行重悬,移到圆底聚苯乙烯管(BD BIOSCIENCES公司)。细胞使用流式细胞仪FACS Canto II(BDBIOSCIENCES公司)和附带的解析软件(FACSDiva)解析。gp100抗原特异性CD8阳性输注T细胞作为gp100四聚体阳性CD90.1阳性CD8阳性的群体检测。
抗原特异性T细胞诱导试验(细胞内细胞因子染色)(图8-4):在48孔培养板(NUNC)中,将细胞悬浮液每1孔添加4×10
<实施例8结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用中的HA纳米凝胶癌症疫苗对gp100抗原特异性CD8阳性T细胞造成的影响,在肿瘤移植后第14天采集区域淋巴结,对该CD8 T细胞进行解析。其结果,HANG-V单独组和HANG-V、TCR-T联用组的淋巴结明显肿胀,在两组中,与未治疗组相比,确认到约9~16倍的淋巴结细胞的增加(图8-1)。另外,对在区域淋巴结流入、聚集的gp100抗原特异性四聚体阳性CD8 T细胞的比例进行解析的结果,与HANG-V未治疗组相比,两组中确认到该CD8 T细胞的明显增加(图8-2),可知该细胞显示高度活化的效应T细胞表型(KLRG1、CD44)(图8-3)。此外得知,在HANG-V、TCR-T联用组中,通过CD8阳性输注T细胞,gp100抗原特异性地明显产生了IFN-γ(图8-4)。
从这些结果,表明HA纳米凝胶癌症疫苗在荷瘤宿主的免疫抑制环境中,在区域淋巴结将CD8阳性输注T细胞强力地诱导向gp100抗原特异性CTL,存在能够抑制B16F10肿瘤的可能性。
实施例9.抗原特异性CD8阳性输注T细胞在肿瘤局部和全身的定位研究
实施与实施例6同样的试验后,在肿瘤移植后第19天采集疫苗施用部位的区域淋巴结(右腹股沟淋巴结)、非区域淋巴结(左腹股沟淋巴结)、脾脏、肿瘤和外周血,按照如下所示的方法将各细胞分离,对在各组织存在的CD8阳性输注T细胞和gp100四聚体阳性CD8阳性T细胞的比例进行研究。
淋巴结细胞和脾脏细胞的分离:将淋巴结(区域和非区域)和脾脏用载玻片玻璃磨碎后,将游离的细胞回收到RPMI1640培养基中。离心分离(400×g、5分钟、4℃)后除去上清,对脾脏细胞加入2mL的红细胞溶血溶液,处理细胞1分钟。然后加入18mL的RPMI1640培养基,离心分离(400×g、5分钟、4℃),将上清除去,将细胞悬浮于RPMI1640培养基(一次细胞悬浮液)。
肿瘤浸润免疫细胞(TIL)的分离:肿瘤浸润免疫细胞在将肿瘤组织使用匀浆器磨碎后,悬浮于RPMI1640培养基。在悬浮的细胞中加入胶原蛋白酶D(最终浓度2mg/mL、罗氏公司)以37℃反应30分钟后,一边加入RPMI1640培养基一边通过过滤器(0.22μm孔径)。离心分离(400×g、5分钟、4℃)后,除去上清,将细胞悬浮于RPMI1640培养基(一次细胞悬浮液)。
外周血单核细胞(PBMC)的分离:外周血单核细胞通过与实施例5同样的方法回收。回收的各组织的一次细胞悬浮液通过与实施例7同样的方法进行染色和测定。CD8阳性输注T细胞作为CD90.1阳性CD8阳性的群体检测,gp100抗原特异性CD8阳性T细胞作为gp100四聚体阳性CD8阳性的群体检测。
<实施例9结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注后的肿瘤局部和全身的抗原特异性CD8阳性输注T细胞的生存持续性(persistence),在肿瘤移植后第19天采集次级淋巴组织、肿瘤组织和外周血,对该T细胞的比例进行研究。其结果得知,输注T细胞除了区域淋巴结,在其他次级淋巴组织(脾脏和非区域淋巴结)或肿瘤组织内、全身的外周血也显著存在(图9-1)。另外,关于gp100抗原特异性CD8 T细胞,在各组织广泛显著存在(图9-2),通过这些定位于全身的抗原特异性CD8 T细胞,表明了本治疗不仅能够抑制肿瘤局部的增殖,而且也能够抑制向全身的转移。
实施例10.治疗施行后的复发抑制效果
采集在实施例6施行后,确认到肿瘤的完全消退的2只个体的外周血(肿瘤移植后经过5个月),对gp100抗原特异性CD8阳性输注T细胞的比例进行研究。之后,对2只个体中的1只再移植B16F10肿瘤(2×10
按照各抗体的制造商推荐的使用浓度,添加包含FITC标记抗小鼠CD8抗体、Brilliant Violet 510标记抗小鼠CD90.1抗体、Pacific Blue标记抗小鼠CD44和PE标记抗小鼠CD62L抗体的溶液50μL并混合后,在4℃的暗处静置15分钟。加入150μL的染色用缓冲液,离心分离将上清除去后,再用200μL的染色用缓冲液将细胞清洗2次。离心分离将上清除去后,在200μL的染色用缓冲液中进行重悬,移到圆底聚苯乙烯管(BD BIOSCIENCES公司)。细胞使用流式细胞仪FACS Canto II(BD BIOSCIENCES公司)和附带的解析软件(FACSDiva)解析。gp100抗原特异性CD8阳性输注T细胞作为gp100四聚体阳性CD90.1阳性CD8阳性的群体检测,效应记忆细胞作为CD44阳性CD62L阴性的群体检测,中央记忆细胞作为CD44阳性CD62L阳性的群体检测。
<实施例10结果>
实施HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法,测定肿瘤完全消退后无复发的个体的外周血中的gp100抗原特异性CD8阳性输注T细胞,其结果得知,即使在治癒5个月后在外周血中也存在该CD8阳性输注T细胞(图10-1)。进而,对该个体再移植B16F10肿瘤或再接种疫苗后,再次对外周血中的gp100抗原特异性CD8阳性输注T细胞的比例进行测定,结果在外周血中确认到该细胞的明显增加(图10-2)。该细胞显示效应记忆T细胞(CD44阳性CD62L阴性)和中央记忆T细胞(CD44阳性CD62L阳性)表型(图10-3),特别是疫苗再接种后的个体中,该细胞爆发式增殖,可知存在CD44强阳性效应细胞(图10-4)。另外,在该个体中再移植B16F10也没有确认到肿瘤的植入、增殖,可知该小鼠没有复发。(图10-5)。
从这些结果可知,通过HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法,在治疗奏效的个体的外周血中,在肿瘤治癒后抗原特异性CD8阳性输注T细胞也长时间残留存在一定量,在肿瘤复发的情况下,该记忆细胞快速增殖,识别肿瘤抗原,发挥抗肿瘤效果,能够抑制复发。另外可知,在治疗奏效后通过定期接种本疫苗,能够诱发非常活化的抗原特异性效应/记忆T细胞,能够预防肿瘤的复发。
本疫苗通过与抗原特异性T细胞输注疗法的联用,对B16F10这样的伴有转移的预后不良的恶性黑色肿瘤发挥强力的抗肿瘤效果,并且还具有肿瘤的复发预防效果,有望能够成为治疗型、预防型的两方面兼备的革新的癌症疫苗。
实施例11.对治疗施行后奏效后转为再增殖的个体的疫苗等治疗效果
实施与小鼠肿瘤增殖试验(实施例1)同样的试验后(治疗组每组9只),对确认到肿瘤的再增殖的个体(9只中的1只),在肿瘤移植后第27、32、36、40、43天将长链肽抗原搭载HA纳米凝胶癌症疫苗75μg与溶解于PBS的50μg的CpG寡聚DNA一起在小鼠的右侧后背部皮下给药。另外,在肿瘤移植后第41天,将从突变型ERK2识别TCR基因导入小鼠(DUC18)的脾脏使用CD8a微珠(Miltenyi)分离的抗原特异性CD8阳性T细胞(2×10
<实施例11结果>
对于实施HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法后,虽然治疗暂时奏效,但是之后确认到肿瘤的再增殖的个体,实施疫苗再施用、再输注和ICI。其结果可知,通常复发的肿瘤的增殖速度快,预后不良(图11-2右图),通过疫苗连续给药,明显抑制肿瘤的增殖,通过与其他免疫疗法(ICI)的联用,能够抑制肿瘤的恶化(图11-1和图11-2左图)。
通过以上的结果,在实施HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法后,治疗暂时奏效,但之后确认到肿瘤的再增殖的情况下,本疫苗的再施用、再输注和ICI追加疗法也能够显著抑制肿瘤的增殖,且能够成为对肿瘤的再次恶化有效的治疗。此外,在本试验中,使用了胆甾醇基的导入率为44和41%的透明质酸纳米凝胶,都显示出高的抗肿瘤效果。
实施例12.对治疗实施后达到完全奏效(完全消退)的个体的复发抑制效果
对于施行实施例11后,确认到肿瘤的完全消退的个体(n=8),在肿瘤移植2个月后对相同个体再移植CMS5a肿瘤(1×10
<实施例12结果>
对实施HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法后,确认到肿瘤的完全消退的个体,再移植CMS5a肿瘤,其结果,在全部小鼠中都确认到肿瘤的增殖抑制,8只中的6只达到肿瘤的完全消退(75%)(图12-1和图12-2)。
通过以上的结果,可以认为本治疗能够在治疗ICI治疗抗性肿瘤的同时,与实施例10的结果同样,在治疗奏效后对肿瘤获得记忆免疫(记忆形成),在相同肿瘤复发时,抗原特异性记忆T细胞迅速识别、破坏它们,能够抑制肿瘤的复发。另外可以认为,通过与实施例10同样进一步再接种疫苗,能够诱导活化的具有强效应功能的抗原特异性CD8记忆T细胞,进而能够预防复发。
实施例13.疫苗和抗原特异性T细胞输注疗法(单次)联用效果
对小鼠肿瘤增殖试验(实施例1),将抗原特异性T细胞输注疗法从2次减到1次,实施同样的试验(治疗组每组9只)。
<实施例13结果>
为了解明HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法联用中的CD8阳性输注T细胞的输注次数对抗肿瘤效果带来的影响,将CD8阳性输注T细胞的输注次数从现有方法的2次逐渐减少到1次,对治疗效果进行研究。其结果,即使在单次输注CD8阳性输注T细胞的情况下,也与现有方法或现有技术的2次输注的情况同等,在全部个体中确认到肿瘤的消退,在9只个体内的8只肿瘤完全消失(奏效率:100%、完全奏效:89%、部分奏效:11%)(图13-1和图13-2)。
通过以上的结果可知,HA纳米凝胶癌症疫苗即使不实施2次抗原特异性T细胞输注,即使是单次输注,也能够十分强力地治愈ICI抗性肿瘤。现在,接受T细胞输注疗法(TCR-T或CAR-T)的患者的身体、经济上的负担成为问题且其改善成为课题,但细胞输注(单次)中本疫苗的连续给药方案能够治愈ICI抗性肿瘤,并且对患者而言,在身体方面、经济方面能够成为负担小的治疗。
实施例14.对于在施行治疗后奏效后转为再增殖的个体的疫苗等治疗效果
对施行实施例13后,确认到肿瘤的再增殖的个体(9只中的1只),在肿瘤移植后第26、30、33和36天将长链肽抗原搭载HA纳米凝胶癌症疫苗75μg和溶解于PBS的50μg的CpG寡聚DNA一起在小鼠的右侧后背部进行皮下给药。另外,在肿瘤移植后第33、36和39天将ICI(抗小鼠PD-1抗体200μg和抗小鼠CTLA-4抗体100μg)在腹腔内给药,经时地测定肿瘤面积。
<实施例14结果>
对于HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法(单次)实施后,治疗暂时奏效,但之后确认到肿瘤的再次增殖的个体,施用疫苗和ICI。其结果得知,通常复发的肿瘤的增殖速度快且预后不良,相对于此,通过疫苗连续给药或ICI联用,能够显著抑制肿瘤的增殖(图14)。
通过以上的结果,即使在HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法实施后,治疗暂时奏效,但之后确认到肿瘤的再次增殖的情况下,本疫苗的连续给药、再输注和ICI追加疗法能够显著抑制肿瘤的增殖,对于肿瘤的再次恶化能够成为有效的治疗。
实施例15.疫苗再给药对施行治疗后达到奏效(完全消退)的个体的记忆T细胞诱
通过与实施例5同样的方法采集(肿瘤移植后第36天)施行实施例13后确认到肿瘤的完全消退的个体(n=8)的外周血,对CD8阳性T细胞的记忆表型进行解析。进而,对同样小鼠(n=4)将长链肽抗原搭载HA纳米凝胶癌症疫苗75μg与溶解于PBS的50μg的CpG寡聚DNA一起在小鼠的右侧后背部进行皮下给药(肿瘤移植后第36和39天),对该细胞的记忆表型进行再次解析(肿瘤移植后第41天)。细胞染色和测定按照与实施例10同样的方法进行。
<实施例15结果>
对HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法(单次)施行后确认到肿瘤的完全消退的个体的外周血中存在的CD8阳性T细胞进行解析,结果得知,在该个体中包含显示效应记忆和中央记忆表型的CD8阳性T细胞,通过疫苗的再接种,两者细胞的比例明显增加(图15)。
通过以上的结果,通过在HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法(单次)实施后、治疗奏效后再接种本疫苗,能够使效应记忆和中央记忆CD8阳性T细胞显著增加,表明存在能够持续诱导记忆T细胞的可能性。
实施例16.疫苗再给药对治疗施行后奏效后转为再增殖的个体(追加治疗)的记忆
通过与实施例5同样的方法采集(肿瘤移植后第36天)由实施例14追加治疗中的个体的外周血,对CD8阳性T细胞的记忆表型进行解析。进而,对同样小鼠将长链肽抗原搭载HA纳米凝胶癌症疫苗75μg与溶解于PBS的50μg的CpG寡聚DNA一起在小鼠的右侧后背部进行皮下给药(采血后同日),对同样细胞的记忆表型进行再解析(肿瘤移植后第41天)。细胞染色和测定按照与实施例10同样的方法进行。
<实施例16结果>
对于HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法(单次)施行后、奏效后转为再增殖的个体(追加治疗中)的外周血中存在的CD8阳性T细胞进行解析,结果得知,与确认到完全消退的个体同样,在追加治疗中的个体中也包含显示效应记忆和中央记忆表型的CD8阳性T细胞,通过疫苗的再接种,两者的细胞的比例显著增加(图16)。
通过以上的结果,即使在HA纳米凝胶癌症疫苗和抗原特异性T细胞输注疗法(单次)实施、治疗奏效后达到肿瘤的再增殖的情况下,本疫苗的接种也能够显著增加、诱导效应记忆和中央记忆CD8阳性T细胞,表明存在能够持续诱导记忆T细胞和治疗效果的可能性。
实施例6~16的考察
从实施例6~16的结果特别可以判明或者暗示以下8点。
1.本治疗对于具有高转移性、高致死性且速致死性、低免疫原性、T细胞难以浸润肿瘤(冷肿瘤、免疫沙漠肿瘤)等特征的难以治疗的恶性黑色素瘤(黑色素瘤),发挥强力的治疗效果(实施例6)。
2.对于上述的难以治疗的肿瘤,用现有技术的CHP疫苗无法抑制肿瘤增殖或致死,而相对于此,本治疗发挥强力的抗肿瘤效果能够抑制肿瘤,维持生存(实施例7)。
3.本治疗能够在疫苗施用部位的区域淋巴结使抗原特异性CD8 T细胞显著增加,能够诱导非常活化的抗原特异性细胞毒性CD8 T细胞(CTL)(实施例8)。
4.输注的抗原特异性CD8 T细胞在肿瘤内也充分浸润,且也明显分布于全身,具有抑制肿瘤转移的可能性(实施例9)。
5.本治疗不仅有强力的治疗效果,而且还能够预防治疗奏效后的复发,兼备癌症治疗型和复发预防型疫苗两个方面(实施例10和实施例12)。
6.进而,通过由本治疗而治疗奏效后或者由追加治疗中的疫苗再给药,能够迅速地强且持续地诱导记忆T细胞(实施例10和实施例15~16)。
7.另外,即使在治疗奏效后确认到肿瘤的再增殖的情况下,通过与疫苗给药或其他免疫疗法的联用,也能够抑制肿瘤的增殖(实施例11和实施例14)。
8.对于现有方法或现有技术(输注疗法2次),本治疗即使以单次也能够发挥显著的治疗效果,能够减轻患者在身体方面和经济方面的负担(实施例13)。
实施例17.使用表达嵌合抗原受体的淋巴细胞、以及包含透明质酸衍生物和抗原
根据实施例1~16中的TCR-T和包含透明质酸衍生物和抗原的给药组合物的试验结果,可以认为摄入透明质酸衍生物和抗原的抗原提呈细胞将抗原有效地提呈到细胞表面,使输注了该抗原提呈细胞的T细胞活化和增殖是高的抗肿瘤效果的机理之一。在现有报道1(Blood(2018)132(11):1134-1145、Antitumor activity of CAR-T cells targetingthe intracellular oncoprotein WT1 can be enhanced by vaccination)中,报道了通过输注表达嵌合抗原受体的淋巴细胞,并且输注摄取抗原的抗原提呈细胞,而提高抗肿瘤效果。在现有报道2(Science.2020Jan24;367(6476):446-453、An RNA vaccine drivesexpansion and efficacy of claudin-CAR-T cells against solid tumors)中,报道了输注表达嵌合抗原受体的淋巴细胞,并且使抗原提呈细胞表达被嵌合抗原受体识别的抗原,而提高抗肿瘤效果。因此,在不仅输注TCR-T而且输注嵌合抗原受体表达淋巴细胞时,通过施用在体内制作摄入抗原的抗原提呈细胞的包含透明质酸衍生物和抗原的给药组合物,同样也能够期待高的抗肿瘤效果。
通过使用以下所示的嵌合抗原受体表达淋巴细胞、表达嵌合抗原受体能够识别的抗原的肿瘤、HLA转基因小鼠,能够证明表达嵌合抗原受体的淋巴细胞和包含透明质酸衍生物和抗原的给药组合物具有高的抗肿瘤效果。
<材料和方法>
(1)细胞
小鼠大肠癌细胞株MC38和CT26使用从ATCC购入且在三重大学传代得到的细胞株。逆转录病毒包装细胞株Plat-E从CELL BIOLABS购入。RPMI1640培养基从细胞科学研究所购入。高葡萄糖D-MEM培养基从和光纯药购入。Opti-MEM和胎牛血清(FBS)从Gibco购入。人白蛋白(albuminar,5%白蛋白制剂250ml)从CSL Behling购入,人IL-2从Novartis购入。
(2)试验动物
HLA-A2转基因(Tg)小鼠是通过将从巴斯德研究所出让的HHD-A2质粒DNA用三重大学动物实验设施注入C57BL/6小鼠的受精卵中而制作的。用三重大学动物实验设施繁殖该小鼠,进而制作、繁殖BALB/c小鼠和回交的HLA-A2 Tg小鼠(BALB/c背景),将它们用三重大学动物实验设施饲养,用于实验。
(3)抗体
抗小鼠CD3e抗体(克隆145-2C11)、抗小鼠CD28抗体(克隆37.51)和Alexa Fluor647标记抗兔IgG抗体(克隆Poly4064)从invitrogen购入。APC标记抗小鼠CD4抗体(克隆RM4-5)和APC/Cyanine7标记抗小鼠CD8抗体(克隆53-6.7)从BioLegend购入。MAGE-A4(E7O1U)XP Rabbit mAb从Cell Signaling technology购入。PE标记抗人HLA-A2抗体(克隆BB7.2)从MBL购入。Purified Rat Anti-Mouse IFN-γ抗体和Biotin Rat Anti-MouseIFN-γ抗体从BD BIOSCIENCES公司购入。
(4)试剂
Lipofectamine 3000试剂、P300试剂和人IFN-γ未包被ELISA试剂盒从invitrogen购入。pCL-ECO Retrovirus Packaging Vector从NOVUS购入。A2 MAGE-A4四聚体使用Streptavidin-R-Phycoerithrin(Agilent)制作。RetroNectin从Takara bio购入。
1.逆转录病毒载体质粒的制作
1-1嵌合抗原受体用
(1)mMAGE#17zG CAR
CAR制作中使用的MAGE#17scFv是对人工制作的HLA-A*02:01MAGE-A4 p230-239肽MHC复合体,使人抗体文库反应而分离得到的(日本特愿2019-523909等/识别来自MAGE-A4的肽的抗原结合性蛋白质)。以在scFv的5’侧连接人VH leader序列,在3’侧连接mCD8hinge、mCD28 TM、mCD28 ICD、mCD3z和mGITR ICD的方式设计,制作人工基因(在Genscript订购)。将本基因整合入逆转录病毒表达质粒,制作mMAGE zG病毒载体质粒(图17-1a和图17-1b)。
(2)mMAGE 28z CAR
以在scFv的5’侧连接人VH leader序列,在3’侧连接mCD8 hinge、mCD28 TM、mCD28ICD和mCD3z的方式设计,制作人工基因(在Genscript订购)。将本基因整合入本基因逆转录病毒表达质粒,制作mMAGE zG病毒载体质粒(图17-2a和图17-2b)。
1-2MAGE-A4、HHD-A2表达MC38细胞和CT26细胞用
(1)mNGFR共表达MAGE-A4
设计人MAGE-A4基因与P2A肽序列、C末端截短的mouse NGFR基因连接而成的序列,制作人工基因(在Genscript订购)。将本基因用内切酶NotI和XhoI消化并切出,制作整合到逆转录病毒表达质粒中的序列(图17-3a和图17-3b)。
(2)HHD-A2
从HHD-A2质粒的MHC序列删除内含子(intron)部分,设计mRNA型HHD-A2表达基因,制作人工基因(在Genscript订购)。制作将本基因用NotI-XhoI切出并整合入逆转录病毒表达质粒的质粒(图17-4a和图17-4b)。
2.嵌合抗原受体表达淋巴细胞的制作
2-1逆转录病毒的制作
将逆转录病毒包装细胞株Plat-E(1.2×10
2-2通过逆转录病毒向小鼠脾脏细胞的基因导入
从BALB/c小鼠采集脾脏,使用载玻片玻璃磨碎后,将细胞回收到RPMI1640培养基中。离心分离(400×g、5分钟、4℃)后,将上清除去,加入2mL的红细胞溶血溶液对细胞处理30秒钟。然后加入18mL的RPMI1640培养基,离心分离(400×g、5分钟、4℃),除去上清,以3×10
在基因导入前一天将RetroNectin用PBS调整成为20μg/mL,在24孔板(Non-Treated Multidishes、NUNC)的各孔中添加500μL后,在4℃静置过夜。第二天,用PBS清洗3次后,将2-1中制作得到的病毒液稀释2倍,在板中添加1mL后,离心分离(2000×g、2小时、32℃)。将板用添加1.5%人白蛋白的PBS清洗2次后,从CO
2-3嵌合抗原受体表达淋巴细胞的确认
回收细胞,转移到96孔V底微孔板(NUNC),离心分离(2000×rpm、2分钟、4℃),将上清除去后,每1孔悬浮于200μL的染色用缓冲液(含0.5% BSA的PBS)。用200μL的染色用缓冲液将细胞清洗2次后,加入稀释了100倍的A2 MAGE-A4 tetramer 30μL,在暗处静置30分钟。用染色用缓冲液将细胞清洗2次后,按照各抗体的制造商推荐的使用浓度,在细胞悬浮液中添加混合APC标记抗小鼠CD4抗体和APC/Cyanine7标记抗小鼠CD8抗体后,在4℃的暗处静置15分钟。加入150μL的染色用缓冲液,离心分离将上清除去后,进而用200μL的染色用缓冲液将细胞清洗2次后,在缓冲液200μL中进行重悬,移到圆底聚苯乙烯管(BD BIOSCIENCES公司)。细胞使用流式细胞仪LSRFortessa Cell Analyzer(BD BIOSCIENCES公司)和附带的解析软件(FACSDiva)解析(图17-5)。
3.表达嵌合抗原受体能够识别的抗原的靶细胞(MAGE-A4、HHD-A2表达MC38细胞和
3-1逆转录病毒的制作
代替1-1(1)中制备的mMAGE#17zG CAR病毒载体质粒,而使用1-2(1)中制备的mNGFR共表达MAGE-A4病毒载体质粒、或者使用1-2(2)中制备的HHD-A2病毒载体质粒,除此以外,按照与2-1中记载的相同的方法制作逆转录病毒。
3-2 MAGEA4、HHD-A2表达MC-38细胞和CT26细胞的制备
使用T75培养烧瓶(Corning),将小鼠大肠癌细胞株MC38和CT26细胞株在含10%FBS的RPMI1640培养基中培养。培养得到的细胞使用含0.5%胰蛋白酶的PBS剥离,悬浮于含10%FBS的RPMI1640培养基中。将悬浮液离心分离(400×g、5分钟、4℃)后除去上清。然后,使用含10%FBS的RPMI1640培养基清洗2次,以3.3×10
在基因导入前一天将RetroNectin用PBS调整成为20μg/mL,在24孔板(Non-Treated Multidishes、NUNC)的各孔中添加500μL后,在4℃静置过夜。第二天,用PBS清洗3次后,将3-1中制作得到的各病毒液稀释2倍,在板中添加1mL后,离心分离(2000×g、2小时、32℃)。将板用添加1.5%人白蛋白的PBS清洗2次后,将悬浮于含10%FBS的RPMI1640培养基中的MC38细胞(3.3×10
将两种细胞回收,移到96孔V底微孔板(NUNC),离心分离(2000×rpm、2分钟、4℃)将上清除去后,每1孔悬浮于200μL的染色用缓冲液。用200μL的染色用缓冲液将细胞清洗2次后,通过下述的方法确认HHD-A2和MAGE-A4的染色和表达。
HHD-A2:按照制造商推荐的使用浓度,在细胞悬浮液中添加PE标记抗HLA-A2抗体,在4℃的暗处静置15分钟。加入150μL的染色用缓冲液,离心分离将上清除去后,进而用200μL的染色用缓冲液将细胞清洗2次后,在缓冲液200μL中进行重悬,转移到圆底聚苯乙烯管(BD BIOSCIENCES公司)。细胞使用流式细胞仪FACS LSRFortessa Cell Analyzer(BDBIOSCIENCES公司)和附带的解析软件(FACSDiva)解析(图17-6)。
MAGE A4的细胞内染色:将调整成为1×10
3-3 mMAGE zG CAR T细胞对靶细胞的识别和反应性确认
将3-2中制作得到的靶细胞(1.MC38细胞、2.HHD-A2导入MC38细胞、3.HHD-A2导入MC38细胞(MAGE-A4 CD8表位肽(序列编号9)10μM脉冲)、4.HHD-A2和MAGE-A4导入MC38细胞)以5×10
IFN-γELISA:将用0.05% NaN
4.长链肽抗原搭载HA纳米凝胶癌症疫苗的制备
4-1使用分子量10k的HA纳米凝胶、肽MAGE-A4 29mer的复合体的制作
透明质酸纳米凝胶(HANG)
如国际公开第2010/053140号的实施例1和2所记载的那样,合成导入了胆甾醇基的透明质酸纳米凝胶(重均分子量为10kDa,胆甾醇基的导入率为44%)。
长链肽抗原
使用上述得到的透明质酸纳米凝胶,如下进行肽-透明质酸纳米凝胶复合体的制备。MAGE-A4肽从Eurofins购入。序列如下:AMEGDSASEEEIWEELGVMGVYDGREHTV(序列编号8)。该序列作为CD8阳性细胞毒性T细胞识别表位序列包含GVYDGREHTV(序列编号9)。
透明质酸纳米凝胶和抗原的复合体制作
称量透明质酸纳米凝胶的冻结干燥体,以成为5mg/mL的浓度的方式添加注射用水,搅拌过夜使其充分溶解。另一方面,在另一个容器中,以肽的浓度成为50mg/mL的方式溶解于二甲基亚砜。确认溶解后,在室温,将上述透明质酸纳米凝胶水溶液与1mol/L的氢氧化钠水溶液以容量比100:2的比例混合。接着将上述透明质酸纳米凝胶水溶液与肽的二甲基亚砜溶液以容量比102:1的比例混合,在室温搅拌24小时,由此得到包含肽-透明质酸纳米凝胶复合体的组合物。然后,将固体的纯化蔗糖(富士胶片和光株式会社制、制造专用、制品编号198-18385)以包含肽-透明质酸纳米凝胶复合体的组合物成为10质量%蔗糖的方式添加,搅拌1小时以上。接着,用含10质量%蔗糖的25mM磷酸缓冲液(pH 7.4)以肽的理论浓度成为0.3mg/mL的方式稀释,用0.2μmPES(聚醚砜)(Pall公司制、Acrodisc注射式过滤器、Φ25mm)灭菌过滤,得到包含肽-透明质酸纳米凝胶复合体的组合物。通过反向色谱分析对此时的包含肽-透明质酸纳米凝胶复合体的组合物中的肽浓度进行定量,以肽浓度成为250ug/mL的方式进行浓度调整,作为给药溶液。
4-2使用分子量10k的HA纳米凝胶、肽MAGE-A4 20mer的复合体的制作
除了使用以下所示的长链肽抗原以外,用上述4-1中记载的方法制备。以肽浓度成为250ug/mL的方式进行浓度调整,作为给药溶液。
长链肽抗原MAGE-A4 20mer
MAGE-A4 20mer从Eurofins购入。序列如下:GVYDGREHTVGVYDGREHTV(序列编号10)。该序列作为CD8阳性细胞毒性T细胞识别表位序列包含下述MAGEA4(氨基酸序列:GVYDGREHTV(序列编号9)。
5.抗肿瘤试验
在HLA-A2 Tg小鼠的右侧前背部侧将3-2中制备的MAGE-A4/HHD-A2表达MC38细胞以5×10
序列表
<110>三重大学
<120>医药组合物
<130>P22-115WO
<150>JP 2021-091520
<151>2021-05-31
<160>14
<170>PatentIn version 3.5
<210>1
<211>9
<212>PRT
<213>人工序列
<220>
<223>突变ERK2肽
<400>1
Gln Tyr Ile His Ser Ala Asn Val Leu
1 5
<210>2
<211>37
<212>PRT
<213>人工序列
<220>
<223>长链肽
<400>2
Asn Asp His Ile Ala Tyr Phe Leu Tyr Gln Ile Leu Arg Gly Leu Gln
1 5 1015
Tyr Ile His Ser Ala Asn Val Leu His Arg Asp Leu Lys Pro Ser Asn
202530
Leu Leu Leu Asn Thr
35
<210>3
<211>17
<212>PRT
<213>人工序列
<220>
<223>表位序列
<400>3
Arg Gly Leu Gln Tyr Ile His Ser Ala Asn Val Leu His Arg Asp Leu
1 5 1015
Lys
<210>4
<211>9
<212>PRT
<213>人工序列
<220>
<223>p25-33
<400>4
Glu Gly Ser Arg Asn Gln Asp Trp Leu
1 5
<210>5
<211>38
<212>PRT
<213>人工序列
<220>
<223>gp100 TRP2 TRP1_6Y
<400>5
Ser Val Tyr Asp Phe Phe Val Trp Leu Tyr Tyr Tyr Tyr Tyr Tyr Thr
1 5 1015
Trp His Arg Tyr His Leu Leu Tyr Tyr Tyr Tyr Tyr Tyr Glu Gly Ser
202530
Arg Asn Gln Asp Trp Leu
35
<210>6
<211>9
<212>PRT
<213>人工序列
<220>
<223>TRP2
<400>6
Ser Val Tyr Asp Phe Phe Val Trp Leu
1 5
<210>7
<211>8
<212>PRT
<213>人工序列
<220>
<223>TRP1
<400>7
Thr Trp His Arg Tyr His Leu Leu
1 5
<210>8
<211>29
<212>PRT
<213>人工序列
<220>
<223>MAGE-A4
<400>8
Ala Met Glu Gly Asp Ser Ala Ser Glu Glu Glu Ile Trp Glu Glu Leu
1 5 1015
Gly Val Met Gly Val Tyr Asp Gly Arg Glu His Thr Val
2025
<210>9
<211>10
<212>PRT
<213>人工序列
<220>
<223>MAGE4
<400>9
Gly Val Tyr Asp Gly Arg Glu His Thr Val
1 5 10
<210>10
<211>20
<212>PRT
<213>人工序列
<220>
<223>MAGE-A4 CD8表位串联序列
<400>10
Gly Val Tyr Asp Gly Arg Glu His Thr Val Gly Val Tyr Asp Gly Arg
1 5 1015
Glu His Thr Val
20
<210>11
<211>1580
<212>DNA
<213>人工序列
<220>
<223>mMAGEzG CAR
<400>11
gcggccgcag atccatgagt gtgcccactc aggtcctggg gttgctgctg ctgtggctta60
caggtgccag atgtcaggtc cagctggtac agtctggggc tgaggtgaag aagcctgggt 120
cctcggtgaa ggtctcctgc aaggcttctg gaggcacctt cagcagctat gctatcagct 180
gggtgcgaca ggcccctgga caagggcttg agtggatggg agggatcatc cctatctttg 240
gtacagcaaa ctacgcacag aagttccagg gcagagtcac gattaccgcg gacaaatcca 300
cgagcacagc ctacatggag ctgagcagcc tgagatctga ggacacggcc gtgtattact 360
gtgcgagatc cccccggcgg gcatatcatg atgcttttga tatctggggc caagggacaa 420
tggtcaccgt ctcttcaggt ggaggcggtt caggcggagg tggcagcggc ggtggcggga 480
gttcctatga gctgactcag ccaccctcga tgtcagtggc cccaggaaag acggccagca 540
ttacctgtgg cggagaccat attggaagta aaagtgttca ctggtaccag cagaagccag 600
gccaggcccc tgtactggtc gtctatgatg atagcgaccg gccctcaggg atccctgagc 660
gattctctgg ctccaactct gggaacacag ccactctgac catcagcggg acccaggcta 720
tggatgaggc tgactattac tgtctggcgt gggacagcag cactgcgatc ttcggcggag 780
ggaccaagct gaccgtccta gcggcgcgcc agatcagcaa ctcggtgatg tacttcagtt 840
ctgtcgtgcc agtccttcag aaagtgaact ctactactac caagccagtg ctgcgaactc 900
cctcacctgt gcaccctacc gggacatctc agccccagag accagaagat tgtcggcccc 960
gtggctcagt gaaggggacc ggattggact ctagattttg ggcactggtc gtggttgctg1020
gagtcctgtt ttgttatggc ttgctagtga cagtggctct ttgtgttatc tggacaaatc1080
tgagagcaaa attcagcagg agtgcagaga ctgctgccaa cctgcaggac cccaaccagc1140
tctacaatga gctcaatcta gggcgaagag aggaatatga cgtcttggag aagaagcggg1200
ctcgggatcc agagatggga ggcaaacagc agaggaggag gaacccccag gaaggcgtat1260
acaatgcact gcagaaagac aagatggcag aagcctacag tgagatcggc acaaaaggcg1320
agaggcggag aggcaagggg cacgatggcc tttaccaggg tctcagcact gccaccaagg1380
acacctatga tgccctgcat atgcagaccc tggcccctcg caggaggcaa cacatgtgtc1440
ctcgagagac ccagccattc gcggaggtgc agttgtcagc tgaggatgct tgcagcttcc1500
agttccctga ggaggaacgc ggggagcaga cagaagaaaa gtgtcatctg gggggtcggt1560
ggccataatc gattctcgag1580
<210>12
<211>1556
<212>DNA
<213>人工序列
<220>
<223>mMAGE 28z CAR
<400>12
gcggccgcag atccatgagt gtgcccactc aggtcctggg gttgctgctg ctgtggctta60
caggtgccag atgtcaggtc cagctggtac agtctggggc tgaggtgaag aagcctgggt 120
cctcggtgaa ggtctcctgc aaggcttctg gaggcacctt cagcagctat gctatcagct 180
gggtgcgaca ggcccctgga caagggcttg agtggatggg agggatcatc cctatctttg 240
gtacagcaaa ctacgcacag aagttccagg gcagagtcac gattaccgcg gacaaatcca 300
cgagcacagc ctacatggag ctgagcagcc tgagatctga ggacacggcc gtgtattact 360
gtgcgagatc cccccggcgg gcatatcatg atgcttttga tatctggggc caagggacaa 420
tggtcaccgt ctcttcaggt ggaggcggtt caggcggagg tggcagcggc ggtggcggga 480
gttcctatga gctgactcag ccaccctcga tgtcagtggc cccaggaaag acggccagca 540
ttacctgtgg cggagaccat attggaagta aaagtgttca ctggtaccag cagaagccag 600
gccaggcccc tgtactggtc gtctatgatg atagcgaccg gccctcaggg atccctgagc 660
gattctctgg ctccaactct gggaacacag ccactctgac catcagcggg acccaggcta 720
tggatgaggc tgactattac tgtctggcgt gggacagcag cactgcgatc ttcggcggag 780
ggaccaagct gaccgtccta gcggcgcgcc agatcagcaa ctcggtgatg tacttcagtt 840
ctgtcgtgcc agtccttcag aaagtgaact ctactactac caagccagtg ctgcgaactc 900
cctcacctgt gcaccctacc gggacatctc agccccagag accagaagat tgtcggcccc 960
gtggctcagt gaaggggacc ggattggact ctagattttg ggcactggtc gtggttgctg1020
gagtcctgtt ttgttatggc ttgctagtga cagtggctct ttgtgttatc tggacaaata1080
gtagaaggaa cagactcctt caaagtgact acatgaacat gactccccgg aggcctgggc1140
tcactcgaaa gccttaccag ccctacgccc ctgccagaga ctttgcagcg taccgccccc1200
tgagagcaaa attcagcagg agtgcagaga ctgctgccaa cctgcaggac cccaaccagc1260
tctacaatga gctcaatcta gggcgaagag aggaatatga cgtcttggag aagaagcggg1320
ctcgggatcc agagatggga ggcaaacagc agaggaggag gaacccccag gaaggcgtat1380
acaatgcact gcagaaagac aagatggcag aagcctacag tgagatcggc acaaaaggcg1440
agaggcggag aggcaagggg cacgatggcc tttaccaggg tctcagcact gccaccaagg1500
acacctatga tgccctgcat atgcagaccc tggcccctcg ctaatcgatt ctcgag1556
<210>13
<211>1979
<212>DNA
<213>人工序列
<220>
<223>MAGE-A4表达载体
<400>13
gcggccgcac caccatgagc tccgagcaga agagccagca ctgcaaaccc gaggaaggcg60
ttgaagccca ggaagaagca ctgggtctgg ttggagcaca agctcccact accgaagaac 120
aggaggctgc cgtttccagt agctctcccc ttgtgccagg aaccctggaa gaggtccctg 180
ctgccgagtc tgccggtcct cctcagagtc ctcaaggcgc aagcgccttg cccacgacca 240
tcagctttac gtgctggaga caacccaatg aaggatcaag ctctcaggag gaagaaggcc 300
catcaacatc tccggatgca gaatcactct ttcgcgaggc actcagcaac aaagtggacg 360
aattggccca tttccttctg cggaagtaca gggctaaaga actggtgaca aaggcggaaa 420
tgctggagag ggtgatcaag aactacaagc ggtgtttccc agtgatcttc ggcaaagcat 480
ccgagagtct gaagatgatc tttggcattg acgtgaagga ggtcgatcca gcctccaaca 540
cctataccct ggtgacttgt ctcgggctct cctatgatgg gcttttgggt aacaaccaga 600
tattccccaa aacagggctg ctgatcattg tgctgggaac catagccatg gagggcgata 660
gtgccagcga agaagagatt tgggaggagc tgggagtgat gggtgtatat gacggacgag 720
agcacactgt ctatggcgag cctcggaaac tcctgactca ggactgggtc caggagaatt 780
acctggagta tcgacaggta ccagggtcaa atccggctcg ctacgagttt ctttggggcc 840
ctcgtgcttt ggcggagaca tcctacgtca aggtgctgga gcatgtggta agggtgaatg 900
cgagagttcg cattgcctac ccatctctga gagaggccgc tctcctggag gaagaggaag 960
gggttatcga tggaagcgga gccacgaact tctctctgtt aaagcaagca ggagatgttg1020
aagaaaaccc cgggcctatg aggagggctg gagccgcctg ttccgccatg gatcgactgc1080
gtttgctgct tctgctcctg ctccttctgg gtgtaagctt tggaggagcc aaagagacat1140
gcagcactgg catgtatacc cacagtggag aatgctgcaa ggcatgcaac ctcggcgaag1200
gagttgctca gccttgtggc gcaaaccaga ctgtgtgtga accctgtctg gacagtgtga1260
cattcagcga tgtggtgtct gccaccgagc catgcaagcc atgtaccgag tgtctgggtc1320
tgcaatccat gtctgcacct tgcgtggaag ctgatgacgc cgtttgtcgc tgtagttacg1380
gttactatca ggacgaggaa acaggcagat gtgaggcttg cagcgtttgt ggtgtagggt1440
ctggactggt gttctcctgc caggataagc agaatacagt gtgcgaagag tgtcccgaag1500
gcacctatag cgatgaggcc aatcacgtcg atccctgcct gccgtgtact gtctgcgagg1560
atacagagcg ccaattgcgc gaatgcacac catgggccga tgcggagtgt gaggagatcc1620
caggaaggtg gattacgcgg tctacccctc ccgagggcag tgacgtaacc acaccctcaa1680
cccaggaacc tgaggcacca ccggagcggg accttatcgc gtcaaccgtc gctgacaccg1740
tcacgacagt gatgggttct agccagccag tcgtgactag aggcactgcg gacaacttga1800
ttccagtgta ctgctctatt ctggctgccg tcgtcgttgg cctcgtggcg tatatcgctt1860
tcaaacgatg gaattcctgc aaacagaaca agcaaggggc caactcaaga cccgtgaatc1920
aaactcctcc tcccgaaggg gagaaactgc actctgatag cgggatatcc taactcgag 1979
<210>14
<211>1451
<212>DNA
<213>人工序列
<220>
<223>HHD A0201表达载体
<400>14
gcggccgcac caccatggcc gtaatggctc ctaggactct ggtgctcctt cttagtggag60
ctttggctct gacccagacc tgggccattc agcggactcc caagatacag gtgtacagca 120
ggcatcccgc tgagaatggg aaaagcaact tcctgaactg ctatgtgagc ggatttcacc 180
catcagacat cgaagtggat ctgttgaaga atggggagcg gattgagaag gtcgagcatt 240
ccgacctgtc attcagcaaa gactggagct tttacctcct gtactatacc gagtttacac 300
ccacagagaa ggatgaatat gcatgccgag tgaatcacgt tacgctgtct cagccaaaga 360
tcgtaaagtg ggaccgggat atgggcggtg gagggtcagg cggtggcggt tcaggaggag 420
gtgggagcgg aagtcattcc atgcgttact tcttcacatc cgtgtcaaga cctggcagag 480
gggagccacg cttcatcgca gtcggctacg tcgatgatac ccagttcgtc cgctttgact 540
ctgacgcagc cagtcagcgt atggaaccgc gtgcaccctg gattgaacag gaaggccctg 600
agtattggga tggggagact aggaaggtga aagcccatag ccagacacac cgagtcgacc 660
ttgggacgct gagaggatac tacaaccagt ccgaagctgg gagtcacacc gttcagcgaa 720
tgtatggctg cgacgtaggc tccgattgga gattcctgag gggctatcac cagtacgcat 780
acgatggtaa ggactatatc gccctcaaag aggatctgcg gtcctggaca gccgctgaca 840
tggccgcgca aacaacgaag cacaaatggg aggctgcgca tgtggccgag caactgaggg 900
cctacctgga gggaacttgt gtggagtggt tgcgcagata cctggagaac ggcaaggaaa 960
ctctccaacg caccgactct ccgaaggcac atgtgactca ccacccaagg agtaagggtg1020
aagtgacctt gcggtgttgg gcactgggat tctatcccgc agacatcaca ctgacctggc1080
aactgaatgg ggaagaactg acccaggaca tggagctcgt ggagacaaga ccagccggag1140
atgggacatt tcagaaatgg gcgtctgttg ttgtccctct cggcaaggag cagaactaca1200
cctgtcgcgt ataccacgaa gggttgcccg aacccctgac cctgcgatgg gaacctccac1260
ctagcactga ttcctatatg gtgattgtgg ccgtccttgg cgttctggga gctatggcca1320
tcataggtgc tgtggttgcc tttgtcatga aaaggcgcag aaacactggt ggcaaaggcg1380
gcgactatgc tctcgcccct ggaagccaat ctagcgagat gtctcttcgg gattgcaaag1440
cttgactcga g 1451
- 一种采用旋转刮蹭及撞击的冶金炉氧枪刮渣机
- 筋膜枪的旋转件的竖直旋转勾挂连接传动结构
- 一种筋膜枪传动机构及筋膜枪
