一种与血红蛋白结合的Tau复合物定量检测试剂盒、检测方法及应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于一种人体蛋白的检测方法,特别涉及一种定量检测外周血中与血红蛋白(Hb)结合的总Tau(Hb-T-Tau)的检测方法,该Hb-T-Tau主要来自外周血红细胞。
技术背景
人的Tau蛋白由染色体17q21上的16个外显子组成的微管相关蛋白Tau(microtubule-associated protein tau,MAPT)的基因编码。人类大脑中表达的Tau蛋白有六种亚型,长度在352~441个氨基酸区间,分子量在45~65kDa之间,包含0、1或2个氨基末端插入序列(0N、1N或2N),3或4个微管结合重复序列(3R或4R),以及一个短的羧基末端尾序列。Tau蛋白在人类主要存在于神经元,在其它细胞只有少量的表达。在神经元中,Tau与微管或微管蛋白结合,使轴突远端的微管保持一种动态稳定状态,这对维持轴突生长锥的动力学和有效的轴突转运非常重要。此外,Tau也可以与肌动蛋白结合,并影响肌动蛋白和肌动蛋白丝与微管的相互作用。Tau是一种磷蛋白,其生物活性受其磷酸化程度的调节。
Tau蛋白参与多种神经退行性疾病的发病过程,这些疾病包括阿尔茨海默病(Alzheimer’s disease,AD)、皮克病(Pick’s disease)、进行性核上麻痹(Progressivesupranuclear palsy,PSP)、皮层基底节变性(Corticobasal degeneration,CBD)、嗜银颗粒痴呆(Argyrophilic grain disease,AGD)以及额颞叶痴呆(Frontotemporal dementia,FTD)等。在这些疾病中,Tau发生异常磷酸化或突变(例如在FTD),丧失与微管结合的能力,并聚集成纤维而沉积在神经元和胶质细胞中。在AD,Tau的异常磷酸化修饰导致其形成直径在2.1~15纳米的成对螺旋细丝(Paired helical filament,PHF),沉积到神经元内,形成AD的特征性病理结构——神经元纤维缠结(Neurofibrillary tangles,NFLs)。Tau的异常磷酸化和聚集是引起AD及其它Tau蛋白病神经元退变的重要原因之一。退变的神经元可以将细胞内的Tau释放到细胞外,并进一步分泌到脑脊液和血液中。因此,检测脑脊液和血液中的磷酸化Tau(p-Tau181、p-Tau217)和总Tau(T-Tau)可以在一定程度上反映AD和其它Tau蛋白病的神经元退变和损伤情况。目前,p-Tau和T-Tau的检测已经被纳入到AD诊断的“A-T-N”分类评估系统,其中“A”是指Aβ42,反映脑中Aβ沉积情况,“T”是指p-Tau,反映脑中p-Tau的沉积,“N”是指神经变性(Neurodegeneration),可以通过检测T-Tau和/或NFL(Neurofilament light chain,神经丝轻链)进行评价。目前,脑脊液的Aβ42或Aβ42/40、p-Tau181和T-Tau的检测已经作为AD诊断的标准的“A-T-N”分类评估系统。在血液,血浆Aβ42或Aβ42/40、p-Tau181/p-Tau217、T-Tau和/或NFL也被认为是脑脊液“A-T-N”分类评估系统的替代物。由于血液样本采集方便,侵袭性小,容易被患者接受,血液中的“A-T-N”分类评估系统在AD诊断中的应用将会有更广阔的前景。
目前国际上开发了多种用于检测AD患者血浆中p-Tau和T-Tau的方法,相对p-Tau181/217,目前多数方法检测血浆中的T-Tau未能显示其在AD患者有显著增高,这与AD患者脑脊液T-Tau含量显著增高不一致。迄今为止,只有IMR(免疫磁衰减测试法)T-Tau检测方法可以检测到AD患者血浆中T-Tau含量的增高,其原因并非仅仅是检测敏感性的问题,而超高敏感性的SIMOA(单个免疫分子测试法)技术在检测血浆T-Tau含量变化时,其区分AD和对照的效率较低,提示血浆中的某些因素影响了T-Tau检测的准确性。Seol NationalUniversity(WO2020031116A1)通过用蛋白酶和磷酸酶抑制剂处理血浆样本后在利用SIMOA技术检测血浆中的T-Tau,发现血浆T-Tau含量的变化在AD高于对照,但区分AD和对照的准确度只有80.2%,但这一数值仍显著低于脑脊液T-Tau变化区分AD和对照的准确度。
现有基于血浆或血清T-Tau的检测方法未能检测出血浆T-Tau含量在AD发生显著变化的原因可能有以下几个原因:1)浓度较低,目前各种检测方法测定的数据显示,血浆T-Tau在1~100pg/mL之间;2)血浆中异噬性抗体、脂蛋白等干扰因素的存在;3)来自红细胞中Tau蛋白的潜在干扰。根据目前的报道,红细胞中Tau的含量约在1μg/mL,远高于血浆,少量溶血即可污染血浆Tau的测试。鉴于红细胞中含有较高浓度的Tau,而且可以反映脑中Tau含量的变化,直接检测红细胞中的Tau含量变化用于判定AD及其它Tau蛋白病的神经退变将是一个合理的选项。以往研究表明,红细胞中的Tau往往与其它蛋白如Aβ或α-突触核蛋白(α-Syn)形成复合物。但红细胞中的Tau是否与血红蛋白结合,这种结合形式的Tau在AD发生何种变化尚未有报道。
发明内容
本发明公开了一种与血红蛋白(Hemglobin,Hb)结合的总Tau蛋白(Hb-T-Tau)的定量检测方法,所述Hb-T-Tau复合物主要来自外周血红细胞。所述方法包括,将链球菌蛋白G(Protein G)或链霉亲和素(Streptavidin,SA)固定在固相载体上,随后加入抗Hb抗体(AHb)或生物素化抗Hb抗体(B-AHb)形成结合体,并分别与样本中的Hb-T-Tau复合物、酶标记抗T-Tau抗体(E-ATau)或生物素标记抗T-Tau抗体(B-ATau)和酶标记亲和素(E-SA)、化学发光液进行反应等步骤。其中,在酶标记抗体或酶标记亲和素的反应液中加入聚乙二醇(PEG)以增强酶标抗体与抗原以及酶促化学发光反应的效率。
其中,所述固相载体选自:酶标板、微孔板、试管、磁珠或微孔滤膜,此处优选的所述固相载体为酶标板;所述固相载体的材质选自:聚苯乙烯、聚氯乙烯、硝酸纤维素、尼龙等。
本发明所述的检测方法,进一步包括,血液样本的收集,ATau与样本中的Hb-T-Tau在液相反应液中形成Hb-T-Tau-ATau复合物(其中的ATau是酶标记的抗T-Tau的抗体,包括任何可以和T-Tau特异性结合的抗体;其中的液相反应液中含有一定量的PEG,复合物和上述结合体(即Protein G或SA与AHb或B-AHb形成的结合体)结合,采用发光法对抗原抗体结合物进行检测等步骤。
本发明所述的检测方法,通过预先在固相形成Proten G或SA与AHb或B-AHb的结合体、预先在液相形成Hb-T-Tau-ATau复合物,以及在酶标记抗体或酶标记亲和素反应液中加入聚乙二醇(PEG),增强了抗原-抗体的结合效率和酶促化学发光反应的反应效率,从而实现了检测方法敏感度的大幅度倍增效果。
所述的检测方法,优选方法如下:
包被酶标板:将配制的Protein G或SA包被液加入酶标板的孔中,孵育过夜,冲洗;将配制的封闭液加入酶标板的孔中,恒温孵育2-4h,冲洗。
向包被的酶标板中加入AHb或B-AHb溶液,恒温孵育0.5-2h,冲洗。
其中,所述Protein G包被液,配制方法为:使用的溶剂为缓冲溶液或生理盐水,配制Protein G的浓度为0.001-0.05μg/mL,优选的为0.002-0.02μg/mL,更优选的为0.005μg/mL。
其中,所述SA包被液,配制方法为:使用的溶剂为缓冲溶液或生理盐水,配制SA的浓度为0.1-10μg/mL,优选的为1-5μg/mL,更优选的为4μg/mL。
其中,所述AHb溶液或B-AHb溶液,配制方法为:使用的溶剂为缓冲溶液或生理盐水AHb或B-AHb,配制的AHb或B-AHb的浓度为0.1-5.0μg/mL,优选的为0.5-2.0μg/mL,更优选的为1.0μg/mL。
其中,所述封闭液选自1%-10%的牛血清白蛋白溶液或含1-2%明胶的溶液或其它任何可以防止抗原、抗体发生非特异性结合的液体;所述1%-10%的牛血清白蛋白溶液配制方法为:将牛血清白蛋白加入缓冲溶液或生理盐水中混合均匀,所述1-2%明胶的溶液配制方法为:将明胶溶于缓冲液或生理盐水中混合均匀。
其中,所述PEG,可以是任何分子量的PEG,包括PEG-200~PEG-20000,优选的为PEG-4000~PEG-8000,更优选的为PEG-6000。其中所述PEG的浓度为0.1 -12%,优选的为2-8%,更为优选的为5%。
其中,以上方法所述缓冲溶液选自:Tris-HCl缓冲液、磷酸盐缓冲液(PBS)、碳酸盐缓冲液(CBS)。
基于本发明的上述方法,所述方法可以避免直接包被抗体可能存在的问题,包括方向的不确定性、变性、固定效率差或污染物与目标分子的结合,影响抗体和抗原分子的结合。因此,所述方法,通过将AHb抗体或B-AHb与事先固定在固相载体的Protein G或SA形成结合体,有利于提高AHb与抗原的结合效率,所述抗原包括Hb、Hb-T-Tau复合物、Hb-T-Tau-ATau复合物。
基于本发明的上述方法,所述方法在酶标记抗T-Tau抗体(E-ATau)或酶标记亲和素(E-SA)反应液中加入PEG,由于PEG可以增加反应物的有效浓度,有利于反应物间的碰撞,因此,一方面可以提高酶标记抗体与抗原的结合效率,另一方面显著提高了酶与化学发光底物的碰撞和反应效率,使检测方法的灵敏度得到大幅度地提高。
本发明所述方法包括将配制的Protein G包被液加入固相载体中,孵育过夜,冲洗;将配制的封闭液加入酶标板的孔中,恒温孵育;向包被固相载体中加入AHb溶液,恒温孵育。
基于本发明的上述方法,本发明进一步提供了完整的检测样本中的Hb-T-Tau复合物与含量的方法,所述方法包括以下步骤:
S1:待检样品的制备;
S2:向固相载体中加入Protein G溶液,孵育,冲洗;
S3:加入封闭液,孵育,冲洗;
S4:加入AHb溶液,孵育,冲洗;
S5:加入待检样品(含有Hb-T-Tau复合物),孵育,冲洗;
S6:加入酶标记的抗T-Tau抗体(E-ATau),孵育,冲洗,加入化学发光液检测其数值;或加入生物素标记的抗T-Tau抗体(B-ATau),孵育,冲洗,加入酶标亲和素(E-SA),孵育,冲洗,加入化学发光液检测其数值;
其中,在E-ATau或E-SA的反应液中可加入一定量浓度的PEG-6000,大幅度地增强了酶促化学发光的反应效率;通过数值计算即可获得样本中的Hb-T-Tau复合物的含量。
本发明所述方法还可以包括在固相载体包被SA,以检测样本中的Hb-T-Tau复合物与含量的方法,所述方法包括以下步骤:
S1:待检样品的制备;
S2:向固相载体中加入SA溶液,孵育,冲洗;
S3:加入封闭液,孵育,冲洗;
S4:加入B-AHb溶液,孵育,冲洗;
S5:加入待检样品(含有Hb-T-Tau复合体),孵育,冲洗;
S6:加入E-ATau反应液,孵育,冲洗,加入化学发光液检测其数值;
其中,在E-ATau反应液中加入一定量浓度的PEG-6000,大幅度地增强了酶促化学发光的反应效率;通过数值计算即可获得样本中的Hb-T-Tau复合物的含量。
本发明也可以采用以下的通过在液相中预先形成的Hb-T-Tau-ATau复合物,以达到进一步提高检测Hb-T-Tau复合物敏感度的目的,所述方法、步骤如下:
S1:待检样品的制备;
S2:向固相载体中加入Protein G,孵育,冲洗;
S3:加入封闭液,孵育,冲洗;
S4:加入AHb溶液,孵育,冲洗;
S5:加入预先形成的Hb-T-Tau-ATau复合物(其中ATau是指酶标记的抗T-Tau抗体),孵育,冲洗;加入化学发光液检测其数值;
其中,在液相反应液中加入一定量浓度的PEG-6000以增强抗原-抗体的结合效率以及酶促化学发光反应的效率,以进一步提高检测方法的灵敏度;通过计算即可得到Hb-T-Tau复合物的含量。
其中,Hb-T-Tau-ATau复合物的制备,方法如下:
制备标记的抗T-Tau抗体(如碱性磷酸酶标记ATau,AP-ATau),在液相与样本中的Hb-T-Tau复合物中的T-Tau结合,即可形成Hb-T-Tau-ATau复合物。
在上述方法中,为计算待测样本中Hb-T-Tau复合物的含量,需要配制Hb-T-Tau复合物标准品,其配制方法如下;
A、用缓冲液分别溶解纯化的T-Tau蛋白和Hb后,将其混合,振荡孵育;
B、孵育样品离心取上清,通过凝胶过滤柱过滤,分离出Hb-T-Tau复合物;
C、用质谱分析方法,确定T-Tau占Hb-T-Tau复合物的质量占比。
为此本发明还包括Hb-T-Tau复合物标准品的制备。该Hb-T-Tau复合物标准品可与抗体AHb和ATau相结合,用于制作化学发光信号与浓度关系标准曲线,获得数学公式,通过数学公式定量计算样本中的Hb-T-Tau复合物的含量。
基于本发明的方法,本发明进一步提供一种检测试剂盒,所述试剂盒包括特异性抗Hb抗体(AHb)、固相载体、Protein G、PEG。在此基础上,本发明所述检测试剂盒还可以含有生物素或酶标记抗T-Tau抗体(B-ATau或E-ATau),还包括酶标记的亲和素(E-SA),其可特异性的与B-ATau相结合,发光剂,必要的溶剂,使用说明书等。
在本发明提供的一个具体实施例中,本发明所述检测试剂盒还可以包括Hb-T-Tau标准品,SA,B-AHb,AP-ATau,发光剂,必要的溶剂,使用说明书等。
在本发明提供的一个具体实施例中,本发明所述检测试剂盒,可以用于检测待测样品中Hb-T-Tau复合物含量,以进一步确定受试者是否患有阿尔茨海默病(AD)或其它Tau蛋白病及其风险。其中,所述待测样品来源于人,优选来源于AD患者和Tau蛋白病患者及其风险的人群的血液样本或来自于血液样本中的红细胞。
在本发明提供的一个具体实施例中,本发明所述检测试剂盒,其中所述抗体ATau为酶标记的抗T-Tau抗体。所述酶为可以催化化学发光反应的酶,如碱性磷酸酶(AlkalinePhosphatase,AP)、辣根过氧化物酶(Horseradish Peroxidase,HRP)或葡萄糖氧化酶(Glucose Oxidase,GO)。
在本发明提供的一个具体实施例中,本发明所述检测试剂盒,还包括荧光素、胶体金等其它物质标记的抗体和亲和素,所述标记抗体和亲和素可特异性的与ATau相结合。
在本发明提供的一个具体实施例中,本发明所述检测试剂盒,其中还包括缓冲液、封闭液等。
本发明还提供了Protein G、AHb、PEG、E-ATau或B-ATau、E-SA在制备用于定量检测待测样本中Hb-T-Tau复合物含量的试剂盒或试剂中的用途。
本发明还提供了SA、B-AHb、Protein G、E-ATau在制备用于检测待测样品是否患有AD或其它Tau蛋白病及其风险的试剂盒或试剂中的用途。本发明所述的抗体为单克隆抗体,例如能够特异性结合Hb的单克隆抗体和能够特异性结合T-Tau的单克隆抗体。示例性地,所述抗体可为完整抗体、抗体片段,例如可以为(Fab)2、Fab’、scFv等。抗体可以为任何动物种属来源,识别任何种属的Hb、T-Tau,优选地识别人的Hb、T-Tau。
本发明提供的Hb-T-Tau复合物检测试剂盒及其检测方法和相关的应用,以Protein G或SA包被固相载体如96孔酶标板,使其与作为捕获抗体的AHb或B-AHb结合,用于捕获样本中的Hb-T-Tau复合物。这种固定抗体的方法可以提高AHb或B-AHb的捕获能力,增加其与样品中的抗原,即Hb-T-Tau复合物,的结合效率。再以ATau为检测抗体,可以大幅度地提高检测方法的灵敏度。
其中,在Protein G包被在固相载体的情况下,AHb通过与Protein G结合固定到固相载体上,因为Protein G主要通过与抗体的Fc段与结合,因此可以使抗体与抗原结合的Fab段朝上,即头(Fab段)朝上,尾(Fc段)朝下。所述AHb头朝上,是相对于朝下、侧卧和平躺而言。这种处理可以避免将抗体直接被动吸附到酶标板或其它固相载体上可能产生一些问题,包括方向的不确定性、抗体变性、固定效率差以及由于空间结构问题导致的抗体与目标分子无法正常结合,因此大幅度提高了捕获抗体与抗原的结合效率。
其中,在SA包被在固相载体的情况下,生物素化的抗Hb抗体(B-AHb)通过与SA结合固定到固相载体上,因为抗体通过生物素与SA结合,其结合效率高,同时避免了抗体直接被动吸附包被酶标板或其它固相载体上可能产生的抗体变性、固定效率差以及由于空间结构问题导致的抗体与目标分子无法正常结合等问题,因此大幅度提高了捕获抗体与抗原的结合效率。
本发明在发明了所述试剂盒的基础上,进一步提供所述试剂盒的使用方法,所述方法,包括以下步骤:
将Protein G或SA固定在固相载体上,随后加入AHb或B-AHb形成结合体的步骤。
具体包括以下步骤:
包被酶标板:将配制的Protein G或SA包被液加入酶标板的孔中,孵育过夜,冲洗;将配制的封闭液加入酶标板的孔中,恒温孵育2-4h,冲洗。
向包被酶标板中加入AHb溶液或B-AHb溶液,恒温孵育0.3-2h,冲洗。
其中,所述Protein G包被液,配制方法为:使用的溶剂为缓冲溶液或生理盐水,配制Protein G溶液的浓度为0.001-0.05μg/mL,优选的为0.002-0.02μg/mL,更优选的为0.005μg/mL。
其中,所述SA包被液,配制方法为:使用的溶剂为缓冲溶液或生理盐水,配制SA的浓度为0.1-10μg/mL,优选的为1-5μg/mL,更优选的为4μg/mL。
其中,所述AHb或B-AHb溶液,配制方法为:使用的溶剂为缓冲溶液或生理盐水,配制AHb或B-AHb溶液的浓度为0.1-5.0μg/mL,优选的为0.5-2.0μg/mL,更优选的为1.0μg/mL。
其中,所述封闭液选自1%-10%的牛血清白蛋白溶液或含1-2%明胶的溶液或任何可以用于抗原或抗体非特异性结合的溶液;所述1%-10%的牛血清白蛋白溶液配制方法为:将牛血清白蛋白加入缓冲溶液或生理盐水中混合均匀,所述1-2%明胶的溶液配制方法为:将明胶溶于缓冲液或生理盐水中混合均匀。
其中,以上方法所述缓冲溶液选自:Tris-HCl缓冲液、PBS缓冲液、CBS缓冲液。
本发明所述试剂盒的使用方法,根据需要还可以包括任何选自现有技术的步骤,如,血液样本的收集以及待测样品的制备,E-ATau的制备,B-ATau的制备,E-SA的制备,Hb-T-Tau复合物的制备,Hb-T-Tau-ATau复合物的制备,缓冲溶液和生理盐水的配制,以及使用化学发光检测仪器,使用已知的化学发光法对抗原抗体结合物进行检测等步骤。
在E-ATau和E-SA孵育液中加入PEG,这个改进可以大幅度增强抗原抗体结合效率和酶促化学发光反应的效率,使检测方法的灵敏度得到大幅度倍增的效果,从而也缩短检测时间;
加了Protein G或SA、PEG和加了Hb-T-Tau-ATau复合物的液相反应,这些改进使检测指标有了三个进步:首先是检测的敏感度,其次是诊断的准确度,再次是检测时间。
本发明进一步包括,所述试剂盒中的试剂在制备检测阿尔茨海默病试剂盒中的应用。
以下为本发明名称术语的解释和说明
1)Hb-T-Tau复合物:血红蛋白与总Tau结合形成的复合物。
2)链球菌蛋白G:即Protein G,是链球菌表面的一种细胞壁蛋白,分子量约65kDa,可以与免疫球蛋白即抗体的Fc段结合。
3)亲和素和链霉亲和素:亲和素是一种糖蛋白,可由蛋清中提取,分子量60kDa,每个分子由4个亚基组成,可以和4个生物素分子紧密结合。链霉亲和素(Streptavidin,SA)是与亲和素(Avidin)有类似生物学特性的一种蛋白质。是由Streptomyces Avidinii菌在培养过程中分泌的一种蛋白质产物,链霉亲和素SA也可通过基因工程手段生产。链霉亲和素SA分子量为65kDa,由4条序列相同的肽链构成,每条链霉亲和素SA肽链可以结合1个生物素分子。因此与A一样,每个链霉亲和素SA分子也具有4个可与生物素分子结合位点,其结合常数与A相同为1015mol/L。
4)固相载体:用于酶联免疫吸附检测(Enzyme-linked immunosorbent assay,ELISA)或化学发光免疫检测(ChemiLuminescent ImmunoAssay,CLIA)反应的固相介质(包括酶标板、微孔板、微孔滤膜、磁珠、胶体金等)。
5)酶标板或微孔板:一种特制塑料板,用于酶联免疫或化学发光免疫测试。可以是不同孔数和孔径,如48孔,96孔,384孔,不同颜色,如透明,白色,黑色等,以及不同孔底,如平底,圆底等。可以用于固定抗原、抗体、Protein G、SA等分子。
6)微孔滤膜:用于固定Protein G、SA或抗体的特制带有微孔的膜,如尼龙膜,醋酸纤维素膜,硝酸纤维素膜,聚偏二氟乙烯膜(PVDF膜)。
7)磁珠:磁珠可通过表面外部修饰的功能基团结合活性蛋白来作为抗原抗体反应的载体。
8)胶体金:能够与抗体分子、抗原分子或其它蛋白质分子结合的金颗粒。
9)聚乙二醇:即polyethylene glycol,PEG,是含有α,ω-双端羟基的乙二醇聚合物的总称。聚乙二醇是一种高分子聚合物,化学式是HO(CH2CH2O)nH。
10)生物素:Biotin,是一种合成的维生素,在免疫检测中,用于标记与特定抗原结合的抗体分子。
11)碱性磷酸酶:Alkaline phosphatase(AP),是特异的磷酸酯酶,在免疫检测中用于标记检测抗体或亲和素,通过催化发光或成色底物,对免疫反应进行量化。12)辣根过氧化物酶:Horseradish peroxidase(HRP),一种来自植物辣根中的酶,由无色的酶蛋白和棕色的铁卟啉结合而成的糖蛋白。是临床检验试剂中的常用酶。该酶在免疫检测中用于标记抗体或亲和素,通过催化发光或成色底物,对免疫反应进行量化。
13)葡萄糖氧化酶:Glucose oxidase(GO),是从金黄色青霉菌中提取获得的一种酶,该酶在免疫检测中用于标记抗体或亲和素,通过催化发光或成色底物,对免疫反应进行量化。
14)抗Hb抗体:可与血红蛋白特异性结合的抗体,在本说明书中缩写为AHb。15)抗Tau抗体:可与Tau分子特异性结合的抗体,在本说明书中缩写为ATau。16)生物素标记抗体:与生物素结合的抗体,如在本说明书中的生物素标记抗Hb抗体(B-AHb)和生物素标记抗Tau抗体(B-ATau)。
17)酶标记抗体:与特定酶结合的抗体,如本说明书中提及的与碱性磷酸酶特定结合的抗Tau抗体(AP-ATau)或与酶标抗体Tau抗体(E-ATau)。
18)酶标亲和素:与特定酶结合的亲和素(E-SA),所述酶如碱性磷酸酶、辣根过氧化物酶等。
19)抗Hb抗体(AHb)的Fab段:抗血红蛋白抗体的特异性的与抗原结合的片段。是抗体经木瓜蛋白酶水解后的产物。
20)Hb-T-Tau-ATau复合物:血红蛋白与Tau以及特异性识别Tau的抗体组成的复合物。
21)荧光素:荧光素又名荧光黄、荧光生、荧光红,可以自动发出荧光或通过一定波长的激发光激发出荧光。在免疫检测中往往作为化学发光底物对免疫反应进行定量检测或量化。
22)单克隆抗体:是由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。通常采用杂交瘤技术来制备。
23)封闭液:用于封阻抗原或抗体与反应界面或其它非目标蛋白的非特异性结合的液体。
24)孵育:生物分子在一定条件下的反应过程。
25)牛血清白蛋白:是牛血清中的一种球蛋白,包含607个氨基酸残基,分子量为66.446KDa,等电点为4.7。
26)明胶:是胶原的水解产物,从动物的骨、皮肤、筋膜等组织中提取,属于蛋白质。
27)Tris-HCl缓冲液:三羟甲基氨基甲烷-盐酸缓冲液。由三羟甲基氨基甲烷溶于水,并加入盐酸调制而成。
28)PBS缓冲液:磷酸盐缓冲液,由磷酸二氢钠、磷酸氢二钠、氯化钠按一定比例加水溶解调制而成。
29)CBS缓冲液:碳酸盐缓冲液,由碳酸和碳酸氢钠按比例加水配制而成。
30)化学发光液:一种在酶的催化作用下能够发出特定波长光的溶液。
31)阿尔茨海默病:Alzheimer’s disease(AD),是一种以认知功能障碍为特征的神经退行性疾病,伴随性格、行为异常。
32)Tau蛋白:是一种微管结合蛋白(Microtubule Associated Protein),广泛分布于神经系统的神经细胞中,是用来稳定作为神经细胞骨架的微管的重要成分。Tau蛋白是神经纤维缠结的主要组分,也是阿尔茨海默症(AD)等一系列神经退行性疾病的标记物。其分子量范围为55kDa-62kDa。
33)红细胞裂解液:红细胞通过反复冻融或在低渗溶液中,细胞膜破裂,形成的含有液体。红细胞裂解液含有待测的目标蛋白,如Tau。
34)化学发光检测仪器:用于检测化学发光强度的特殊仪器。
本发明方法实例
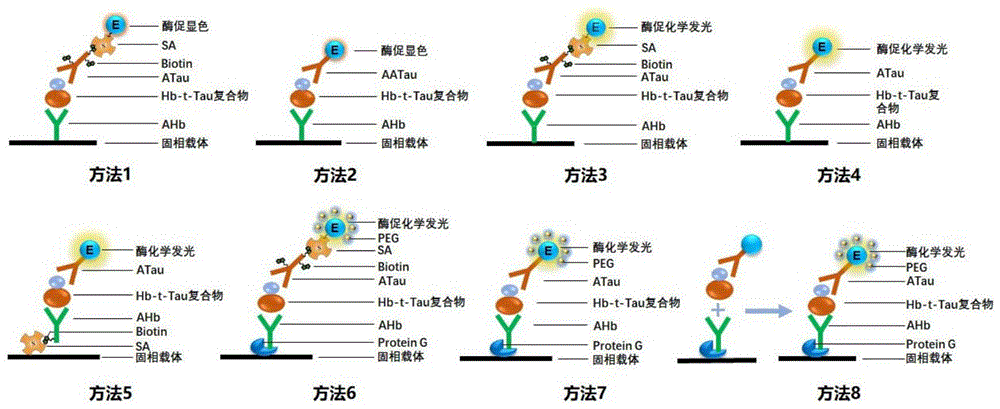
方法1和2:捕获抗体直接包被在酶标板上结合生物素或酶标记检测抗体的酶联免疫检测法(ELISA):捕获抗体(本专利中为AHb)首先直接包被在酶标板上,然后与样品中的抗原分子(如Hb-T-Tau复合物)反应,再分别与生物素标记Tau抗体(B-ATau)和酶标记亲和素(如AP-SA)反应(方法1),或直接与酶标记抗Tau抗体(本专利中为AP-ATau)反应(方法2),最后与含有显色底物(如硝基苯磷酸,pNPP)的显色液反应,酶标仪记录特定波长的吸光度值。
方法3和4:捕获抗体直接包被在酶标板上结合生物素或酶标记检测抗体的化学发光免疫检测法(CLIA):捕获抗体(本专利中为AHb)首先直接包被在酶标板上,然后与样品中的抗原分子(如Hb-T-Tau复合物)反应,再分别与生物素标记Tau抗体(B-ATau)和酶标记SA(如AP-SA)反应(方法3),或直接与酶标记抗Tau抗体(本专利中为AP-ATau)反应(方法4),最后与化学发光液反应,记录特定波长的光强度。
方法5:捕获抗体通过SA固定到酶标板上结合酶标记检测抗体的化学发光免疫检测法(CLIA):首先将SA包被在酶标板上,然后与生物素化捕获抗体(本专利中为生物素化抗Hb单抗,B-AHb)结合,然后与样品中的抗原分子(如Hb-T-Tau复合物)反应,再与酶标记的抗Tau抗体(如AP-ATau)反应,最后与化学发光液反应,记录特定波长的化学发光强度。
方法6和7:捕获抗体通过Protein G固定到酶标板上结合PEG增强酶标记抗体或亲和素的化学发光免疫检测法(CLIA):首先将Protein G包被在酶标板上,然后与捕获抗体(本专利中为AHb)结合,然后与样品中的抗原分子(如Hb-T-Tau复合物)反应,再分别与生物素标记抗Tau抗体(B-ATau)和酶标记亲和素(如AP-SA)反应(方法6),或直接与酶标记抗Tau抗体(如AP-ATau)反应(方法7),最后与化学发光液反应,记录特定波长的化学发光强度。其中在酶标记抗Tau抗体或酶标记亲和素的反应液中,加入一定量的PEG以增强酶促化学发光反应的效率。
方法8:捕获抗体通过Protein G固定到酶标板上结合PEG增强液相酶标检测抗体-抗原复合物反应的化学发光免疫检测法(CLIA):首先将Protein G包被在酶标板上,并结合AHb。同时在含有PEG的液相中反应液中进行样品中的抗原(即Hb-T-Tau复合物)与酶(如碱性磷酸酶)标记抗Tau抗体反应,形成Hb-T-Tau-ATau复合物,然后与酶标板上的结合在Protein G上的AHb反应,最后与化学发光液反应,记录特定波长的化学发光强度。
本发明与以往方法比较进行的技术改进包括:1)用Protein G或SA包被酶标板,然后与捕获抗体AHb或B-AHb结合,提高了AHb与抗原Hb-T-Tau复合物的结合效率;2)在液相形成Hb-T-Tau-ATau复合物进一步提高抗原-抗体结合效率;3)引入PEG大幅度增强酶催化学发光反应效率。这些技术改进使检测方法的灵敏度成协同加,检测时间明显缩短了,诊断的准确度显著提高。这些技术方案都属于本发明的保护范围。
本发明至少具有以下优势之一:
1)用包被到固相载体的Protein G或SA结合抗AHb或B-AHb,可以提高AHb与抗原Hb-T-Tau复合体的结合能力。
2)在酶标抗体或酶标记亲和素孵育液中加入PEG,可以酶标抗体与抗原的结合效率,增强酶促化学发光反应的效率,从而大幅度提高检测方法的灵敏度,也缩短了检测时间。
3)通过将酶标标记抗Tau抗体与样本事先在液相反应,形成抗原-抗体-酶复合
物,同时在液相反应液中加入PEG,进一步地提高了检测方法的灵敏度。
4)本发明提供的Hb-T-Tau复合物检测试剂盒和检测方法适用于所有与Hb结合的T-Tau含量的定量检测,包括与外周血红细胞中的与Hb结合的T-Tau含量的定量检测。
5)由于改进后的方法大幅度地提高了试剂盒的灵敏度,不仅在检测外周血红细胞中的Hb-T-Tau复合物时所需样本量大幅度减少,而且可以使用全血样本进行Hb-T-Tau复合物的测试。改进后的方法使血液样本的采集和处理更便捷,适合大规模人群筛查。
6)测试结果更稳定,测试精准度大幅度提高。
7)鉴于机体组织尤其是脑组织中的Tau可以进入血浆,后者可以进一步进入红细胞并与红细胞中的Hb结合,利用本发明所述检测方法所测试的Hb-T-Tau复合物的含量可以反映机体组织尤其是脑组织中Tau含量的变化。
8)能够解决现有的检测血浆和血清样本中Tau的技术所存在的问题,包括红细胞中的Tau因溶血释放到血浆或血清,干扰血浆和血清Tau测试结果的准确度问题以及血浆脂蛋白或异噬性抗体对测试准确度的干扰问题。
本发明所提供的方法的主要创新点如下:
1)首次建立了Hb-T-Tau复合物的化学发光免疫检测免疫检测方法和试剂盒,并将其作为反映Tau蛋白病理的标志物,其含量高,检测结果稳定,可以很好地区分AD以及其它Tau蛋白病患者与健康对照。
2)在酶标板事先包被Protein G或SA,然后与抗Hb抗体(AHb)或生物素化抗Hb抗体(B-AHb)反应。该方法的优点:避免了直接将抗Hb抗体包被在酶标板上时可能出现的抗体变性、固定效率差或污染物与目标分子的结合等问题。此外,在使用Protein G包被的情况下,还可以解决包被抗体头尾朝向不确定的问题。因此,本专利所提供的方法,大幅度地提高了抗Hb抗体的捕获能力,增加了其与样品中的抗原,即Hb-T-Tau复合物,的结合效率。
3)在酶标记的抗Tau抗体(E-Tau)或酶标记的亲和素(E-SA)反应液中加入PEG,不仅可以提高酶标记抗Tau抗体与抗原的结合效率,也可以显著增强
酶促化学发光反应的效率,从而大幅度提高了检测方法和试剂盒的灵敏度。4)在液相中首先进行抗原即Hb-T-Tau复合物与酶标记抗Tau抗体(E-ATau)的反应,形成Hb-T-Tau-ATau复合物,然后再与固定到酶标板上的捕获抗体,即抗Hb抗体(AHb)结合,并在Hb-T-Tau-ATau复合物液相反应液中加入PEG。这种改进进一步提高了抗原和抗体的结合效率和酶促化学发光反应的效率,使检测方法和试剂盒的灵敏度得到进一步提高。
本发明的有益效果包括:
1)本发明提供的Hb-T-Tau复合物检测试剂盒大幅度地提高了检测方法的灵敏度,只需要少量红细胞样本(1~2μL)即可进行样本中的Hb-T-Tau复合物的精确定量测试。
2)由于外周血中的Hb-T-Tau复合物含量高,并且本发明所提供的方法大幅度地提高了检测的敏感度,本方法可以直接利用少量全血样本(3~4μL)进行Hb-T-Tau复合物的测试。
3)与直接测试血浆和血清样本中的T-Tau方法相比较,外周血中的Hb-T-Tau复合物含量高,可以规避血浆脂蛋白、异噬性抗体对测试的干扰,测试结果稳定、准确度高、重复性好。
4)使用血液样本,尤其是全血样本,取材容易、侵袭性小、成本低,并且样本的需要量极少,无需复杂前处理,适用于大规模筛查阿尔茨海默病或其它Tau蛋白病高危人群,或通过动态重复测试跟踪阿尔茨海默病患者或其它Tau蛋白病患者和高危人群身体中的T-Tau含量的变化情况。
5)与目前检测血液T-Tau的技术相比较:a)在不需要大型昂贵设备如质谱仪、超敏感单分子检测仪的前提下,与各种检测血浆T-Tau技术相比较,AD/HC比值、区分AD和HC的敏感性、特异性、AUC具有明显优势;b)与各种检测血浆神经元来源外泌体T-Tau技术相比较,各种技术指标相当,但需要的样本量明显减少,不需要外泌体分离的复杂过程,成本明显降低,操作简单、便于社区高危人群筛查和动态跟踪。
附图说明
图1发明实例检测方法原理示意图。方法1和2为酶联免疫检测法,方法3~8为化学发光免疫检测法。其中,方法1~7为固相免疫检测,即捕获抗体、抗原、检测抗体、亲和素依次在固相进行反应。方法8为液相免疫检测,抗原和酶标检测抗体首先在液相形成复合物,然后与通过Protein G固定到固相的捕获抗体反应。PEG加在含酶标记抗体或酶标记亲和素的稀释液中。
图2PEG-6000对检测方法中生物素标记抗体和酶标记亲和素两个检测步骤的不同增益效果柱状图。捕获抗体(AHb)直接包被酶标板,依次与Hb-T-Tau复合物(来自AD和HC的红细胞裂解液)、B-ATau、AP-SA和化学发光液反应,测试化学发光信号值。其中,在B-ATau或/和AP-SA稀释液中加入一定浓度的PEG-6000,比较PEG-6000对不同反应步骤对化学发光强度的影响。AHb:抗血红蛋白抗体;B-ATau:生物素标记抗Tau抗体;AP-SA:碱性磷酸酶标记链霉亲和素;AD:阿尔茨海默病;HC:健康对照。
图3Protein G和PEG-6000在酶标记检测抗体化学发光免疫检测方法中对发光信号不同增益效果柱状图。Protein G包被酶标板,与捕获抗体AHb结合,再依次与Hb-Aβ复合物(来自AD和HC的红细胞裂解液)、AP-ATau和化学发光液反应,测试化学发光信号值。其中,在Protein G包被酶标板或AP-ATau稀释液中加入一定浓度的PEG-6000,比较两种增益条件对化学发光强度的影响。AHb:抗血红蛋白抗体;AP-ATau:碱性磷酸酶标记抗Tau抗体;AD:阿尔茨海默病;HC:健康对照。
图4发明实例不同检测方法测试Hb-T-Tau标准品浓度对应化学发光信号关系曲线。
图5发明实例不同检测方法测试外周红细胞和全血和样本中Hb-T-Tau复合物化学发光信号和浓度值散点图以及ROC曲线分析图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
需要说明的是,本发明中总Tau、Total Tau、T-Tau或t-tau等均为同一物质,且英文名称、简写等不区分大小写。
本发明中部分试剂的配制方法如下,其它试剂均为常规配制方法。
0.01mol/L PBS,配制方法为:
200mmol/L NaHCO
NaHCO
20%叠氮钠(NaN
DDW 50mL
1%的封闭液,配制方法为:
BSA 1g
PBST 100mL
含0.05%Tween-20的0.01mol/L PBS(PBST),配制方法为:
实施例1T-Tau试剂盒的制备方法
1.配制包被液:
采用缓冲溶液将Protein G稀释至0.001μg/mL~0.1μg/mL;或采用缓冲溶液将SA稀释至0.1μg/mL~10μg/mL;所述缓冲溶液选自:Tris-HCl缓冲液、PBS缓冲液、CBS缓冲液或缓冲生理盐水。本实施例采用NaHCO
2.配制封闭液:
封闭液选自1%~10%的新生牛血清或明胶含量为2.5%的PBST溶液(含0.05%Tween-20的0.01mol/L PBS)。本实施例采用含1%BSA的PBST溶液。
3.结合捕获抗体
封闭完成后,采用缓冲液将AHb稀释至0.1μg/mL~4μg/mL;或采用缓冲液将B-AHb抗体稀释至0.1μg/mL~4μg/mL,优选的为0.5~2μg/mL,更优选的为1μg/mL;所述缓冲溶液选自:PBS缓冲液、PBST溶液、CBS缓冲液或缓冲生理盐水。恒温孵育1-2个小时,冲洗即得。本实例采用PBST溶液。包被用固相载体:
固相载体可为酶标板、微孔板、磁珠、试管或微孔滤膜。本实施例中采用酶标板,且对酶标板进行修饰,其中所述的修饰通过如下进行:将酶标板置于装有紫外灯的医用净化操作台上,固定紫外灯与微孔板基底的垂直距离,对微孔板进行紫外处理。
4.标准品的配制(定量标准曲线的建立):
1)用500μL的0.01mol/L PBS溶解Tau蛋白和Hb,使终浓度分别为2mol/L与2mol/L,混合于37℃、230rpm、振荡孵育24h;本例选择的Tau蛋白是非磷酸化的全长Tau。
2)孵育样品在10000×g离心5min,吸取上清,以PBS为流动相,HiPrep 26/60Sephacryl S-200High Resolution层析柱凝胶过滤,分离Hb-T-Tau复合物;
3)用SWATH(Sequential Window Acquisition of all Theoretical MassSpectra)定量蛋白组方法,确定平均每个Hb分子结合的Tau分子数,从而计算出Tau占复合物的重量百分比或摩尔百分比。据此,配制不同浓度的Hb-T-Tau复合物溶液,将其作为标准蛋白,制作标准曲线。
5.配制抗T-Tau抗体稀释溶液
将ATau用酶偶联物稳定剂稀释而成。本实施例中对ATau不做限定,可以为任意能够特异性识别T-Tau的抗体。
酶偶联物稳定剂是能够保持抗体与酶偶联物之间稳定性的试剂,能够保持抗体及酶的活性。优选的,其可为碱性磷酸酶(AP)偶联物稳定剂,本发明中酶偶联物稳定剂可为市售产品。
6.配制酶标抗体溶液
用封闭液稀释碱性磷酸酶(AP)标记的抗t-tau抗体,即AP-ATau。
7.洗液
洗液为含吐温-20(Tween-20)的PBS溶液(简称PBST溶液),其中,PBST溶液中可包含生物液体防腐剂如Proclin300。
8.底物溶液
底物溶液可为AMPPD(1,2-二氧环已烷衍生物)、APS-5、本例优选的为AMPPD。
9.样品稀释液
样品稀释液为PB溶液。
本发明提供的试剂盒中,各种试剂分别包装,优选使用包装管,每个包装管装入试剂的量以够一个样本使用量为基本量,可以扩大到10个,100个,1000个样本的使用量。
实施例2不同试剂盒检测方法操作原理和流程(图1)
方法1:捕获抗体直接包被在酶标板上结合生物素标记检测抗体的酶联免疫检测法(ELISA)
S1:取5-10mL外周血,混匀,贴壁加入至离心管中,取部分外周血全血-80℃保存。剩余部分按照一定的稀释比例加入PBS,充分混匀。
S2:将稀释后的全血缓慢加至淋巴细胞分离液上,离心,分离红细胞层。将红细胞转移到新的离心管中,加PBS,离心,-80℃保存。
S3:将冻存红细胞在室温融化后按一定稀释比例加入样本稀释液,即为胞浆样品。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液300μL,孵育2h。冲洗。
S6:反应1:向酶标板各孔中加入稀释后的外周血全血或红细胞裂解液,或Hb-T-Tau复合物标准蛋白,孵育2h。冲洗。
S7:反应2:用封闭液稀释生物素标记抗T-Tau抗体(B-ATau)至终浓度为0.1-2μg/mL。向酶标板的各孔加入该抗体稀释液,孵育2h。冲洗。
S8:反应3:用封闭液稀释碱性磷酸酶标记亲和素(AP-SA)(1:5000稀释),向酶标板的各孔加入该酶稀释液,每孔100μL。孵育1h。冲洗。
S9:显色:向酶标板的各孔加入显色液,室温避光显色0.5h。
S10:终止:用10%H
S11:测定含量:使用酶标仪在紫外分光光度计特定波长处测定酶标板各孔的吸光度值。
S12:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与特定波长处吸光值之间的关系曲线,计算样品中Hb-T-Tau复合物的含量。
方法2:捕获抗体直接包被在酶标板上结合酶标记检测抗体的酶联免疫免疫检测法(ELISA)
S1-S3:方法1所示。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液300μL,孵育2h。冲洗。
S6:反应1:向酶标板各孔中加入稀释后的外周血全血或红细胞裂解液,或Hb-T-Tau复合物标准蛋白,孵育2h。冲洗。
S7:反应2:用封闭液稀释碱性磷酸酶标记抗T-Tau抗体(AP-ATau)至终浓度为0.1-2μg/mL。向酶标板的各孔加入该抗体稀释液,孵育2h。冲洗。
S8:显色:向酶标板的各孔加入显色液,室温避光显色0.5h。
S9:终止:用10%H
S10:测定含量:使用酶标仪在紫外分光光度计特定波长处测定酶标板各孔的吸光度值。
S11:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与吸光值之间的关系曲线,计算样品中Hb-T-Tau复合物的含量。
方法3:捕获抗体直接包被在酶标板上结合生物素标记检测抗体的化学发光免疫检测法(CLIA)
S1-S3:如方法1所示。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液300μL,孵育2h。冲洗。
S6:反应1:向酶标板各孔中加入稀释后的外周血全血或红细胞裂解液,或Hb-T-Tau复合物标准蛋白,孵育1h。冲洗。
S7:反应2:用封闭液稀释生物素化抗T-Tau抗体(B-ATau)至终浓度为0.5-4μg/mL。向酶标板的各孔加入该抗体稀释液,孵育1h。冲洗。
S8:反应3:用封闭液稀释碱性磷酸酶标记亲和素(AP-SA)(1:10000稀释),向酶标板的各孔加入该酶稀释液,每孔100μL。孵育1h。冲洗。
S9:化学发光:向酶标板的各孔加入化学发光液。
S10:测定含量:化学发光值检测仪测定酶标板各孔的化学发光值。
S11:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与化学发光值之间的关系曲线,计算样品中复合物物的含量。
方法4:捕获抗体直接包被在酶标板上结合酶标记检测抗体的化学发光免疫检测法(CLIA)
S1-S3:如方法1所示。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液300μL,孵育2h。冲洗。
S6:反应1:向酶标板各孔中加入稀释后的外周血全血或红细胞胞浆样品,或Hb-T-Tau复合物标准蛋白,孵育1h。冲洗。
S7:反应2:用封闭液稀释碱性磷酸酶标记抗T-Tau抗体(AP-ATau)至终浓度为0.1-2μg/mL。向酶标板的各孔加入该抗体稀释液,孵育1h。冲洗。
S8:化学发光:向酶标板的各孔加入化学发光液。
S9:测定含量:化学发光信号检测仪器测定酶标板各孔的化学发光值。
S10:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与化学发光值之间的关系曲线,计算样品中与Hb-T-Tau复合物的含量。
方法5:捕获抗体通过SA固定到酶标板上结合酶标检测抗体的化学发光免疫检测法
S1-S3:如方法1所示。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液300μL,孵育2h。冲洗。
S6:结合:向酶标板各孔中加入生物素化抗Hb抗体(B-AHb),孵育0.5h。冲洗。
S7:反应1:向酶标板各孔中加入稀释后的外周血全血或红细胞裂解,或Hb-T-Tau复合物标准蛋白,孵育1h。冲洗。
S8:反应2:用封闭液稀释碱性磷酸酶标记抗T-Tau抗体(AP-ATau)至终浓度为0.1-2μg/mL。向酶标板的各孔加入该抗体稀释液,孵育1h。冲洗。
S9:化学发光:向酶标板的各孔加入化学发光液。
S10:测定含量:化学发光信号检测仪器测定酶标板各孔的化学发光值。
S11:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与化学发光值之间的关系曲线,计算样品中与Hb-T-Tau复合物的含量。
方法6:捕获抗体通过Protein G固定到酶标板上结合PEG增强酶标亲和素的化学发光免疫检测(CLIA)
S1-S3:如方法1所示。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液,孵育2h。冲洗。
S6:结合:向酶标板各孔中加入抗Hb抗体(AHb),孵育0.5h。冲洗。
S7:反应1:向酶标板各孔中加入稀释后的外周血全血或红细胞裂解液,或Hb-T-Tau复合物标准蛋白,孵育1h。冲洗。
S8:反应2:用封闭液稀释生物素化抗T-Tau抗体(B-ATau)至终浓度为0.5~4μg/mL。向酶标板的各孔加入该抗体稀释液,孵育1h。冲洗。
S9:反应3:用含PEG-6000的稀释液稀释碱性磷酸酶标记链霉亲和素(AP-SA)(1:10000稀释),向酶标板的各孔加入该酶稀释液,每孔100μL。孵育0.5h。冲洗。
S10:化学发光:向酶标板的各孔加入化学发光液。
S11:测定含量:化学发光值检测仪测定酶标板各孔的化学发光值。
S12:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与化学发光值之间的关系曲线,计算样品中复合物物的含量。
方法7捕获抗体通过Protein G固定到酶标板上结合PEG增强酶标检测抗体的化学发光免疫检测法(CLIA)
S1-S3:如方法1所示。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液300μL,孵育2h。冲洗。
S6:结合:向酶标板各孔中加入抗Hb抗体,孵育0.5h。冲洗。
S7:反应1:向酶标板各孔中加入稀释后的外周血全血或红细胞裂解液,或Hb-T-Tau复合物标准蛋白,孵育1h。冲洗。
S8:反应2:用PEG-6000溶液稀释碱性磷酸酶标记抗T-Tau抗体(AP-ATau)至终浓度为0.1-2μg/mL。向酶标板的各孔加入该抗体稀释液,孵育0.5h。冲洗。
S9:化学发光:向酶标板的各孔加入化学发光液。
S10:测定含量:化学发光信号检测仪器测定酶标板各孔的化学发光值。
S11:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与化学发光值之间的关系曲线,计算样品中与Hb-T-Tau复合物的含量。
方法8:捕获抗体通过Protein G固定到酶标板上结合PEG增强液相酶标检测抗体-抗原复合物反应的化学发光免疫检测法(CLIA)
S1-S3:如方法1所示。
S4:包被:用NaHCO
S5:封闭:向酶标板各孔中加入封闭液300μL,孵育2h。冲洗。
S6:结合:向酶标板各孔中加入抗Hb抗体(AHb),孵育0.5h。冲洗。
S7:反应1:向EP管中加入PEG-6000稀释液稀释后的外周血全血或红细胞裂解液及碱性磷酸酶标记抗T-Tau抗体(AP-ATau),预先形成的复合物Hb-T-Tau-ATau,孵育0.5h。
S8:向酶标板各孔中加入预先形成的Hb-T-Tau-ATau复合物100μL,孵育0.5h,冲洗
S9:化学发光:向酶标板的各孔加入化学发光液。
S10:测定含量:化学发光信号检测仪器测定酶标板各孔的化学发光值。
S12:计算:根据体外制备的Hb-T-Tau复合物标准品的浓度与化学发光值之间的关系曲线,计算样品中与Hb-T-Tau复合物的含量。
实施例3Hb-T-Tau检测试剂盒灵敏度、重复性、精密度试验
以方法7中选出的最佳条件制备Hb-T-Tau试剂盒,分别取三批,每批中随机抽取20个试剂盒进行如下试验。
精密度试验:采用上述抽取出的试剂盒分别测定三例样本,各8次。计算测定浓度的变异系数。实验结果表明,上述三批试剂盒的检测结果的变异系数小于10.0%。
重复性试验:采用上述抽取出的试剂盒分别对相同样本重复试验3次,其结果显示相对标准差RSD为0.80%。
以上实验结果表明各试剂盒对样品的检测结果的离散程度较小,重复性较好,均可用于T-Tau的检测。
实施例4不同方法对试剂盒灵敏度的增益效果
1.PEG-6000对Hb-T-Tau检测试剂盒的增益作用
AHb直接包被酶标板,然后依次与待测抗原(即来自AD和HC红细胞样本中的Hb-T-Tau复合物)、生物素标记ATau(B-ATau)以及AP标记亲和素(AP-SA)反应。加入化学发光液检测化学发光信号值。在B-ATau或/和AP-SA稀释液中加入一定量的PEG-6000,观察其对化学发光信号值的影响。结果显示,以无PEG情况下的信号值为1计算,在B-ATau或AP-SA稀释液中加入PEG可以使信号值分别增加1.35和5.73倍,而在B-ATau和AP-SA稀释液均加入PEG的情况下,信号值增加7.90倍。该结果表明,PEG有一定促进抗原-抗体结合的效果,但对酶促化学发光反应的增强效果更显著(图2)。
2.Protein G和PEG-6000对Hb-T-Tau检测试剂盒的联合增益作用
用Protein G包被酶标板,与AHb结合,然后依次与待测抗原(即来自AD和HC红细胞样本中的Hb-T-Tau复合物)以及AP标记ATau(AP-ATau)反应。加入化学发光液检测化学发光信号强度。在Protein G包被酶标板或AP-ATau稀释液中加入一定量的PEG-6000,或在Protein G包被酶标板和AP-ATau稀释液中加入一定量的PEG-6000两种条件同时存在情况下,观察其对化学发光信号强度的影响。结果显示,在有Protein G包被酶标板的情况下,化学发光信号值与无Protein G包被的情况相比较,整体提高了2倍以上。此外,在有ProteinG包被酶标板的情况下,AP-ATau稀释液加入PEG仍然可以大幅度提高化学发光信号的值。以无PEG情况下的信号值为1计算,在Protein G包被酶标板或AP-ATau稀释液中加入PEG条件下可以使信号值分别增加2.51和5.36倍,而在Protein G包被酶标板和AP-ATau稀释液中加入PEG的两种情况同时存在下,信号值增加13.35倍。该结果表明,Protein G包被酶标板和PEG对抗原-抗体结合和酶促化学发光反应效率均有增强效果,但PEG对酶促化学发光反应效率的增强作用更强,而且在Protein G包被酶标板和AP-ATau稀释液中加入PEG两种情况同时存在的条件下的增益效果不是单纯的相加作用,而是协同的作用(图3)。
3.不同检测方法测试Hb-T-Tau标准品浓度与化学发光信号关系曲线
利用不同方法检测Hb-T-Tau标准品,绘制Hb-T-Tau浓度与化学发光信号关系曲线,获得不同方法的最低检测限、曲线斜率等指标。方法1和方法2均采用ELISA方法,灵敏度没有明显变化(图4A)。方法3和方法6均采用CLIA法,其中,捕获抗体与抗原结合后,分别与B-ATau和AP-SA反应。由于方法6增加了Protein G包被和在AP-SA稀释液中加入PEG-6000,使检测的灵敏度得到大幅度提升(图4B)。在抗原直接结合AP-ATau进行的CLIA方法中,捕获抗体通过SA包被酶标板(方法5)比直接包被酶标板(方法4)的灵敏度高,捕获抗体通过Protein G包被酶标板结合在AP-ATau稀释液中加入PEG-6000显著增强检测方法的灵敏度(方法7)。Protein G包被酶标板,结合液相中形成Hb-T-Tau-ATau复合物,以及在液相复合物反应液中加入PEG-6000,使检测的灵敏度得到进一步提高(方法8)(图4C)。各种方法测试Hb-T-Tau标准品获得的Hb-T-Tau浓度与化学发光信号关系曲线的斜率、R
实施例5不同Hb-T-Tau检测试剂盒区分AD和HC的效果比较
利用本发明实施例2中选出不同方法制备Hb-T-Tau检测试剂盒,检测43例健康对照(HC)受试者,49例AD病人外周血全血和红细胞中的Hb-T-Tau的化学发光值,然后根据标准曲线计算每个受试者的Hb-T-Tau浓度,即Hb-T-Tau ng/mL(图5A和A’)或Hb-T-Tau ng/mgHb(图5B和B’)。根据测试结果绘制成散点图和受试者操作特征曲线(Receiver operatingcharacteristic curve,ROC)(图5C和C’)。结果如表1所示。本专利所用改进方法(方法5~8)在检测红细胞中的Hb-T-Tau复合物时,其区分AD和HC的敏感性、特异性和AUC均有不同程度提升,其中,方法7和8的提升效果最为明显。这些方法在检测外周血全血样本中的Hb-T-Tau复合物时,其区分AD和HC的敏感性、特异性和AUC作用有明显提升。图5显示了部分试剂盒方法检测AD和HC红细胞和全血样本中的Hb-T-Tau复合物测试值的散点图和ROC曲线
表1:实例验证不同检测方法各项技术指标对比
说明:LOD:最低检出限;AUC:受试者操作特征曲线下面积,代表诊断的准确性,数值越高,准确性越高。
/>
- 平板扫描仪、扫描数据的制作方法
- 一种平板扫描仪智能辅助扫描装置
