一种检测维生素B2和B6的高效液相色谱荧光光谱法
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及分析检测技术领域,尤其涉及一种检测维生素B2和B6的高效液相色谱荧光光谱法。
背景技术
水溶性B族维生素是对在功能、结构、理化特性上相似的一类维生素的总称,其结构中全部含有氮,均易溶于水。主要以辅酶的形式参与体内多种物质的合成和分解代谢过程,与血细胞的形成以及能量的释放有着密切的关系。
维生素B2又称核黄素,在体内容易消化吸收。维生素B2作为机体最重要辅酶的组成成分,广泛存在于所有组织细胞中。
维生素B6是庞大的水溶性B族维生素家族中的重要一员,它是人体内约140种酶的辅酶,参与80多种生化反应,在人体蛋白质代谢,糖类及脂类代谢中具有不可替代的作用。
水溶性维生素的测试方法主要包括微生物法,分光光度法,高效液相色谱法,高效液相色谱质谱联用法。例如CN 113917018A公开了一种同时检测水溶性维生素及代谢产物的沉淀剂和方法,检测方法采用液相质谱-串联质谱进行检测。但是,质谱仪设备昂贵、使用和维护成本较高,制约了采用质谱仪的相关检测方法在一些基层医院和科研单位的使用。又如郭巧珍等人在《高效液相色谱法同时测定维生素B中两种生物活性成分》中通过高效液相色谱荧光光谱法检测了两种不同形式的维生素B6,该方法无法同时检测到维生素B2。
发明内容
为解决上述现有技术存在的缺陷,特提出如下发明内容。
首先,本发明提供了一种同时检测维生素B2和维生素B6的检测方法,包括:
将样本与硫酸锌溶液以及甲醇混合,震荡离心后取上清液,采用高效液相色谱荧光光谱法进行检测;
所述高效液相色谱荧光光谱法采用C18色谱柱;
流动相A含有磷酸二氢钾溶液和磷酸;所述磷酸二氢钾溶液的浓度为20~50mM;流动相B为甲醇;
梯度程序如下:
各时间段流动相A和流动相B的体积百分比之和为100%。
为满足采用高效液相色谱荧光光谱法同时实现对维生素B2和维生素B6的准确检测要求,本发明首先对样本前处理方法进行大量尝试。由于采用不同的蛋白沉淀剂对不同的目标物的提取效率存在较大的差异,本发明在大量的尝试后发现选择硫酸锌作为蛋白沉淀剂,能够兼顾维生素B2和维生素B6的提取效率,使得蛋白沉淀后两者的提取率均较高,而且使得本发明的检测方法的基质效应满足要求。
进一步,本发明发现,通过将蛋白沉淀后的上清液与甲醇混合,甲醇能够进一步发挥蛋白沉淀效果,促进维生素B2和维生素B6提取效率进一步提升,有利于本发明检测方法的准确度大幅提升。而且,采用甲醇能够使得上机前的待检样本的体系与后续梯度洗脱程序中流动相的体系兼容性好,通过上述特定的色谱流动相以及梯度洗脱程序,使得维生素B2和维生素B6有效分离,且获得极好的峰型,从而实现利用荧光检测器对维生素B2和维生素B6的准确检测。
此外,本发明还发现,控制磷酸二氢钾溶液的浓度为20~50mM时能够获得优异的分离效果,当浓度过低时维生素B6的峰型拖尾,浓度过高时容易在洗脱过程中析出,损坏色谱柱。
优选地,流动相A的pH为2~3.5。
更优选地,流动相A的pH为2~3。
可通过调整流动相A中磷酸的添加量或浓度实现对流动相A的pH的调整。
在上述pH范围内,高效液相色谱对维生素B2和维生素B6的分离效果更好。
优选地,流动相A包括:每1000mL水中含有2.7g~6.9g的磷酸二氢钾以及0.3mL~0.8mL的45%~55%(体积百分比)磷酸溶液。
更优选地,流动相A包括:每1000mL水中含有2.7g~3g的磷酸二氢钾以及0.4mL~0.6mL的48%~52%(体积百分比)磷酸溶液。
最优选地,流动相A包括:每1000mL水中含有2.72g的磷酸二氢钾以及0.5mL的50%(体积百分比)磷酸溶液。
优选地,所述C18色谱柱的规格为(4~6)μm (4~5)×(140~160)mm;更优选为5μm4.6×150mm。
优选地,硫酸锌溶液的浓度为0.1~0.3mol/L,样本与硫酸锌溶液按照体积比为1:(0.4~0.8)混合。
优选地,样本与甲醇的体积比为1:(0.8~1.2)。
优选地,在3000rpm以上震荡,然后在12000rpm以上离心后取上清液,采用高效液相色谱荧光光谱法进行检测。
更优选地,在3000rpm以上震荡1min以上,然后在12000rpm以上离心10min以上后取上清液,采用高效液相色谱荧光光谱法进行检测。
优选地,离心在2℃~6℃下进行。
优选地,所述样本包括血清、校准品、质控品中的至少一种。
优选地,所述校准品或质控品采用盐酸溶液配制;
和/或,所述校准品或质控品采用PBS配制的BSA溶液稀释。
优选地,盐酸溶液的浓度为0.1~0.2mol/L。
优选地,PBS配制的BSA溶液的浓度为4%~6%。
优选地,流动相的流速为0.8~1.2 mL/min。
优选地,色谱柱柱温为30~50℃。
优选地,进样量为10~50μL。
优选地,高效液相色谱荧光光谱法中荧光检测器的波长程序如下:
。
优选地,通过内标法或外标法建立标准曲线实现对维生素B2和维生素B6的定量检测。
与现有技术相比,本发明的有益效果在于:
本发明提供了一种同时检测维生素B2和B6的高效液相色谱荧光光谱法,该方法前处理操作简单,快速,节约前处理时间。本发明的检测方法能满足相关法规对维生素B2和B6的线性、重复性、基质效应、准确度等的要求,对监测人体维生素B2和B6有重要作用。
附图说明
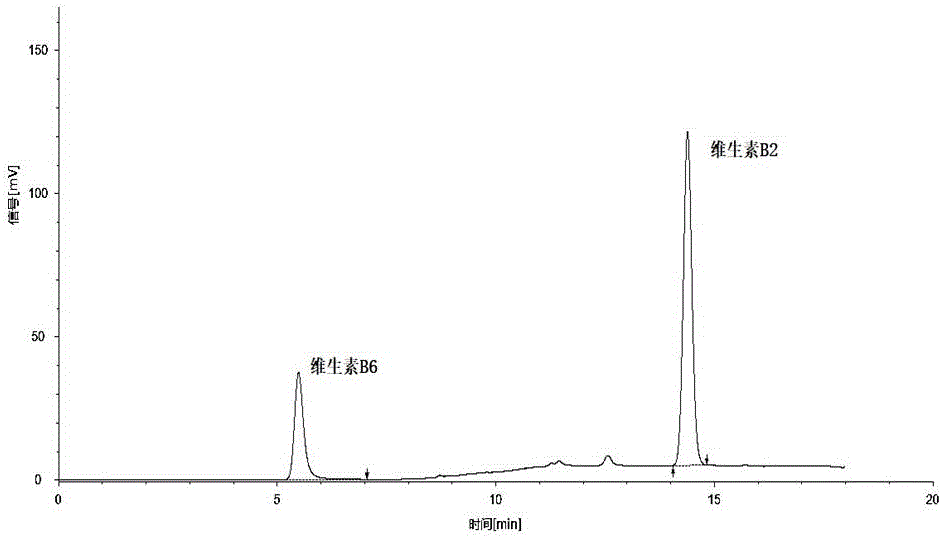
图1是本发明实施例的检测方法同时检测校准品中维生素B2和B6的高效液相色谱图。
图2是本发明对比例3的检测方法检测校准品中维生素B6的高效液相色谱图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例中未注明具体技术或条件者,均为常规方法或者按照本领域的文献所描述的技术或条件进行,或者按照产品说明书进行。所用试剂和仪器等未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
由于人源样本难以获得,下述实施例采用BSA作为人血清的替代基质配制标准曲线的各个浓度点及质控。
实施例
本实施例提供了一种同时检测维生素B2和维生素B6的检测方法,步骤如下:
1、试剂配制
用到的试剂如表1所示。
表1
用到的仪器设备如表2所示。
表2
1.1、维生素B2、维生素B6校准品及质控品配制
1.1.1、储备液配制
维生素B2储备液配制:使用十万分之一电子天平,准确称取维生素B2 10 mg,置于100 mL容量瓶,用0.1 mol/L盐酸溶解后并定容至刻度线,配制成1000 μg/mL浓度的储备液,转移至15 mLPP塑料瓶中,贴标签,-20℃保存;
维生素B6储备液配制:使用十万分之一电子天平,准确称取维生素B6 10 mg,置于10 mL容量瓶,用0.1 mol/L盐酸溶解后并定容至刻度线,配制成1000 μg/mL浓度的储备液,转移至15 mLPP塑料瓶中,贴标签,-20℃保存。
1.1.2、校准品S1至S6配制
维生素B2、维生素B6次级储备液配制:用10 μL移液枪准确移取维生素B2,维生素B6储备液各20 μL置于10 mL容量瓶中,用0.1 mol/L盐酸溶液定容至刻度线,配制成2000ng/ml次级储备液,贴标签,-20℃保存。
校准品S6配制:使用合适规格移液枪准确移取维生素B2、维生素B6次级储备液50μL置于10 mL容量瓶中,用0.1 mol/L盐酸溶液定容至刻度线,配制成50 ng/ml维生素B2校准品,100 ng/ml维生素B6校准品,贴标签,-20℃保存。
校准品S5配制:使用合适规格移液枪准确移取1.8 mL校准品S6,加入1.2 mL0.1mol/L盐酸溶液,混匀后配制成30 ng/ml维生素B2校准品,60 ng/ml维生素B6校准品,贴标签,-20℃保存。
校准品S4配制:使用合适规格移液枪准确移取0.6 mL校准品S6,加入2.4 mL 0.1mol/L盐酸溶液,混匀后配制成10 ng/ml维生素B2校准品,20 ng/ml维生素B6校准品,贴标签,-20℃保存。
校准品S3配制:使用合适规格移液枪准确移取0.21 mL校准品S6,加入2.79 mL0.1 mol/L盐酸溶液,混匀后配制成3.5 ng/ml维生素B2校准品,7 ng/ml维生素B6校准品,贴标签,-20℃保存。
校准品S2配制:使用合适规格移液枪准确移取0.06 mL校准品S6,加入2.94 mL0.1 mol/L盐酸溶液,混匀后配制成1 ng/ml维生素B2校准品,2 ng/ml维生素B6校准品,贴标签,-20℃保存。
校准品S1配制:使用合适规格移液枪准确移取0.03 mL校准品S6,加入2.97 mL0.1 mol/L盐酸溶液,混匀后配制成0.5 ng/ml维生素B2校准品,1 ng/ml维生素B6校准品,贴标签,-20℃保存。
1.1.3、质控品配制
维生素B2、维生素B6次级储备液配制:用10 μL移液枪准确移取维生素B2,维生素B6储备液各20 μL置于10 mL容量瓶中,用0.1 mol/L盐酸溶液定容至刻度线,配制成2000ng/ml次级储备液,贴标签,-20℃保存。
校准品S6配制:使用合适规格移液枪准确移取维生素B2、维生素B6次级储备液50μL置于10 mL容量瓶中,用0.1 mol/L盐酸溶液定容至刻度线,配制成50 ng/ml维生素B2校准品,100 ng/ml维生素B6校准品,贴标签,-20℃保存。
低浓度质控品QCL配制:使用合适规格移液枪准确移取0.09 mL校准品S6,加入2.91 mL 0.1 mol/L盐酸溶液,混匀后配制成1.5 ng/ml维生素B2校准品,3 ng/ml维生素B6校准品。
中浓度质控品QCM配制:使用合适规格移液枪准确移取1.50 mL校准品S6,加入1.50 mL 0.1 mol/L盐酸溶液,混匀后配制成25 ng/ml维生素B2校准品,50 ng/ml维生素B6校准品。
高浓度质控品QCH配制:使用合适规格移液枪准确移取2.10 mL校准品S6,加入0.90 mL 0.1 mol/L盐酸溶液,混匀后配制成35 ng/ml维生素B2校准品,70 ng/ml维生素B6校准品。
1.2、沉淀剂配制
室温条件下,用万分之一天平精密称取3.22g硫酸锌,精确至0.0001g,置于100mL容量瓶中,加入屈臣氏水,溶解后继续加水至刻度线,配制成0.2 mol/L硫酸锌溶液。
1.3、流动相配制
流动相A配制:用量筒准确移取1000mL水,加入2.72g磷酸二氢钾,0.5毫升50%(体积百分比)磷酸溶液,混匀超声脱气,待用。
流动相B配制:用量筒准确移取1000mL色谱级甲醇,超声脱气,待用。
1.4、稀释液配制
1.4.1、PBS稀释液配制:量取10mL 10
1.4.2、5%BSA配制:称取5g BSA,精确至0.0001g放入玻璃容器瓶中,加入100mLPBS稀释液,盖上瓶盖,上下震荡至BSA完全溶解。
2、前处理以及检测
1)加校准品、质控品溶液:精密移取20μL校准品、质控品溶液,分别加入到2mL离心管中;
2)加稀释液:精密移取180 μL稀释液,分别加入到以上对应的离心管中;
3)加血清样本:精密移取200μL的血清样本,分别加入到2mL离心管中;
4)加沉淀剂:精密移取100μL沉淀剂,分别加入到以上对应的2mL离心管中;
5)加甲醇:精密移取200 μL甲醇,分别加入到以上对应的2mL离心管中;
6)震荡:盖上离心管盖,置于2mL涡旋混匀仪上,3000rpm充分震荡1 min;
7)离心并转移:于4 ℃、15000 rpm离心10 min。离心后用移液枪移取200μL的上清液置于96孔U型板中;
8)检测:将96孔板置于液相色谱分析仪中,进行检测;检测条件如表3所示,梯度洗脱程序如表4所示,校准品的色谱图如图1所示。
表3
表4
3、线性范围试验数据
3.1、验证方法:按照上述样品处理方法处理校准品S1~S6溶液,每个浓度重复测试3次。可参考公式计算线性回归的相关系数r,相关系数r应≥0.990。
;
r:线性回归相关系数;
x
y
3.2、接受标准:维生素B2和维生素B6线性回归的相关系数r均≥0.990。
3.3、实验结果如表5所示;
线性范围:维生素B2线性范围为0.5~50 ng/mL,维生素B6线性范围为1~100 ng/mL。
表5
3.4、结论:维生素B2,维生素B6线性回归的相关系数r均≥0.990,满足接受标准。
4、重复性测试数据
4.1、验证方法:使用已配制好的质控品,按照上述方法检测,每个样本重复测定10次。可参考公式计算重复性的变异系数(CV),低值质控品CV≤20%,高值质控品CV≤15%。
;
CV:重复性的变异系数;
:10次测量结果的平均值;
S:10次测量结果的标准差。
4.2、接受标准:低值质控品的变异系数CV≤20%,高值质控品的变异系数CV≤15%。
4.3、实验结果如表6所示。
表6
4.4、结论:低值质控品的变异系数CV≤20%,高值质控品的变异系数CV≤15%,满足接受标准。
5、HPLC基质效应结果评价
5.1、实验流程
处理混合血样和BSA基质样本,前处理后,在BSA基质样本和3份混合血样中分别加入相同浓度的校准品,在1份混合血样中加入0.1mol/L盐酸溶液,并计算出维生素B2,维生素B6的峰面积,计算出基质效应。
5.2、实验结果
维生素B6基质效应结果如表7所示,维生素B2基质效应结果如表8所示。
表7
表8
5.3、实验小结
结果显示,测试相同血样维生素B2,维生素B6的基质效应均≤±15%,基质效应评价满足方法学要求。
6、加标回收率数据
6.1、验证方法
6.1.1、血清样本本底测试:取两种不同的混血(血1bk和血2bk),分别取200μL血清各4个,按照上述方法进行检测,使用已配制好的校准品测试血清中维生素B2及维生素B6本底含量。
6.1.2、加标样本配制:取180μL的混合血清样本,分别加入维生素B2浓度为15 ng/mL,250 ng/mL,350 ng/mL及维生素B6浓度为3 ng/mL,50 ng/mL,70 ng/mL的低、中、高三种浓度的校准品20 μL,待用。
6.1.3、按照上述检测方法使用已配制好的校准品测试血清加标后的样本。
6.2、接受标准:加标回收率80%~120%。
6.3、测试结果如表9所示,维生素B2的加标回收率为99.93%~113.67%,维生素B6的加标回收率为95.35%~113.92%,均在范围内,满足要求。
表9
6.4、结论:维生素B2、维生素B6加标回收率均在范围内,满足要求。
7、实际样本检测数据
按照上述检测方法,使用已配制好的校准品测试实际人血样本20例,数据如表10所示。
表10
综上所述,本发明采用高效液相色谱荧光光谱法同时测定血清中维生素B2、维生素B6含量,一次检测可同时得到维生素B2、维生素B6含量,具有灵敏度高,重复性好,准确性高等特点。该方法维生素B2线性范围为0.5~50 ng/mL,维生素B6线性范围为1~100 ng/mL,相关系数均r≥ 0.990,结果表明本发明的检测方法线性范围宽;低值质控品重复性的变异系数(CV)≤ 20%,高值质控品重复性的变异系数(CV)≤ 15%,结果表明本发明的检测方法重复性好;基质效应≤ ±15%,加标回收率为80%~120%,结果表明本发明的检测方法准确度好。
对比例1
本对比例提供了一种同时检测维生素B2和维生素B6的检测方法,步骤仅与实施例1不同的是:
前处理中,将沉淀剂替换为等量的饱和硫酸铵溶液。经液相色谱分析仪检测,维生素B6基质效应如表11所示,结果表明维生素B6的基质效应无法满足要求。
表11
对比例2
本对比例提供了一种同时检测维生素B2和维生素B6的检测方法,步骤仅与实施例1不同的是:
前处理中省略加甲醇的步骤。
经液相色谱分析仪检测,维生素B2和维生素B6的加标回收率无法满足要求,测试结果如表12所示。
表12
/>
对比例3
本对比例提供了一种同时检测维生素B2和维生素B6的检测方法,步骤仅与实施例1不同的是:
流动相A中磷酸二氢钾替换成10mM。
经液相色谱分析仪检测,如图2所示,维生素B6峰型有拖尾。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 一种火箭测发控系统及测试仿真方法
- 一种运载火箭地面测发控软件的等效测试方法及其系统
