检测细胞上清液中大分子化合物的方法
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于细胞培养检测领域,具体地,本发明涉及检测细胞上清液中大分子化合物的方法,更具体地,本发明涉及检测细胞培养上清液中胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF)的方法。
背景技术
细胞在培养过程中,合理优化培养基的营养物成分非常重要,以促进细胞生长、延长培养时间并提高产物合成。胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF)是细胞培养中必需的物质,对细胞的生长、增殖和功能调节起着重要作用。
胰岛素是一种多肽类激素,具有调节血糖水平、细胞增殖以及糖、脂和蛋白质代谢等多种功能。在细胞培养中,胰岛素是必需的营养物质,对于细胞的正常生长和代谢至关重要。表皮生长因子和胰岛素样生长因子是特定受体上的生物活性因子,通过与受体结合调节细胞的生长、增殖、分化和功能。它们在培养液中起着重要的作用,促进体外细胞的增殖和功能表达。
由于不同类型的细胞和不同培养阶段的细胞对这些物质的需求量和最适添加量可能有所差异,因此在细胞培养过程中,对胰岛素、EGF和IGF的监控非常必要。通过监测它们的浓度变化,可以更好地了解它们对细胞生长、代谢和抗体合成的影响。
因此,亟需开发一种方法来检测细胞上清液中胰岛素、EGF和IGF的浓度。
发明内容
本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。
发明人发现,目前检测胰岛素(Insulin)、EGF和IGF的检测方法主要有酶联免疫法和HPLC方法。其中,酶联免疫法自动化和商品化程度高,对于不同基质样品,存在交叉反应,影响结果可靠性,而且价格昂贵,操作复杂耗时,不能实现一个试剂盒同时测定3种物质;HPLC方法选择性好,但是灵敏度差。为了克服这一问题,发明人利用液相色谱串联质谱法检测细胞培养上清液中大分子化合物,准确地测定细胞培养上清液中3种大分子化合物胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF)的含量。该方法可实现同时检测细胞培养上清液中的胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF),并且该方法中的单个样本分析运行程序只需10min即可实现对单样本多指标的同步检测,具有灵敏度高、精密度好、准确性高、时间短和操作简单的优点。
基于此,本发明的第一个方面,本发明提出了一种检测细胞培养上清液中大分子化合物的方法。根据本发明的实施例,所述方法包括:利用液相色谱串联质谱法对待检细胞培养上清液进行检测处理,以便获得液相色谱图和质谱图;以及基于所述液相色谱图和质谱图,确定所述待检细胞培养上清液中的大分子化合物的含量,其中,所述大分子化合物包括胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF)。根据本发明实施例的方法可实现同时检测细胞培养上清液中的胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF),并且该方法中的单个样本分析运行程序只需10min即可实现对单样本多指标的同步检测,具有灵敏度高、精密度好、准确性高、时间短和操作简单的优点。
本发明的第二个方面,本发明提出了一种检测细胞培养上清液中大分子化合物的方法。根据本发明的实施例,所述大分子化合物包括胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF);
所述方法包括:
将所述大分子化合物分别通过加入5mmol/L的0.1%BSA盐酸溶液的稀释液进行配制处理,以便分别获得所述大分子化合物的标准品储备液,其中,胰岛素(Insulin)标准品储备液浓度为0.877mg/L,表皮生长因子(EGF)标准品储备液浓度为3mg/L,胰岛素样生长因子(IGF)标准品储备液浓度为7.5mg/L;
将所述大分子化合物标准品储备液分别通过加入5mmol/L的0.1%BSA盐酸溶液的稀释液进行第一稀释处理,以便分别获得检出限样本和校准品样本;其中,胰岛素检出限样本的浓度依次为0.877ppb和87.7ppb;表皮生长因子检出限样本的浓度依次为30ppb、150ppb和300ppb;胰岛素样生长因子检出限样本的浓度依次为75ppb、750ppb和1500ppb;胰岛素校准品样本的浓度依次为0.05ppb、0.5ppb、1ppb、2.5ppb、5ppb和10ppb;表皮生长因子校准品样本的浓度依次为0.001ppm、0.005ppm、0.1ppm、0.25ppm、0.5ppm和1ppm;胰岛素样生长因子校准品样本的浓度依次为0.5ppm、0.75ppm、1ppm、1.5ppm和2ppm;
利用液相色谱串联质谱法对所述待检细胞培养上清液、检出限样本和校准品样本分别进行检测处理,以便获得所述待检细胞培养上清液、检出限样本和校准品样本的液相色谱图和质谱图;以及基于所述液相色谱图和质谱图,确定所述细胞培养上清液中的所述大分子化合物的含量;
其中,所述液相色谱串联质谱法中的液相色谱条件包括:
所述液相色谱的流动相A为体积分数为0.1%的甲酸水;
所述液相色谱的流动相B为体积分数为0.1%的甲酸乙腈;
所述液相色谱的柱温为40℃;
所述液相色谱的洗针液由体积分数为33.3%水,体积分数为33.3%乙腈,体积分数为33.3%甲醇和体积分数为0.2%乙酸组成;
所述液相色谱的流速为0.7mL/min;
所述液相色谱的洗脱梯度如下:
时间在0.00min时,流动相B在流动相中的体积分数为10%;
时间在0.2min时,流动相B在流动相中的体积分数为10%;
时间在3.7min时,流动相B在流动相中的体积分数为45%;
时间在4min时,流动相B在流动相中的体积分数为95%;
时间在4.4min时,流动相B在流动相中的体积分数为95%;
时间在4.5min时,流动相B在流动相中的体积分数为10%;
时间在4.8min时,流动相B在流动相中的体积分数为10%;所述液相色谱的色谱柱为Phenomenex® Kinetex®,2.6 µm,C18 column,3.0x50 mm;
所述液相色谱串联质谱法中的质谱条件包括:
所述质谱采用的参数包括:ESI-离子源,扫描模式正模式,离子源温度650℃,离子源喷雾电压5500V,气帘气40psi,GAS165psi,GAS265psi;
在检测处理前进一步包括对质谱仪进行平衡处理,所述平衡处理可通过进样30针稀释液实现;
所述待检细胞培养上清液是通过将细胞培养上清液进行第二稀释处理后获得的,所述第二稀释处理的倍数为2。
根据本发明实施例的方法可实现同时检测细胞培养上清液中的胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF),并且该方法中的单个样本分析运行程序只需10min即可实现对单样本多指标的同步检测,具有灵敏度高、精密度好、准确性高、时间短和操作简单的优点。
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
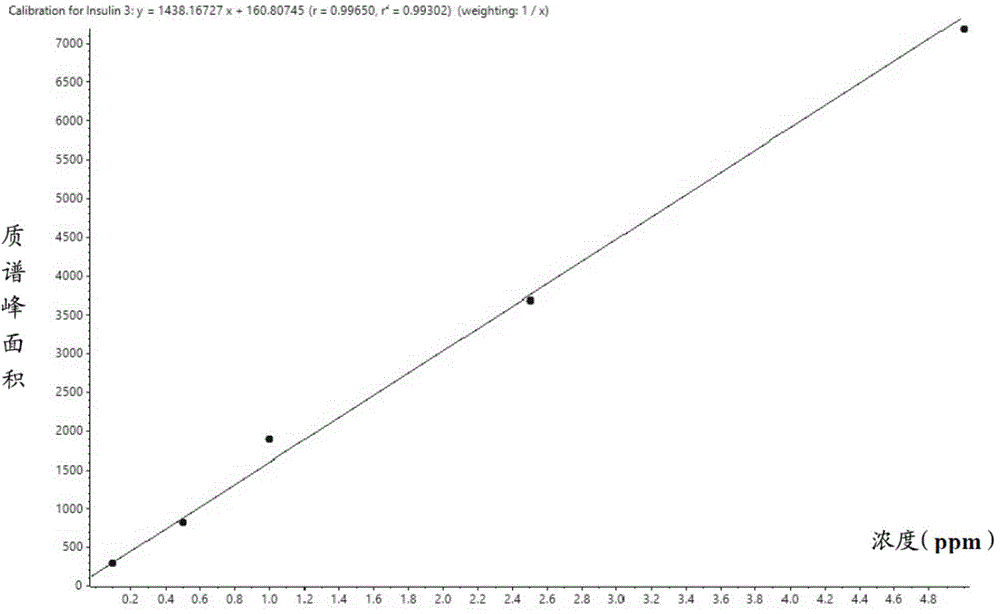
图1是实施例1中胰岛素(Insulin)的标准曲线图。
图2是实施例1中表皮生长因子(EGF)的标准曲线图。
图3是实施例1中胰岛素样生长因子(IGF)的标准曲线图。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
在本发明中,术语“包含”或“包括”为开放式表达,即包括本发明所指明的内容,但并不排除其他方面的内容。
在本发明中,术语“任选地”、“任选的”或“任选”通常是指随后所述的事件或状况可以但未必发生,并且该描述包括其中发生该事件或状况的情况,以及其中未发生该事件或状况的情况。
在本发明中,术语“细胞培养上清液”指的是细胞在液体培养基中培养一段时间后的培养基部分,培养基部分包括细胞分泌的代谢产物或细胞因子等。当细胞生长到一定程度时,它们会分泌出各种生物活性物质,如蛋白质、激素、细胞因子等,这些物质会溶解在培养基中,形成上清液。细胞培养上清液是一种含有细胞分泌物的复杂液体,其中可能包含了细胞分泌的蛋白质、多肽、激素、细胞因子、生长因子等。上清液中的这些分子可能对细胞的生长、增殖、分化和功能调节起着重要作用。细胞培养上清液通常通过将培养器中的培养基和细胞离心分离得到。离心操作可以将细胞沉淀在底部,而上清液则可以收集并进一步处理或分析。
在本发明中,术语“甲酸水”指的是甲酸作为溶质溶解在水中的溶液,其中水是充当溶剂的介质。
在本发明中,术语“甲酸乙腈”指的是甲酸作为溶质溶解在乙腈中的溶液,其中乙腈是充当溶剂的介质。
本发明提出了一种检测细胞培养上清液中大分子化合物的方法,下面将分别对其进行详细描述。
检测细胞培养上清液中大分子化合物的方法
本发明的第一个方面,本发明提出了一种检测细胞培养上清液中大分子化合物的方法。根据本发明的实施例,所述方法包括:利用液相色谱串联质谱法对待检细胞培养上清液进行检测处理,以便获得液相色谱图和质谱图;以及基于所述液相色谱图和质谱图,确定所述待检细胞培养上清液中的大分子化合物的含量,其中,所述大分子化合物包括胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF)。根据本发明实施例的方法可实现同时检测细胞培养上清液中的胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF),并且该方法中的单个样本分析运行程序只需10min即可实现对单样本多指标的同步检测,具有灵敏度高、精密度好、准确性高、时间短和操作简单的优点。
根据本发明的实施例,所述检测处理是通过如下方式进行的:
利用所述液相色谱串联质谱法对所述待检细胞培养上清液、检出限样本和校准品样本分别进行检测,其中,所述检出限样本和所述校准品样本为含有所述大分子化合物标准品的溶液。需要解释说明的是,本发明中的检出限样本用来检测所能检测的待检样本最小浓度,校准品样本用来建立胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF)的浓度-目标化合物色谱峰面积的校准曲线,由待检细胞培养上清液的色谱图结果,可知待细胞培养上清液中目标大分子化合物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))的目标化合物色谱峰面积。
根据本发明的实施例,检出限样本和校准品样本是通过如下方式制备获得的:
将所述大分子化合物的标准品分别进行配制处理,以便分别获得所述大分子化合物的标准品储备液;将所述大分子化合物标准品储备液分别进行第一稀释处理,以便分别获得检出限样本和校准品样本。
根据本发明的实施例,胰岛素(Insulin)标准品储备液浓度为0.5mg/L~1mg/L,表皮生长因子(EGF)标准品储备液浓度为1mg/L~5mg/L,胰岛素样生长因子(IGF)标准品储备液浓度为5mg/L~10mg/L。
根据本发明的实施例,所述胰岛素(Insulin)标准品储备液浓度为0.877mg/L,所述表皮生长因子(EGF)标准品储备液浓度为3mg/L,所述胰岛素样生长因子(IGF)标准品储备液浓度为7.5mg/L。
根据本发明的实施例,所述配制处理和所述第一稀释处理是通过加入稀释液进行的。
根据本发明的实施例,所述稀释液为5mmol/L的0.1%BSA盐酸溶液。
根据本发明的实施例,胰岛素检出限样本的浓度依次为0.877ppb和87.7ppb;表皮生长因子检出限样本的浓度依次为30ppb、150ppb和300ppb;胰岛素样生长因子检出限样本的浓度依次为75ppb、750ppb和1500ppb。
根据本发明的实施例,胰岛素校准品样本的浓度依次为0.05ppb、0.5ppb、1ppb、2.5ppb、5ppb和10ppb;表皮生长因子校准品样本的浓度依次为0.001ppm、0.005ppm、0.1ppm、0.25ppm、0.5ppm和1ppm;胰岛素样生长因子校准品样本的浓度依次为0.5ppm、0.75ppm、1ppm、1.5ppm和2ppm。
根据本发明的实施例,所述液相色谱串联质谱法包括液相色谱和质谱联用。
根据本发明的实施例,所述液相色谱的流动相A为体积分数为0.01%~0.3%的甲酸水。根据本发明实施例的方法,可将待检细胞培养上清液中的三种大分子化合物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))有效分离,进而分别准确测定三种大分子化合物的浓度。
根据本发明的实施例,所述液相色谱的流动相A为体积分数为0.1%的甲酸水。根据本发明实施例的方法,可将待检细胞培养上清液中的三种大分子化合物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))进一步有效分离,进而分别进一步准确测定三种大分子化合物的浓度。
根据本发明的实施例,所述液相色谱的流动相B为体积分数为0.01%~0.3%的甲酸乙腈。根据本发明实施例的方法,可将待检细胞培养上清液中的三种大分子化合物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))有效分离,进而分别准确测定三种大分子化合物的浓度。
根据本发明的实施例,所述液相色谱的流动相B为体积分数为0.1%的甲酸乙腈。根据本发明实施例的方法,可将待检细胞培养上清液中的三种大分子化合物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))进一步有效分离,进而分别进一步准确测定三种大分子化合物的浓度。
根据本发明的实施例,所述液相色谱的柱温为35~45℃。
根据本发明的实施例,所述液相色谱的柱温为40℃。
根据本发明的实施例,所述液相色谱的洗针液由体积分数为25%~35%水,体积分数为25%~35%乙腈,体积分数为25%~35%甲醇和体积分数为0.1%~1%乙酸组成。
根据本发明的实施例,所述液相色谱的洗针液由体积分数为33.3%水,体积分数为33.3%乙腈,体积分数为33.3%甲醇和体积分数为0.1%乙酸组成。
根据本发明的实施例,所述液相色谱的流速为0.5mL/min~1mL/min。
根据本发明的实施例,所述液相色谱的流速为0.7mL/min。
根据本发明的实施例,所述液相色谱采用的是Shimadzu 30 LC液相系统。
根据本发明的实施例,所述液相色谱的洗脱梯度如下:
时间在0.00min时,流动相B在流动相中的体积分数为10%,
时间在0.2min时,流动相B在流动相中的体积分数为10%,
时间在3.7min时,流动相B在流动相中的体积分数为45%,
时间在4min时,流动相B在流动相中的体积分数为95%,
时间在4.4min时,流动相B在流动相中的体积分数为95%,
时间在4.5min时,流动相B在流动相中的体积分数为10%,
时间在4.8min时,流动相B在流动相中的体积分数为10%。
需要解释说明的是,本发明中的“流动相”包括流动相B和流动相A。
根据本发明实施例的方法,可将待检细胞培养上清液中的三种大分子化合物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))梯度洗脱,从而有效分离这三种大分子化合物,进而分别准确测定三种大分子化合物的浓度。
根据本发明的实施例,所述液相色谱的色谱柱为Phenomenex® Kinetex®,2.6 µm,C18 column,3.0x50 mm。
根据本发明的实施例,所述质谱采用的参数包括:ESI-离子源,扫描模式正模式,离子源温度650℃,离子源喷雾电压5500V,气帘气40psi,GAS165psi,GAS265psi。根据本发明实施例的方法,可将待检细胞培养上清液中的三种大分子化合物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))梯度洗脱,从而有效分离这三种大分子化合物,进而分别准确测定三种大分子化合物的浓度。
根据本发明的实施例,所述质谱采用的质谱仪为Sciex Triple Quad 4500 质谱仪。
根据本发明的实施例,所述待检细胞培养上清液是通过对细胞培养上清液进行第二稀释处理后获得的。
根据本发明的实施例,所述第二稀释处理的倍数为2。
根据本发明的实施例,进行所述检测处理之前,预先将质谱仪进行平衡处理,所述平衡处理是通过进样10~50针稀释液实现。
根据本发明的实施例,所述平衡处理可通过进样30针稀释液实现。
检测细胞培养上清液中大分子化合物的方法
本发明的第二个方面,本发明提出了一种检测细胞培养上清液中大分子化合物的方法。根据本发明的实施例,所述大分子化合物包括胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF);
所述方法包括:
将所述大分子化合物分别通过加入5mmol/L的0.1%BSA盐酸溶液的稀释液进行配制处理,以便分别获得所述大分子化合物的标准品储备液,其中,胰岛素(Insulin)标准品储备液浓度为0.877mg/L,表皮生长因子(EGF)标准品储备液浓度为3mg/L,胰岛素样生长因子(IGF)标准品储备液浓度为7.5mg/L;
将所述大分子化合物标准品储备液分别通过加入5mmol/L的0.1%BSA盐酸溶液的稀释液进行第一稀释处理,以便分别获得检出限样本和校准品样本;其中,胰岛素检出限样本的浓度依次为0.877ppb和87.7ppb;表皮生长因子检出限样本的浓度依次为30ppb、150ppb和300ppb;胰岛素样生长因子检出限样本的浓度依次为75ppb、750ppb和1500ppb;胰岛素校准品样本的浓度依次为0.05ppb、0.5ppb、1ppb、2.5ppb、5ppb和10ppb;表皮生长因子校准品样本的浓度依次为0.001ppm、0.005ppm、0.1ppm、0.25ppm、0.5ppm和1ppm;胰岛素样生长因子校准品样本的浓度依次为0.5ppm、0.75ppm、1ppm、1.5ppm和2ppm;
利用液相色谱串联质谱法对所述待检细胞培养上清液、检出限样本和校准品样本分别进行检测处理,以便获得所述待检细胞培养上清液、检出限样本和校准品样本的液相色谱图和质谱图;以及基于所述液相色谱图和质谱图,确定所述细胞培养上清液中的所述大分子化合物的含量;
其中,所述液相色谱串联质谱法中的液相色谱条件包括:
所述液相色谱的流动相A为体积分数为0.1%的甲酸水;
所述液相色谱的流动相B为体积分数为0.1%的甲酸乙腈;
所述液相色谱的柱温为40℃;
所述液相色谱的洗针液由体积分数为33.3%水,体积分数为33.3%乙腈,体积分数为33.3%甲醇和体积分数为0.2%乙酸组成;
所述液相色谱的流速为0.7mL/min;
所述液相色谱的洗脱梯度如下:
时间在0.00min时,流动相B在流动相中的体积分数为10%,
时间在0.2min时,流动相B在流动相中的体积分数为10%,
时间在3.7min时,流动相B在流动相中的体积分数为45%,
时间在4min时,流动相B在流动相中的体积分数为95%,
时间在4.4min时,流动相B在流动相中的体积分数为95%,
时间在4.5min时,流动相B在流动相中的体积分数为10%,
时间在4.8min时,流动相B在流动相中的体积分数为10%;
所述液相色谱的色谱柱为Phenomenex® Kinetex®,2.6 µm,C18 column,3.0x50mm;
所述液相色谱串联质谱法中的质谱条件包括:
所述质谱采用的参数包括:ESI-离子源,扫描模式正模式,离子源温度650℃,离子源喷雾电压5500V,气帘气40psi,GAS165psi,GAS265psi;
在检测处理前进一步包括对质谱仪进行平衡处理,所述平衡处理可通过进样30针稀释液实现;
所述待检细胞培养上清液是通过将细胞培养上清液进行第二稀释处理后获得的,所述第二稀释处理的倍数为2。
根据本发明实施例的方法可实现同时检测细胞培养上清液中的胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF),并且该方法中的单个样本分析运行程序只需10min即可实现对单样本多指标的同步检测,具有灵敏度高、精密度好、准确性高、时间短和操作简单的优点。
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1:检测细胞培养上清液中胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF)
1.细胞培养上清液前处理
利用5mmol/L的0.1%BSA盐酸溶液对细胞培养上清液进行2倍稀释。
2.平衡质谱仪
将5mmol/L的0.1%BSA盐酸溶液作为空白,进样30针,平衡质谱仪。
3.配制标准品储备液、检出限样本和校准品样本
3.1配制标准品储备液
采用5mmol/L的0.1%BSA盐酸溶液配制0.877mg/L胰岛素(Insulin)标准品储备液;
采用5mmol/L的0.1%BSA盐酸溶液配制7.5mg/L胰岛素样生长因子(IGF)标准品储备液;
采用5mmol/L的0.1%BSA盐酸溶液配制3mg/L表皮生长因子(EGF)标准品储备液。
3.2配制检出限样本
将0.877mg/L胰岛素(Insulin)标准品储备液,采用5mmol/L的0.1%BSA盐酸溶液依次稀释为0.877ppb和87.7ppb,进行质谱检测;
将7.5mg/L胰岛素样生长因子(IGF)标准品储备液,采用5mmol/L的0.1%BSA盐酸溶液依次稀释为75ppb、750ppb和1500ppb,进行质谱测定;
将3mg/L表皮生长因子(EGF)标准品储备液,采用5mmol/L的0.1%BSA盐酸溶液依次稀释为30ppb、150ppb和300ppb,进行质谱测定。
3.3配制校准品样本
将0.877mg/L胰岛素(Insulin)标准品储备液,采用5mmol/L的0.1%BSA盐酸溶液依次稀释为0.05ppb、0.5ppb、1ppb、2.5ppb、5ppb和10ppb,采用串联液相色谱质谱LC-MS(Shimadzu 30 LC-Sciex Triple Quad 4500)自动进样并采集信号,从而制备标准曲线,标准曲线如图1所示;
将7.5mg/L胰岛素样生长因子(IGF)标准品储备液,采用5mmol/L的0.1%BSA盐酸溶液依次稀释为0.5ppm、0.75ppm、1ppm、1.5ppm和2ppm,进行检测,从而制备标准曲线,标准曲线如图2所示;
将3mg/L表皮生长因子(EGF)标准品储备液,采用5mmol/L的0.1%BSA盐酸溶液依次稀释为0.001ppm、0.005ppm、0.1ppm、0.25ppm、0.5ppm和1ppm,进行检测,从而制备标准曲线,标准曲线如图3所示。
4.液相色谱条件
色谱柱:Phenomenex® Kinetex®,2.6 µm,C18 column,3.0x50 mm;
柱温:40℃;
流动相A:0.1%甲酸水;
流动相B:0.1%甲酸乙腈;
洗针液:33.3%水;33.3%乙腈;33.3%甲醇;0.2%乙酸;
流速:0.7ml/min;
洗脱梯度如表1所示。
表1
5.质谱条件
质谱参数表2所示。
表2:质谱参数
本实施例示例性展示质谱结果中的离子对信息,质谱结果中的离子对信息如表3所示。
表3:离子对信息
6.结果
6.1定量结果:首先,采用外标法定量,通过液相色谱质谱联用测定一组如本实施例步骤3所示的不同浓度的标准溶液,获取响应浓度的响应信号,以浓度为横坐标,信号值为纵坐标,获得如图1~3所示的标准曲线。随后,通过液相色谱质谱联用测定3个未知浓度的细胞培养上清液样品(细胞培养上清液样品1、2和3),分别获取3个未知浓度的细胞培养上清液样品中的信号值(目标化合物的色谱峰面积),并分别将3个未知浓度的细胞培养上清液样品中的信号值代入如图1~3所示的标准曲线中,从而分别获得3个未知浓度的细胞培养上清液样品中目标分析物(胰岛素(Insulin)、表皮生长因子(EGF)和胰岛素样生长因子(IGF))的浓度。
结果显示,细胞培养上清液样品1中胰岛素(Insulin)的浓度为0.51ppb、表皮生长因子(EGF)为0.206ppm、胰岛素样生长因子(IGF)为0.103ppm;细胞培养上清液样品2中胰岛素(Insulin)的浓度为1.01ppb、表皮生长因子(EGF)为0.409ppm、胰岛素样生长因子(IGF)为0.21 ppm;细胞培养上清液样品3中胰岛素(Insulin)的浓度为1.98ppb、表皮生长因子(EGF)为0.604ppm、胰岛素样生长因子(IGF)为0.405 ppm。
7.检测本实施例所建立的方法的线性相关关系、灵敏度、精密度和准确度
7.1线性相关关系
根据本实施例步骤3中的方法测定胰岛素(Insulin)、胰岛素样生长因子(IGF)、表皮生长因子(EGF)三种标准目标化合物的标准曲线,从而判断本实施例所建立的方法的线性相关关系是否良好。
结果如图1~3所示,胰岛素(Insulin)、胰岛素样生长因子(IGF)、表皮生长因子(EGF)三种标准目标化合物的标准曲线的R
7.2灵敏度检测(检出限检测)
分别配制低浓度的0.05ppb Insulin、0.5ppm IGF、0.001ppm EGF;用SciexTriple Quad 4500 质谱仪自动进样检测;分别获取0.05ppb Insulin、0.5ppm IGF、0.001ppm EGF的响应信号,并自动与噪音信号做比值,比值大于10,即判定符合定量要求。
结果显示,低浓度0.05ppb Insulin、0.5ppm IGF、0.001ppm EGF三种样品的信噪比均大于10;符合定量限的要求,说明本实施例建立的检测方法的灵敏度好。
7.3精密度检测
分别连续进样6次0.5ppb的胰岛素(Insulin),0.5ppm的胰岛素样生长因子(IGF),0.01ppm的表皮生长因子(EGF),Sciex Triple Quad 4500 质谱仪根据6次进样保留时间,自动计算标准偏差分辨;Sciex Triple Quad 4500 质谱仪根据6次进样峰面积,自动计算标准偏差。
结果显示,胰岛素(Insulin)样品溶液的保留时间的相对标准偏差分辨为0.5%,胰岛素样生长因子(IGF)样品溶液的保留时间的相对标准偏差分辨为1.9%,表皮生长因子(EGF)样品溶液的保留时间的相对标准偏差分辨为1.2%;
胰岛素(Insulin)样品溶液的相对标准偏差为2.1%,胰岛素样生长因子(IGF)样品溶液的相对标准偏差为3.5%表皮生长因子(EGF)样品溶液的相对标准偏差为2.9%。
由此可见,本实施例建立的检测方法的精密度好。
7.4准确度
首先,准备3个未知浓度的细胞培养上清液样品4、5和6,分别将3个未知浓度的细胞培养上清液样品进样6次,分别测定3个未知浓度的细胞培养上清液样品1~3中的insulin、IGF和EGF的平均值。
其次,准备含有三种目标分析化合物insulin、IGF和EGF的混合物标准样品,将混合标准样品分别加入到上述3个未知浓度的细胞培养上清液样品4、5和6;其中,混合物标准样品中insulin的加标量为0.2ppb、IGF的加标量为0.3ppm、EGF的加标量为0.1ppm。将分别加入混合物标准样品的3个未知浓度的细胞培养上清液样品4、5和6作为加标待测样1、2和3。分别将这3个加标待测样进样6次,分别测定3个加标待测样中insulin、IGF和EGF的加标平均值并计算加标回收率。
结果如表4所示,从表4中可知,3个加标待测样1、2和3中的insulin、IGF和EGF的回收率均在80%~120%的范围内,说明本实施例建立的检测方法的准确度好。
表4:回收率表
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、 “示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 一种聚乙烯醇/壳聚糖凝胶珠的制备方法
- 一种磁性壳聚糖-二氧化硅复合气凝胶的制备方法
- 基于纤维素纳米纤维的磁性复合水凝胶的制备方法及用途
- 一种磁性壳聚糖凝胶珠的制备方法及用途
- 一种吸附重金属的可食性壳聚糖-果胶凝胶珠的制备方法及其应用
