一种硼酸化纳米靶向制剂及其制备方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及医药技术领域,涉及一种硼酸化纳米靶向制剂及其制备方法。
背景技术
在非传染性疾病中,癌症仍然是全世界最重要的死亡原因之一,据估计到2040年全球癌症负担将达到2840万例癌症病患者。目前,对肿瘤的治疗主要采用药物疗法、放疗和手术三大手段相结合,其中传统的药物疗法是治疗肿瘤的必不可少的手段,盐酸多柔比星、顺铂、甲氨蝶呤等传统化学药物由于靶向性低,药物无法富集到肿瘤组织,导致治疗效果低,同时长期使用化疗药物还会导致对正常增殖细胞的致命损害,而且在实体瘤的治疗中,化疗药物很难迅速浸润实体瘤的癌细胞,使得化疗药物的使用剂量远大于病体所需的药物剂量。随着药物制剂的发展,盐酸多柔比星脂质体、白蛋白结合性紫杉醇等药物相继出现,其中脂质体和白蛋白作为纳米药物载体,被认为能够通过肿瘤的高通透性和滞留(EPR效应)实现被动靶向,一定程度上减轻了传统化学药物的不良反应,显示出纳米载体的极大优势。然而相比主动靶向,被动靶向机制依然存在争议。最新研究表明,纳米粒主要通过受体介导的胞吞转运而非内皮间隙穿透肿瘤。通过对纳米粒进行修饰使其与靶细胞(如肿瘤细胞或免疫细胞)表面特异性受体相结合可以有效提高靶向能力,因此将研究重心从EPR效应介导的被动靶向型纳米粒转移至设计主动靶向型药物递送系统会更具成效。
碳点(CDs)是一种尺寸小于10nm的新型纳米材料,由于优异的理化性质,如荧光稳定、表面易修饰、生物安全性良好,而被广泛的用于生物传感、光学成像、药物递送等领域。CDs内部是以碳为主的碳骨架、表面是易于修饰的-OH、-COOH、-NH2等基团。利用CDs独特的荧光性质,可以用于定位细胞、组织、器官等,实现诊断的目的;但当CDs作为诊疗平台时,由于单独的CDs不能与病灶组织或细胞特异性结合,无法主动靶向病灶部位。
发明内容
有鉴于此,本发明的目的是提供一种硼酸化纳米靶向制剂及其制备方法和应用,以解决让化疗药物具有主动靶向功能,进而使更多药物富集在肿瘤部位的技术问题。
本发明硼酸化纳米靶向制剂包括碳量子点、负载在碳量子点上的药物和结合在碳量子点上的三氧化二硼。
进一步,所述药物为阿霉素。
进一步,所述碳量子点以罗丹明B为原料,采用溶剂热法合成。
本发明还公开了所述硼酸化纳米靶向制剂的制备方法,其包括步骤:
①以罗丹明B为原料,含氢氧化钠的水溶液为溶剂,采用溶剂热法合成罗丹明碳量子点;
②将步骤①制备的罗丹明碳量子点与阿霉素溶液混合,在避光及室温条件下反应,得到负载有阿霉素的纳米制剂;
③将步骤②制备的纳米制剂和硼酸采用纯化水溶解,对溶液加热使硼酸裂解并结合在碳量子点的表面,然后对溶液进行蒸发脱水处理,得到碳量子点表面结合有三氧化二硼的纳米靶向制剂粗产物;
④对步骤③得到的纳米靶向制剂粗产物在缓冲液中透析除去未结合的硼酸,得到硼酸化纳米靶向制剂终产物。
进一步,所述步骤①采用溶剂热法合成罗丹明碳量子点的溶剂温度为150℃~200℃。
进一步,所述步骤③中对溶液加热使硼酸裂解的溶液温度为150℃~200℃。
本发明的有益效果:
1、本发明中硼酸化纳米靶向制剂,其能负载药物,如负载传统的化疗药物阿霉素(Doxorubicin,DOX),且与碳量子点结合的三氧化二硼能通过其结构上的氧负离子能与肿瘤表面过量表达的唾液酸(SA)特异性结合,让化疗药物具有了主动靶向功能,从而能使更多药物富集在肿瘤部位,有利于肿瘤的靶向治疗。
2、由于硼常以B(OH)3的形式均匀分布在人体全身各处,因此本发明中硼酸化纳米靶向制剂以三氧化二硼作为修饰材料,无需考虑修饰材料降解后的毒性问题,安全性好。
3、本发明中硼酸化纳米靶向制剂,其制备原料易得,成本低。
4、本发明中硼酸化纳米靶向制剂的制备方法简单可控,且可以通过调节反应条件(时间、温度,投料比例等),对纳米制剂的粒径、电位等物理性质进行调节。
5、本发明中硼酸化纳米靶向制剂的制备方法,所用溶剂绿色无毒,相比有机溶剂,纯化水安全绿色,成本低。
附图说明
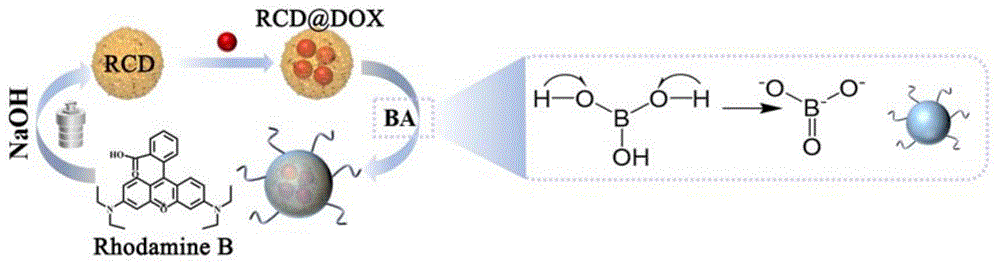
图1为硼酸化纳米靶向制剂(RCD@DOX/BA)的制备示意图。罗丹明B碳量子点(RCD)通过静电相互作用负载模型药物DOX,通过硼酸(BA)分解而来的三氧化二硼结构上的氧负离子与肿瘤表面过量表达的唾液酸SA特异性的结合,将DOX靶向递送至肿瘤,发挥靶向治疗效果。
图2为实施例二所述RCD@DOX/BA的透射电镜(TEM)图,从图结果可知,RCD@DOX/BA大小均一,分散性较好,粒径大小在12nm左右。
图3为实施例二所述RCD@DOX/BA X射线电子能谱图中硼元素的窄普图,结果表明,RCD@DOX/BA表面存在B元素,且含有三氧化二硼结构,表面修饰成功。
图4为细胞摄取实施例二的RCD@DOX/BA后,细胞的SEM图,从结果来看,引入RCD@DOX/BA后,细胞表面粗糙,提示更多的药物富集在肿瘤细胞表面。
图5为实施例二的RCD@DOX/BA用于小鼠皮下肿瘤模型治疗效果图,从图结果可知,经过一段时间后,RCD@DOX/BA处理组的小鼠肿瘤体积明显小于RCD@DOX处理组和DOX组,原因是RCD@DOX/BA组具有主动靶向作用,治疗效果优于其他组。
具体实施方式
下面结合附图和实施例对本发明作进一步描述。
实施例一:本实施例硼酸化纳米靶向制剂包括碳量子点、负载在碳量子点上的药物和结合在碳量子点上的三氧化二硼。本实施例中,负载在碳量子点上的药物为阿霉素;当然在不同实施例中,负载在碳量子点上的药物还可为其它药物。本实施例中,所述碳量子点以罗丹明B为原料,采用溶剂热法合成。
实施例二:制备实施例一中所述硼酸化纳米靶向制剂的制备方法,包括步骤:
①以罗丹明B为原料,含氢氧化钠的水溶液为溶剂,采用溶剂热法合成罗丹明碳量子点。具体的,将罗丹明B加入氢氧化钠溶液中搅拌均匀形成混合物,氢氧化钠溶液的浓度为0.67M,每6.4mg罗丹明B溶于1mL氢氧化钠溶液,当然氢氧化钠溶液的浓度和罗丹明B的溶解量还可适当调整;再将溶液置于马弗炉中,在150℃条件下反应8h,得到黄棕色的罗丹明碳量子点RCD粗产物;向粗产物溶液中缓慢加入稀盐酸(稀盐酸的浓度为37%,当然在不同实施例中还可用其它浓度的稀盐酸),以除去未反应完全的氢氧化钠,直至出现大量沉淀,停止滴加稀盐酸,将其静止12h,采用离心的方式分离上清液,得到棕色沉淀物,用烘箱缓慢干燥棕色沉淀物,即可得到罗丹明B碳量子点RCD。
②将步骤①制备的罗丹明碳量子点与阿霉素溶液混合,具体实施中RCD溶液与阿霉素DOX溶液按体积比2:1投料。在避光及室温条件下搅拌24h,离心除去游离的DOX,冷冻干燥即得到负载有阿霉素的纳米制剂RCD@DOX。
③将步骤②制备的纳米制剂和硼酸采用纯化水溶解,具体的RCD和硼酸BA可按1:10的质量比投料。对溶液加热使硼酸裂解并结合在碳量子点的表面,溶液温度控制在150℃,反应5h;然后对溶液进行蒸发脱水处理,得到碳量子点表面结合有三氧化二硼的纳米靶向制剂粗产物。
④对步骤③得到的纳米靶向制剂粗产物在缓冲液中透析除去未结合的硼酸,得到硼酸化纳米靶向制剂终产物RCD@DOX/BA。
实施例三:制备实施例一中所述硼酸化纳米靶向制剂的制备方法,包括步骤:
①以罗丹明B为原料,含氢氧化钠的水溶液为溶剂,采用溶剂热法合成罗丹明碳量子点。具体的,将罗丹明B加入氢氧化钠溶液中搅拌均匀形成混合物,氢氧化钠溶液的浓度为0.67M,每6.4mg罗丹明B溶于1mL氢氧化钠溶液;再将溶液置于马弗炉中,在180℃条件下反应6h,得到黄棕色的罗丹明碳量子点RCD粗产物;向粗产物溶液中缓慢加入稀盐酸,以除去未反应完全的氢氧化钠,直至出现大量沉淀,停止滴加稀盐酸,将其静止12h,采用离心的方式分离上清液,得到棕色沉淀物,用烘箱缓慢干燥棕色沉淀物,即可得到罗丹明B碳量子点RCD。
②将步骤①制备的罗丹明碳量子点与阿霉素溶液混合,具体实施中RCD溶液与阿霉素DOX溶液按体积比1.5:1投料。在避光及室温条件下搅拌24h,离心除去游离的DOX,冷冻干燥即得到负载有阿霉素的纳米制剂RCD@DOX。
③将步骤②制备的纳米制剂和硼酸采用纯化水溶解,具体的RCD和硼酸BA按1:9的质量比投料。对溶液加热使硼酸裂解并结合在碳量子点的表面,溶液温度控制在180℃,反应4.5h;然后对溶液进行蒸发脱水处理,得到碳量子点表面结合有三氧化二硼的纳米靶向制剂粗产物。
④对步骤③得到的纳米靶向制剂粗产物在缓冲液中透析除去未结合的硼酸,得到硼酸化纳米靶向制剂终产物RCD@DOX/BA。
实施例三:制备实施例一中所述硼酸化纳米靶向制剂的制备方法,包括步骤:
①以罗丹明B为原料,含氢氧化钠的水溶液为溶剂,采用溶剂热法合成罗丹明碳量子点。具体的,将罗丹明B加入氢氧化钠溶液中搅拌均匀形成混合物,氢氧化钠溶液的浓度为0.67M,每6.4mg罗丹明B溶于1mL氢氧化钠溶液;再将溶液置于马弗炉中,在180℃条件下反应7h,得到黄棕色的罗丹明碳量子点RCD粗产物;向粗产物溶液中缓慢加入稀盐酸,以除去未反应完全的氢氧化钠,直至出现大量沉淀,停止滴加稀盐酸,将其静止12h,采用离心的方式分离上清液,得到棕色沉淀物,用烘箱缓慢干燥棕色沉淀物,即可得到罗丹明B碳量子点RCD。
②将步骤①制备的罗丹明碳量子点与阿霉素溶液混合,具体实施中RCD溶液与阿霉素DOX溶液按体积比1.5:1投料。在避光及室温条件下搅拌24h,离心除去游离的DOX,冷冻干燥即得到负载有阿霉素的纳米制剂RCD@DOX。
③将步骤②制备的纳米制剂和硼酸采用纯化水溶解,具体的RCD和硼酸BA按1:9的质量比投料。对溶液加热使硼酸裂解并结合在碳量子点的表面,溶液温度控制在150℃,反应5h;然后对溶液进行蒸发脱水处理,得到碳量子点表面结合有三氧化二硼的纳米靶向制剂粗产物。
④对步骤③得到的纳米靶向制剂粗产物在缓冲液中透析除去未结合的硼酸,得到硼酸化纳米靶向制剂终产物RCD@DOX/BA。
实施例五:制备实施例一中所述硼酸化纳米靶向制剂的制备方法,包括步骤:
①以罗丹明B为原料,含氢氧化钠的水溶液为溶剂,采用溶剂热法合成罗丹明碳量子点。具体的,将罗丹明B加入氢氧化钠溶液中搅拌均匀形成混合物,氢氧化钠溶液的浓度为0.67M,每6.4mg罗丹明B溶于1mL氢氧化钠溶液;再将溶液置于马弗炉中,在200℃条件下反应5h,得到黄棕色的罗丹明碳量子点RCD粗产物;向粗产物溶液中缓慢加入稀盐酸,以除去未反应完全的氢氧化钠,直至出现大量沉淀,停止滴加稀盐酸,将其静止12h,采用离心的方式分离上清液,得到棕色沉淀物,用烘箱缓慢干燥棕色沉淀物,即可得到罗丹明B碳量子点RCD。
②将步骤①制备的罗丹明碳量子点与阿霉素溶液混合,具体实施中RCD溶液与阿霉素DOX溶液按体积比2.5:1投料。在避光及室温条件下搅拌24h,离心除去游离的DOX,冷冻干燥即得到负载有阿霉素的纳米制剂RCD@DOX。
③将步骤②制备的纳米制剂和硼酸采用纯化水溶解,具体的RCD和硼酸BA可按1:11的质量比投料。对溶液加热使硼酸裂解并结合在碳量子点的表面,溶液温度控制在200℃,反应4h;然后对溶液进行蒸发脱水处理,得到碳量子点表面结合有三氧化二硼的纳米靶向制剂粗产物。
④对步骤③得到的纳米靶向制剂粗产物在缓冲液中透析除去未结合的硼酸,得到硼酸化纳米靶向制剂终产物RCD@DOX/BA。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,本领域的普通技术人员应当理解,可以对上述实施例中的溶液浓度、投料比例、反应温度、反应时间等参数进行修改,但这些修改或者等同替换与本发明所述技术方案实质相同,因此这些实质相同的修改或等同替换也均应涵盖在本发明的权利要求范围当中。
- 一种基于双评价的生态保护红线划定方法
- 一种陆地生态系统固碳功能的生态保护红线划定方法
