一种药物靶标蛋白Sec24-2及其在农业上的用途
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于农业生物药物技术领域,具体涉及一种药物靶标蛋白Sec24-2及其在农业上的用途。
背景技术
目前可作为绿色农药创制的杀菌剂靶标主要集中于呼吸链复合体II和III、附着胞黑色素合成关键酶等几个靶标,这样作用位点单一,农药结构同质化严重,靶标蛋白基因的微小突变便导致药剂活性丧失,抗性风险巨大。同时,病原菌靶标蛋白的晶体结构数据少,且多以模式生物的蛋白晶体结构进行分子设计,不能准确反映化学分子与靶标的作用方式,导致化合物筛选误差大和效率低。
因而,在明确粮食作物病原菌致害机制的基础上,挖掘潜在药剂靶标,构建可靠的靶标三维结构,进而设计具有高度选择性的新分子,可望实现新型绿色农药的原创性开发。
目前,还没有关于以囊泡组分蛋白为靶标的杀菌剂的报道,因此,研究囊泡转运抑制剂作为新型作用机制的杀菌剂至关重要。
发明内容
有鉴于此,本发明的目的在于提供一种COPII囊泡组分蛋白Sec24-2蛋白,可以作为药物研发的分子靶标,为真菌病害药物的研发提供基础。
本发明首先提供一种在植物中阻止或减弱编码所述Sec24-2蛋白功能或基因表达的试剂在防治植物真菌病害蔓延中的应用,所述植物真菌病害为由稻瘟病菌(Magnaporthe)、镰刀菌(Fusarium)、炭疽病菌(Colletotrichum)、稻曲病菌(Ustilaginoidea)、核盘菌(Sclerotinia)、曲霉病菌(Aspergillus)、全蚀病菌(Gaeumannomyces)、轮枝病菌(Verticillium)、葡萄孢病菌(Botrytis)和粗糙脉孢霉病菌(Neurospora)引起的植物病害。
优选地,所述植物病原真菌为稻瘟病菌、镰刀菌和炭疽病菌。
更具体地,所述Sec24-2蛋白的氨基酸序列如SEQ ID NO:1~3所示,优选地所述基因的核苷酸序列SEQ ID NO:4~6所示。
另外优选地,所述植物为小麦,水稻,大豆。
更具体地,所述由稻瘟病菌引起的植物病害为稻瘟病,镰刀菌引起的植物病害为小麦赤霉病和/或水稻恶苗病,由炭疽病菌引起的植物病害为大豆炭疽病和/或葡萄炭疽病。
在具体实施方式中,所述试剂是能够阻止或减弱编码Sec24-2蛋白功能或基因转录的小分子化合物、蛋白类抑制剂、天然产物,例如siRNA、抗体、利用基因编辑实现所述目的的试剂。
本发明也提供一种药物靶标Sec24-2蛋白的突变体,其是在如SEQ ID NO:2所示氨基酸序列的基础上进行结构域片段缺失突变或点突变,以使其活性降低或失活;优选地,所述结构域片段的缺失为:第313~351位和第648-730位氨基酸形成的功能域的基因或蛋白序列全部或部分缺失;所述点突变为在K560、K754、F240、E241、H243、Q257、Q358和R364中一个或多个位点发生突变,更具体为K560R、K754R、F240+E241+H243+Q257组合点突变或Q358+R364组合点突变。
进而本发明提供所述药物靶标Sec24-2蛋白在设计或筛选防治植物真菌病原特异性药剂中的应用,所述植物真菌病原为稻瘟病菌、镰刀菌和炭疽病菌;优选地,其是针对所述药物靶标Sec24-2蛋白的K560、K754、F240、E241、H243、Q257、Q358和R364关键位点进行设计或筛选。
更具体地,利用AlphaFold2预测了稻瘟病菌、镰刀菌和炭疽菌Sec24-2蛋白的三级结构,用AutoDockvina软件进行待候选的小分子化合物进行筛选;将上述预测的Sec24-2三级结构的PDB文件和小分子化合物MOL2文件提交AutoDockvina软件,利用该软件的虚拟对接功能,选出结合自由能为-18.0kcal/mol~-8.0kcal/mol,且RMSD均值为
上述也可以认为一种设计或筛选防治植物真菌病原特异性药剂的方法,其步骤包括利用AlphaFold2预测了稻瘟病菌、镰刀菌和炭疽菌Sec24-2蛋白的三级结构,用AutoDockvina软件进行待候选的小分子化合物进行筛选;将上述预测的Sec24-2三级结构的PDB文件和小分子化合物MOL2文件提交AutoDockvina软件,利用该软件的虚拟对接功能,选出结合自由能为-18.0kcal/mol~-8.0kcal/mol,且RMSD均值为
本发明也提供所述药物靶标Sec24-2蛋白在降低植物真菌病原致病力方面的应用;所述植物真菌病原为稻瘟病菌、镰刀菌和炭疽病菌。优选地通过对植物真菌病原中的所述药物靶标Sec24-2蛋白的K560、K754、F240、E241、H243、Q257、Q358和R364关键位点进行突变来实现,更具体突变为在K560、K754、F240、E241、H243、Q257、Q358和R364中一个或多个位点发生突变,更具体为K560R、K754R、F240+E241+H243+Q257组合点突变或Q358+R364组合点突变。具体地,所述降低植物真菌病原致病力包括抑制植物病原真菌生长发育和降低毒素产量方面。
上述也可以认为一种降低植物真菌病原致病力的方法;所述植物真菌病原为稻瘟病菌、镰刀菌和炭疽病菌,其是包括对植物真菌病原中的所述药物靶标Sec24-2蛋白的K560、K754、F240、E241、H243、Q257、Q358和R364关键位点进行突变的步骤,以及得到突变后的植物真菌病原突变体的步骤。
本发明发现稻瘟病菌MoSec24-2蛋白的第313~351位和第648-730位氨基酸是两个重要功能域,其折叠形成的活性口袋可作为受体区域设计靶向药物。稻瘟病菌MoSec24-2蛋白第240、241、243、257、358、364、560、754位氨基酸对菌体囊泡解聚、效应蛋白分泌和致病力具有关键作用,作为药敏性位点设计的杀菌剂可以防治植物真菌病害。本发明提供病原真菌Sec24-2蛋白突变体,可根据其功能位点,开发靶向选择性药物或制备筛选药物材料,有着安全、高效、广谱的应用前景。
附图说明
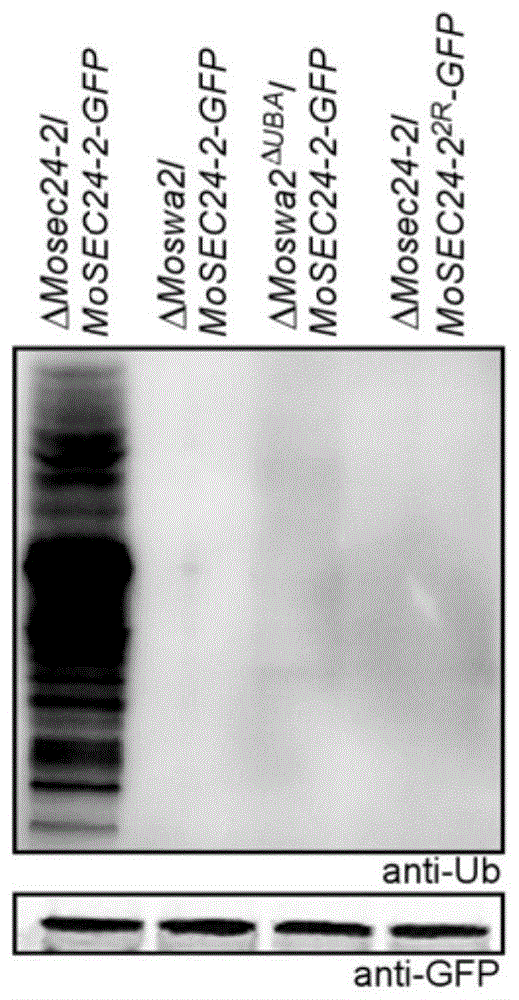
图1是稻瘟病菌MoSec24-2及其泛素化位点点突变蛋白泛素化Western Blot检测结果。上部分图片为泛素化检测(抗体为Anti-Ub),下部分图片为总蛋白检测(抗体为Anti-GFP)。
图2是稻瘟病菌MoSEC24-2基因敲除及其泛素化位点点突变突变体致病力分析结果。A为接种稻瘟病菌7天后叶片发病图片;B为叶片发病面积(disease lesion area,DLA)统计结果;C为发病叶片中真菌生物量(relative fungal growth)统计结果。
图3是稻瘟病菌MoSEC24-2基因敲除及其互作位点点突变突变体致病力分析结果。A为接种稻瘟病菌7天后叶片发病图片;B为叶片发病面积(diseaselesionarea,DLA)统计结果;C为发病叶片中真菌生物量(relative fungal growth)统计结果。
图4是稻瘟病菌MoSEC24-2基因敲除及其泛素化位点点突变突变体侵染水稻叶鞘能力分析结果。A为不同类型侵染菌丝分级标准;B为根据不同类型侵染菌丝分类统计结果。
图5是稻瘟病菌MoSEC24-2基因敲除及其泛素化位点点突变突变体侵染抑制寄主活性氧能力分析结果。A为显微镜下观察到的不同突变体及野生型侵染导致水稻活性氧积累的图片;B为具有活性氧积累的水稻细胞统计结果。
图6是炭疽病菌CgSEC24-2基因敲除突变体致病力分析结果。A为接种炭疽病菌7天后叶片发病图片;B为叶片病斑直径统计结果。
图7是赤霉病菌FgSEC24-2基因敲除突变体致病力分析结果。A为接种赤霉病菌14天后小麦发病图片;B为发病穗数统计结果。
图8是MST分析炭疽病菌CgSec24-2和赤霉病菌FgSec24-2蛋白及其突变体蛋白与化合物1438结合能力结果。注:Kd值越小,结合能力越强。
图9是化合物1438抑制稻瘟病分析结果。A为不同浓度化合物1438处理24h后,再接种稻瘟病菌7天后叶片发病图片;B为叶片发病面积(disease lesion area,DLA)统计结果;C为发病叶片中真菌生物量(relative fungal growth)统计结果。
图10是化合物1438抑制炭疽病和赤霉病分析结果。A和C为不同浓度化合物1438处理24h后,再接种炭疽病菌和赤霉病菌7-14天后叶片发病图片;B为接种炭疽病菌7天后叶片发病面积统计结果;B为赤霉病菌接种14天后,发病穗数统计结果。
图11是不同真菌中Sec24-2蛋白序列进化分析和蛋白序列相似度(identity)结果。
具体实施方式
下面通过具体实施方式对本发明进一步说明,以期更好的理解本发明,但并不构成对本发明限制。
实施例1:SEC24-2基因的敲除
1、SEC24-2基因敲除载体的构建
为了研究该SEC24-2基因在稻瘟病菌(MoSEC24-2)、镰刀菌(FgSEC24-2)和炭疽病菌(CgSEC24-2)中的功能,从NCBI数据库https://www.ncbi.nlm.nih.gov中获得编码登录号为MGG_06569、MU270241.1和FGRAMPH1_01T20499的基因预测核酸序列(分别如SEQ IDNo:4至6所示,编码的氨基酸序列如SEQ ID No:1-3所示)。
以稻瘟病菌野生型菌株Guy11为模板,分别利用引物:MoSEC24-2-p1-F(5’-CCGCTCGAGGTCTAAGTAGCCATAGTC-3’)/MoSEC24-2-p2-R(5’-CCGATATCGGAGCTCACTGCATCTGC-3’);MoSEC24-2-p3-F(5’-CGGGATCCCGGTCAGGGATGCAGTGTCACC-3’)/MoSEC24-2-p4-R(5’-GGACTAGTCCTGGCGTCATCAGAGCAACT-3’)扩增MoSEC24-2基因的约1kb上游旁侧序列和约1kb下游旁侧序列,MoSEC24-2-p2/MoSEC24-2-p3引物包含EcoR V酶切位点。利用MoSEC24-2-p1-F/MoSEC24-2-p4-R,将两段旁侧序列连接起来,克隆的2kb片段纯化后构建到pMD19-T载体上。潮霉素HPH基因约1.4kb利用FL1111(5’-GGAGGTCAACACATCAATG-3’)/FL1112(5’-CTCTATTCCTTTGCCCTCG-3’)扩增,并用EcoR V将片段插入到pMD-MoSEC24-2质粒中。3.4kb的片段用MoSEC24-2-p1-F/MoSEC24-2-p4-R应物扩增用于原生质体转化。
以镰刀菌菌株PH-1为模板,分别利用引物FgSEC24-2-p1-F(5’-CATCACTCATGTTGATCAG-3’)/FgSEC24-2-p2-R(5’-GGCGGTGTCGAGGTTCGGGA-3’)和FgSEC24-2-p3-F(5’-GAACAGGTGGTGACTT-3’)/FgSEC24-2-p4-R(5’-TAGTGGGTGTTGTCAAGC-3’)扩增FgSEC24-2基因的约1kb上游旁侧序列和约1kb下游旁侧序列,FgSEC24-2-p2/FgSEC24-2-p3引物包含EcoR V酶切位点。利用FgSEC24-2-p1-F/FgSEC24-2-p4-R,将两段旁侧序列连接起来,克隆的2kb片段纯化后构建到pMD19-T载体上。潮霉素HPH基因约1.4kb利用FL1111(5’-GGAGGTCAACACATCAATG-3’)/FL1112(5’-CTCTATTCCTTTGCCCTCG-3’)扩增,并用EcoR V将片段插入到pMD-MoSEC24-2质粒中。3.4kb的片段用FgSEC24-2-p1-F/FgSEC24-2-p4-R应物扩增用于原生质体转化。
以炭疽菌菌株SMCG1#C为模板,分别利用引物CgSEC24-2-p1-F(5’-TAGTATCTTGAAGC-3’)/CgSEC24-2-p2-R(5’-GGTTGCAGGAGGTGTGCG-3’)和CgSEC24-2-p3-F(5’-GAAAAAGGTTACTAAAGTG-3’)/CgSEC24-2-p4-R(5’-CCATGTCAATGTCTCGTTC-3’)扩增CgSEC24-2基因的约1kb上游旁侧序列和约1kb下游旁侧序列,CgSEC24-2-p2/CgSEC24-2-p3引物包含EcoR V酶切位点。利用CgSEC24-2-p1-F/CgSEC24-2-p4-R,将两段旁侧序列连接起来,克隆的2kb片段纯化后构建到pMD19-T载体上。潮霉素HPH基因约1.4kb利用FL1111(5’-GGAGGTCAACACATCAATG-3’)/FL1112(5’-CTCTATTCCTTTGCCCTCG-3’)扩增,并用EcoR V将片段插入到pMD-MoSEC24-2质粒中。3.4kb的片段用FgSEC24-2-p1-F/FgSEC24-2-p4-R应物扩增用于原生质体转化。
上文中的稻瘟病菌MoSEC24-2约1kb上游旁侧序列如SEQ ID NO:7所示。上文中的稻瘟病菌MoSEC24-2基因约1kb下游旁侧序列如SEQ ID NO:8所示。上文中的镰刀菌FgSEC24-2约1kb上游旁侧序列如SEQ ID NO:9所示。上文中的镰刀菌FgSEC24-2基因约1kb下游旁侧序列如SEQ ID NO:10所示。上文中的炭疽菌CgSEC24-2约1kb上游旁侧序列如SEQID NO:11所示。上文中的炭疽菌CgSEC24-2基因约1kb下游旁侧序列如SEQ ID NO:12所示。
2、SEC24-2基因敲除突变体的获得
1)培养基的配置
CM培养基配置方法:量取20×硝酸盐(120g硝酸钠,10.4g氯化钾,10.4g七水硫酸镁,30.4g磷酸二氢钾,加蒸馏水溶解至1L)50ml,1000×微量元素(2.2g七水硫酸锌,1.1g硼酸,0.5g四水氯化锰,0.5g七水硫酸铁,0.17g六水氯化钴,0.16g五水硫酸铜,0.15g二水锰酸钠,5g EDTA四钠,加蒸馏水溶解至100ml)1ml,维生素溶液(0.01g生物素,0.01g维生素B6,0.01g维生素B1,0.01核黄素,0.01对氨基苯甲酸,0.01烟酸,加蒸馏水溶解至100ml)1ml,称取葡萄糖10g,蛋白胨2g,酵母提取物1g,酪蛋白氨基酸1g,琼脂粉15g,加蒸馏水定量至1L,分装于三角瓶中,121℃灭菌20分钟,冷却后备用。
产孢培养基配置方法:用玉米粉和水稻秆配制,称取100g水稻秆加入1L水煮沸30分子,再加入40g玉米粉和15g琼脂粉煮沸20分钟,最后用蒸馏水定容到1L,分装于三角瓶中,121℃灭菌20分钟,冷却后备用。
PDA培养基:马铃薯200g煮沸过滤去渣,葡萄糖20g,琼脂15g,纯水定容至1L,高温高压灭菌。
YEPD培养基:酵母提取物3g,蛋白胨10g,葡萄糖20g,纯水定容至1L,高温高压灭菌。
1×STC的配置方法:称取质量体积比为20%的蔗糖,称取50mM的Tris·Cl PH8.0,50mM的氯化钙,加蒸馏水定量至1L,分装于三角瓶中,121℃灭菌20分钟,冷却后备用。
TB3培养基配置方法:称取3g酵母提取物,3g Casamino Acids和20%的蔗糖,加蒸馏水定量至1L,分装于三角瓶中,121℃灭菌20分钟,冷却后备用。
PTC的配置方法:称取60% PEG4000溶解在1×STC,用细菌过滤器过滤后备用。
酶液的配制:用0.7M NaCl溶液溶解酶(lysing Enzymes fromTrichodermaharzianum,sigma),酶液浓度为7.5-10mg/ml,过滤除菌,现配现用。
2)原生质体的制备(Protoplasting)
a、活化菌株:接种菌丝块于CM或PDA平板上生长3-4d,菌落直径约3cm。菌株不宜太老。
b、切取直径约3cm的菌落,尽量切碎,置于约100ml CM或YPD的液体培养基中(含50μg/ml Amp),28℃、150rpm振荡培养2d(36-48h)。
c、1-2层Miracloth过滤收集菌丝,无菌水冲洗两遍,用吸水纸将水稍吸干。
d、将菌丝置于盛有10-20ml酶液(含50μg/ml Amp)的50ml离心管中酶解。离心管平躺,30℃、60rpm振荡1.5-2h酶解。酶解过程中应吸取菌液镜检,检查原生质体释放情况。
e、以下步骤于4℃下完成,0.7M NaCl溶液,1×STC先放于4℃预冷
f、取出酶解液,加少许0.7M NaCl溶液,轻轻摇晃,倒于三层灭菌擦镜纸过滤,用0.7M NaCl溶液轻轻冲洗1-2次,去残渣,收集滤液于50ml离心管中。
g、离心,3000rpm、4℃离心10min
h、小心弃上清,加10-20ml 1×STC悬浮,用剪去尖头的枪头轻轻吹打,然后3000rpm、4℃离心10min。
i、重复步骤8两次。
j、加适量(约300μl)1×STC悬浮,计数,使原生质体终浓度为10
3)原生质体转化
a、将2μg DNA(5-10μl)加于150μl原生质体中,轻轻混匀,室温静置25min,DNA浓度需足够大,且要干净。
b、分2-3次加1ml PTC,轻轻混匀,室温静置25min。静置时间不宜过长,PTC对原生质体有毒性。加好后去解冻TB3或者YEPD固体培养基。
c、把原生质体加到10ml左右熔化后冷却至45-50℃的TB3或者YEPD固体培养基中(含50μg/ml Amp),轻轻混匀后倒入培养皿中。置于28℃、黑暗培养24h。Optional:或原生质体加到5-10ml TB3或者YEPD(含50μg/ml Amp)液体中,28℃,轻轻振荡培养过夜。
d、往培养皿中再倒入10ml含300μg/ml Hygromycin B/Bleomycin的TB3或者YEPD固体培养基(含50μg/ml Amp)。
e、28℃下黑暗培养7-10d,一般5d后即可看出转化是否成功。
f、待上述转化子菌落直径约5mm时,从菌落上挑取小块菌丝块移置含150μg/mlHygromycin B/Bleomycin的CM固体培养基中进行筛选转化子。
g、进一步采用PCR验证转化子和Southern验证,所用内部探针用引物SEC24-2-p5-F/SEC24-2-p6-R,HPH探针用FL1111/FL1112扩增。
h、分析突变体的表现型。
实施例2:互补载体的构建
用引物MoSEC24-2-p7-F(5’-GGCATTGTAAGCCGTGATG-3’)/MoSEC24-2-p2-R,FgSEC24-2-p7-F(5’-TGTCGCTGTAGAGAGCAGAGATG-3’)/FgSEC24-2-p2-R,CgSEC24-2-p7-F(5’-CTGTGGCCCGCATTATAGGCAG-3’)/CgSEC24-2-p2-R扩增包含上游约1.5kb自身启动子,将片段通过酵母转化插入pYF11载体中(博来霉素抗性),形成pYF11-MoERS1载体。并通过原生质体转化将该载体导入ΔMosec24-2,ΔFgsec24-2,ΔCgsec24-2突变体中,获得ΔMosec24-2/MoSEC24-2,ΔFgsec24-2/FgSEC24-2,ΔCgsec24-2/CgSEC24-2的互补菌株。转化子首先根据表型来筛选,再用PCR验证,最后根据致病性、生长及其它表型测定验证互补情况。
同时,用引物MoSEC24-2-p8-F(5’-ACTCACTATAGGGCGAATTGGGTACTCAAATTGGTTGTTGAGCGGAGGCGAGAACG-3’)/MoSEC24-2-p9-R(5’-CAATCTCGCCACCAGGGTGGCGGCCATCATCCCTCATGAAG-3’),FgSEC24-2-p10-F(5’-CTTCATGAGGGATGATGGCCGCCACCCTGGTGGCGAGATTG-3’)/FgSEC 24-2-p11-R(5’-GCGGGCGAGGATGGAATAAACC-3’),CgSEC24-2-p12-F(5’-GGTTTATTCCATCCTCGCCCGCGAAGCTGCAACAAAGCTTG-3’)/CgSEC24-2-p13-R(5’-CACCACCCCGGTGAACAGCTCCTCGCCCTTGCTCACCCAGTACCCAGGTCGCAAAC-3’),扩增第313~351位氨基酸形成的功能域、第648-730位氨基酸形成的功能域片段的缺失,以及K560R、K754R泛素化位点点突变,F240+E241+H243+Q257组合点突变或Q358+R364组合点突变的片段;将片段通过酵母转化插入pYF11载体中(博来霉素抗性),形成pYF11-MoSEC24-2载体。并通过原生质体转化将该载体导入ΔMosec24-2突变体中,获得不同功能域片段的缺失和点突变互补菌株。转化子首先根据表型来筛选,再用PCR验证,最后根据致病性、生长及其它表型测定验证互补情况。
实施例3:稻瘟病菌MoSec24-2蛋白在体内发生泛素化
1、蛋白提取:配制蛋白裂解液,每个样品1ml lysis buffer+10ul cocktail(1%)+10ul PMSF(1mM)于2.0ml EP管中置于冰上,多个样品可以先混到一起再分装;收集菌丝,用无菌水冲洗两遍,吸水纸压干,液氮研磨至粉状,取适量粉末加到事先预冷的蛋白裂解液中,震荡混匀,冰上放置30min,每隔10min震荡一次(样品会变微红);最大转速4度离心10min,吸上清500ul至新的1.5ml EP管;最大转速4度离心10min,吸上清200ul至新的1.5mlEP管;配制稀释缓冲液(可在3-4步离心时操作),每个样品需800ul稀释缓冲液=稀释液+1%cocktail+1mM PMSF,多个样品可以先混到一起再分装;将200ul蛋白上清用稀释缓冲液稀释至1ml(200ul+800ul)后置于冰上,吸出一份作为总蛋白对照(稀释的目的是将去垢剂NP-40浓度降至0.2%以下);
2、珠子孵育:取25ul珠子于新的1.5ml EP管,用500ul WB洗液清洗3次,每次2500g2min,弃上清,最后一次清洗用黄枪头将残余液体吸出,勿吸到珠子;将第6步的蛋白与洗好的珠子混合,置于4度冰箱旋转(2h-过夜);取出样品,4度2500g 2min,吸出一份上清作为上清蛋白对照(即没有结合到珠子上的蛋白),剩余上清去除;清洗珠子:加500ul WB洗液4度2500g 2min,反复弃上清洗6到8次,每次轻弹管子将珠子混匀即可,最后一遍用黄枪头吸净;将珠子用剪过的枪头吸至新的1.5ml EP管中;
3、洗脱:加入50ul 0.2M glycine pH 2.5,轻弹30秒,4度2500g 2min,再吸出45ul上清液至新的管中,加入5ul 1M Tris base(pH 10.4)。
4、泛素化检测:利用上述3中洗脱的蛋白进行SDS-PAGE配置胶电泳,电泳后将胶块上的蛋白转膜至PVDF膜上,用脱脂奶粉封闭2小时,再用1xTBST洗膜3-5次;用3%的脱脂奶粉缓冲液20ml配置Anti-Ub一抗(货号:AUB01,品牌:Cytoskeleton),孵育1-2小时后,用1xTBST洗膜3-5次,最后用化学发光试剂盒ECL luminescence reagent(P0018AS,Beyotime)染色观察结果。
试剂配制:
Lysis buffer(CoIP):10mM Tris/Cl pH 7.5;150mM NaCl;0.5mM EDTA;0.5%NP-40
Wash buffer:10mM Tris/Cl pH 7.5;150mM NaCl;0.5mM EDTA
Elution buffer:200mM glycine pH 2.5
For neutralization:1M Tris base(pH 10.4)
实验结果显示,MoSec24-2在体内发生了泛素化,且该泛素化依赖于稻瘟病菌囊泡解聚因子MoSwa2的UBA功能域。当K560、K754两个泛素化位点突变后(ΔMosec24-2/MoSEC24-2
实施例4:稻瘟病菌MoSEC24-2基因缺失及点突变突变体致病力测定
1、采用稻瘟病菌孢子液喷雾接种水稻叶片的方法,具体方法如下:
1)首先诱导稻瘟病菌产生分生孢子,将CM培养基上的稻瘟病菌Guy11菌丝块接种到SDC培养基上,28℃黑暗培养4天,然后将表面菌丝刮掉,黑光灯下诱导3天,即可获得分生孢子。产孢培养基配置方法详见实施例1.2。
2)温室培养14天的水稻苗用于喷雾接种实验,收集上述SDC平板上的分生孢子4ml,浓度为5×10
3)统计发病面积和病斑数目。
4)每个处理重复三次。
2、采用稻瘟病菌孢子液注射接种水稻幼苗的方法,具体方法如下:
1)首先诱导稻瘟病菌产生分生孢子,具体方法见实施案例3.1。
2)温室培养20天的水稻苗用于接种实验,收集上述SDC平板上的分生孢子,浓度为1×10
3)统计发病面积和病斑数目。
4)每个处理重复三次。
水稻喷雾接种实验结果显示,ΔMosec24-2突变体和第313~351位氨基酸形成的功能域、第648-730位氨基酸形成的功能域片段的缺失突变体,以及K560R、K754R泛素化位点点突变(ΔMosec24-2/MoSEC24-2
实施例5:MoSEC24-2基因缺失突变体侵染菌丝扩展能力测定
稻瘟病菌侵染实验方法具体见实施例3。为了解释上述ΔMosec24-2突变体,以及K560R、K754R泛素化位点点突变突变体(ΔMosec24-2/MoSEC24-2
实施例6:MoSEC24-2基因缺失突变体无法抑制寄主活性氧的积累
DAB(3,3′-diamino-benzidine)染色方法:稻瘟病菌侵染水稻叶鞘方法具体见实施例4。侵染24小时后的水稻叶鞘,用1mg/ml的DAB(PH 3.5)染色,室温黑暗条件下染色8小时,再用乙醇/乙酸(94:4)脱色1h,用镊子撕取叶鞘内表皮进行显微观察。
利用DAB对侵染的水稻细胞进行活性氧(ROS)染色观察,实验结果显示在野生型菌株Guy11侵染的水稻叶鞘中,没有ROS的产生,而在ΔMosec24-2突变体侵染的水稻叶鞘细胞中积累了大量的ROS(图5中A);通过统计100个侵染位点分析发现,野生型只有不到15%的叶鞘有活性氧的产生,而突变体则超过50%的叶鞘细胞有活性氧的产生(图5中B)。结果表明MoSec24-2能够抑制寄主活性氧的产生,促进侵染菌丝扩展。
实施例7:赤霉病菌FgSEC24-2基因缺失及点突变突变体致病力测定
产孢培养基配置方法详见实施例1.2。诱导产孢方法详见4.1,其中SDC培养基改用PDA培养基。喷雾室中,用扬花期的小麦(栽培品种郑麦0943),通过注射野生型菌株PH-1和ΔFgsec24-2突变体孢子悬浮液(1×10
实验结果显示,ΔFgsec24-2突变体接种小麦穗子后发病的小穗数较野生型明显减少,并且病斑不能正常扩展(图6);这一结果说明FgSEC24-2基因调控镰刀菌致病力。
实施例8:炭疽病菌CgSEC24-2基因缺失及点突变突变体致病力测定
产孢培养基配置方法详见实施例1.2。诱导产孢方法详见3.1,其中SDC培养基改用PDA培养基。喷雾室中,用3叶苗期的大豆(栽培品种合丰47),通过注射野生型菌株SMCG1#C和ΔCgsec24-2突变体孢子悬浮液(1×10
实验结果显示,ΔCgsec24-2突变体接种大豆叶片后发病面积较野生型明显减少,并且病斑不能正常扩展(图7中A);经统计分析发现,突变体发病穗数均值为2,野生型和互补菌株均值为11(图7中B),这一结果说明CgSEC24-2基因调控镰刀菌致病力。
实施例9:利用稻瘟病菌、镰刀菌和炭疽菌Sec24-2作为靶标,设计和筛选杀菌剂
本试验利用AlphaFold2预测了稻瘟病菌、镰刀菌和炭疽菌Sec24-2蛋白的三级结构(图8),并利用AutoDockvina软件进行10万级别的小分子化合物库的筛选,本实施列将上述预测的Sec24-2三级结构的PDB文件和小分子化合物MOL2文件提交AutoDockvina软件,利用该软件的虚拟对接功能(包括结合自由能、RMSD值的计算,数值越低结合的可能性越大),成功筛选到一个能够结合并抑制Sec24-2功能的小分子化合物1438(结合自由能为-13.0kcal/mol,RMSD均值为
实施例10:化合物1438用于控制或预防植物病原性微生物侵染的方法
喷雾室中,用ChemBridgh公司订制合成的1438化合物和对照溶剂(DMSO)喷雾3叶苗期的水稻(感病品种CO39)、小麦(栽培品种郑麦0943)和大豆(栽培品种合丰47)。通过在施用后24小时喷雾孢子(1×10
实验结果显示化合物1438对稻瘟病具有显著防效,随着药剂浓度的增加,稻瘟病的发病面积显著下降(图9A),发病面积(DLA)统计数据显示不做药剂处理(DMSO)发病面积均值为近50%,100μM药剂1438处理发病面积均值为36%,200μM为30%,500μM为17%,1000μM为8%(图9中B),药剂处理导致发病面积显著下降;通过真菌生物量分析发现,不做药剂处理(DMSO)真菌生物量为25,100μM药剂1438处理后均值为18,200μM为15,500μM为8,1000μM为3(图9中B),表明化合物1438显著抑制了真菌在水稻中的生长。1438也表现出对炭疽病具有显著防效(图10中A),病斑直径统计数据显示不做药剂处理(DMSO)直径均值为2.4cm,200μM药剂1438处理病斑直径均值为1.6cm,500μM为1.2cm,1000μM为0.8cm(图10中B),可见药剂处理能够显著抑制炭疽病菌的侵染。同样的,1438也表现出对赤霉病具有显著防效(图10C),病穗数目统计显示不做药剂处理(DMSO)发病穗数均值为11,100μM药剂1438处理病穗数目均值为7,200μM为5,500μM为3,1000μM为2(图9中B),可见药剂处理能够显著抑制赤霉病菌的侵染。
这些结果表明化合物1438具有作为杀菌剂开发的潜力,对其骨架进行进一步的优化设计可望获得对不同病原真菌具有广谱杀菌活性的新型杀菌剂。
值得注意的是,通过NCBI blastP搜索,获得了不同真菌中Sec24-2蛋白的氨基酸序列,利用MEG7软件进行了进化树分析,并通过BioEdit软件进行序列的同源性分析,发现Sec24-2蛋白在不同病原真菌中高度保守(图10)。这一结果表明Sec24-2蛋白在不同真菌中可能具有与稻瘟病菌中相似的功能,能够调控真菌的致病力。因此本发明所述用途理应不限于以上实施例中提供的病原菌,可扩展至进化树中列举的相关真菌,如核盘菌(Sclerotinia)、曲霉病菌(Aspergillus)、全蚀病菌(Gaeumannomyces)、轮枝病菌(Verticillium)、葡萄孢病菌(Botrytis)和粗糙脉孢霉病菌(Neurospora)等。
最后,需要注意的是,以上列举的仅是本发明的若干个具体实施案列。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 型钢混凝土墙梁斜向节点加腋的施工方法
- 一种梁端加腋型钢混凝土梁柱节点的施工方法
