肠神经前体细胞的制造方法
文献发布时间:2024-04-18 20:00:50
本申请是申请号为201980055151.8的中国专利申请(申请日:2019年8月21日,发明名称:肠神经前体细胞的制造方法)的分案申请。
技术领域
本发明涉及肠神经前体细胞的制造方法和扩大培养方法以及这些方法中使用的培养基。
背景技术
神经嵴细胞(Neural Crest Cell:NCC)是在早期发育阶段由神经板形成神经管时,从神经外胚层与表皮外胚层之间产生的细胞。肠神经前体细胞(Enteric NeuralPrecursor:ENP)是从该NCC产生,并分化为肠神经细胞系的细胞。ENP具有分化为肠神经细胞和胶质细胞的分化能力。
作为先天性肠神经节细胞缺乏症引起的疾病,存在呈现消化管运动抑制现象的先天性巨结肠(Hirschsprung)症。近年来,报道了旨在通过对取自患者并在体外增殖的ENP进行自体移植从而治疗先天性巨结肠症的基础性尝试(非专利文献1)。
为了制造包含ENP的细胞药品,正在研究由诱导性多能干细胞(induciblePluripotent Stem Cell:iPSC)等多能干细胞诱导NCC,进而由NCC诱导ENP。
例如,非专利文献2中记载了由人多能干细胞制作肠神经系统前体细胞(entericnervous system progenitor)。非专利文献2中未示出PHOX2B阳性的肠神经前体细胞,也没有记载有关神经调蛋白1(Neuregulin-1:NRG1)的内容。
此外,非专利文献3中记载了通过在包含TGFβ抑制剂、GSK3β抑制剂以及NRG1的培养基培养人iPSC,从而制作雪旺氏前体细胞(Schwann cell precursor)。非专利文献3中记载的方法未使用视黄酸,所获得的雪旺氏前体细胞是不同于ENP的细胞(例如,ENP的PHOX2B表达为阳性,然而该文献中记载的雪旺氏前体细胞为阴性)。
现有技术文献
非专利文献
非专利文献1:“Postnatal human enteric neuronal progenitors canmigrate,differentiate,and proliferate in embryonic and postnatal aganglionicgut environments”Pediatric Research,2017,81,5,838-846。
非专利文献2:“Deriving human ENS lineages for cell therapy and drugdiscovery in Hirschsprung disease”Nature,2016,531,105-109。
非专利文献3:“Schwann Cell Precursors from Human Pluripotent StemCells as a Potential Therapeutic Target for Myelin Repair”,Stem Cell Reports,2017,8,1714-1726。
发明内容
发明要解决的问题
为了实现使用了ENP的细胞治疗等,需要能够大量提供ENP的技术。如上所述,虽然报道了由人多能干细胞诱导肠神经系统前体细胞(enteric nervous system progenitor)的方法(非专利文献2),但是至今还未开发出用于使诱导后的ENP增殖并进行扩大培养的方法。
本发明的主要目的在于,提供一种用于维持ENP的分化为肠神经细胞和胶质细胞的分化能力(多能(multipotency)),同时使其增殖的技术。
用于解决问题的手段
为了解决上述问题,本发明提供以下[1]至[27]。
[1]一种肠神经前体细胞的制造方法,包括以下工序:工序(A1),提供肠神经前体细胞;以及工序(A2),在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养肠神经前体细胞。
[2]根据[1]所述的制造方法,其中,
所述培养基还包含TGFβ抑制剂和GSK3β抑制剂。
[3]根据[1]或[2]所述的制造方法,其中,
所述培养基还包含视黄酸和/或其衍生物。
[4]根据[1]至[3]中任一项所述的制造方法,其中,
所述培养基还包含GDNF。
[5]根据[1]至[4]中任一项所述的制造方法,其中,
所述培养基还包含基质胶。
[6]根据[1]至[5]中任一项所述的制造方法,其中,
所述ERBB3激动剂和/或ERBB4激动剂为NRG1。
[7]一种肠神经前体细胞,其通过[1]至[6]中任一项所述的制造方法获得。
[8]一种冷冻储备物,包含[7]所述的肠神经前体细胞。
[9]一种细胞药品,包含[7]所述的肠神经前体细胞。
[10]一种肠神经前体细胞的制造方法,包括以下工序:工序(B1),提供神经嵴细胞;以及工序(B2),在包含ERBB3激动剂和/或ERBB4激动剂以及视黄酸和/或其衍生物的培养基中培养神经嵴细胞。
[11]根据[10]所述的制造方法,其中,
所述神经嵴细胞为迷走神经嵴细胞。
[12]根据[11]所述的制造方法,其中,
所述迷走神经嵴细胞为SOX10阳性、HOXB5阳性、HOXB9阴性且PHOX2B阴性,所述肠神经前体细胞为SOX10阳性且PHOX2B阳性。
[12a]根据[10]至[12]所述的制造方法,其中,
所述培养基还包含TGFβ抑制剂和/或GSK3β抑制剂。
[12b]根据[10]至[12a]中任一项所述的制造方法,其中,
所述培养基还包含视黄酸和/或其衍生物。
[12c]根据[10]至[12b]中任一项所述的制造方法,其中,
所述培养基还包含GDNF。
[12d]根据[10]至[12c]中任一项所述的制造方法,其中,
所述培养基还包含基质胶。
[12e]根据[10]至[12d]中任一项所述的制造方法,其中,
所述ERBB3激动剂和/或ERBB4激动剂为NRG1。
[12f]一种肠神经前体细胞,其通过[10]至[12e]中任一项所述的制造方法获得。
[13]一种肠神经前体细胞培养基,包含ERBB3激动剂和/或ERBB4激动剂。
[14]根据[13]所述的培养基,其中,
所述培养基还包含TGFβ抑制剂和/或GSK3β抑制剂。
[15]根据[13]或[14]所述的培养基,其中,
所述培养基还包含视黄酸和/或其衍生物。
[16]根据[13]至[15]中任一项所述的培养基,其中,
所述培养基还包含GDNF。
[17]根据[13]至[16]中任一项所述的培养基,其中,
所述培养基还包含基质胶。
[18]根据[13]至[17]中任一项所述的培养基,其中,
所述ERBB3激动剂和/或ERBB4激动剂为NRG1。
[19]一种肠神经前体细胞的扩大培养方法,包括以下工序:工序(C1),提供肠神经前体细胞;以及工序(C2),在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养肠神经前体细胞。
[20]一种肠道类器官的制造方法,包括对肠神经前体细胞和后肠细胞进行共培养的工序。
[21]一种人造肠的制造方法,包括:
通过对肠神经前体细胞和后肠细胞进行共培养从而获得肠道类器官的工序;以及
将所述肠道类器官移植至生物体内而形成人造肠的工序。
[21a]一种人造肠的制造方法,包括:
通过对肠神经前体细胞和后肠细胞进行共培养从而获得肠道类器官的工序;以及
将所述肠道类器官移植至人以外的哺乳动物的生物体内而形成人造肠的工序。
[22]根据[20]至[21a]所述的制造方法,其中,
所述肠神经前体细胞为通过[1]至[6]中任一项所述的制造方法获得的肠神经前体细胞。
[23]一种肠道类器官,其通过[20]或[22]所述的制造方法获得。
[24]一种人造肠,其通过[21]至[22]中任一项所述的制造方法获得。
[25]一种用于肠神经前体细胞培养基的添加剂,包含ERBB3激动剂和/或ERBB4激动剂。
[26]一种ERBB3激动剂和/或ERBB4激动剂的应用,用于肠神经前体细胞的扩大培养。
[27]根据[25]所述的添加剂或[26]所述的应用,其中,
所述ERBB3激动剂和/或ERBB4激动剂为NRG1。
在本发明中,“神经嵴细胞(Neural Crest Cell:NCC)”是指在早期发育阶段由神经板形成神经管时从神经外胚层与表皮外胚层之间产生的细胞,具有能够分化为神经细胞、胶质细胞、间充质基质细胞、骨细胞、软骨细胞、角膜细胞以及黑色素细胞等许多种类的细胞的多能(multipotency)和自我增殖能力。NCC为SOX10阳性。
“脑神经嵴细胞(Cranial NCC)”是指,在发育阶段先于耳泡而从脑部开始产生并分化为脸部的骨头、软骨以及神经等的细胞群。脑神经嵴细胞作为神经嵴细胞标记的SOX10为阳性、HOXB基因组(HOXB1-10)为阴性的细胞。
“迷走神经嵴细胞(Vagal NCC)”是指在发育阶段从相当于体节第1节至第7节的部位产生并分化为肠神经系统等的细胞群。迷走神经嵴细胞是作为神经嵴细胞神经嵴细胞标记的的SOX10为阳性、HOXB5为阳性、HOXB9为阴性且PHOX2B为阴性的细胞。优选的是,SOX10为阳性、HOXB1-7为阳性、HOXB9为阴性、HOXB10为阴性、且PHOX2B为阴性。
“躯干神经嵴细胞(Trunk NCC)”是指在发育阶段从相当于体节第8节至尾部的部位产生并分化为自主神经系统、感觉神经、黑色素细胞以及肾上腺髓质的嗜铬细胞等的细胞群。躯干神经嵴细胞是作为神经嵴细胞标记的SOX10为阳性、HOXB1-9为阳性、HOXB10为阴性且PHOX2B为阴性的细胞。
“骶椎神经嵴细胞(Sacral NCC)”是指在发育阶段从相当于最尾部的部位产生并分化为大肠的部分肠神经系统等的细胞群。骶椎神经嵴细胞是作为神经嵴细胞标记为SOX10阳性,HOXB1至HOXB10阳性且PHOX2B阴性的细胞。
“肠神经前体细胞(Enteric Neural Precursor:ENP)”是指,由迷走神经嵴细胞和骶椎神经嵴细胞分化,且作为神经嵴细胞以及胶质细胞标记的SOX10为阳性且PHOX2B为阳性的细胞。ENP具有分化为PHOX2B阳性且SOX10阴性的肠神经细胞、以及S100β阳性、PLP1阳性且SOX10阳性的胶质细胞的分化能力。
“肠神经细胞”是指来源于肠神经前体细胞,并且PHOX2B阳性且SOX10阴性的细胞。
“胶质细胞”是指S100β阳性、PLP1阳性且SOX10阳性,或者GFAP阳性的细胞。在本说明书中,胶质细胞有时特指“肠胶质细胞”。肠胶质细胞可以通过例如使肠神经前体细胞分化为胶质细胞的方式获得。
“肠神经前体细胞培养基”是指在ENP的制造和/或ENP的扩大培养中使用的培养基。ENP的制造可以包括使iPS细胞、ES细胞以及NCC等干细胞分化为ENP的步骤。
“肠道类器官”是指在生物体外制作的组织结构体,具有人等哺乳动物的肠所具有的多种功能(例如蠕动运动功能、粘液分泌功能、物质吸收功能等)或者与这些功能类似的一种以上的功能的组织结构体。肠道类器官由包含例如后肠细胞、前肠细胞等构成肠道的各种细胞来源的细胞、以及后肠细胞、前肠细胞、肠神经细胞、肠神经前体细胞、肠干细胞(LGR5阳性)、潘氏细胞(LYZ阳性)、杯状细胞(Mucin阳性)和分泌细胞等构成肠道的各种细胞、以及选自这些细胞来源的细胞中的至少一种细胞的细胞群构成。
“人造肠”是指将肠道类器官移植至人或人以外的哺乳动物的生物体内并使其成熟而获得的组织结构体,具有人等哺乳动物的肠所具有的多种功能(例如蠕动运动功能、粘液分泌功能、物质吸收功能等)或者与这些功能类似的一种以上的功能的组织结构体。人造肠通过例如将肠道类器官移植至小鼠等哺乳动物的体内(例如腹腔内)并经过规定时间段的方式制作。人造肠是包含例如后肠细胞、前肠细胞等构成肠道的各种细胞来源的细胞、以及后肠细胞、前肠细胞、肠神经细胞、肠神经前体细胞、肠干细胞(LGR5阳性)、潘氏细胞(LYZ阳性)、杯状细胞(Mucin阳性)和分泌细胞等构成肠道的各种细胞、以及选自这些细胞来源的细胞中的至少一种细胞的细胞群。进一步,人造肠还可以包含例如肌细胞以及起搏细胞等,这种情况下,神经细胞被放置在肌细胞之间。
“后肠细胞”是在发育过程中由内胚层分化的细胞,其特征在于CDX2阳性。除后肠细胞之外,后肠细胞块还可以包含上皮细胞(E-钙黏着蛋白阳性)以及间充质细胞(波形蛋白阳性)。
“胚体内胚层”是在发育过程中由前原条分化的细胞,其特征在于SOX17阳性且FOXA2阳性。
“ERBB3”是指由ERBB3基因编码的酪氨酸激酶受体,是EGF受体家族的一种。也称为HER3(human epidermal growth factor receptor 3,人表皮生长因子受体3)。ERBB3与ERBB2形成异二聚体,激活与细胞的增殖、分化相关的信号通路。已知ERBB3在肠神经前体细胞中表达。已知ERBB3存在剪接变体,然而本发明中的ERBB3包括但不特别限定于这些变体。
“ERBB3激动剂”只要是与ERBB3结合并具有激活其下游的信号通路的能力(ERBB3激动剂活性)的物质即可,也可以是蛋白质、肽、核酸和低分子化合物以及它们的衍生物等。ERBB3激动剂包括例如NRG1、NRG2以及NRG6等蛋白质。NRG1、NRG2以及NRG6等蛋白质可以是全长蛋白,也可以是具有ERBB3激动剂活性的蛋白质片段。
“ERBB4”是指由ERBB4基因编码的酪氨酸激酶受体,是EGF受体家族的一种。也称为HER4(human epidermal growth factor receptor 4,人表皮生长因子受体4)。ERBB4与ERBB2形成异二聚体,激活与细胞的增殖、分化相关的信号通路。已知ERBB4存在各种剪接变体,然而本发明中的ERBB4包括但不特别限定于这些变体。
“ERBB4激动剂”只要是与ERBB4结合并具有激活其下游的信号通路的能力(ERBB4激动剂活性)的物质即可,也可以是蛋白质、肽、核酸和低分子化合物以及它们的衍生物等。ERBB4激动剂包括例如NRG1、NRG2、NRG3、NRG4、NRG5、BTC、EPR以及HBEGF等蛋白质。NRG1-5、BTC、EPR以及HBEGF等蛋白质可以是全长蛋白,也可以是具有ERBB4激动剂活性的蛋白质片段。
“神经调蛋白1(Neuregulin-1:NRG1)”是指由NRG1基因编码的EGF样生长因子。也称为调蛋白。已知其与ERBB3以及ERBB4结合,激活其下游的信号通路。
“胶质细胞源性神经营养因子(Glial cell line Derived NeurotrophicFactor:GDNF)”是指由GDNF基因编码的因子,其作为GFRα1和RET的激动剂发挥作用。已知其涉及神经细胞和胶质细胞的保护、肠神经前体细胞的增殖。
“基质胶”是从富含细胞外基质蛋白的Engelbreth-Holm-Swarm(EHS)小鼠肉瘤中提取的可溶性基底膜制备品,主要组分为层粘连蛋白、IV型胶原、硫酸乙酰肝素蛋白聚糖、以及巢蛋白/触觉蛋白1,它们包含TGFβ、上皮细胞生长因子(EGF)、胰岛素样生长因子(IGF)、成纤维细胞生长因子(FG F)、组织型纤溶酶原激活因子3和组织型纤溶酶原激活因子4、以及在Engelb reth-Holm-Swarm(EHS)肿瘤中自然产生的其他生长因子。
“培养”是指在体外环境中使细胞维持、增殖(成长)、和/或使其分化。“进行培养”是指在组织外或体外,例如在细胞培养皿或烧瓶中使细胞维持、增殖(成长)和/或分化。
“扩大培养”是指以使所需的细胞群增殖,并使细胞数量增加为目的进行培养。细胞数量的增加只要是通过使细胞的增殖引起的数量增加超过死亡引起数量减少来达成即可,不需要使细胞群的所有细胞增殖。与扩大培养开始前相比,细胞数量的增加可以为1.1倍、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍以上。
“维持培养”是指对所需的细胞群进行培养同时维持其数量。细胞数量的维持可以通过使细胞存活而不增殖的方式达成,也可以通过使细胞的增殖引起的数量增加与死亡引起的数量减少拮抗的方式达成。细胞数量的维持不需要使细胞数量被维持为完全相同,只要遵照本发明的目的使细胞数量被维持为基本相同即可。
“细胞群”是指相同种类或不同种类的2种以上的细胞。“细胞群(population)”也指相同种类或不同种类的细胞的块(mass)。
“粘附培养”是指在使细胞附着于容器的状态下,例如在适当的培养基的存在下使细胞附着于灭菌塑料(或经涂布的塑料)的细胞培养皿或烧瓶的状态下进行培养。
“悬浮培养”是指在不使细胞附着于容器而是分散于适当的培养基中的状态下进行培养。
“多能(pluripotency)”是指能够分化为各种具有不同形态或功能的组织或细胞,且能够分化为三胚层的任一层的细胞的能力。“多能(pluripotency)”不能够分化为胚盘,因此从不具有形成个体的能力的角度来看,区别于能够分化为包括胚盘的生物体的所有组织的“全能(totipotency)”。
“多能(multipotency)”是指能够分化为多个有限数量的层的细胞的能力。例如,间充质干细胞、造血干细胞、神经干细胞为多潜能(multipotency),而非多能(pluripotency)。ENP具有分化为神经细胞和胶质细胞的多能(multipotency)。
“标记”是指“标记蛋白质”或“标记基因”,是在特定的细胞型中细胞表面、细胞质内和/或细胞核内等特异性表达的蛋白或其基因。标记可为阳性选择标记或阴性选择标记。优选的是,标记为细胞表面标记、特别是细胞表面阳性选择标记时,可实施活细胞的浓缩、分离和/或检测。
标记蛋白的检测可利用对该标记蛋白具有特异性的抗体进行免疫学分析来实施,所述免疫学分析例如为ELISA、免疫染色、流式细胞术等。可以使用与标记蛋白质中的特定氨基酸序列或结合了标记蛋白质的特定糖链等结合的抗体,作为针对标记蛋白质的特异性抗体。此外,对于表达于细胞内、且不出现在细胞表面的标记蛋白(例如转录因子或其亚单位等)而言,可使该标记蛋白与报告蛋白一起表达,并通过检测该报告蛋白来检测作为对象的标记蛋白(例如非专利文献4)。该方法在无法确定适当的细胞表面标记时可优选使用。标记基因的检测可利用该领域公知的核酸扩增方法和/或核酸检测方法来实施,所述方法例如为RT-PCR、微阵列、生物芯片及RNAseq等。
“表达(expression)”是指由细胞内的启动子所驱动的特定的核苷酸序列的转录和/或翻译。
“阳性(positive)”或者“表达”是指蛋白质或基因以利用该领域公知的方法而能够检测的量进行表达。蛋白质的检测可以利用使用了抗体的免疫学分析来进行,所述免疫学分析为例如ELISA、免疫染色、流式细胞术。此外,对于表达于细胞内、且不出现在细胞表面的蛋白(例如转录因子或其亚单位等)而言,可使该蛋白与报告蛋白一起表达,并通过检测该报告蛋白来检测作为对象的蛋白。基因的检测可以利用例如RT-PCR、微阵列、生物芯片及RNAseq等核酸扩增方法和/或核酸检测方法来进行。
“阴性(negative)”或者“不表达”是指蛋白质或基因的表达量小于上述公知方法的全部或者任一检测下限值。蛋白质或基因的表达的检测下限值可根据各方法的不同而不同。
“SOX10”在所有神经嵴细胞、肠神经前体细胞以及肠神经前体细胞来源的胶质细胞中表达。另一方面,SOX10在肠神经细胞中不表达。
已知“HOXB5”在迷走神经嵴细胞、躯干神经嵴细胞以及骶椎神经嵴细胞中表达,且是肠神经细胞的正常发育所必须的。另一方面,HOXB5在脑神经嵴细胞中不表达。
“HOXB9”在躯干神经嵴细胞和骶椎神经嵴细胞中表达。另一方面,HOXB9在脑神经嵴细胞和迷走神经嵴细胞中不表达。
“PHOX2B”在肠神经前体细胞和肠神经前体细胞来源的肠神经细胞中表达。
“GFAP(Glial fibrillary acidic protein,胶质原纤维酸性蛋白)”在胶质细胞中表达。另一方面,GFAP在肠神经前体细胞和肠神经细胞中不表达。
“包括/包含(comprise(s)或comprising)……”是指表示包括/包含但不限于该语句之后的要素。因此,建议包括/包含该短语之后要素,但不建议排除任何其他要素。
“约”或“大致”表示相对于基准值分别在正或负30%、25%、20%、15%、10%、8%、6%、5%、4%、3%、2%或1%内波动的值。优选的是,术语“约”或“大致”表示相对于基准值分别为正或负15%、10%、5%或1%的范围。
发明的效果
通过本发明,提供一种用于维持ENP分化为肠神经细胞和胶质细胞的分化能力的同时使其增殖的技术。
附图说明
图1是示出本发明的第二实施方式涉及的ENP的制造方法的工序的一个例子的图。
图2是示出由人iPSC分化得到的迷走神经嵴细胞的基因表达分布图的图。图2(A)示出了HOXB2、HOXB3、HOXB4、HOXB5、HOXB7以及HOXB9的表达量,图2(B)示出了SOX10和EDNRB的表达量。纵轴通过将脑神经嵴细胞中的表达量设为1而得到的比以log2表示的值示出了表达量(差异倍数,Fold change)。
图3是示出在肠神经前体细胞培养基中对迷走神经嵴细胞进行继代培养时的总细胞数量(accumulated cell number)的经时变化的图。
图4是示出在肠神经前体细胞培养基中对迷走神经嵴细胞进行培养而得到的细胞的流式细胞术分析结果的图。图4(A)示出了培养第11天的迷走神经嵴细胞中的SOX10-tdTomato和PHOX2B-emGFP的表达,图4(B)示出了继代次数(1次至6次)的肠神经前体细胞中的SOX10-tdTomato和PHOX2B-emGFP的表达。
图5是示出在肠神经前体细胞培养基中或者从该培养基中去除NRG1或GDNF后的培养基中对迷走神经嵴细胞进行培养而获得的细胞的荧光图像和利用流式细胞术得到的SOX10-tdTomato和PHOX2B-emGFP的表达分析结果的图。在荧光图像中,红色表示SOX10-tdTomato的荧光,绿色表示PHOX2B-emGFP的荧光。
图6是示出在肠神经前体细胞培养基中对迷走神经嵴细胞进行培养而获得的细胞的基因表达分布图的图。EDNRB和RET分别表示“内皮素B型受体”和“ret原癌基因”。
图7为在肠神经诱导培养基中培养肠神经前体细胞而获得的细胞的荧光免疫染色图像。在荧光免疫染色图像中,绿色表示PHOX2B-emGFP的荧光,紫色表示ChAT、nNOS、GABA或者5-HT的表达。
图8为由肠道类器官形成的人造肠的荧光免疫染色图像,示出了PHOX2B-emGFP和SOX10-tdTomato阳性的肠神经前体细胞来源的细胞。右上段图像是左上段图像的局部放大,右下段图像为左下段图像的局部放大。在荧光免疫染色图像中,红色表示SOX10-tdTomato的荧光,绿色表示PHOX2B-emGFP的荧光,蓝色表示细胞核。
图9为由肠道类器官形成的人造肠的荧光免疫染色图像,示出了肠神经前体细胞来源的S100β阳性(A)、GFAP阳性(B)或TUBB3(C)阳性的神经细胞或者胶质细胞。在荧光免疫染色图像中,红色表示SOX10-tdTomato的荧光,绿色表示PHOX2B-emGFP的荧光,黄色表示S100β、GFAP或TUBB3的表达,蓝色表示细胞核。
图10是示出由肠道类器官形成的人造肠针对电刺激的收缩舒张反应的测量结果的图表。
图11是示出由肠道类器官形成的人造肠针对电刺激的收缩舒张反应的测量结果的图表。
图12是示出由肠道类器官形成的人造肠针对电刺激的收缩舒张反应的测量结果的图表。
图13示出了扩大培养后进行了冻融的肠神经前体细胞的增殖能力和分化能力的评价结果。图13(A)示出了扩大培养时的细胞数量的经时变化(左图),肠神经前体细胞占全部细胞的比例的经时变化(右图)。图13(B)示出了通过流式细胞术对肠神经前体细胞(ENP,左图)以及由肠神经前体细胞分化得到的肠神经细胞(ENS,右图)中的PHOX2B和SOX10的表达进行分析得到的结果。图13(C)示出了由肠神经前体细胞分化得到的肠神经细胞和胶质细胞的荧光免疫染色图像。在荧光免疫染色图像中,绿色表示PHOX2B-emGFP的荧光或者GFAP的表达,紫色表示Peripherin、ChAT、nNOS、GABA、TH或SST的表达。
图14为由扩大培养后的肠神经前体细胞分化得到的胶质细胞的荧光免疫染色图像。
图15为将扩大培养后的肠神经前体细胞移植至小鼠盲肠壁经过一星期后的移植部位的荧光免疫染色图像。在荧光免疫染色图像中,蓝色表示细胞核,绿色表示PHOX2B-emGFP的荧光,红色表示SOX10-tdTomato的荧光,紫色表示TUBB3的表达。图15(b)是图15(a)的局部放大。
具体实施方式
下面,对用于实施本发明的适宜的方式进行说明。另外,以下说明的实施方式用于示出本发明的代表性的实施方式的一个例子,本发明的范围不因此而被狭义地解释。
本发明人等发现,通过在ERBB3激动剂和/或ERBB4激动剂的存在下培养肠神经前体细胞(ENP),从而可在维持ENP分化为肠神经细胞和胶质细胞的分化能力同时使其增殖。
基于此认知,作为第一实施方式,本发明提供一种ENP的制造方法,所述制造方法包括以下工序(A1)以及工序(A2)。
工序(A1),提供ENP;以及
工序(A2),在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养ENP。
在工序(A2)中,ENP进行增殖,从这个角度来看,第一实施方式涉及的ENP的制造方法与ENP的扩大培养方法同义。
在本发明涉及的ENP的制造方法中,ENP也可以是由神经嵴细胞(NCC)分化并增殖得到的细胞。从这个角度来看,作为第二实施方式,本发明提供一种ENP的制造方法,包括以下工序(B1)以及工序(B2)。
工序(B1),提供NCC;以及
工序(B2),在包含ERBB3激动剂和/或ERBB4激动剂以及视黄酸和/或其衍生物的培养基中培养NCC。
作为第三实施方式,本发明提供一种ENP的扩大培养方法,包括以下工序(C1)以及工序(C2)。
工序(C1),提供ENP;以及
工序(C2),在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养ENP。
下面,依次对第一实施方式涉及的ENP的制造方法的工序(A1)以及工序(A2)、第二实施方式涉及的ENP的制造方法的工序(B1)以及工序(B2)、以及第三实施方式涉及的ENP的扩大培养方法的工序(C1)以及工序(C2)进行说明。
[第一实施方式涉及的制造方法(包括ENP的增殖工序的方法)]
〔第一实施方式工序(A1):提供肠神经前体细胞的工序〕
在该工序中,提供ENP。该工序至少提供ENP即可,也可以提供单一的ENP细胞、ENP的细胞群或者包含ENP的细胞群。
该工序中提供的ENP可以是市售获得的ENP,也可以是从生物体中分离的ENP,还可以是通过后述的方法由NCC等诱导得到的ENP。市售获得的ENP可以是处于培养状态的ENP,也可以是处于冷冻状态的ENP。此外,在ENP为由NCC等诱导的ENP的情况下,也可以是处于培养状态的ENP,也可以是处于冷冻状态的ENP。
作为从生物体分离ENP的方法,已知例如将肠道组织切割成1mm见方,并实施酶处理(分散酶和XI型胶原酶,37℃,90分钟)后,将获得的细胞在包含EGF和FGF的培养基中培养,并分离ENP作为凝集细胞的方法等。在分离时,组合基于抗CD271抗体的细胞分选,也能够提高ENP的纯度。
〔第一实施方式工序(A2):培养肠神经前体细胞的工序〕
在该工序中,在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养ENP。
ERBB3激动剂只要是具有与ERBB3结合并激活其下游的信号通路的能力(ERBB3激动剂活性)的物质即可,也可以是蛋白质、肽、核酸和低分子化合物以及它们的衍生物等。ERBB3激动剂包括例如NRG1、NRG2以及NRG6等蛋白质。NRG1、NRG2以及NRG6等蛋白质可以是全长蛋白,也可以是具有ERBB3激动剂活性的蛋白质片段。
ERBB4激动剂只要是具有与ERBB4结合并激活其下游的信号通路的能力(ERBB4激动剂活性)的物质即可,也可以是蛋白质、肽、核酸和低分子化合物以及它们的衍生物等。ERBB4激动剂包括例如NRG1、NRG2、NRG3、NRG4、NRG5、BTC、EPR以及HBEGF等蛋白质。NRG1-5、BTC、EPR以及HBEGF等蛋白质可以是全长蛋白,也可以是具有ERBB4激动剂活性的蛋白质片段。
NRG1、NRG2、NRG3、NRG4、NRG5、NRG6、BTC、EPR以及HBEGF等蛋白质中,按照作为培养对象的细胞来源种类,适当使用人来源的蛋白质、或者例如猴、猪、牛、山羊、绵羊、小鼠、大鼠等人以外的哺乳动物来源的蛋白质。
这些蛋白质可以使用通常的分子生物学方法作为重组蛋白质而制备,还可以作为市售的试剂而获得。
ERBB3激动剂和ERBB4激动剂优选为它们的片段,此类片段具有NRG1或者ERBB3激动剂活性或ERBB4激动剂活性。
序列号1(NCBI Accession number:NP_039250)示出了人NRG1的全长氨基酸序列。
作为具有ERBB3激动剂活性或ERBB4激动剂活性的NRG1的片段,可例举出由序列号1的氨基酸序列产生的、例如氨基酸数量为10至300、20至150、或者30至100的片段。
NRG1的片段可以为包含例如针对ERBB3或ERBB4的结合域(EGF-like domain)的片段。结合域为序列号1中的氨基酸序号190至220。
NRG1及其片段可以使用通常的分子生物学方法作为重组蛋白质而制备,还可以作为市售的试剂而获得。包含针对ERBB3或ERBB4的结合域(EGF-like domain)的NRG1片段可以由市售获得(例如,重组人调蛋白β-1,目录号:100-03,PEPROTECH)。
在序列号1所述的氨基酸序列或其部分序列中,NRG1或其片段也可以由缺失、取代、插入或者添加了一个或多个氨基酸的修饰氨基酸序列构成,且具有ERBB3激动剂活性或ERBB4激动剂活性的物质。
这里,多个是指20个以下,优选为10个以下,更优选为5个以下,进一步优选为3个以下,最优选为2个。
作为修饰氨基酸序列,可以是针对序列号1的氨基酸序列具有80%以上、优选为85%以上、更优选为90%以上、进一步优选为95%以上、最优选为98%以上的同一性的氨基酸序列。氨基酸序列的同一性可以利用通用的分析工具进行计算,例如可以利用美国国家生物信息中心(NCBI)提供的BLAST。
此外,在可保持ERBB3激动剂活性或ERBB4激动剂活性的前提下,NRG1或其片段也可以是与其它蛋白质之间的融合蛋白或者与其它分子结合的修饰蛋白。
有关蛋白质片段等的ERBB3激动剂活性或ERBB4激动剂活性的评价可以使用市售的试剂盒来进行检测。例如使用PathHunter(注册商标)ERBB2-ERBB3功能检测或者PathHunter(注册商标)ERBB4功能检测(均来自DiscoverX公司),在各种浓度的激动剂候选物质存在下对试剂盒中包含的细胞株进行培养后测量β-半乳糖苷酶活性。β-半乳糖苷酶活性显示高值的候选物质具有激动剂活性。
对于该工序中的培养基中的ERBB3激动剂和/或ERBB4激动剂的浓度而言,可根据所添加的ERBB3激动剂和/或ERBB4激动剂的种类进行适当地调整,可以为例如1ng/mL至1000ng/mL、优选为50ng/mL至200ng/mL。
使用NRG1作为ERBB3激动剂和/或ERBB4激动剂的情况下,其在培养基中的浓度可以为例如1ng/mL至1000ng/mL、优选为50ng/mL至200ng/mL、特别优选为约100ng/mL。
培养基也可以包含TGFβ抑制剂和GSK3β抑制剂。
“TGFβ抑制剂”是指对于TGFβ(转化生长因子β)具有抑制活性的物质。TGFβ是与2种丝氨酸/苏氨酸蛋白激酶型受体结合的细胞因子,通过以Smad(R-Smad)的激活为主的信号传导来控制细胞增殖、细胞分化、细胞死亡等。作为具有TGFβ抑制活性的物质,可例举出抑制TGFβ与其受体结合的物质、或者抑制TGFβ结合至受体后的下游信号的物质。作为该下游信号,可列举TGFβII型受体所致的TGFβI型受体的磷酸化、磷酸化TGFβI型受体所致的Smad的磷酸化等。本发明中使用的“TGFβ抑制剂”只要具有TGFβ抑制活性则没有特别限定。
作为TGFβ抑制剂,可例举出SB431542(4-[4-(1,3)苯并二噁-5-基)-5-(2-吡啶基)-1H-咪唑-2-基]-苯甲酰胺)、A83-01(4-[4-(1,3-苯并二噁-5-基)-5-(2-吡啶基)-1H-咪唑-2-基]-苯甲酰胺)、LDN193189(4-[6-[4-(1-哌嗪基)苯基]吡唑并[1,5-a]嘧啶-3-基]-喹啉)、GW788388(4-[4-[3-(吡啶-2-基)-1H-吡唑基-4-基]-吡啶-2-基]-N-(四氢-2H-吡喃-4-基)苯甲酰胺)、SM16(4-[4-(1,3-苯并二噁-5-基)-5-(6-甲基-2-吡啶基)-1H-咪唑-2-基]-双环[2.2.2]辛烷-1-甲酰胺)、IN-1130(3-[[5-(6-甲基-2-吡啶基)-4-(6-喹噁啉基)-1H-咪唑-2-基]甲基]-苯甲酰胺)、GW6604(2-苯基-4-[3-(吡啶-2-基)-1H-吡唑-4-基]吡啶)、以及SB505124(2-(4-(1,3-苯并二噁-5-基)-2-(1,1-二甲基乙基)-1H-咪唑-5-基)-6-甲基吡啶)等。可组合使用其中的2种以上。
对于该工序中的培养基中的TGFβ抑制剂的浓度而言,可根据所添加的TGFβ抑制剂的种类进行适当地调整,但可以为例如0.1μM至50μM、优选为1μM至20μM。
在使用SB431542(4-[4-(1,3-苯并二噁-5-基)-5-(2-吡啶基)-1H-咪唑-2-基]-苯甲酰胺)作为TGFβ抑制剂的情况下,其在培养基中的浓度可以为例如1μM至100μM、优选为5μM至20μM、特别优选为约10μM。
“GSK3β抑制剂”是对GSK3β(糖原合酶激酶3β)具有抑制活性的物质。GSK3(糖原合酶激酶3)是一种丝氨酸/苏氨酸蛋白激酶,并参与许多与糖原产生、细胞凋亡、干细胞维持等有关的信号通路。GSK3具有α和β两种亚型。本发明中使用的“GSK3β抑制剂”只要具有GSK3β抑制活性就没有特别限制,可以是兼具GSK3β抑制活性和GSK3α抑制活性的物质。
作为GSK3β抑制剂,可例举出CHIR98014(N
GSK3β抑制剂不限于此,也可使用针对GSK3β的mRNA的反义寡核苷酸或siRNA、结合GSK3β的抗体、显性负GSK3β变异体等作为GSK3β抑制剂,上述物质可通过商业手段获得,或可根据公知的方法合成。
对于该工序中的培养基中的GSK3β抑制剂的浓度而言,可根据所添加的GSK3β抑制剂的种类进行适当地调整,但可以为例如0.1μM至10μM、优选为0.5μM至20μM。
在使用CHIR99021作为GSK3β抑制剂的情况下,其在培养基中的浓度可以为例如0.1μM至10μM、优选为0.5μM至2μM、特别优选为约1μM。
该工序中的培养基还可以包含视黄酸(RA)和/或其衍生物(以下,有时仅称为“RA等”)、胶质细胞来源神经营养因子(GDNF)、以及基质胶中的任一种以上。
作为视黄酸(RA)的衍生物,可使用视黄醇、视黄醛、维A酸、异维A酸、阿利维A酸、阿维A酯、阿曲丁、他扎罗汀、贝沙罗汀、阿达帕林。可组合使用其中的2种以上。
对于该工序中的RA等在培养基中的浓度而言,可根据所添加的RA等的种类进行适当调整,但可以为例如0.001μM至50μM、优选为0.1μM至10μM。
在使用RA作为RA等的情况下,其在培养基中的浓度可以为例如0.001μM至50μM、优选为0.1μM至10μM、特别优选为约1μM。
该工序中的GDNF在培养基中的浓度可以为例如1ng/mL至1000ng/mL、优选为50ng/mL至200ng/mL。
该工序中的基质胶在培养基中的浓度可以为例如0.2%(v/v)至20%(v/v)、优选为1%(v/v)至4%(v/v)、特别优选为约2%(v/v)。
对于基础培养基没有特别限定,但适宜使用例如混合了StemFit AK03(味之素健康供应公司)的A液和B液的物质、TeSR1培养基以及化学成分确定(化学成份明确的培养基,CDM)培养基。此外,也可以使用BME培养基、BGJb培养基、CMRL 1066培养基、Glasgow MEM培养基、Improved MEM(IMEM)培养基、Improved MDM(IMDM)培养基、Medium 199培养基、EagleMEM培养基、αMEM培养基、DMEM培养基(高浓度葡萄糖、低浓度葡萄糖)、DMEM/F12培养基、Ham培养基、RPMI 1640培养基、Fischer's培养基、以及它们的混合培养基等。
作为CDM培养基,没有特别限定,但可使用例如由Iscove氏改良的Dulbecco氏培养基(GE医疗公司制)制备的培养基。
基础培养基中可添加转铁蛋白、单硫代甘油、牛血清白蛋白(BSA)、胰岛素和/或抗生素等通常用于细胞培养的物质。
通过在包含ERBB3激动剂和/或ERBB4激动剂,优选为还包含TGFβ抑制剂、GSK3β抑制剂、RA等、GDNF以及基质胶中的任一种以上的培养基中培养ENP,从而能够在维持ENP的多能(multipotency)的同时进行培养,使其增殖。
对于该工序的培养时间段没有特别限定,只要是ENP增殖并达到目标细胞数量的时间段即可,但可以为例如7天以上、10天以上、14天以上、20天以上、25天以上、30天以上、40天以上、50天以上、60天以上、70天以上、80天以上、90天以上、7至100天、100天以上。
其间的细胞的增殖速度达到非常高的速度,以细胞倍增时间计为约75小时。
该工序优选粘附培养,但也可以是悬浮培养。
粘附培养中使用培养皿、烧瓶、微孔板、OptiCell(产品名称,Nunc)等细胞培养片之类的培养容器。
对于粘附培养中使用的容器,可以实施用于提高容器与细胞之间的粘附性(亲水性)的表面处理,用胶原、明胶、多聚-L-赖氨酸、多聚-D-赖氨酸、层粘连蛋白、纤维结合蛋白、基质胶、玻连蛋白等细胞粘附用基质进行涂布,但更优选使用未实施这些表面处理、涂布的容器。
在悬浮培养中,使细胞分散在培养基中,通过搅拌或振荡使培养基成分和培养基内氧浓度均匀,同时形成细胞聚集体。可根据细胞密度和培养容器的大小适当设定适宜的搅拌速度,但过度的搅拌或振荡会对细胞施加物理应力,抑制细胞聚集体的形成。因此,控制搅拌或振荡速度,既使得培养基成分和培养基内氧浓度能够均匀,且不抑制细胞聚集体的形成。也可以不进行搅拌或振荡,静置进行悬浮培养。
优选在悬浮培养中使用Prime surface(产品名称,住友电木株式会社)等的低粘附涂布的容器。
对于培养温度没有特别限制,可以在30℃至40℃(例如37℃)下进行。此外,培养容器中的二氧化碳浓度可以为例如5%左右。
[第二实施方式涉及的制造方法(包括NCC向ENP分化和ENP增殖的方法)]
〔第二实施方式工序(B1):提供神经嵴细胞的工序〕
在该工序中,提供NCC。该工序至少提供NCC即可,也可以提供单一的NCC细胞、NCC的细胞群或者包含NCC的细胞群。
该工序中提供的NCC可以是市售获得的NCC,也可以是从生物体中分离的NCC,还可以是由干细胞(stem cell)等分化得到的NCC。市售获得的NCC可以是处于培养状态的NCC,也可以是处于冷冻状态NCC。此外,在NCC为从干细胞等分化得到的NCC的情况下,NCC可以是处于培养状态的NCC,也可以是处于冷冻状态的NCC。
作为市售的NCC,可例举出例如人毛囊外毛根鞘细胞(科世模生物公司制)、O9-1小鼠颅神经嵴细胞系(默克密理博公司制)等。
此外,已报道了NCC存在于受精后30天前后的人胚的神经管,胎生第9天前后的小鼠胚的神经管,人、猪以及啮齿类的成体的皮肤等中(Betters等人,Developmentalbiology,2010,344(2):578-592、Jiang等人,Development,2000,127(8):1607-1616、Dupin等人,Developmental biology,2012,366(1):83-95、Nagoshi等人,Cell Stem Cell 2,April 2008,392-403)。NCC也可以使用公知的方法(例如,Motohashi等人,Biology open,2016,5:311-322、Pfaltzgraff等人,Journal of Visualized Experiments,2012,64:4134)进行提取,并提供至该工序。
在分化为NCC中使用的干细胞为例如多能干细胞(pluripotent stem cell)。本发明中能够使用的“多能干细胞(pluripotent stem cell)”是指具有如下能力的干细胞:能够分化为生物体的各种具有不同形态或功能的组织或细胞,且能够分化为三胚层(内胚层、中胚层、外胚层)的任一层的细胞。对其没有特别限定,可以例举出例如胚胎干细胞(ESC)、经由核移植获得的胚胎克隆衍生的胚胎干细胞、精子干细胞、胚胎生殖细胞、诱导性多能干细胞(本说明书中,有时也称为“iPSC”)等。此外,本发明中能够使用的“多能干细胞(multipotent stem cell)”是指具有能够分化为多个有限数量的层的细胞的能力的干细胞。可以例举出例如牙髓干细胞、口腔粘膜衍生的干细胞、毛囊干细胞、衍生自培养成纤维细胞或骨髓干细胞的成体干细胞等,作为本发明中可使用的“多能干细胞(multipotentstem cell)”。优选的多能干细胞(pluripotent stem cell)为ESC和iPSC。
若是小鼠ESC,可以使用inGenious targeting laboratory公司、理研(理化学研究所)等建立的各种小鼠ESC株;若是人ESC,可以使用威斯康星大学、NIH、理研、京都大学、国立成育医疗研究中心以及Cellartis公司等建立的各种人ESC株,作为“ESC”。例如,可以使用ESI Bio公司分开出售的CHB-1至CHB-12株、RUES1株、RUES2株、HUES1至HUES28株等、WiCell Research分开出售的H1株、H9株等、理研分开出售的KhES-1株、KhES-2株、KhES-3株、KhES-4株、KhES-5株、SSES1株、SSES2株、SSES3株等,作为人ESC株。
“诱导性多能干细胞”是指通过将特定的因子(核重编程因子)导入哺乳动物体细胞或未分化干细胞内进行重编程而获得的细胞。目前,“诱导性多能干细胞”有许多种类,除了山中等通过将Oct3/4、Sox2、Klf4、c-Myc四种因子导入小鼠成纤维细胞内,从而建立的iPSC(Takahashi K,Yamanaka S.,Cell,(2006)126:663-676)之外,还可以使用将同样的四种因子导入人成纤维细胞内而建立的人细胞衍生的iPSC(Takahashi K,Yamanaka S.,等人,Cell,(2007)131:861-872.)、在导入上述四种因子后,以Nanog的表达作为指标进行筛选而建立的Nanog-iPSC(Okita,K.,Ichisaka,T.,以及Yamanaka,S.(2007).Nature 448,313-317.)、通过不包括c-Myc的方法制作的iPSC(Nakagawa M,Yamanaka S.,等人,NatureBiotechnology,(2008)26,101-106)、通过无病毒法导入了六种因子而建立的iPSC(OkitaK等人,Nat.Methods 2011May;8(5):409-12,Okita K等人,Stem Cells.31(3):458-66.)。此外,还可以使用Thomson等制作的、导入了OCT3/4、SOX2、NANOG、LIN28四种因子而建立的诱导性多能干细胞(Yu J.,Thomson JA.等人。Science(2007)318:1917-1920.)、Daley等制作的诱导性多能干细胞(Park IH,Daley GQ.等人。Nature(2007)451:141-146)、樱田等制作的诱导性多能干细胞(日本特开第2008-307007号)等。
此外,还可以使用已公开的所有论文(例如,Shi Y。Ding S.,等人。Cell StemCell,(2008)Vol3,Issue 5,568-574;、Kim JB。Scholer HR。等人。Nature,(2008)454,646-650;Huangfu D。Melton,DA。等人。Nature Biotechnology,(2008)26,No 7,795-797)、或者日本专利(例如日本特开第2008-307007号、日本特开第2008-283972号、US2008-2336610、US2009-047263、WO 2007-069666、WO 2008-118220、WO 2008-124133、WO 2008-151058、WO2009-006930、WO 2009-006997、WO 2009-007852)中记载的该领域公知的诱导性多能干细胞中的任一种。
可以使用NIH、理研、京都大学等建立的各种iPSC株,作为诱导性多能干细胞。例如,若是人iPSC株,可以例举出理研的HiPS-RIKEN-1A株、HiPS-RIKEN-2A株、HiPS-RIKEN-12A株、Nips-B2株等、京都大学的253G1株、201B7株、409B2株、454E2株、606A1株、610B1株、648A1株、1231A1株、1231A3株等,优选1231A1株、1231A3株,更优选1231A3株。
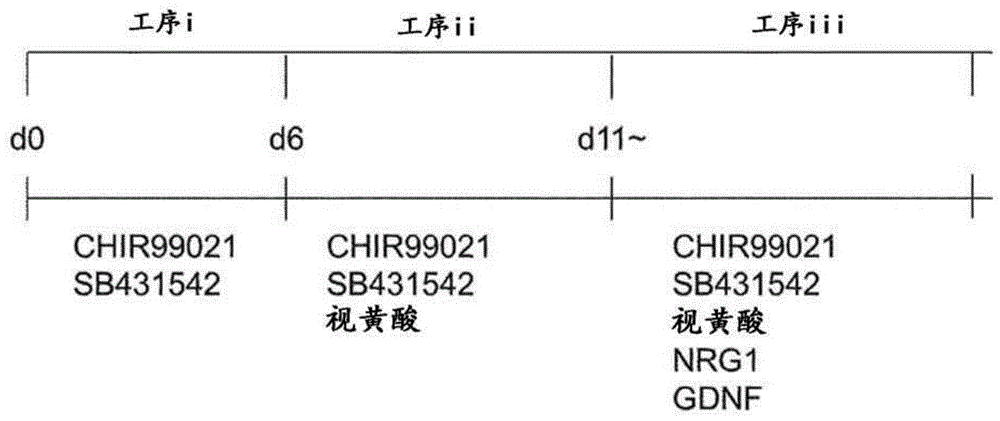
自干细胞至NCC的分化可以按照文献公知(例如,非专利文献2)的方法来进行。图1示出了使人iPSC分化为NCC的情况下的工序的一例。首先,将iPSC接种至培养皿等进行粘附培养后,在包含TGFβ抑制剂和GSK3β抑制剂的培养基中进行粘附培养(图1,工序i),然后在进一步添加了RA和/或其衍生物的培养基中进行粘附培养,从而分化为NCC(工序ii)。
对于该工序中的培养基中的TGFβ抑制剂的浓度而言,可根据所添加的TGFβ抑制剂的种类进行适当地调整,但可以为例如0.1μM至50μM、优选为1μM至20μM。
在使用SB431542(4-[4-(1,3-苯并二噁-5-基)-5-(2-吡啶基)-1H-咪唑-2-基]-苯甲酰胺)作为TGFβ抑制剂的情况下,其在培养基中的浓度可以为例如1μM至100μM、优选为5μM至20μM、特别优选为约10μM。
该工序中的GSK3β抑制剂在培养基中的浓度可根据所添加的GSK3β抑制剂的种类而适当调整,但例如为0.1μM至10μM、优选为0.5μM至2μM。
在使用CHIR99021作为GSK3β抑制剂的情况下,其在培养基中的浓度可以为例如0.1μM至10μM、优选为0.5μM至2μM、特别优选为约1μM。
根据工序ii中的RA等在培养基中的浓度,可以使干细胞分化为脑神经嵴细胞(Cranial NCC)、迷走神经嵴细胞(Vagal NCC)、躯干神经嵴细胞(Trunk NCC)、骶椎神经嵴细胞(Sacral NCC)中的任一种。
例如,在使人iPSC分化为脑神经嵴细胞的情况下,不添加RA等。
在使人iPSC分化为迷走神经嵴细胞或者躯干神经嵴细胞的情况下的RA等在培养基中的浓度例如为0.001μM至50μM、优选为0.1μM至10μM。
但是,RA等在培养基中的浓度可根据所添加的RA等的种类而适当调整。
在后段的工序(B2)中,为了获得具有分化为肠神经细胞以及胶质细胞的高分化能力的ENP,优选使其分化为迷走神经嵴细胞(Vagal NCC)。
在包含TGFβ抑制剂和GSK3β抑制剂的培养基中的培养时间段(图1,工序i)可以为例如0天至12天,尤其可以为约6天。
在进一步添加了RA等的培养基中的培养时间段(工序ii)可以为例如1天至12天,尤其可以为约5天。
基础培养基中可以使用上述物质。
粘附培养中可以使用上述培养容器。
优选对培养容器进行用于提高与细胞之间的粘附性(亲水性)的表面处理,或利用胶原、明胶、多聚-L-赖氨酸、多聚-D-赖氨酸、层粘联蛋白、纤维连接蛋白、基质胶、玻连蛋白等细胞粘附用基质进行涂布。
对于培养温度没有特别限制,在30℃至40℃(例如37℃)下进行。此外,培养容器中的二氧化碳浓度为例如约5%。
〔第二实施方式工序(B2):培养神经嵴细胞的工序〕
在该工序中,在包含ERBB3激动剂和/或ERBB4激动剂、以及视黄酸和/或其衍生物的培养基中培养NCC(图1,工序iii)。这里使用的NCC优选为迷走神经嵴细胞(Vagal NCC)。
所使用的ERBB3激动剂、ERBB4激动剂和RA等、以及它们在培养基中的浓度可以与工序(A2)相同。
培养基也可以进一步包含TGFβ抑制剂和/或GSK3β抑制剂。
所使用的TGFβ抑制剂和GSK3β抑制剂、以及它们在培养基中的浓度可以与工序(A2)相同。
培养基也可以进一步包含GDNF和基质胶中的任一种以上。
GDNF和基质胶在培养基中的浓度、以及所使用的基础培养基也可以与工序(A2)相同。
与工序(A2)同样地,该工序优选粘附培养,但也可以是悬浮培养。
通过在包含ERBB3激动剂和ERBB4激动剂和RA等,优选为进一步包含TGFβ抑制剂、GSK3β抑制剂、GDNF以及基质胶中的任一种以上的培养基中培养ENP,能够维持ENP的多能(multipotency),同时使ENP增殖。
对于该工序的培养时间段没有特别限定,只要是ENP增殖并达到目标细胞数量的时间段即可,但可以为例如7天以上、10天以上、14天以上、20天以上、25天以上、30天以上、40天以上、50天以上、60天以上、70天以上、80天以上、90天以上、7至100天、100天以上。
其间的细胞的增殖速度达到较高的速度,以细胞倍增时间计为约75小时。
[第三实施方式涉及的扩大培养方法]
〔第三实施方式工序(C1):提供肠神经前体细胞的工序〕
在该工序中,提供ENP。
该工序中提供的ENP可以与工序(A1)相同。
〔第三实施方式工序(C2):培养肠神经前体细胞的工序〕
在该工序中,在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养ENP。
所使用的ERBB3激动剂和/或ERBB4激动剂、以及它们在培养基中的浓度可以与工序(A2)相同。
培养基也可以进一步包含TGFβ抑制剂和GSK3β抑制剂。
所使用的TGFβ抑制剂和GSK3β抑制剂、以及它们在培养基中的浓度可以与工序(A2)相同。
培养基也可以进一步包含RA等、胶质细胞来源神经营养因子(GDNF)、以及基质胶中的任一种以上。
所使用的RA等、以及它们的添加浓度可以与工序(A2)相同。
GDNF和基质胶在培养基中的浓度、以及所使用的基础培养基也可以与工序(A2)相同。
与工序(A2)同样地,该工序优选粘附培养,但也可以是悬浮培养。
通过在包含ERBB3激动剂和/或ERBB4激动剂以及RA等,优选为进一步包含TGFβ抑制剂、GSK3β抑制剂、GDNF以及基质胶中的任一种以上的培养基中培养ENP,能够在维持ENP的多能(multipotency)的同时进行培养并使ENP增殖。
对于该工序的培养时间段没有特别限定,只要是ENP增殖并达到目标细胞数量的时间段即可,但可以为例如7天以上、10天以上、14天以上、20天以上、25天以上、30天以上、40天以上、50天以上、60天以上、70天以上、80天以上、90天以上、7至100天、100天以上。
其间的细胞的增殖速度达到较高的速度,以细胞倍增时间计为约75小时。
[肠神经前体细胞培养基]
本发明还提供在上述ENP的制造方法或扩大培养方法中使用的ENP培养基。培养基的优选组分如上所述。ENP的制造可包括使iPSC、ESC以及NCC等干细胞分化为ENP的步骤。
本发明的一方式中,肠神经前体细胞培养基包含ERBB3激动剂和/或ERBB4激动剂。在本发明的另一方式中,除了ERBB3激动剂和/或ERBB4激动剂,肠神经前体细胞培养基也可以进一步包含TGFβ抑制剂和/或GSK3β抑制剂,优选包含TGFβ抑制剂和GSK3β抑制剂。在本发明的另一方式中,除了ERBB3激动剂和/或ERBB4激动剂,肠神经前体细胞培养基也可以包含GDNF。在本发明的另一方式中,除了ERBB3激动剂和/或ERBB4激动剂,肠神经前体细胞培养基也可以包含基质胶。在本发明的另一方式中,除了ERBB3激动剂和/或ERBB4激动剂,肠神经前体细胞培养基也可以包含GDNF和基质胶。在本发明的另一方式中,除了ERBB3激动剂和/或ERBB4激动剂,肠神经前体细胞培养基也可以包含TGFβ抑制剂、GSK3β抑制剂、GDNF以及基质胶。这些肠神经前体细胞培养基也可以进一步包含RA等。肠神经前体细胞培养基中的ERBB3激动剂和/或ERBB4激动剂、TGFβ抑制剂、GSK3β抑制剂、GDNF、基质胶以及RA等的浓度分别可以与工序(A2)相同。
在另一方面中,本发明还提供包含ERBB3激动剂和/或ERBB4激动剂的ENP培养基添加剂、以及ERBB3激动剂和/或ERBB4激动剂的应用,用于ENP扩大培养。
[肠神经前体细胞]
通过本发明涉及的ENP制造方法或扩大培养方法,能够在保持分化为肠神经细胞和胶质细胞的分化能力(多能(multipotency))的同时大量地获得ENP。
“保持了多能(multipotency)的ENP”可以通过多种方法进行评价。作为其方法没有特别限定,可例举出例如使作为评价对象的ENP分化为肠神经细胞和胶质细胞的方法。若作为评价对象的ENP实际上能够分化为肠神经细胞和胶质细胞,则可以判断为作为评价对象的ENP是“保持了多能(multipotency)的ENP”。
作为其他方法,可例举出例如对标记蛋白、基因的表达进行测量的方法。在作为评价对象的ENP中,若作为转录因子的SOX10和PHOX2B表达,则可以判断为作为评价对象的ENP是“保持了多能(multipotency)的ENP”。
SOX10和PHOX2B的检测可利用对该标记蛋白具有特异性的抗体进行免疫学分析来实施,所述免疫学分析例如为ELISA、免疫染色、流式细胞术等。标记基因的检测可利用该领域公知的核酸扩增方法和/或核酸检测方法来实施,所述方法例如为RT-PCR、微阵列、生物芯片等。此外,也可以使用如下方法:若是在SOX10和PHOX2B基因的下游插入了对报告蛋白(例如,Nano-Lantern(Saito K.等人,“Luminescent proteins for high-speed single-cell and whole-body imaging.”Nat.Commun.,2012;3:1262.))进行编码的碱基序列的细胞,且是在SOX10等启动子的控制下表达报告蛋白或者其与SOX10等之间的融合蛋白的细胞,则检测该报告蛋白(例如,测量荧光强度)。
[细胞药品/冷冻储备物]
可以将通过本发明涉及的制造方法或扩大培养方法获得的ENP作为细胞药品来应用,该细胞药品用于预防或治疗由肠神经细胞的缺失或异常引起的疾病。作为这样的疾病,可例举出例如先天性巨结肠(Hirschsprung)症、食管失弛缓症、胃运动障碍、先天性肥大性幽门狭窄、慢性特发性假性肠梗阻、神经性便秘或者恰加斯病等。
细胞药品所含有的ENP可以是对培养中的细胞进行剥离而回收的细胞,也可以是冷冻保存液中冷冻的细胞。从稳定地获得相同的作用效果的观点、操作性优异的观点等来看,优选使用将扩大培养得到的相同群的细胞等分并冷冻保存的细胞药品。
也可以根据用途、形态,按照常规方法使细胞药品含有药学上可接受的载体、添加物等其它组分。作为载体、添加物,可例举出例如等渗剂、増稠剂、糖类、糖醇类、防腐剂(保存剂)、杀菌剂或抗菌剂、pH调节剂、稳定剂、螯合剂、油性基质、凝胶基质、表面活性剂、混悬剂、超增塑剂、分散剂、缓冲剂、抗氧化剂等。
提供上述疾病的治疗方法,包括通过细胞药品,向患者施用该细胞药品的治疗有效量的步骤。
治疗有效量是指,在向患者施用了ENP的情况下,与未施用的对照组相比,能够获得对上述疾病具有治疗效果的ENP量。作为具体的治疗有效量,可根据ENP的施用方式、施用方法、使用目的以及患者的年龄、体重、症状等适当地设定。人(例如成人)的每1次治疗的有效量为例如200000个/kg体重至100000000个/kg体重。这些细胞可以被分散为单细胞状态,也可以成为多个细胞聚集而成的细胞块(球,sphere),也可以将它们混合。
作为细胞药品的施用方法,可例举出例如腹腔内注射、皮下注射、淋巴结内注射、静脉注射、胸腔内注射、通过剖腹向消化器官的局部(例如食道、胃、十二指肠、小肠、空肠、回肠、结肠、直肠)直接注射、以及直肠腔内施用等。
本发明还提供一种冷冻储备物,包含通过上述制造方法或扩大培养方法获得的ENP。
冷冻储备物可以通过以下方式制造:通过离心分离将所得的ENP从培养基中分离,并悬浮于冷冻保存液中进行冷冻。冷冻保存液中使用以往在细胞的冷冻保存中使用的试剂即可。例如,市售的Cryostem Freezing Medium(商品名称)以及Stemcell Banker GMPGrade(日本全药工业株式会社)等。
冷冻储备物可以作为用于使ENP分化而获得肠神经细胞和胶质细胞的起始材料被使用。此外,冷冻储备物可以被用于制作作为ENP的结构要素的组织模型。
[自肠神经前体细胞至肠神经细胞或胶质细胞的诱导]
所获得的ENP以及通过文献公知的方法使ENP分化而获得的神经细胞和胶质细胞可用于再生医疗用的细胞制剂,还可以适宜应用于建立各种筛选系统。
自ENP至肠神经细胞的诱导可以参照例如非专利文献2。此外,自ENP至胶质细胞的诱导可以应用以往公知的方法(例如“A novel bidirectional interaction betweenendothelin-3and retinoic acid in rat enteric nervous system precursors”,Gisser,J.M.等人,PLosOne 2013)。
[肠道类器官/人造肠的制造方法]
本发明涉及的肠道类器官的制造方法包括对ENP和后肠细胞进行共培养的工序。
ENP可以通过上述ENP制造方法或扩大培养方法来获得。
后肠细胞可以按照以往公知的方法由干细胞分化而获得。例如,存在以下方法:通过在包含Activin A、BMP4以及bFGF的培养基中培养人诱导性多能干细胞,获得胚体内胚层,并在包含FGF4和GSK3β抑制剂的培养基中培养胚体内胚层从而获得后肠细胞。
作为胚体内胚层诱导时以及后肠细胞诱导时的基础培养基,也可以使用上述基础培养基。
胚体内胚层诱导时的Activin A在培养基中的浓度可以为例如10ng/mL至1000ng/mL、优选为50ng/mL至500ng/mL、更优选为约100ng/mL。此外,BMP4在培养基中的浓度可以为例如1ng/mL至100ng/mL、优选为5ng/mL至50ng/mL、更优选为约10ng/mL。bFGF在培养基中的浓度可以为例如1ng/mL至200ng/mL、优选为5ng/mL至100ng/mL、更优选为约20ng/mL。培养时间段可以为例如1天至10天、优选为2天至6天、更优选为约4天。
后肠细胞诱导时的FGF4在培养基中的浓度可以为例如10ng/mL至1000ng/mL、优选为50ng/mL至500ng/mL、更优选为约100ng/mL。GSK3β抑制剂在培养基中的浓度而言,例如在使用CHIR99021的情况下,可以为例如1μM至30μM、优选为4μM至10μM、更优选为约6μM。培养时间段可以为例如4天至12天、优选为6天至10天、更优选为约8天。
作为ENP和后肠细胞的共培养,可以对以往公知的基于NCC和后肠细胞的共培养的肠道类器官的制造方法进行适当改进,在此基础上进行应用。
例如,存在以下方法:将悬浮于基质胶溶液的后肠细胞和ENP接种至板上而使其凝胶化,并添加包含R-脊椎蛋白1、Noggin、Wnt3a、EGF、前列腺素E2以及ROCK抑制剂的培养基进行培养。还可以根据需要将通过共培养获得的肠道类器官重悬浮于基质胶溶液并在此基础上通过再次应用相同的方法使其成熟。
此外,还存在以下方法:例如将悬浮于基质胶溶液的后肠细胞接种至板上而使其凝胶化,并添加包含R-脊椎蛋白1、Noggin、Wnt3a、EGF、前列腺素E2以及ROCK抑制剂的培养基进行培养,获得肠道类器官后,暂时使肠道类器官分散并与ENP的细胞悬浮液混合,在包含R-脊椎蛋白1、Noggin、Wnt3a、EGF、前列腺素E2以及ROCK抑制剂的培养基中,对离心分离混合液而获得的细胞颗粒进行培养。这种情况下,也可以根据需要使通过共培养获得的肠道类器官成熟。
作为ENP和后肠细胞的共培养时的基础培养基,也可以使用上述基础培养基。
R-脊椎蛋白1在培养基中的浓度可以为例如100ng/mL至10000ng/mL、优选为500ng/mL至5000ng/mL、更优选为约1000ng/mL。
Noggin在培养基中的浓度可以为例如10ng/mL至1000ng/mL、优选为50ng/mL至500ng/mL、更优选为约100ng/mL。
Wnt3a在培养基中的浓度可以为例如10ng/mL至1000ng/mL、优选为50ng/mL至500ng/mL、更优选为约100ng/mL。
EGF在培养基中的浓度可以为例如10ng/mL至1000ng/mL、优选为50ng/mL至500ng/mL、更优选为约100ng/mL。
前列腺素E2在培养基中的浓度可以为例如0.5μM至10μM、优选为1μM至5μM、更优选为约2.5μM。
例如在使用Y27632的情况下,ROCK抑制剂可以为1μM至100μM、优选为5μM至50μM、更优选为约10μM。
培养时间段可以为例如15天至40天、优选为20天至30天、更优选为24天至25天。
本发明涉及的人造肠的制造方法包括将上述获得的肠道类器官移植至生物体内形成人造肠的工序。
对于生物体内的移植没有特别限定,例如可以通过以下方式进行:使离心分离肠道类器官的分散液而得到的细胞颗粒粘附于适当的支架材料(支架),并留置于肠道膜脂肪上。支架材料可以利用各种市售的材料,例如聚乙醇酸片(Gunze公司)、聚-L-乳酸(DURECT)。
作为移植目标的动物,可以为小鼠、大鼠、兔、狗、猪、牛、马以及猴等非人哺乳动物或者人,优选选择非人哺乳动物。此外,可以优选使用免疫缺陷的动物。
移植后的肠道类器官在生物体内分化、成熟,形成人造肠。分化和成熟所需的时间段可根据移植的细胞数、使用的支架材料、移植目标的动物和部位的不同而不同,例如为5周以上、优选为10周以上、更优选为约13周至20周。
所获得的人造肠包含ENP来源的神经细胞和胶质细胞,可对电刺激有响应而显示收缩舒张反应。
此外,该神经细胞具有在内产生乙酰胆碱和肾上腺素而使肌肉收缩、产生一氧化氮而使肌肉舒张、或对人造肠电刺激有响应而使肌肉舒张的功能。
实施例
[试验例1:人iPSC的维持培养]
人iPSC使用了1231A3株(参见Scientific Reports,2014,4,3594)。
对于iPSC的维持培养,不使用饲养细胞,而是通过使用涂布了iMatrix 511Silk(株式会社Nippi)的板来进行。培养在37℃、5%CO
每天进行培养基更换,每6天至7天进行继代。通过以下方式进行继代:使用添加了0.5mM的EDTA的磷酸缓冲液(以下,记为“PBS”)而稀释2倍后的TrypLE Select CTS(LifeTechnologies),使iPSC单细胞化并从板上剥离后,将剥离的iPSC接种至用iMatrix511Silk涂布了的新的板上。接种时的培养基中可以使用将添加了10μM的Y27632(富士胶片和光纯药株式会社)的StemFit AK03N的A液、B液以及C液混合而得的物质。
[试验例2:SOX10::tdTomato-PHOX2B::emGFP报道人iPSC株的建立]
使用Neon Transfection system(Life Technologies)向单细胞化后的上述人iPSC同时导入了SpCas9 D10A nickase表达质粒、SOX10 sgRNA表达质粒、SOX10-F2A-tdTomato供体质粒、嘌呤霉素抗性基因表达质粒(富士胶片和光纯药株式会社)。
在基于嘌呤霉素处理的药物筛选后对所获得的细胞进行集落提取,并进行扩大培养。将所得的集落中通过PCR观察到目的序列的插入的集落作为SOX10::tdTomato株。
进一步,使用Neon Transfection system(Life Technologies)向单细胞化后的人iPSC(SOX10::tdTomato株)同时导入了SpCas9 D10A nickasse蛋白、PHOX2B gRNA(IDT)、PHOX2B-F2A-emGFP供体质粒、嘌呤霉素抗性基因表达质粒(富士胶片和光纯药株式会社)。
在基于嘌呤霉素处理的药物筛选后对所获得的细胞进行集落提取,并进行扩大培养。将所得的集落中通过PCR观察到目的序列的插入的集落作为SOX10::tdTomato-PHOX2B::emGFP株。
[试验例3:自人iPSC至迷走神经嵴细胞的分化]
(1)iPSC的预培养
将利用试验例1中记载的方法进行了维持培养的人iPSC(SOX10::tdTomato-PHOX2B::emGFP株)分别以2×10
(2)自iPSC至迷走神经嵴细胞的分化
预培养后,将培养基更换为包含10μM的SB431542(富士胶片和光纯药株式会社)和1μM的CHIR99021(Axon MedChem)的培养基(培养第0天),并在37℃、5%CO
在培养第11天,获得了迷走神经嵴细胞。
此外,除了不添加视黄酸,在其他条件相同情况下进行iPSC的培养,诱导(分化)了脑神经嵴细胞。
为了调查迷走神经嵴细胞的分化标记的表达,回收培养第11天的细胞,并使用RNeasy(凯杰公司(Qiagen))对总RNA组分进行纯化。使用Prime Script逆转录试剂盒(Takara Bio Inc.)合成cDNA后,实施定量RT-PCR,并对规定作为迷走神经嵴细胞标记的SOX10和内皮素B型受体(EDNRB)以及前后轴的位置信息的HOX基因组中的HOXB2、HOXB3、HOXB4、HOXB5、HOXB7和HOXB9基因表达量进行了测量。求出基因表达量与内部对照的GAPDH的表达量之比。
各基因的表达量示于图2。图中,纵轴示出了差异倍数(将脑神经嵴细胞中的表达量设为1时的比以log2表示的值)。由于表达了SOX10、EDNRB、HOXB2、HOXB3、HOXB4、HOXB5以及HOXB7,而未表达HOXB9,因此确认了迷走神经嵴细胞的分化。
[试验例4:自迷走神经嵴细胞至肠神经前体细胞的分化以及扩大培养]
通过酶处理分散利用试验例3的方法获得的、培养第11天的细胞(迷走神经嵴细胞),并进行回收。如下述那样实施酶处理。
吸除培养基并替换为PBS之后,用细胞刮取器将细胞剥离。通过移液使剥离后的细胞块分散在Accutase(Innovative Cell Technologies)中。然后,添加MACS缓冲液(Miltenyi Biotec),使其通过40μm的细胞过滤器而单细胞化。对所得的细胞悬浮液,进行300×g、3分钟离心后去除上清液,并悬浮于肠神经前体细胞培养基。作为肠神经前体细胞培养基,使用了在混合有StemFit AK03N的A液和B液的培养基中包含10μM的SB431542(富士胶片和光纯药株式会社)、1μM的CHIR99021(Axon MedChem)、1μM的视黄酸(富士胶片和光纯药株式会社)、100ng/mL神经调节蛋白1(NRG1)(Pepro Tech)以及50mg/mL的胶质细胞原神经营养因子(GDNF)(富士胶片和光纯药株式会社)的培养基。在进行粘附培养的情况下,向细胞悬浮液中添加基质胶(Corning)直至2%,利用多孔板(Corning)进行培养。在进行悬浮培养的情况下,使用实施了细胞低粘附处理的多孔板(Corning)。培养均在37℃、5%CO
粘附培养时的继代方法如下所示。
吸除培养基并替换为PBS之后,吸除PBS,添加TrypLE Select CTS(LifeTechnologies),并在37℃静置10分钟。然后,吸除TrypLE Select CTS,添加肠神经前体细胞培养基,通过移液使细胞分散。
将分散后的细胞以2×10
每1周至2周对所获得的细胞实施1次继代。每次继代用自动细胞计数器对总细胞数量、存活细胞数量以及死亡细胞数量进行计数。根据继代时接种的存活细胞数量以及下次继代时获得的存活细胞数量来计算总细胞数量(accumulated cell number)。
总细胞数量(accumulated cell number)的经时变化示于图3。能够对细胞实施至少7次继代,显示了线性的细胞增殖。
[试验例5:肠神经前体细胞的流式细胞术分析]
每次继代均使用流式细胞术对试验例4中培养的细胞中的SOX10-tdTomato和PHOX2B-emGFP的表达进行分析。
对继代时得到的细胞分散液进行300×g、3分钟离心,去除上清液后,使细胞悬浮于包含DAPI以及1%的牛血清白蛋白的HBSS,提供至基于FACS Aria Fusion(日本BectonDickinson)的分析。
SOX10-tdTomato和PHOX2B-emGFP的表达分析结果示于图4。图中,P1至P6是指继代次数(1次至6次)。每经过一次继代,SOX1-tdTomato和PHOX2B-emGFP同时表达的肠神经前体细胞所占的比例上升。5次继代以后,肠神经前体细胞所占的比例达到80%以上。
[试验例6:与肠神经前体细胞培养基的组分相关的研究]
除了在肠神经前体细胞培养基中不添加NRG1和/或GDNF之外,在与试验例4相同的条件下,在肠神经前体细胞培养基中培养迷走神经嵴细胞,并使用荧光显微镜(BZ-X700,Keyence)进行观察。此外,利用与试验例5相同的方法实施了流式细胞术分析。
细胞的荧光图像以及SOX10-tdTomato和PHOX2B-emGFP的表达分析结果示于图5。在不包含NRG1的条件下,细胞增殖非常慢,无法获得用于实施流式细胞术所需的细胞数量。在不包含GDNF的条件下,虽然获得了SOX10-tdTomato和PHOX2B-emGFP同时表达的肠神经前体细胞,但是与包含GDNF的条件相比,细胞的增殖较慢。
[试验例7:肠神经前体细胞的基因表达分析]
从在试验例4中继代时得到的细胞中提取整个RNA,确认了作为肠神经前体细胞的标记的SOX10、PHOX2B、HOXB5、EDNRB以及ret原癌基因(RET)的基因表达。与上述方法相同,实施了基因表达分析。
结果示于图6。图中,纵轴表示表达水平(相对于内部对照的GAPDH的表达量的比)或者差异倍数(将iPSC中的表达量设为1时的比以log2表示的值)。在肠神经前体细胞培养基中培养的细胞即使经过继代也表达了SOX10、PHOX2B、HOXB5、EDNRB以及RET。
[试验例8:自肠神经前体细胞至肠神经系统的分化]
在肠神经分化用的培养基中对与试验例4同样地获得的肠神经前体细胞进行培养并进行肠神经的分化。作为肠神经分化用培养基,使用了向神经基础培养基(LifeTechnologies)中添加了B27(Life Technologies)、N2添加剂(富士胶片和光纯药株式会社)、L-谷氨酰胺(富士胶片和光纯药株式会社)、青霉素/链霉素(Life Technologies)、100μM的抗坏血酸(富士胶片和光纯药株式会社)以及25ng/mL的GDNF的培养基。
培养第40天添加4%PFA并在室温下进行固定,提供至荧光免疫染色,用于评价分化为各种肠神经亚型的分化能力。将细胞与作为一抗的抗胆碱乙酰转移酶(ChAT)抗体(ab224267、Abcam)、抗神经元一氧化氮合酶(nNOS)抗体(ab76067,Abcam)、抗γ-氨基丁酸(GABA)抗体(A2052,Sigma)或者抗5-羟基色胺(5-HT)抗体(S5545,Sigma)反应,进一步与作为二抗的与一抗的免疫动物相对应的Alexa647标记二抗依次反应后,在荧光显微镜下观察。
荧光免疫染色图像示于图7。确认了ChAT、nNOS、GABA以及5-HT阳性的神经,分别显示为胆碱能神经元、抑制性神经元、GABA能神经元以及羟色胺能神经元。因此,显示了该培养方法获得的肠神经前体细胞保持了分化为各种肠神经亚型的分化能力。
[试验例9:人iPSC的维持培养]
人iPSC使用了253G1株(参见Nature Biotechnology,2008,26,(1):101-106)。
iPSC的维持培养使用涂布了Vitronection(TN-N)Recombinant Human Protein,Truncated(Thermo Fisher公司制造)的板,而不使用饲养细胞。培养在37℃、5%CO
维持培养时的培养基使用混合了Essential 8Flex Medium Kit(Thermo Fisher)的基础培养基和添加剂的培养基。每天进行培养基更换,每6天至7天进行继代。
继代通过以下方式进行:使用添加了0.5mM的EDTA的PBS使iPSC单细胞化并从板上剥离后,将剥离的iPSC接种至涂布了Vitronection(TN-N)Recombinant Human Protein,Truncated的新的板上。
作为接种时的培养基,使用了向混合有Essential 8Flex Medium kit的基础培养基和添加剂的培养基中添加了10μM的Y27632(富士胶片和光纯药株式会社)的培养基。
[试验例10:LGR5::emGFP报道人iPSC株的建立]
使试验例9的人iPSC单细胞化后,使用NEPA21(Nepagene)并同时导入了SpCas9表达质粒、LGR5 sgRNA表达质粒、LGR5::emGFP供体质粒(能够在LGR5的N末端中敲入“嵌合内含子+emGFP+SV40polyA”的构造)。
在基于嘌呤霉素处理的药物筛选后对所获得的细胞进行集落提取,并进行扩大培养。将所得的集落中通过PCR观察到目的序列的插入为单等位性的集落作为LGR5::emGFP株。
[试验例11:自人iPSC至肠道类器官的分化]
(1)iPSC的预培养
试验例10的LGR5::emGFP株以4×10
(2)自人iPSC至胚体内胚层的分化
预培养后,将培养基更换为包含100ng/mL的Activin A(PeproTech)、10ng/mL的BMP4(R&D Systems)、20ng/mL的bFGF(富士胶片和光纯药株式会社)的培养基(培养第0天),并在37℃、5%CO
为了确认胚胎内胚层的分化,回收培养4天后的细胞,通过定量RT-PCR确认了作为胚胎内胚层标记的SOX17和FOXA2表达。
(3)自胚体内胚层至后肠的分化
胚体内胚层分化后,将培养基更换为包含100ng/mL的FGF4(PeproTech)和6μM的CHIR99021(Axon MedChem)的培养基(培养第4天),并在37℃、5%CO
(4)肠道类器官的分化1
将在孔内形成的后肠细胞块与培养上清一起回收。向包含后肠细胞块的溶液中添加试验例4中制作的包含肠神经前体细胞的细胞悬浮液,离心后去除培养上清液。将重新悬浮于基质胶溶液的后肠细胞块和肠神经前体细胞以50μL/孔接种至24孔板上,并在37℃、5%CO
培养约2周后,向包含后肠细胞块和自肠神经前体细胞分化的肠道类器官的基质胶中添加4℃的D-PBS(-)(富士胶片和光纯药株式会社),并使基质胶溶解。离心并去除培养上清液。将重新悬浮于基质胶溶液的肠道类器官以50μL/孔接种至24孔板上,并在37℃、5%CO
(5)肠道类器官的分化2
将在孔内形成的后肠细胞块与培养上清一起回收。离心并去除培养上清液。将重新悬浮于基质胶溶液的细胞块以50μL/孔接种至24孔板上,并在37℃、5%CO
培养约2周后,向包含由后肠细胞块分化的肠道类器官的基质胶中添加4℃的D-PBS(-),并使基质胶溶解。向包含肠道类器官的溶液中,添加试验例4中制作的包含肠神经前体细胞的细胞悬浮液,进行离心并去除培养上清液。向去除上清后的细胞颗粒中添加包含1000ng/mL的R-脊椎蛋白1、100ng/mL的Noggin、100ng/mL的Wnt3a、100ng/mL的EGF、2.5μM的前列腺素E2、10μM的Y27632的培养基,并在37℃、5%CO
[试验例12:自肠道类器官至人造肠的体外形成]
(1)小鼠移植至肠道类器官
将试验例11中获得的、包含肠道类器官的基质胶添加至4℃的D-PBS(-)并使其溶解。对包含肠道类器官的溶液进行离心并去除培养上清液。向去除上清后的细胞颗粒中添加胶原I(Corning)。向使用聚乙醇酸片(Gunze)和聚-L-乳酸(DURECT)制成的支架中添加包含细胞颗粒和胶原I的溶液,使细胞颗粒粘附于支架。
在异氟烷的麻醉下对6周龄的免疫缺陷小鼠(雄性NOG小鼠、实验动物中央研究所)进行剖腹。将粘附了细胞颗粒的支架留置于肠道膜脂肪上,并缝合。移植后,饲养小鼠13周。
(2)移植后的肠道类器官的采样
在异氟烷的麻醉下对小鼠进行剖腹。将肠道膜脂肪上形成的人造肠从肠道膜脂肪中分离并采样。
(3)人造肠的组织学分析
通过4%多聚甲醛/磷酸缓冲液(富士胶片和光纯药株式会社)将采样的人造肠固定,提供给荧光免疫染色。将其与作为一抗的抗TUBB3抗体(Abcam)、抗S100β抗体(Abcam)、抗GFAP抗体(Abcam)反应,进一步与作为二抗的与一抗的免疫动物对应的荧光标记二抗依次反应后,在荧光显微镜下观察。
荧光免疫染色图像示于图8、图9。如图8所示,存在PHOX2B-emGFP和SOX10-tdTomato为阳性的肠神经前体细胞来源的细胞(神经细胞和胶质细胞)。此外,如图9所示,观察到与PHOX2B-emGFP或SOX10-tdTomato阳性图像一致或者接近的S100β(A)、GFAP(B)或TUBB3(C)的阳性图像,确认了肠神经前体细胞来源的细胞已分化为神经细胞和胶质细胞。显示了实施例4中获得的肠神经前体细胞具有分化为肠神经细胞并构成人造肠的能力。
(4)人造肠的运动功能分析
将采样的人造肠切成长条状的组织片,并将其一端挂在器官浴分析装置(Panlab)的腔室内。将另一端连接于压力传感器(Bio Research Center公司制造),由此能够定量监测组织片的收缩舒张反应。向腔室内填充克氏溶液(NaCl:120.7mM,KCl:5.9mM,NaHCO
结果示于图10至图12。响应于电刺激,观察到收缩舒张反应(参见图10)。通过添加1μM的作为毒蕈碱性乙酰胆碱受体抑制剂的阿托品硫酸单水合物(富士胶片和光纯药株式会社)、10μM的作为α肾上腺素能阻断剂的盐酸酚苄明(东京化成工业株式会社)、或者10μM的β肾上腺素受体阻断剂的盐酸普萘洛尔(富士胶片和光纯药株式会社),从而部分解除收缩反应(参见图11)。由此,暗示了实施例4中获得的肠神经前体细胞在人造肠内产生乙酰胆碱和肾上腺素并形成使肌肉收缩的神经。
另一方面,依存于电刺激的舒张反应残存。由于添加了作为一氧化氮合成酶的抑制剂的NG-硝基-L-精氨酸甲酯盐酸盐,舒张反应消失(参见图11)。由此,暗示了实施例4中获得的肠神经前体细胞在人造肠内产生一氧化氮并形成使肌肉舒张的神经。
进而,由于添加了3μM的河豚毒素(富士胶片和光纯药株式会社),由1μM的阿托品硫酸单水合物、10μM的盐酸酚苄明或10μM的盐酸普萘洛尔的添加引起的收缩反应的解除消失。由此,也暗示了由肠神经前体细胞分化的神经细胞具有响应于电刺激而使肌肉舒张的功能。
[试验例13:扩大培养后的肠神经前体细胞的冷冻储备物制作、以及该冷冻储备物解冻后的特性评价]
使用与试验例4同样的方法获得的肠神经前体细胞制作了冷冻储备物。此外,进行了冷冻储备物解冻后的肠神经前体细胞的增殖能力和分化能力的确认。
对分化第76天的肠神经前体细胞的细胞分散液进行300×g、3分钟离心,去除上清后,以20万个/200μL的浓度使细胞悬浮于Stemcell Banker GMP Grade(日本全药工业株式会社),并在-80℃下冷冻保存。
在37℃下对冷冻储备物进行解冻。使细胞悬浮于肠神经前体细胞培养基后,进行300×g、3分钟离心,去除上清液后,使细胞重新悬浮于肠神经前体细胞培养基。利用试验例4中记载的方法进行培养。此外,利用试验例4和试验例5中记载的方法实施继代和流式细胞术分析。进而,按照试验例8和试验例14中记载的方法确认了分化至肠神经细胞和胶质细胞的分化能力。
结果示于图13。图13(A)示出了扩大培养时的细胞数量的经时变化和扩大培养时的肠神经前体细胞占全部细胞的比例的经时变化。图13(B)示出了通过流式细胞术对肠神经前体细胞(ENP)以及由肠神经前体细胞分化得到的肠神经细胞(ENS)中的PHOX2B和SOX10的表达进行分析而得的结果。图13(C)示出了由肠神经前体细胞分化得到的肠神经细胞和胶质细胞的荧光免疫染色图像。确认了冷冻解冻后的肠神经前体细胞保持了优异的增殖能力。此外,确认了冷冻解冻后的肠神经前体细胞保持了分化至肠神经细胞(PHOX2B和外周蛋白阳性且SOX10阴性)和胶质细胞(GFAP阳性)的分化能力。肠神经细胞包含表达nNOS(neuronal nitric oxide synthase,神经型一氧化氮合成酶)、TH(tyrosinehydroxylase,酪氨酸羟化酶)、ChAT(gamma amino butyric acid,胆碱乙酰转移酶)、GABA(gamma amino butyric acid,γ-氨基丁酸)或者SST(somatostatin,生长抑素)的各种亚型。
[试验例14:自肠神经前体细胞至胶质细胞的分化]
使用与试验例4同样的方法获得的肠神经前体细胞,进行胶质细胞的分化。
作为胶质细胞分化用培养基,使用了向Astrocyte maturation kit(Stem CellTechnologies)中添加了青霉素-链霉素(Life Technologies)的培养基。
通过多聚甲醛/磷酸缓冲液对培养第46天的细胞进行固定,提供给荧光免疫染色。将细胞与作为一抗的抗GFAP抗体(CST#3670、Cell Signaling)反应,进一步与作为二抗的与一抗的免疫动物对应的荧光标记二抗依次反应后,在荧光显微镜下观察。
荧光免疫染色图像示于图14。确认了GFAP阳性胶质细胞。因此,显示了利用该培养方法获得的肠神经前体细胞保持了分化为胶质细胞的分化能力。
[试验例15:肠神经前体细胞在免疫缺陷小鼠肠道中的存活性确认]
使用与试验例4同样的方法获得的肠神经前体细胞,进行免疫缺陷小鼠肠道中的存活性确认。
(1)移植用肠神经前体细胞的细胞块的制备
将肠神经前体细胞悬浮于肠神经前体细胞培养基,并以320000个/孔接种至球形培养板(RB500 400NA 24,Kuraray),培养3天形成细胞块(球)。
(2)肠神经前体细胞移植至小鼠
回收所获得的细胞块(球),并使用注射针(30gauge)以580球/部位/只移植至在麻醉下剖腹的免疫缺陷小鼠(NOD.CB17-Prkdc
(3)移植后样品的组织学分析
将固定后的样品提供至荧光免疫染色。将细胞与作为一抗的抗TUBB3抗体(Abcam)反应,进一步与作为二抗的与一抗的免疫动物对应的荧光标记二抗依次反应后,在荧光显微镜下观察。
荧光免疫染色图像示于图15。在从小鼠肠道的粘膜下层起至相当于肌肉层的部位,存在PHOX2B-emGFP和SOX10-tdTomato为阳性的肠神经前体细胞来源的细胞(不断分化为神经细胞和胶质细胞的细胞)(图15a和图15b),确认了肠神经前体细胞在小鼠肠道的存活。此外,观察到与PHOX2B-emGFP或SOX10-tdTomato阳性图像一致或者接近的TUBB3阳性图像(图15c),确认了肠神经前体细胞来源的细胞不断分化为神经细胞。
序列表自由文本
序列号1:人NRG1的全长氨基酸序列
综上所述,本发明包括但不限于以下项:
1.一种肠神经前体细胞的制造方法,包括以下工序:
工序(A1),提供肠神经前体细胞;以及
工序(A2),在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养肠神经前体细胞。
2.根据项1所述的制造方法,其中,
所述培养基还包含TGFβ抑制剂和GSK3β抑制剂。
3.根据项1或2所述的制造方法,其中,
所述培养基还包含视黄酸和/或其衍生物。
4.根据项1至3中任一项所述的制造方法,其中,
所述培养基还包含GDNF。
5.根据项1至4中任一项所述的制造方法,其中,
所述培养基还包含基质胶。
6.根据项1至5中任一项所述的制造方法,其中,
所述ERBB3激动剂和/或ERBB4激动剂为NRG1。
7.一种肠神经前体细胞,其通过项1至6中任一项所述的制造方法获得。
8.一种冷冻储备物,其包含项7所述的肠神经前体细胞。
9.一种细胞药品,其包含项7所述的肠神经前体细胞。
10.一种肠神经前体细胞的制造方法,包括以下工序:
工序(B1),提供神经嵴细胞;以及
工序(B2),在包含ERBB3激动剂和/或ERBB4激动剂以及视黄酸和/或其衍生物的培养基中培养神经嵴细胞。
11.根据项10所述的制造方法,其中,
所述神经嵴细胞为迷走神经嵴细胞。
12.根据项11所述的制造方法,其中,
所述迷走神经嵴细胞为SOX10阳性、HOXB5阳性、HOXB9阴性且PHOX2B阴性,所述肠神经前体细胞为SOX10阳性且PHOX2B阳性。
13.一种肠神经前体细胞培养基,包含ERBB3激动剂和/或ERBB4激动剂。
14.根据项13所述的培养基,其中,
所述培养基还包含TGFβ抑制剂和/或GSK3β抑制剂。
15.根据项13或14所述的培养基,其中,
所述培养基还包含视黄酸和/或其衍生物。
16.根据项13至15中任一项所述的培养基,其中,
所述培养基还包含GDNF。
17.根据项13至16中任一项所述的培养基,其中,
所述培养基还包含基质胶。
18.根据项13至17中任一项所述的培养基,其中,
所述ERBB3激动剂和/或ERBB4激动剂为NRG1。
19.一种肠神经前体细胞的扩大培养方法,包括以下工序:
工序(C1),提供肠神经前体细胞;以及
工序(C2),在包含ERBB3激动剂和/或ERBB4激动剂的培养基中培养肠神经前体细胞。
20.一种肠道类器官的制造方法,包括对肠神经前体细胞和后肠细胞进行共培养的工序。
21.根据项20所述的制造方法,其中,
所述肠神经前体细胞是通过项1至6中任一项所述的制造方法获得的肠神经前体细胞。
22.一种人造肠的制造方法,包括:
通过对肠神经前体细胞和后肠细胞进行共培养从而获得肠道类器官的工序;以及
将所述肠道类器官移植至生物体内而形成人造肠的工序。
23.根据项22所述的制造方法,其中,
所述肠神经前体细胞是通过项1至6中任一项所述的制造方法获得的肠神经前体细胞。
- 信号发送方法、信号接收方法、终端设备及网络设备
- 一种控制信息的发送、接收方法及设备
- 一种信号发送、信号接收方法以及相关设备
- 一种上行控制信息的发送、接收方法和设备
- 一种接收控制信息、发送控制信息的方法及设备
- 一种网络非连续发送和接收的方法和设备
- 一种网络非连续发送和接收的方法和设备
