α-氰基-3-氨基肉桂酸在MALDI质谱中对还原糖检测分析的应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及糖生化分析领域,具体涉及α-氰基-3-氨基肉桂酸反应型基质在MALDI质谱中对还原糖检测分析的应用
背景技术
糖基化是蛋白质最关键和最多样的翻译后修饰之一,在许多生物学过程中发挥着重要作用,如蛋白质折叠、细胞免疫反应、细胞间信号传导和蛋白质翻译调控。越来越多的研究表明,异常的糖基化与多种疾病有关,如肿瘤、感染等。因此,聚糖的表征对糖生物学研究具有重要意义。
基质辅助激光解吸/电离质谱法(MALDI-MS)具有软电离、高耐盐性、低样品消耗和易于制备样品的优点,已广泛应用于各种高度异质性生物分子的检测,如蛋白质、核酸和碳水化合物。然而,由于糖类化合物的天然丰度低和电离效率差,MALDI-MS检测聚糖仍然受到挑战。2,5-二羟基苯甲酸(DHB)是检测聚糖最常用的MALDI基质,但它容易与分析物在靶板上形成不均匀的针状结晶,重现性差,检测灵敏度也有限,极大地限制了它对聚糖的定性定量分析。
为了提高聚糖的电离效率,化学衍生是一种常用的方法,通过在糖链上引入一些容易电离的基团可以明显提高聚糖的离子化效率。然而,传统的化学衍生化方法,如全甲基化和还原胺化,往往会引入过量的杂质,需要经过复杂的后处理才能达到检测的要求,而且在繁琐的纯化过程中也容易导致样品的损失。与还原胺化相比,非还原胺化由于无需添加还原剂,操作简便,成为近年来人们研究和应用得比较多的一种化学衍生化方法。为了尽可能地实现聚糖的完全衍生化,添加的衍生化试剂通常都需要大大过量,这也给后续的纯化处理过程增加了难度,即使是非还原胺化也难以避免。但如果过量的衍生化试剂同时可以作为检测聚糖的MALDI基质,则不仅不需要后处理过程,还省去了添加MALDI基质的步骤,这种同时具备MALDI基质和化学衍生化试剂双重功能的物质,被称为反应型基质。反应型基质甚至可以直接与聚糖在MALDI靶板上进行化学衍生,进一步简化实验流程,提高工作效率。
目前已经报道的聚糖的反应型基质都是基于非还原胺化的原理,如3-氨基喹啉(3-AQ)、2,5-二羟基苯甲酰肼(DHBH)、2-肼基对苯二甲酸(2-HTA)等。3-AQ本就是检测聚糖的传统基质,DHBH和2-HTA则是在传统基质DHB的骨架结构上进行功能性改造,引入容易与聚糖还原端反应的活性基团。α-氰基-4-羟基肉桂酸(CHCA)也是一种常用的MALDI基质,主要用于多肽和蛋白质的检测,其在MALDI激光波长(355nm)处有远高于DHB的能量吸收,因此,设计和开发基于CHCA骨架结构的新型MALDI反应型基质对实现还原糖的高通量定性定量检测具有深远的意义。
发明内容
本发明提供了α-氰基-3-氨基肉桂酸作为MALDI反应型基质在还原糖分析中的应用,3-CACA(α-氰基-3-氨基肉桂酸)作为反应型基质与CHCA(α-氰基-4-羟基肉桂酸)进行组合(CHCA/3-CACA)在还原糖分析中的应用。在MALDI质谱中,基于CHCA/3-CACA的靶板衍生化策略可实现对还原糖的高通量定性定量分析。3-CACA具有氨基反应基团,作为反应型基质可以与还原性N-聚糖的半缩醛进行脱水反应生成席夫碱,从而提高还原糖的电离化效率;同时,3-CACA作为基质可辅助糖类化合物的离子化,因此过量的3-CACA无需分离。CHCA为有机酸,可极大地催化衍生化反应的进行;同时CHCA作为传统有机基质在MALDI激光波长(355nm)处有极高的能量吸收,可以促进糖类化合物的解吸电离。此外,结构相似却具备不同酸碱度的CHCA与3-CACA的组合使用可显著改善样品结晶的均匀度,提高定量检测的准确性。本发明所述的3-CACA结构式如式(1)所示:
所述的3-CACA(α-氰基-3-氨基肉桂酸)和CHCA(α-氰基-4-羟基肉桂酸)的组合型基质在MALDI质谱中对还原糖检测的应用。3-CACA为反应型基质,具有氨基反应基团,可与糖链的还原末端的半缩醛反应。CHCA为催化剂,可显著促进3-CACA与还原糖的衍生化反应。
所述的对还原糖检测为对还原糖进行高通量定性定量检测,所述的应用具体包括如下步骤:
1、试剂配制
以二甲亚砜与甲醇的等体积混合溶剂配制CHCA溶液,CHCA为α-氰基-4-羟基肉桂酸;以3-CACA为溶质,3-CACA为α-氰基-3-氨基肉桂酸,CHCA溶液为溶剂,配制CHCA/3-CACA混合基质溶液;配制还原糖的水溶液;
2、点样
分别取等体积的还原糖的水溶液和CHCA/3-CACA混合基质溶液,依次点在MALDI靶板的同一个点样孔,在靶板上直接混合均匀,得到点样后的靶板。
3、靶板衍生化反应
点样后的靶板在55~70℃下放置25~40min,混合样品点完全干燥,进行MALDI质谱分析。
步骤1中,用于溶解基质的二甲亚砜和甲醇为分析纯或色谱级溶剂;
配制还原糖的水溶液的溶剂是超纯水或双蒸水;
所述的CHCA/3-CACA混合基质溶液中3-CACA的浓度为0.01~0.05mol/L,进一步优选为0.03mol/L;
所述的CHCA/3-CACA混合基质溶液中CHCA的浓度为0.05~0.15mol/L,进一步优选为0.10mol/L;
步骤2中,还原糖的水溶液的点样体积为0.5~1.0μL;
CHCA/3-CACA混合基质溶液的点样体积为0.5~1.0μL;
还原糖的水溶液和CHCA/3-CACA混合基质溶液的混匀使用移液枪在抛光靶板进行重复吸打10~20次;
步骤3中,点样后的靶板在60℃下放置30min,
所述的MALDI质谱分析采用的检测模式为正离子反射模式。
本发明中所述的“MALDI质谱”是指基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS),简称为MALDI质谱。MALDI的工作原理是用激光照射样品与基质形成的共结晶,基质从激光中吸收能量传递给样品分子而使其电离的过程。MALDI是一种软电离技术,适用于生物大分子的测定。
本发明中所述的“反应型基质”是指作为常规基质辅助还原糖电离的同时,可与其还原端半缩醛发生快速反应,共价结合离子化标签,提高电离化效率。
本发明中所述的“靶板衍生化策略”是指在靶板上样品的点样和衍生同步进行,极大地简化了操作步骤,兼容了MALDI的高通量特性。
本发明中所述的衍生化效率=衍生化产物峰强度/(衍生化产物峰强度+未衍生的峰强度)
与现有技术相比,本发明具有如下有益效果:
1、3-CACA与传统有机酸基质CHCA具有类似的骨架结构,对MALDI激光能量可进行有效吸收和传递,适用于作为糖类物质的基质。
2、CHCA/3-CACA混合基质中,3-CACA为反应型基质,具有氨基反应基团,可与还原糖的半缩醛末端反应。CHCA为酸性催化剂,可显著促进3-CACA与还原糖的衍生化反应。3-CACA作为基质可辅助糖类化合物的离子化,因此无需分离,适用于靶板衍生化对还原糖进行高通量检测。
3、由于衍生、催化和促进电离等多重效应,CHCA/3-CACA混合基质具有优良的基质特性,可显著提高还原糖的电离化效率和检测灵敏度,拓展还原性多糖的质量检测范围。
4、结构相似却具备不同酸碱度的CHCA与3-CACA的组合使用,可明显改善样品结晶均匀度,提高定量检测的准确性和稳定性(RSD<10%)。CHCA/3-CACA混合基质适用于对还原糖的定性定量检测,在0.2~20pmol/μL范围具有良好的线性关系,R
附图说明
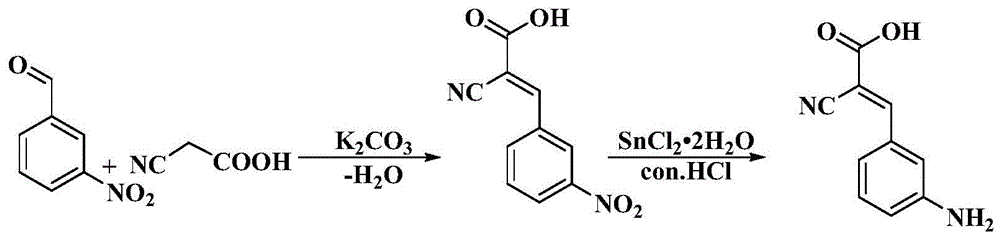
图1为3-CACA的合成流程示意图;
图2为3-CACA的NMR谱图及高分辨ESI质谱图;图2A为3-CACA的
图3为相同摩尔浓度DHB、CHCA和3-CACA的紫外吸收光谱图;
图4为检测麦芽七糖(G7)的MALDI质谱图;图4A为DHB作为基质检测G7的MALDI质谱图;图4B为3-CACA作为基质检测G7的MALDI质谱图;
图5为基于CHCA/3-CACA的还原糖的靶板衍生化原理图;
图6为不同有机酸基质与3-CACA的组合基质对G7衍生化反应的影响并与不加有机酸基质的情况进行对比;
图7为3-CACA浓度、CHCA浓度、温度和反应时间对靶板衍生化反应的影响;
图8为以CHCA/3-CACA为MALDI基质检测不同分子量的寡糖和葡聚糖D2000的适用性;
图9为分别以DHB和CHCA/3-CACA为MALDI基质检测不同分子量还原糖的检测限;图9A,E为麦芽七糖(G7)的检测限;图9B,F为检测NGA3的检测限;图9C,G为NA2的检测限;图9D,H为Man-8的检测限;其中图9A-D为以CHCA/3-CACA为基质检测的谱图;图9E-H为以DHB为基质检测的谱图;
图10为以DHB和CHCA/3-CACA为基质检测G7时信号的重现性和对NGA3,NA2和Man-8检测的定量曲线;图10A为同一点样孔45次检测峰强度均值归一化图和RSD值;图10B为CHCA/3-CACA基质检测NGA3的线性范围;图10C为CHCA/3-CACA基质检测NA2的线性范围;图10D为CHCA/3-CACA基质检测Man-8的线性范围;
图11为以CHCA/3-CACA为基质对不同品种的果实中还原性N-糖链进行靶板衍生化后的MALDI质谱图;图11A为检测安农水蜜桃中还原性N-糖链的质谱图和放大后质谱峰的归属和相应的糖链结构图;图11B为含量归一化后不同品种果实中不同还原性N-糖链的含量分析热图。
具体实施方式
下面的实施例将对本发明予以进一步的说明,但本发明并不限于下述实施例。
下述实施例中所用的样品、试剂等,如无特殊说明,均可从商业途径获得。下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例所用的基质辅助激光解吸电离飞行时间质谱仪的具体型号为UlrafleXtreme
下面简写词或外文术语的使用贯穿本发明:
3-CACA,α-氰基-3-氨基肉桂酸;
‘ANSM’,‘安农水蜜’;
‘BL’,‘百丽’;
CHCA,α-氰基-4-羟基肉桂酸;
‘CH’,‘春花’;
ddH
DHB,2,5-二羟基苯甲酸;
DMSO,二甲亚砜;
ESI,电喷雾质谱;
G1,葡萄糖;
G2,麦芽糖;
G3,麦芽三糖;
G4,麦芽四糖;
G5,麦芽五糖;
G6,麦芽六糖;
G7,麦芽七糖;
D2000,葡聚糖2000
HRMS,高分辨质谱;
‘HY002’,‘沪油002’;
‘HY004’,‘沪油004’;
Hz,赫兹;
IS,内标;
‘JXHT’,‘锦绣黄桃’;
LOD,检测限;
LOQ,定量限;
MALDI,基质辅助激光解吸离子化;
MeOH,甲醇;
min,分钟;
M.P.,熔点;
MS,质谱;
MW,分子量;
m/z,质荷比;
NMR,核磁共振;
PA,质子亲和势;
PNGase A,肽N-糖苷酶A;
RSD,相对标准偏差;
rt,室温;
S/N,信噪比;
Tis-HCl,三羟甲基氨基甲烷盐酸盐;
μL,微升;
V,伏特;
‘ZL’,‘早露’;
‘ZHBS’,‘早红宝石’
实施例1:3-CACA的合成和表征
1、3-CACA的合成
25℃下将3-硝基苯甲醛(4mmol)、氰基乙酸(4mmol)和碳酸钾(8mmol)在乙醇(20mL)中搅拌约4小时。然后向反应溶液中加入适量的1mol/L HCl,直至溶液呈中性,析出大量白色固体。将固体产物过滤并用适量的水和乙醇各洗涤三次,干燥得到α-氰基-3-硝基肉桂酸。将α-氰基-3-硝基肉桂酸(2mmol)和氯化亚锡二水合物(6mmol)在盐酸(5mL)中于80℃搅拌30分钟。
2、3-CACA的分离纯化
将反应结束后的反应液冷却至室温,析出大量白色沉淀。将沉淀物过滤并用适量盐酸洗涤,干燥后得到α-氰基-3-氨基肉桂酸盐酸盐。将α-氰基-3-氨基肉桂酸盐酸盐再次溶解在水中,加入饱和碳酸氢钠溶液调节溶液pH至中性,再次析出白色沉淀。将沉淀物用适量的水和乙醇各洗涤三次,最后干燥得到目标产物α-氰基-3-氨基肉桂酸
3、3-CACA的表征
3-CACA的表征采用NMR、高分辨ESI,紫外吸收光谱仪和熔点仪等。
实施例1中,图1为3-CACA的合成流程示意图。图2为3-CACA的
实施例2:3-CACA自身作为MALDI基质检测糖类物质
(1)配制50pmol/0.5μL的G7糖溶液,可在4℃冰箱保存;
(2)以甲醇和二甲亚砜等体积混合溶液为溶剂,配制0.05mol/L的3-CACA基质溶液,可在4℃冰箱保存;
(3)配制0.05mol/L的DHB甲醇溶液,可在4℃冰箱保存;
(4)分别取0.5μL步骤1中的G7糖液与0.5μL步骤2中的3-CACA基质溶液,依次点在靶板的同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。15℃下自然干燥;
(5)作为对照,分别取0.5μL步骤1中的G7糖液与0.5μL步骤2中的DHB基质溶液,依次点在靶板的同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。15℃下自然干燥;
(6)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例2中,图4为分别以DHB和3-CACA为基质检测G7的MALDI质谱图。1175.370Da对应[G7+Na]
实施例3:3-CACA与CHCA进行组合,构建还原糖靶板衍生化策略
1、混合基质中有机酸基质的选择
(1)配制CHCA/3-CACA和DHB/3-CACA的混合基质,以实施例2中配制的0.05mol/L的3-CACA溶液为溶剂,分别以CHCA和DHB为溶质,配制有机酸基质浓度为0.05mol/L的CHCA/3-CACA和DHB/3-CACA混合基质溶液。
(2)分别取0.5μL实施例2中的G7糖液和0.5μL步骤(1)中的CHCA/3-CACA和DHB/3-CACA混合基质溶液,依次点在靶板的同一点样孔。作为对比,同样取0.5μL G7糖液和0.5μL0.05mol/L不加有机酸基质的3-CACA单基质溶液,依次点在靶板的同一点样孔。移液枪直接在MALDI靶板重复吸打10次,进行混匀。65℃下反应45min;
(3)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例3中,图5为基于组合型基质的还原糖靶板衍生化原理图,其中,3-CACA为反应型基质,具有氨基反应基团,可与还原糖的半缩醛反应。有机酸基质为催化剂,可显著催化3-CACA与还原糖的衍生化反应。过量的3-CACA可作为MALDI质谱检测的高效基质,无需分离,适用于靶板衍生化策略,可实现对还原糖的高通量检测。图6为不同有机酸基质与3-CACA的组合基质对G7衍生化反应的影响并与不加有机酸基质的情况进行对比。可见单独使用3-CACA虽然也可以衍生化G7,但是衍生化效率不足;而加入有机酸基质可以明显提高衍生化效率,二者均实现了完全的衍生化,说明该衍生化反应需要弱酸催化。从衍生化产物的信号强度和信噪比可以看出,CHCA/3-CACA的混合基质效果要明显优于DHB/3-CACA的混合基质。从共结晶图像可以看出,DHB的加入会一定程度上破坏共结晶的均匀性,CHCA和3-CACA则可以形成非常均匀稳定的共结晶。
2、CHCA/3-CACA混合基质中3-CACA的浓度优化
(1)配制CHCA/3-CACA混合基质,分别配制CHCA浓度为0.05mol/L,3-CACA浓度为0.01mol/L,0.02mol/L,0.03mol/L,0.04mol/L和0.05mol/L的CHCA/3-CACA混合基质溶液;
(2)分别取0.5μL实施例2中的G7糖液和0.5μL步骤(1)中的CHCA/3-CACA混合基质溶液,依次点在靶板的同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。55℃下反应30min;
(3)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例3中,图7A不同浓度的3-CACA对G7衍生化效率的影响。可见,当3-CACA的浓度为0.03mol/L时,衍生化效率和产物信噪比的综合评价最高。
3、CHCA/3-CACA混合基质中CHCA的浓度优化
(1)配制CHCA/3-CACA混合基质,分别配制3-CACA浓度为0.03mol/L,CHCA浓度为0.05mol/L,0.075mol/L,0.1mol/L,0.125mol/L和0.15mol/L的CHCA/3-CACA混合基质溶液;
(2)分别取0.5μL实施例2中的G7糖液和0.5μL步骤(1)中的CHCA/3-CACA混合基质溶液,依次点在靶板的同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。55℃下反应30min;
(3)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例3中,图7B不同浓度的CHCA对G7衍生化效率的影响。可见,当CHCA的浓度为0.1mol/L时,衍生化效率和产物信噪比的综合评价最高。
3、靶板衍生化的反应温度优化
(1)配制CHCA/3-CACA混合基质,配制3-CACA浓度为0.03mol/L,CHCA浓度为0.1mol/L的CHCA/3-CACA混合基质溶液;
(2)分别取0.5μL实施例2中的G7糖液和0.5μL步骤(1)中的CHCA/3-CACA混合基质溶液,依次点在靶板的同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。分别在55、60、65和70℃下反应30min;
(3)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例3中,图7C不同反应温度对G7衍生化效率的影响。可见,当反应温度为60℃时,衍生化效率和产物信噪比的综合评价最高。
4、靶板衍生化的反应时间优化
(1)配制CHCA/3-CACA混合基质,配制3-CACA浓度为0.03mol/L,CHCA浓度为0.1mol/L的CHCA/3-CACA混合基质溶液;
(2)分别取0.5μL实施例2中的G7糖液和0.5μL步骤(1)中的CHCA/3-CACA混合基质溶液,依次点在靶板的同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。在60℃下分别反应25、30、35和40min;
(3)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例3中,图7D不同反应时间对G7衍生化效率的影响。可见,当反应时间为30min时,衍生化效率和产物信噪比可以达到最佳。
实施例4:定性考察CHCA/3-CACA组合型基质检测不同分子量还原糖
1、CHCA/3-CACA作为基质检测不同分子量的寡糖和葡聚糖混合物
(1)分别配制50pmol/0.5μL的G1、G2、G3、G4、G5、G6糖溶液和1mg/mL的D2000糖溶液,可在4℃冰箱保存;
(2)分别取0.5μL步骤(1)中的G1、G2、G3、G4、G5、G6糖溶液和D2000糖液与0.5μL实施例3中的CHCA/3-CACA的基质溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。60℃下反应30min,保证还原糖完全反应;
(3)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例4中,图8为CHCA/3-CACA基质定性检测G1、G2、G3、G4、G5、G6和D2000的MALDI质谱图。以CHCA/3-CACA为基质时检测小分子的寡糖具有背景干扰小和较高的信噪比,而检测葡聚糖混合物也具有明显的信噪比,且每个质谱峰都可以被区分开并得到归属。其中,1669.523Da对应[G9+3-CACA+Na]
2、CHCA/3-CACA作为基质检测还原性N-聚糖
(1)配制50pmol/0.5μL的G7糖溶液,后稀释至20pmol/0.5μL,10pmol/0.5μL,5pmol/0.5μL,2pmol/0.5μL,1pmol/0.5μL,500fmol/0.5μL和50fmol/0.5μL,得各梯度浓度的G7糖溶液,可在4℃冰箱保存;
(2)分别配制20pmol/0.5μL NGA3,NA2和Man-8的标准糖溶液,后稀释至10pmol/0.5μL,5pmol/0.5μL,2pmol/0.5μL,1pmol/0.5μL,500fmol/0.5μL和50fmol/0.5μL,得各梯度浓度的NGA3,NA2和Man-8糖液,可在-20℃冰箱保存;
(3)分别取0.5μL步骤(1)中的G7糖溶液或步骤(2)中的NGA3,NA2或Man-8的标准糖溶液与0.5μL实施例3中的CHCA/3-CACA的基质溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。60℃下反应30min,保证还原糖完全反应;
(4)作为对照,分别取0.5μL步骤(1)中的G7糖溶液或步骤(2)中的NGA3,NA2或Man-8的标准糖溶液与0.5μL实施例2中的0.05M DHB甲醇溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀。室温下自然干燥30min;
(5)靶板送入MALDI质谱仪,选用正离子反射模式进行数据采集。
实施例4中图9为分别以CHCA/3-CACA和DHB为MALDI基质检测不同分子量还原性N-聚糖的检测限。其中,图9A-D为以CHCA/3-CACA为基质检测的谱图,图9E-H为以DHB为基质检测的谱图。具体的检测限结果汇总于表1中,以DHB为基质检测G7,NGA3,NA2和Man-8时,检测限均为500fmol,而以CHCA/3-CACA为基质时,检测限均低至50fmol。可见,以CHCA/3-CACA为基质检测效果最佳,适用于寡糖和多糖等的检测。表1:基质的质子亲和势、熔点及对G7,NGA3,NA2和Man-8的检测限。
表1
实施例5:定量考察以CHCA/3-CACA为基质方法的稳定性和线性范围
(1)配制浓度为2pmol/0.5μL的G7糖溶液为内标溶液,可在4℃冰箱保存;
(2)取实施例4中20pmol/0.5μL的NGA3,NA2和Man-8的标准糖溶液,分别稀释至10pmol/0.5μL,5pmol/0.5μL,2pmol/0.5μL,1pmol/0.5μL,500fmol/0.5μL和200fmol/0.5μL,得各梯度浓度的NGA3,NA2和Man-8糖液,可在-20℃冰箱保存;
(3)分别取0.5μL实施例2中的G7糖液,0.5μL实施例2中的DHB基质溶液或实施例3中CHCA/3-CACA混合基质溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀,60℃下反应30min。靶板送入MALDI质谱仪,采用正离子反射模式,在同一点样孔采样45次;
(4)分别取0.5μL步骤(2)中不同浓度的NGA3糖液,0.5μL步骤(1)中G7内标溶液,0.5μL实施例3中CHCA/3-CACA混合基质溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀,60℃下反应30min。靶板送入MALDI质谱仪,正离子反射模式采集数据,每个样孔随机采样10次取平均值;
(5)分别取0.5μL步骤(2)中不同浓度的NA2糖液,0.5μL步骤(1)中G7内标溶液,0.5μL实施例3中CHCA/3-CACA混合基质溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀,60℃下反应30min。靶板送入MALDI质谱仪,正离子反射模式采集数据,每个样孔随机采样10次取平均值;
(6)分别取0.5μL步骤(2)中不同浓度的Man-8糖液,0.5μL步骤(1)中G7内标溶液,0.5μL实施例3中CHCA/3-CACA混合基质溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀,60℃下反应30min。靶板送入MALDI质谱仪,正离子反射模式采集数据,每个样孔随机采样10次取平均值;
实施例5中,图10A为以DHB和CHCA/3-CACA为基质检测还原糖时信号的重现性。通过对45个点信号强度的均值归一化,可以很直观的看出,以CHCA/3-CACA为基质时,G7离子强度在整个测试过程中基本保持稳定,相对标准偏差为7.60%,明显低于对照组基质(59.46%)。可见,以CHCA/3-CACA为基质时,方法的稳定性好,有利于提高定量分析的准确性。图10B-D为以G7为内标,正离子反射模式下分别对NGA3,NA2和Man-8的线性范围进行考察,发现它们在0.2~20pmol/0.5μL呈良好的线性关系,R
实施例6:CHCA/3-CACA对不同果实中的还原性N-糖链的定量分析
本发明中自制N-还原糖采用标准糖蛋白N-糖的制备方法,采用PNGase A酶法制备N-还原糖,以安农水蜜桃果皮为例进行说明,具体步骤如下:
(1)总蛋白提取。称取1g安农水蜜桃果皮,用缓冲溶液Y[1mol/L Tris-HCl(pH8.2),10%(w/v)十二烷基硫酸钠,1%(v/v)β-巯基乙醇,0.5mol/L乙二醇双四氧乙酸,0.5mol/L乙二胺四乙酸,0.1mol/L苯甲基磺酰氯和1×蛋白酶抑制剂]在65℃进行提取,12000rpm室温离心20min,上清液转移至新的离心管。加入适量冷酚,涡旋1min,12000rpm 4℃离心20min,弃上清。加入冷缓冲溶液Z(50mmol/L Tris-HCl,pH 8.2)洗涤两次,再加入0.1mol/L的冷乙酸铵甲醇溶液,于-20℃过夜沉淀。
(2)酶解。将提取出的蛋白溶解与0.01mol/L的Tris-HCl(pH 8.2),100℃加热10min使蛋白变性,后冷却至室温。加入30μg胰蛋白酶、30μg胰凝乳蛋白酶和2μL的0.2mol/L的氯化钙,37℃孵育24h进行酶解。再加入0.5μL PNGase A,混匀,37℃孵育24h进行酶解。
(3)纯化。将酶解得到的样品离心,依次用C18固相萃取小柱和石墨化碳固相萃取小柱对解离的还原性N-糖进行纯化。C18固相萃取小柱用于除去杂质肽、蛋白和其他污染物,纯化过程如下:4mL甲醇用于活化柱子,4mL超纯水用于平衡柱子。吸取上清液加入小柱内,分3次用超纯水洗脱柱子,每次1mL,收集洗脱液。然后,采用石墨化碳固相萃取小柱对盐和小分子极性化合物进行除杂,具体过程如下:依次用3mL乙腈和1mL 50%的乙腈水溶液对小柱进行活化,用3mL超纯水进行小柱的平衡。将C18纯化过程收集的糖液上样,5mL超纯水洗脱除杂。用2mL 50%的乙腈水溶液洗脱并收集洗脱糖液,室温真空离心去除溶剂,复溶于25μL超纯水中,可在-20℃冰箱保存;
(4)分别取0.5μL步骤(2)中的糖液,0.5μL实施例5中的G7内标溶液,0.5μL实施例3中CHCA/3-CACA混合基质溶液,依次点在靶板同一点样孔。使用移液枪直接在MALDI靶板重复吸打10次,进行混匀,60℃下反应30min。靶板送入MALDI质谱仪,正离子反射模式采集数据;
(5)内标法进行质量校准。对检测到的多种还原性N-糖数据进行归一化处理,随后求得各还原性N-糖在不同品种果实中的相对含量,并根据N-糖结构和含量推测水果糖链决定簇与过敏反应的潜在关系。
实施例6中,图11为以CHCA/3-CACA为基质对不同品种果实中还原性N-糖链进行靶板衍生化后的MALDI质谱图;图11A为检测安农水蜜桃中还原性N-糖链的质谱图和放大后质谱峰的归属和相应的糖链结构图;图11B为含量归一化后不同品种果实中不同还原性N-糖链的含量分析热图。结果表明,使用CHCA/3-CACA基质成功实现了对果实样品中22种糖进行高通量高灵敏的定性定量分析,其中含有α-1,3-岩藻糖和/或β-1,2-木糖取代基的N-聚糖含量最高,达到了一半以上,包括6种平均水平最高的N-聚糖(m/z为1026.375、1188.428、1391.507、1594.587、1902.698和2210.808)。此外,在不同品种果实中,“ZHBS”的各种N-聚糖含量差异最小,“ZL”的N-聚糖含量最丰富,而“CH”和“HY004”是N-聚糖含量最低的两个品种,这可能为桃子的育种和栽培提供方向。作为植物中还原性N-聚糖的高通量定性定量分析方法,该发明可能对植物选育的相关研究提供重要的数据支撑和理论指导。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 一种智慧电厂综合监控中心智能监控实现方法
- 一种河道智能监控综合管理系统及方法
- 一种河道智能监控综合管理系统及方法
